Dados los resultados favorables del el uso de quimioterapia con densidad de dosis en adyuvancia nos proponemos evaluar la eficacia en neoadyuvancia de la combinación cada 15 días de adriamicina-ciclofosfamida seguido de docetaxel (más trastuzumab si Her-2 sobre-expresado) en pacientes con cáncer de mama localmente avanzado. El objetivo primario de eficacia es la respuesta completa patológica (pCR) en la mama y ganglios. Como objetivos secundarios la respuesta clínica y la toxicidad. Tras el estudio encontramos una pCR en mama y axila del 29% y sólo en mama del 36%, por lo que concluimos que el tratamiento neoadyuvante con densidad de dosis de adriamicina-ciclofosfamida seguido por docetaxel (junto a trastuzumab si hay sobrexpresión de Her-2) es altamente eficaz en cáncer de mama localmente avanzado.
Previous studies have shown benefitial results of dose density adjuvant chemotherapy. We evaluate the eficcacy in the neoadjuvant setting of the combination every 15 days of doxorrubicin-cyclophosphamid followed by docetaxel (trastuzumab was added to docetaxel if Her-2 was overexpressed) in patient with locally advanced breast cancer. The end point was the pathological complete response (pCR) in the breast and axillary nodes. Secundary objetives were clinical response and toxicity. We observed a 29% pCR in breast and axillary lymph nodes and a 36% pCR just in breast, so we conclude that the dose dense eoadjuvant treatment with doxorrubin-cyclophosphamide followed by docetaxel (and trastuzumab if there is overexpresion of Her-2) is highly efective in locally advanced breast cancer.
Introducción
El cáncer de mama es la neoplasia maligna sólida más frecuente diagnosticada en las mujeres occidentales, una de cada nueve mujeres lo padecerá.
El interés por administrar quimioterapia antes de la cirugía (neoadyuvante) se basa en que la oportunidad de una introducción temprana del tratamiento sistémico dará lugar a una acción precoz sobre enfermedad micrometastásica, a la vez que disminuirá el tamaño tumoral permitiendo un mayor número de cirugía conservadora de la mama. Otra ventaja potencial del uso de quimioterapia aplicada antes de la cirugía incluye la determinación de la sensibilidad del tumor al tratamiento sistémico1-4. Además, la respuesta tumoral a la quimioterapia preoperatoria puede servir de herramienta pronóstica útil.
Se ha observado que la combinación de varios agentes quimioterápicos administrados postoperatoriamente (adyuvante) es superior a la administración de un solo agente1,5,6. Los esquemas de tratamiento con antraciclinas han demostrado superioridad sobre los regímenes con base en ciclofosfamida-metotrexate-5fluorouracilo7.
Aunque los esquemas con antraciclinas han sido considerados como estándar8-11, numerosos estudios reconocen una mayor eficacia al añadir taxanos en el esquema de poliquimioterapia12,13. Por otra parte el uso de docetaxel parece más adecuado frente al de paclitaxel en enfermedad metastásica14.
La forma de administrar la quimioterapia, de manera secuencial o concurrente, se cuestiona en un estudio aleatorizado del Grupo Internacional de Mama15. Concluyen que existe un aumento del periodo libre de enfermedad al incorporar docetaxel al esquema de antraciclinas en adyuvancia en mujeres con ganglios positivos, siendo de forma significativa el aumento de dicho periodo al administrar docetaxel de forma secuencial comparado con la administración concurrente.
El ensayo intergrupal del grupo norteamericano CLB974116 comparó el uso simultáneo de adriamicina, ciclofosfamida y paclitaxel (adriamicina y ciclofosfamida seguido de paclitaxel) frente a la manera secuencial (adriamicina seguida de paclitaxel seguido de ciclofosfamida), administrados cada tres semanas o cada dos semanas, con el uso de filgrastín. La conclusión es que el tratamiento de dosis densa (cada dos semanas) aumenta el tiempo libre de enfermedad en toda la población de pacientes pero no la supervivencia global.
La sobreexpresión del receptor del factor de crecimiento epidérmico humano Her-2 (3 + inmunohistoquimia o amplificación genética por FISH), se observa en el 20 a 30% de los carcinomas de mama invasivo. Her-2, receptor transmembrana tirosín quinasa, consta de un dominio extracelular, un segmento transmembrana lipofílico y uno funcional de dominio intracelular de tirosín quinasa. Una vez activada la señal de transducción de cascada de estos receptores se promueve la proliferación celular17. Regulan el crecimiento y la supervivencia, así como la migración y la diferenciación. Trastuzumab, un anticuerpo se une al dominio de Her-2 extracelular e inhibe la proliferación y la supervivencia de los tumores, demostrando en los primeros estudios su eficacia en cáncer de mama metastático Her-2 positivo18. En estadio temprano de cáncer de mama con sobreexpresión del Her-2- administrado como tratamiento adyuvante tras y junto a la quimioterapia proporciona de forma significativa un aumento del periodo libre se enfermedad y de la supervivencia global, en comparación con las pacientes que sólo reciben quimioterapia19.
El ensayo randomizado del grupo de Buzdar y sus colaboradores20 evidencia el aumento de tasas de prepuesta completa tras el tratamiento neoadyuvante con un esquema de quimioterapia con trastuzumab, paclitaxel y epirrubicina frente a las pacientes Her-2 positivas que sólo llevaron paclitaxel y epirrubicina.
Basándonos en los estudios previos nos proponemos comprobar la eficacia en neoadyuvancia del esquema administrado con densidad de dosis de: adriamicina-ciclofosfamida seguido de docetaxel. Se añadirá trastuzumab al docetaxel a las pacientes que sobreexpresen el receptor Her-2.
Hipótesis de trabajo y objetivos
La hipótesis sería el esquema de tratamiento neoadyuvante (precirugía) adriamicina-ciclofosfamida 4 ciclos seguido de 4 ciclos de docetaxel al que se le añadiría trastuzumab si existe sobreexpresión de Her-2 administrado con densidad de dosis (cada 15 días), con soporte de pegfilgastrim produce un elevado número de respuestas completas clínicas y de respuestas completas patológicas en pacientes con cáncer de mama.
En cuanto a los objetivos, dados los resultados favorables del uso de quimioterapia con densidad de dosis en adyuvancia nos proponemos evaluar la eficacia en neoadyuvancia de la combinación cada 15 días de adriamicina-ciclofosfamida seguido de docetaxel (más trastuzumab si existe Her-2 sobreexpresado) en pacientes con cáncer de mama estadio IIB y III.
El objetivo primario es la valoración de la eficacia del esquema de tratamiento analizando la respuesta anatomopatológica.
Los objetivos secundarios son:
1) Valoración de respuesta clínica al tratamiento.
2) Valoración del número de cirugías conservadoras realizadas.
3) Valoración de la toxicidad del tratamiento.
Pacientes
Todas las pacientes fueron estudiadas en sesión conjunta multidisciplinar antes de su inclusión en el programa de tratamiento neoadyuvante.
Los criterios de inclusión fueron:
1) Pacientes con estadio IIB o III de cáncer de mama confirmados histológicamente en el Hospital Universitario San Cecilio desde 2008 hasta enero 2009. La confirmación histológica fue realizada con una biopsia.
2) Mayores de 18 años.
3) Para que un tumor fuera considerado Her-2 positivo debía mostrar sobreexpresión de 3 + por inmunohistoquimia o bien resultar positivo por FISH (técnica que se solicitó sistemáticamente a todas las pacientes Her-2 2 + por inmunohistoquimia).
En cuanto a los criterios de exclusión fueron:
1) Cáncerinflamatorio.
2) Presencia de metástasis. Se realizó como estudio de extensión a todas las pacientes: historia clínica completa, examen físico, hemograma, bioquímica general, radiografía de tórax, ecografía abdominal y gammagrafía ósea. Se realizó mamografía de las dos mamas.
3) Deficiente función de médula ósea, definida como un recuento absoluto de neutrófilos inferior a 1.500/μml o de plaquetas inferior a 100.000/μl.
4) Anormal funcionamiento renal (definido como creatinina sérica superior a 2,5 mg/100 ml) o hepático.
5) Pacientes con historia de fallo congestivo cardiaco o fracción de eyección del ventrículo izquierdo inferior al 45%. Se solicitó fracción de eyección del ventrículo izquierdo por MUGA a todas las pacientes).
6) Historia previa de cáncer.
Metodología del proyecto
El tipo de intervención utilizado fue la administración de 4 ciclos de adriamicina 60 mg/m2 y ciclofosfamida 600 mg/m, seguidos de 4 ciclos de docetaxel 100 mg/m2 administrados cada 15 días con factor estimulante de colonias de granulocitos (pegfílgastrim en el quinto día de cada ciclo de quimioterapia). Trastuzumab fue administrado junto a docetaxel a las pacientes que presentaran sobreexpresión de Her-2 por inmunohistoquimia o hibridación in situ por fluorescencia.
En la valoración de la respuesta anatomopatológica se hizo estudio de la pieza quirúrgica. La respuesta completa patológica (pCR) no evidencia enfermedad residual en la pieza quirúrgica.
En cuanto a la clínica se aplicó medición mediante exploración clínica del tamaño tumoral, se utilizaron los criterios RECIST de respuesta:
1) Completa: desaparición de evidencia clínica de actividad tumoral en examen físico.
2) Parcial: disminución de la longitud del diámetro mayor tumoral superior al 30% durante 4 semanas.
3) Progresión: aumento del tamaño o aparición de nuevas lesiones.
4) Terapia local. Tras completar el tratamiento neoadyuvante, cada paciente fue evaluada. A las pacientes que se consideraron candidatas apropiadas para cirugía conservadora se les ofreció dicha cirugía. Para las que no se consideraron candidatas apropiadas o que no deseaban cirugía conservadora se les realizó mastectomía radical modificada. A todas las pacientes con o sin enfermedad clínica persistente en la axila se les propuso realización de técnica de detención de ganglio centinela y exéresis del mismo junto linfadenectomía axilar. El motivo de la realización de la técnica de ganglio centinela y de la linfadenectomía axilar independientemente del resultado del estudio del ganglio centinela es que necesitábamos la validación de dicha técnica en nuestro centro en la situación de neoadyuvancia.
Todas las pacientes con cirugía conservadora de la mama recibieron irradiación completa de la mama. La mama fue tratada con una dosis de 50 Grey administrados en 25 fracciones. La radioterapia no se ofreció a las pacientes con estadio clínico inicial II que fueran tratadas con mastectomía y presentaran ganglios axilares negativos.
5) Descripción de la toxicidad observada en las pacientes.
6) Análisis estadístico: uso del programa informático SPSS. Descriptivo de frecuencias para obtener los índices de respuesta y de toxicidad.
Resultados
De las 28 pacientes incluidas, un 32% tenían tumores T3, el 64% tenían clínicamente ganglios axilares positivos, y el 21% sobreexpresaban Her-2.
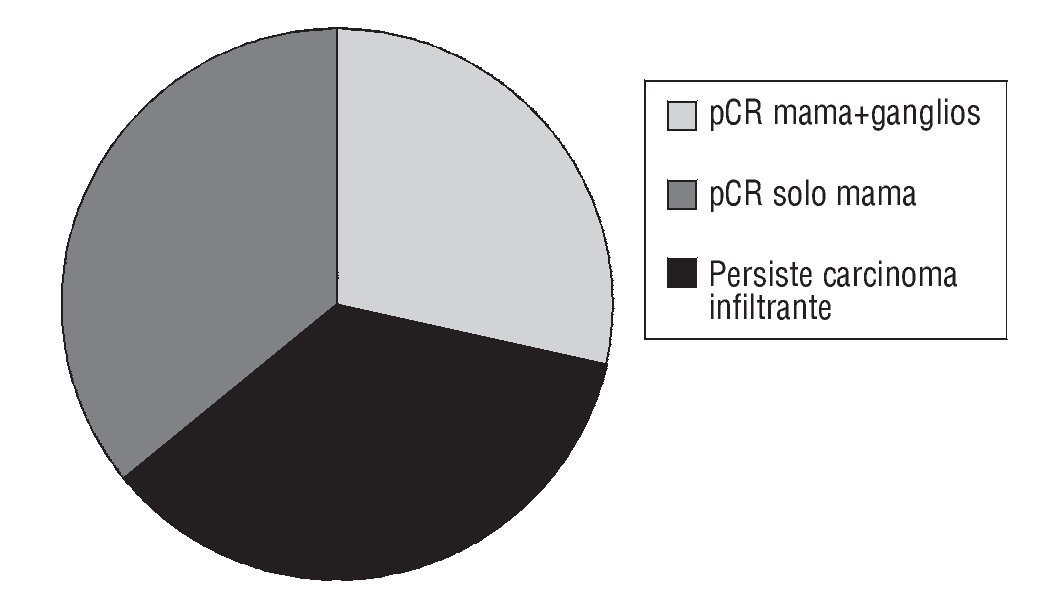
La respuesta patológica fue: ocho pacientes (29%) consiguieron pCR en la mama y en los ganglios; diez pacientes (36%) consiguieron pCR en la mama (no en los ganglios) y dieciocho pacientes (64%) sin afectación patológica en los ganglios (fig. 1).
Fig. 1 ¿ Resultados del studio. pCR: respuesta completa patológica.
En cuanto a la respuesta clínica fue documentada en 25 pacientes (respuestas parciales y completas) (89%) con 11 respuestas completas clínicas (39%). La mayoría de las pCR se observaron en las pacientes en las que se logró una respuesta completa clínica. No hubo progresión durante tratamiento en ninguna paciente.
Se realizó cirugía conservadora en el 85% de las pacientes.
Toxicidad grado 3-4: astenia 39%; epidemolisis en manos: 25% (sólo se apreció tras la administración de dos o más ciclos de docetaxel); neutropenia febril: 10% (solo una paciente requirió ingreso para antibióticos intravenosos); vómitos: 3%. No se evidenciaron muertes en relación al tratamiento.
La dosis de quimioterapia no hubo de ser reducida por la neutropenia pero si hubo de administrarse cada 21 días en el 10% de las pacientes.
No se evidenció una mayor incidencia de neutropenia en las pacientes que recibieron trastuzumab junto al docetaxel (pacientes Her-2 positivas) en comparación con las pacientes que sólo recibieron el docetaxel.
Ninguna paciente desarrolló fallo congestivo cardiaco.
Al cerrar el estudio de los datos para esta publicación no se ha apreciado ninguna recaída o muerte en ninguna paciente (fig. 1).
Discusión
Creemos confirmado el objetivo de este estudio dado el alto porcentaje de respuestas completas patológicas obtenidas, un 29% en mama y ganglios y del 36% en mama. En estudios previos de mujeres tratadas con esquemas de antraciclinas en neoadyuvancia, la obtención de pCR se ha demostrado asociarse a una mayor supervivencia libre de enfermedad y supervivencia global al compararlo con las pacientes que no obtuvieron dicha pCR21. Dado que nuestro estudio ha sido llevado a cabo durante este año y el anterior no tenemos aún una mediana de seguimiento mínima para aportar datos de supervivencia. En el 89% de las pacientes se objetivó una respuesta clínica (parcial o completa). La explicación lógica por este alto porcentaje es el uso de dos agentes quimioterápicos sin resistencias cruzadas administrados secuencialmente. La adición de trastuzumab a las pacientes que sobreexpresaran Her-2. Otra posibilidad incluye la larga duración del tratamiento neoadyuvante.
La cirugía conservadora se pudo realizar en el 85% de las pacientes. En comparación con otros estudios con esquemas similares en el que el porcentaje está en un 50%20, valoramos nuestros resultados como muy positivos, dado que la conservación de la mama se asocia a una mayor calidad de vida de la paciente y a un menor impacto negativo psicológico de los procedimientos terapéuticos en el tratamiento de esta enfermedad sin que se observe una menor supervivencia 22-23.
No hemos apreciado toxicidad cardiaca en relación al uso de antraciclinas (dado que hemos administrado una dosis total de 240 mg/m2, muy por debajo de la dosis acumulada de riesgo de toxicidad cardiaco). Además se ha evitado en la planificación del tratamiento del uso concurrente de antraciclinas y trastuzumab, dada la evidencia de un aumento del riesgo de cardiotoxicidad del uso24.
Respecto a la toxicidad observada, la más frecuente fue la astenia, básicamente en relación a la administración de docetaxel. La epidermolisis observada en manos y pies siendo muy dolorosa para las pacientes no supuso riesgo vital y todas las que lo sufrieron se recuperaron completamente, el tratamiento aplicado fue hidratación tópica abundante y analgesia vía oral. Dicha toxicidad que no se suele observar habitualmente en la administración cada 21 días del docetaxel, la creemos por tanto relacionada a la administración con densidad de dosis de dicha quimioterapia.
Conclusiones
Con una pCR en mama y axila del 29% y sólo en mama del 36%, el tratamiento neoadyuvante con densidad de dosis de adriamicina-ciclofosfamida seguido por docetaxel (junto a trastuzumab si hay sobrexpresión de Her-2) es altamente eficaz.
Aunque bien tolerado en general, se ha observado un número significativo de casos con epidermolisis en manos en relación a la administración con densidad de dosis del docetaxel, por lo que en futuros estudios recomendamos la administración de docetaxel cada 21 días.
Conflicto de intereses
Los autores declaran que no tienen ningún conflicto de intereses.
Historia del artículo:
Recibido el 26 de diciembre de 2011 Aceptado el 11 de abril de 2012
* Autor para correspondencia.
Correo electrónico:
blancaslb@hotmail.com (I. Blancas).