El cáncer de ovario presenta alta prevalencia con 238.719 casos reportados a nivel mundial, cuya mortalidad alcanza y supera el 50%, siendo la mayor causada por cáncer ginecológico.
ObjetivoDescribir las características de las pacientes diagnosticadas o tratadas por cáncer de ovario en el Servicio de Ginecología Oncológica del Hospital de San José en el periodo 2009-2013.
Materiales y métodosSerie de casos retrospectiva.
ResultadosSe incluyeron 68 pacientes con edad promedio de 49 años (DE: 15,5, mínima: 14 y máxima: 82); 57,5% (n=39) fueron posmenopáusicas. El tipo histológico seroso papilar fue el más común en pre y menopáusicas. El 70,6% se diagnosticaron en estadios iii-iv. Se logró citorreducción óptima (R1) o total (R0) en el 40,9%. Se administró quimioterapia adyuvante al 74,24%. La supervivencia libre de recurrencia fue de 63,23% y la supervivencia global de 54,41%.
ConclusiónEn nuestra población el cáncer de ovario se diagnosticó en edades más tempranas que lo reportado a nivel mundial. Coincidiendo con la literatura la histología más frecuente fue el seroso papilar, que se detectó en etapas avanzadas y con alta mortalidad.
Ovarian cancer has high prevalence, with 238,719 cases reported worldwide. The death rate is greater than 50%, and accounts for the most cancer deaths from gynaecological tumours.
ObjectiveTo describe the features of patients diagnosed or treated for ovarian cancer at the Oncological Gynaecology Department of the Hospital de San José during the period 2009-2013.
Materials and methodsA retrospective case series.
ResultsA total of 68 patients were included, with a mean age of 49 years (SD 15.5: range: 14 - 82), of whom 39 (57.5%) were post-menopausal. Serous papillary tumours were the most common histology in pre- and menopausal patients, with 70.6% being diagnosed in stages III-IV. Optimal cytoreduction (R1) or total cytoreduction (R0) was achieved in 40.9%. Adjuvant chemotherapy was administered to 74.24%. Tumour-free survival rate was 63.23%, and overall survival rate was 54.41%.
ConclusionIn our population, ovarian cancer is diagnosed at a more early age than that reported in the world literature. Coinciding with the literature, the serous papillary histotype in advanced stages is the most frequently detected type with a high mortality rate.
El cáncer de ovario es la cuarta causa de neoplasias malignas en las mujeres, siendo antecedido por los de mama, cérvix y útero1,2. A nivel mundial, según Globocan, en 2012 hubo 238.719 casos de cáncer de ovario, con 151.905 muertes asociadas1,2. En Colombia es la tercera causa de cáncer en mujeres, con incidencia del 3,9% y mortalidad del 4,6%, localizándolo después del cáncer de mama y del cáncer cérvico-uterino. Para el 2012 fueron reportados 1.438 casos y 883 muertes1,2.
Debido a la falta de pruebas diagnósticas adecuadas para realizar la detección temprana, muchos casos se presentan en etapas avanzadas, en las cuales la supervivencia a 5 años es del 30% a 40%3, lo que explica la alta mortalidad de esta enfermedad. Cerca del 80% son diagnosticados en mujeres mayores de 60 años4,5.
Entre los factores de riesgo tenemos, en orden descendente3,6: a) mutaciones de BRCA1 y BRCA2; b) cáncer colorrectal no polipósico hereditario; c) endometriosis; d) nuliparidad; e) índice de masa corporal elevado; f) menarquia temprana o menopausia tardía; y g) exposición perineal al talco. Es importante mencionar que las mutaciones en los genes BRCA1 y BRCA2 son responsables del 10% al 15% de los casos de cáncer de ovario.
En relación con el origen histológico de la célula tumoral, en la anatomía ovárica existen 4 categorías de tumores ováricos, a saber6–8: a) tumores epiteliales (65-70%); b) de los cordones sexuales-estroma ovárico (8%); c) germinales (15-20%); y d) metastásicos (5%).
Se ha reportado un importante aumento en la supervivencia por estadio, que se puede explicar por un mejor entendimiento de la enfermedad, a las mejoras en las técnicas quirúrgicas, la experiencia actual con la quimioterapia y el surgimiento de nuevas moléculas para terapia, como es la anti-angiogénica y la terapia para blancos moleculares, entre otras9.
Muchos de estos nuevos conocimientos se basan en el estudio histopatológico y del conocimiento de las alteraciones genéticas y moleculares. Así, se ha dividido el cáncer ovárico en 2 grupos, siendo los tumores del tipo i (los carcinomas seroso de bajo grado, mucinoso, endometrioide y de células claras y el tumor maligno de Brenner) por lo general indolentes y con un crecimiento lento; y los del tipo ii (los carcinomas serosos de alto grado, el carcinoma indiferenciado y el carcinosarcoma), tumores con crecimiento rápido y más agresivos4,6,10.
El abordaje inicial y el éxito del tratamiento de las pacientes con masas anexiales depende mucho de la evaluación minuciosa de la historia clínica, el examen físico, las pruebas de laboratorio y las imágenes pertinentes.
Los síntomas iniciales suelen ser la sensación de masa abdominal o una que es palpable durante el examen físico, la distensión abdominal, la sensación de inflamación abdominal, el dolor abdominal, la saciedad o plenitud posprandial y la urgencia o frecuencia urinaria1,3,4,8,11. De estos, los más frecuentes son la distensión y el dolor abdominales8.
Es de suma importancia que las pacientes con sospecha y diagnóstico de cáncer de ovario sean operadas y manejadas por ginecólogos oncólogos, ya que hay una correlación directa entre la citorreducción óptima (R0, R1) y la supervivencia. Existen varios estudios que abordan dicho tema y se han creado varios sistemas de puntuación para establecer el riesgo de malignidad en aquellas con masas anexiales, que incluyen el estado menopáusico, variables ecográficas, CA125, HE-4 y otros12–20.
El objetivo de la cirugía debe ser la estadificación según las recomendaciones de la FIGO3,12 y la citorreducción óptima (residuo tumoral<1cm) o la total (R=0). Un análisis de 3 estudios multicéntricos aleatorios prospectivos de fase 3, con 3.126 pacientes, demostró que existía una mejoría en la supervivencia libre de progresión y la supervivencia global cuando el residuo tumoral, después de la citorreducción primaria, era de 0, comparado con 1-10mm (hazard ratio [HR]) para supervivencia libre de progresión de 2,52 (IC 95%: 2,26-2,81) y un HR para la supervivencia global de 2,70 (IC 95%: 2,37-3,07)21.
Existen controversias entre el uso de quimioterapia neoadyuvante versus citorreducción primaria en casos de cáncer de ovario avanzados. El estudio de Vergote22 concluyó que no existían diferencias en supervivencia global entre las pacientes con cáncer de ovario IIIC o iv a quienes se les ofreció quimioterapia neoadyuvante y aquellas a quienes se sometió a cirugía citorreductora primaria. Otro estudio23 que incluyó 278 pacientes evaluó el efecto de la cirugía citorreductora después de quimioterapia de inducción en cáncer de ovario epitelial avanzado. Reportaron 140 pacientes a quienes se les practicó cirugía y 138 a quienes no se les realizó. Encontraron mejoría de 6 meses en la supervivencia global y en la libre de progresión en el grupo sometido a cirugía. En el mismo sentido, no encontraron diferencias en cuanto a morbimortalidad asociada con la cirugía.
Considerando los avances en las técnicas y los abordajes multidisciplinarios que involucra una citorreducción total, la cirugía de citorreducción primaria sigue siendo el objetivo de consideración primordial en este grupo de pacientes con cáncer de ovario avanzado, sin demeritar la quimioterapia neoadyuvante.
En pacientes con cáncer de ovario temprano y alto riesgo de recurrencia (etapas IB/C con grados 2/3 o cualquier tumor grado 3 o con histología de células claras) aun con citorreducción óptima, y en aquellas pacientes con tumores en etapas ii-iv, es recomendada la quimioterapia adyuvante11,24. Los esquemas actuales contienen paclitaxel 175mg/m2 y carboplatino ABC 6-5, administrados por vía iv cada 3 semanas, por lo general en 6s ciclos. En pacientes con tumores en etapas ii y iii, en las cuales se logró citorreducción con tumores<1cm, existe la alternativa de quimioterapia combinada intraperitoneal/endovenosa con cisplatino-paclitaxel.
El seguimiento debe ser realizado con visitas cada 2 a 4 meses durante 2 años, luego cada 3 a 6 meses durante 3 años y luego anualmente, e incluye24: a) examen físico; b) CA125 u otros marcadores dependiendo de su valor inicial; c) referencia para valoración genética; d) hemograma completo y perfil químico según indicación; e) TAC de tórax/abdomen/pelvis; f) RMN, PET-TAC o PET, según lo indicado clínicamente; y g) RX de tórax.
Materiales y métodosEl diseño del presente estudio correspondió a una serie de casos con temporalidad retrospectiva. Luego de la aprobación por parte del comité de ética, se realizó la búsqueda de las historias clínicas de las pacientes, utilizando los códigos CID10 para tumores del ovario (C56, C79.6, D07.3, D27, D39.1). Incluimos los códigos para tumores benignos del ovario (D27) y de tumores de comportamiento incierto del ovario (D39.1) para evitar subregistros debido a equivocaciones en la tabulación de los expedientes clínicos, o faltas en la actualización de los diagnósticos iniciales o de sospecha.
Se consideró como población objeto a todas las pacientes que fueron diagnosticadas o tratadas en el Hospital de San José de Bogotá D.C. por cáncer de ovario, entre enero de 2009 y diciembre de 2013. Los criterios de exclusión fueron las pacientes con enfermedad ovárica benigna y las pacientes con diagnóstico de tumores borderline del ovario. Los investigadores crearon un formato de recolección de datos para esta investigación.
Se realizó la revisión de historias clínicas físicas y electrónicas; en aquellos casos donde hicieran falta datos se procedió a llamar a las pacientes o a las personas responsables, con el fin de realizar los registros correspondientes. Se creó una base datos en Excel® y el análisis estadístico de la información se realizó en Stata 12.0®.
Se hizo un análisis descriptivo. Las características demográficas y clínicas se resumieron con frecuencias, medidas de tendencia central y de dispersión, según el tipo de variable, la asociación entre los antecedentes personales y familiares de cáncer con el tipo histológico, y el antecedente de endometriosis con el tipo histológico mediante porcentajes. Se reportó la frecuencia absoluta y relativa de los tipos histológicos, la estadificación y el tipo de tratamiento ofrecido. Para describir la supervivencia libre de progresión y la supervivencia global se utilizó una gráfica de Kaplan-Meier.
ResultadosDurante el periodo 2009-2013 se identificaron 142 historias clínicas con diagnóstico de cáncer de ovario, pero 61 expedientes referían enfermedad benigna o tumores borderline. De las 81 historias clínicas fue necesario excluir 13 debido a la inexistencia del registro del diagnóstico histológico o faltantes del tratamiento o seguimiento. El análisis se realizó con 68 pacientes.
EdadLa edad promedio en el momento del diagnóstico fue de 49 años (DE: 15,5, mínima: 14 y máxima: 82). La paciente con menor edad, 14 años, fue diagnosticada de un tumor germinal mixto en estadio IC. Se le ofreció cirugía de citorreducción óptima y adyuvancia con bleomicina, etopósido y cisplatino debido a factores de riesgo. Se encuentra viva en la actualidad y sin recurrencia.
Índice de masa corporalSiete pacientes presentaron obesidad; 3 fueron diagnosticadas de carcinoma seroso papilar (2 en estadio iii y una en estadio iv) y una con tumor de células claras (estadio IIIC). De estas pacientes 3 se encuentran vivas, y una falleció (carcinoma seroso papilar IIIb). Las 3 obesas restantes tuvieron diagnósticos de adenocarcinoma mucinoso (IA), tumor de células de Leydig (IA) y tumor de células de la granulosa del adulto (IC). Todas tuvieron una adecuada evolución y se encuentran vivas en el momento del estudio. En nuestro grupo de estudio encontramos una paciente con delgadez severa (IMC=15); padecía de una condición genética caracterizada por ausencia de caracteres sexuales secundarios y de menarquia. Su diagnóstico fue de tumor del seno endodérmico en estadio IV. Falleció 56 días después del diagnóstico.
MenarquiaLa edad promedio de la menarquia fue de 13 años (DE: 1,3); 4 la tuvieron antes de los 13 años (9-11 años). La paciente con menarquia a los 9 años era obesa, tuvo diagnóstico de carcinoma seroso papilar IIIB y falleció 3 años después del diagnóstico.
Embarazos y lactancia maternaCincuenta pacientes tuvieron al menos un embarazo; todas refirieron lactancia materna, excepto una que terminó en aborto; 18 (26,4%) negaron embarazos; de estas, 10 pacientes (55%) fueron diagnosticadas de tumores con histología adversa y en estadios avanzados.
MenopausiaEl 57,3% (n=39) de la población fue menopáusica, con edad promedio de aparición a los 49 años (DE: 4,1). De las 39 pacientes 4 (10%) alcanzaron la menopausia después de los 55 años. Tres de ellas fueron diagnosticadas de carcinoma seroso papilar en estadio avanzado (IIIC y IV). Solo una se encuentra viva en el momento del estudio.
EndometriosisEn ninguno de los casos estudiados se reportó el antecedente de endometriosis.
Antecedente personal de cáncerTres pacientes reportaron antecedente personal de cáncer. Los tipos de cáncer indicados fueron: mama (2) y meningioma (una), todas con carcinoma seroso papilar de ovario.
Antecedente familiar de cualquier tipo de cáncerEl 17,65% (n=12) reportó antecedente familiar de cáncer. La frecuencia fue: 3 con cáncer de ovario, 2 de colon, 2 de mama, una gástrico, una de tiroides y otra de pulmón. Dos pacientes reportaron más de un antecedente familiar de cáncer: una con 2 familiares con cáncer (endometrio y vesícula biliar) y otra 3 (ovario, gástrico y hepático). Esta última paciente tuvo pruebas para mutaciones BRCA1 y BRCA2 negativas y el diagnóstico fue carcinoma seroso papilar de alto grado.
Anticonceptivos oralesSolo 2 pacientes reportaron ser usuarias de anticonceptivos orales.
Infertilidad y tratamientoNinguna paciente tuvo antecedente de infertilidad o tratamiento para la misma.
Estadio de la Federación Internacional de Ginecología y ObstetriciaEl 70,6% (n=48) de la población fue diagnosticada en estados avanzados (iii-iv).
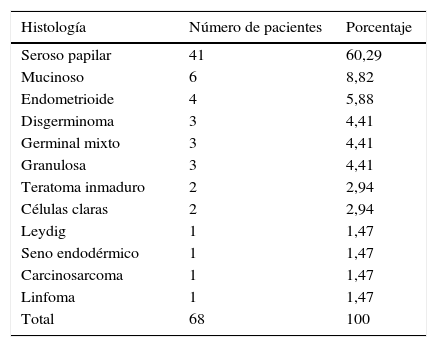
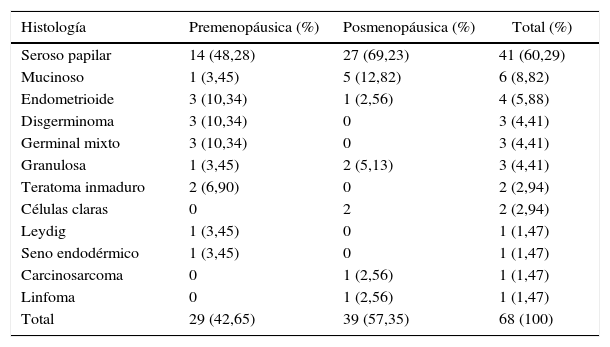
HistologíaEl 60% (n=41) fue diagnosticada con carcinoma seroso papilar; el 69,2% (n=27) eran menopáusicas y el 48,2% (n=14) de las premenopáusicas presentaron esta histología. Coincidiendo con lo esperado los tumores de células germinales (disgerminoma, seno endodérmico y teratoma inmaduro) solo ocurrieron en premenopáusicas, y a excepción de la paciente con tumor del seno endodérmico fueron diagnosticados en etapas iniciales (tablas 1 y 2).
Histología y frecuencia
| Histología | Número de pacientes | Porcentaje |
|---|---|---|
| Seroso papilar | 41 | 60,29 |
| Mucinoso | 6 | 8,82 |
| Endometrioide | 4 | 5,88 |
| Disgerminoma | 3 | 4,41 |
| Germinal mixto | 3 | 4,41 |
| Granulosa | 3 | 4,41 |
| Teratoma inmaduro | 2 | 2,94 |
| Células claras | 2 | 2,94 |
| Leydig | 1 | 1,47 |
| Seno endodérmico | 1 | 1,47 |
| Carcinosarcoma | 1 | 1,47 |
| Linfoma | 1 | 1,47 |
| Total | 68 | 100 |
Histología y estado menopáusico
| Histología | Premenopáusica (%) | Posmenopáusica (%) | Total (%) |
|---|---|---|---|
| Seroso papilar | 14 (48,28) | 27 (69,23) | 41 (60,29) |
| Mucinoso | 1 (3,45) | 5 (12,82) | 6 (8,82) |
| Endometrioide | 3 (10,34) | 1 (2,56) | 4 (5,88) |
| Disgerminoma | 3 (10,34) | 0 | 3 (4,41) |
| Germinal mixto | 3 (10,34) | 0 | 3 (4,41) |
| Granulosa | 1 (3,45) | 2 (5,13) | 3 (4,41) |
| Teratoma inmaduro | 2 (6,90) | 0 | 2 (2,94) |
| Células claras | 0 | 2 | 2 (2,94) |
| Leydig | 1 (3,45) | 0 | 1 (1,47) |
| Seno endodérmico | 1 (3,45) | 0 | 1 (1,47) |
| Carcinosarcoma | 0 | 1 (2,56) | 1 (1,47) |
| Linfoma | 0 | 1 (2,56) | 1 (1,47) |
| Total | 29 (42,65) | 39 (57,35) | 68 (100) |
La mediana del tiempo entre la sospecha diagnóstica y el tratamiento inicial fue de 13 días (rangos intercuartílicos: 4,5-31,5). Llama la atención que el 16,18% (n=11) tuvo un tratamiento rápido debido a su cuadro clínico, muy sugestivo de cáncer, y en algunos casos con cuadro de abdomen agudo. En otros el tiempo entre la sospecha diagnóstica y el tratamiento fue mayor de 90 días, y en una paciente fue de un año. En cada caso la demora se asoció con trámites administrativos de sus EPS.
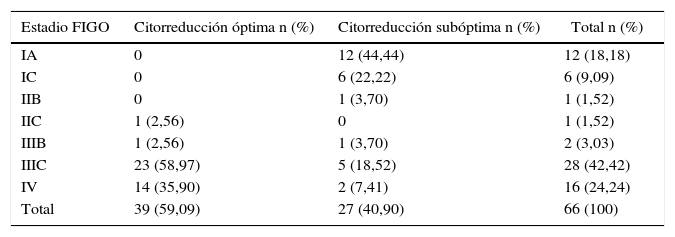
TratamientoSesenta y cinco pacientes (97%) fueron tratadas con cirugía de citorreducción primaria; solo se logró una óptima (R0 o R1) en el 40,9% (n=27) de los casos. A 2 se les ofreció neoadyuvancia y al 74,2% (n=49) quimioterapia adyuvante. La mortalidad por cáncer de ovario fue del 50% (34 pacientes). Esto puede explicarse por el alto porcentaje de pacientes diagnosticadas en etapas avanzadas, donde la mortalidad es alta y el hecho de no haber logrado una citorreducción óptima (tabla 3).
Citorreducción y estadio FIGO
| Estadio FIGO | Citorreducción óptima n (%) | Citorreducción subóptima n (%) | Total n (%) |
|---|---|---|---|
| IA | 0 | 12 (44,44) | 12 (18,18) |
| IC | 0 | 6 (22,22) | 6 (9,09) |
| IIB | 0 | 1 (3,70) | 1 (1,52) |
| IIC | 1 (2,56) | 0 | 1 (1,52) |
| IIIB | 1 (2,56) | 1 (3,70) | 2 (3,03) |
| IIIC | 23 (58,97) | 5 (18,52) | 28 (42,42) |
| IV | 14 (35,90) | 2 (7,41) | 16 (24,24) |
| Total | 39 (59,09) | 27 (40,90) | 66 (100) |
De las pacientes estudiadas 2 recibieron neoadyuvancia, y por tanto no aparecen en esta tabla.
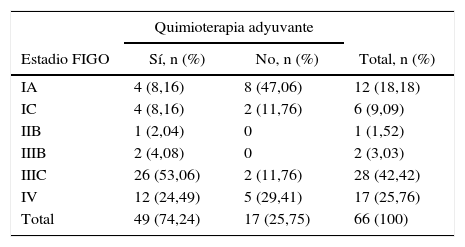
A las pacientes en estadios FIGO temprano y sin factores de riesgo no se les administró quimioterapia adyuvante (tabla 4).
Quimioterapia adyuvante y estadio FIGO
| Quimioterapia adyuvante | |||
|---|---|---|---|
| Estadio FIGO | Sí, n (%) | No, n (%) | Total, n (%) |
| IA | 4 (8,16) | 8 (47,06) | 12 (18,18) |
| IC | 4 (8,16) | 2 (11,76) | 6 (9,09) |
| IIB | 1 (2,04) | 0 | 1 (1,52) |
| IIIB | 2 (4,08) | 0 | 2 (3,03) |
| IIIC | 26 (53,06) | 2 (11,76) | 28 (42,42) |
| IV | 12 (24,49) | 5 (29,41) | 17 (25,76) |
| Total | 49 (74,24) | 17 (25,75) | 66 (100) |
A todas las que estaban en etapa avanzada se les ordenó quimioterapia adyuvante basada en platinos y taxanos. En caso de recurrencia los esquemas utilizados fueron con doxorrubicina liposomal, gemcitabina y bevacizumab. Los casos donde no se administró quimioterapia adyuvante se debieron a fallecimiento y al deseo de la paciente o su representante de no administrarla. Para los tumores germinales, en caso de requerir adyuvancia, se utilizó el esquema bleomicina, etopósido y cisplatino.
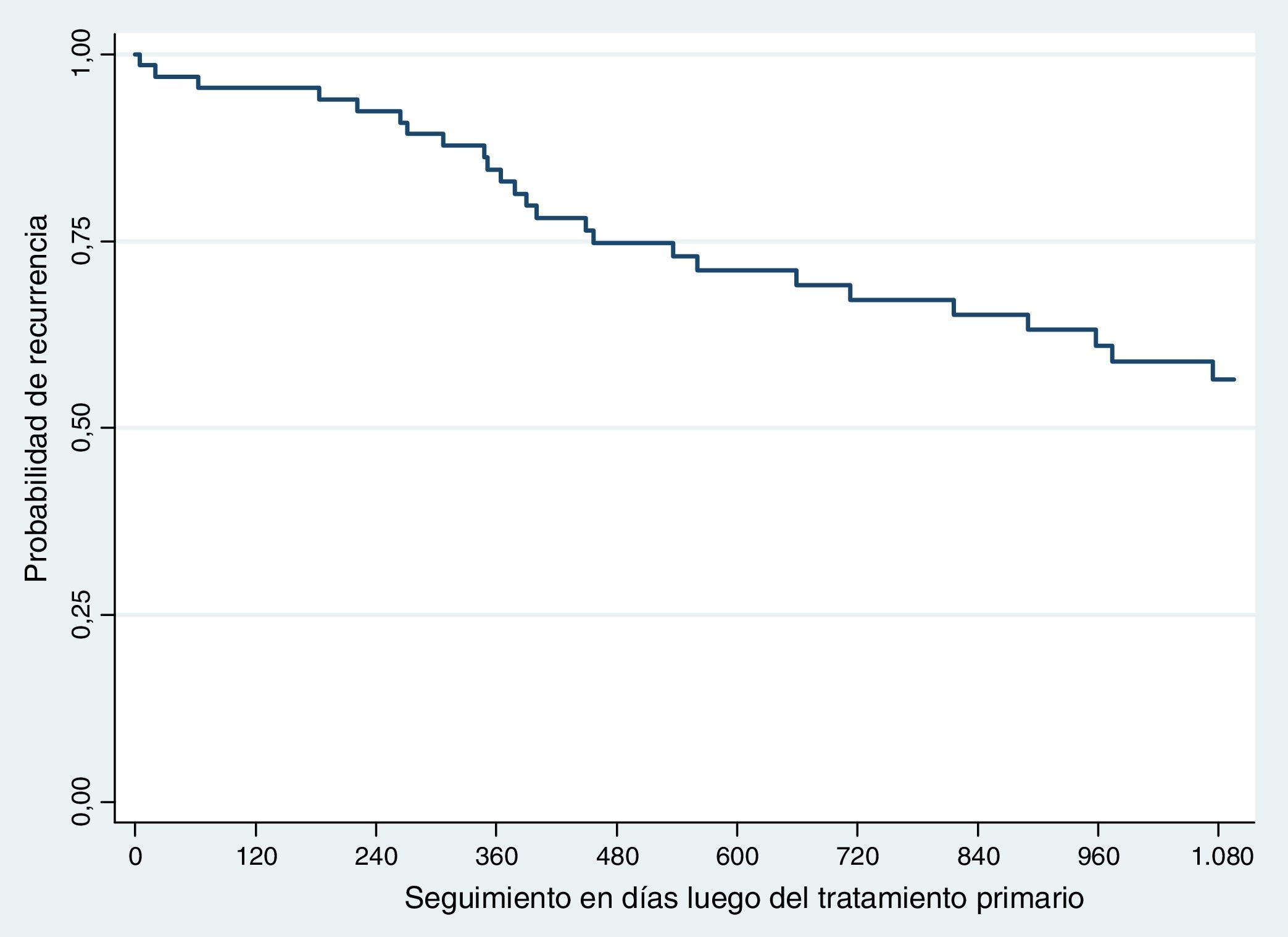
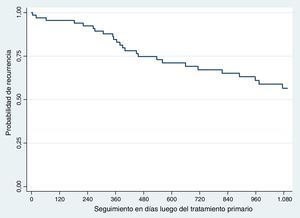
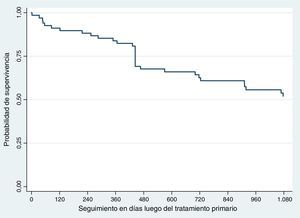
RecurrenciaLa recurrencia global fue del 41,17% (n=28). La recurrencia a 3 años fue del 36,76% (n=25) y la supervivencia libre de recaída del 63,23% (fig. 1).
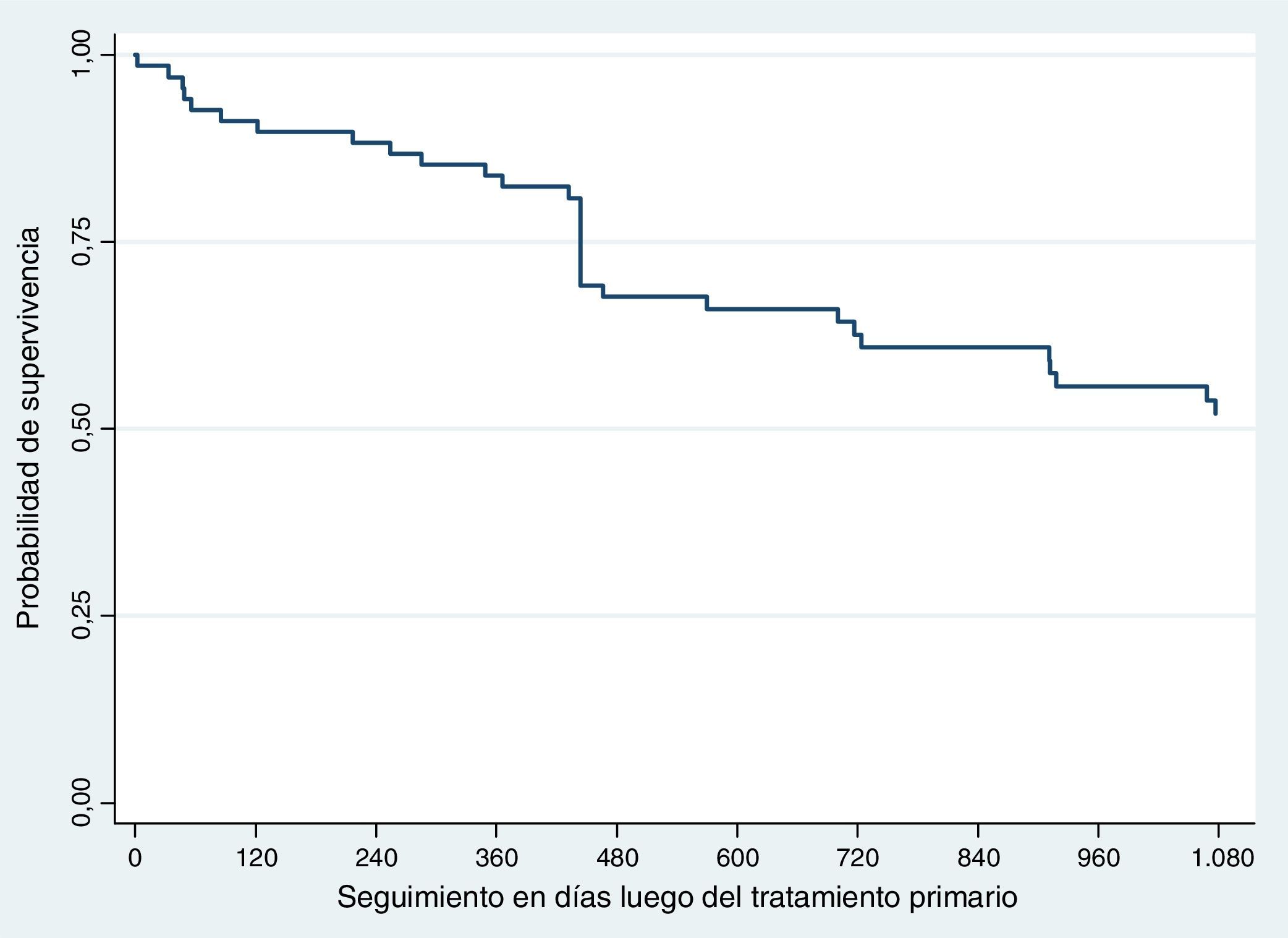
SupervivenciaHubo 31 defunciones durante los primeros 3 años de seguimiento. La supervivencia global fue del 54,41% (n=37) (fig. 2).
DiscusiónNuestro estudio buscaba describir las características demográficas de las pacientes, como estado socioeconómico y escolaridad, sin embargo no encontramos estos datos en ninguna historia clínica. No existen estudios que establezcan una asociación entre el estado socioeconómico o la escolaridad y el riesgo de padecer cáncer de ovario, pero podríamos pensar que a menor estado socioeconómico y a menor escolaridad, menor será el conocimiento sobre esta enfermedad, sus signos y síntomas, y mayor será el umbral de alarma antes de acudir a un centro de atención médica, con la consecuencia del retraso en el diagnóstico y en el tratamiento.
La edad promedio de diagnóstico en nuestro estudio fue 49 años (DE: 15,5, mínima: 14 y máxima: 82), menor de lo descrito en la literatura, que es 60 años5,8,11. Existen múltiples factores de riesgo asociados con el cáncer de ovario, siendo el más importante la historia familiar de cáncer de ovario, mama o colon, y las mutaciones de genes BRCA1 y BRCA25,8,11. En nuestro estudio solo encontramos datos sobre estos 2 últimos en una paciente y con resultados negativos. Ninguna con antecedente personal de cáncer presentó cáncer de ovario en edad temprana. Una paciente con antecedente familiar de cáncer de colon y otra de ovario fueron diagnosticadas a los 34 años (tumor de Leydig) y 19 años (seno endodérmico). Un porcentaje importante de las estudiadas fueron nuligestas (26,4%). Existen estudios que muestran el papel protector de los embarazos, con reducción de riesgo del 40% con un embarazo y uno de cerca del 10% con cada embarazo siguiente25; de igual forma, la lactancia materna se asoció con una reducción del 30% en el riesgo de cáncer de ovario25. Es probable que la suma de estos factores y más no establecidos en las historias clínicas (genéticos, ambientales, fallo en la historia clínica, etc.) explicarían la menor edad de aparición del cáncer de ovario en las pacientes de nuestro estudio.
Existe un metaanálisis que analizó los efectos de la obesidad en la supervivencia de las pacientes con cáncer de ovario26. Encontraron una asociación inversa entre obesidad y supervivencia (HR=1,17, IC 95%: 1,03-1,34). La mayor parte de nuestra población presentó un índice de masa corporal normal. En las 7 con obesidad no encontramos diferencia significativa en cuanto a la supervivencia.
El carcinoma seroso papilar fue el diagnóstico más frecuente en la población estudiada (60%), todos de alto grado, y fue el más común tanto en pacientes pre como posmenopáusicas. En las menores de 30 años los más frecuentes fueron los tumores de células germinales, lo cual coincide con la literatura3,4,9,11.
El diagnóstico en estadios avanzados también coincidió con la literatura internacional, y corresponde con la falta de pruebas de tamizaje y a la presencia de signos y síntomas solo cuando la enfermedad se encuentra en etapas avanzadas5,11. La supervivencia en estos casos (iii-iv) es cercana al 30%. Se ha descrito que con la citorreducción total (R0) u óptima con residuo menor de 1cm (R1), el porcentaje de supervivencia podría alcanzar hasta 50%, aun en etapa iii11,27. En nuestro estudio, la supervivencia a 3 años fue de 54,41% (n=37), lo cual se asocia con el porcentaje de citorreducción óptima (40,9%), el alto número de histologías adversas (60%) y el diagnóstico en etapas avanzadas (70,6%).
Concluimos que el carcinoma de ovario es una enfermedad de gran interés en nuestra población y cursa con alta mortalidad. Múltiples factores de riesgo contribuyen al desarrollo de esta enfermedad, siendo la historia personal, la familiar y las mutaciones de BRCA1 y BRCA2 los factores de riesgo más importantes. No existen pruebas de tamizaje establecidas para el diagnóstico temprano del cáncer de ovario. Hay índices de riesgo de malignidad que permiten saber qué pacientes deben ser manejadas por un ginecólogo oncólogo y cuáles por el ginecólogo general. En cuanto al tratamiento, el objetivo más importante es la citorreducción óptima (R1) o total (R0), lo cual se traduce en una mejoría en la supervivencia global y en la libre de progresión. El abordaje quirúrgico, por lo tanto, debe realizarlo un equipo multidisciplinario capaz de garantizar el mayor esfuerzo citorreductor posible. Para estadios avanzados en pacientes que no sean candidatas para citorreducción, la quimioterapia neoadyuvante es una estrategia adecuada y de aceptación internacional.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.