La inmunofluorescencia en tejidos fijados y preservados en parafina (IF-P), al igual que la inmunohistoquímica (IHQ) y la inmunofluorescencia (IF), tiene como objetivo localizar antígenos a través de la unión antígeno-anticuerpo. Esta técnica es poco conocida en la patología quirúrgica, su utilidad ha sido principalmente en estudios experimentales. El objetivo de este artículo es revisar los conceptos básicos de la IF-P, conocer sus ventajas y desventajas frente a la IF y la IHQ, al igual que las posibles aplicaciones en el campo de la patología quirúrgica.
The objective of immunofluorescence labelling of paraffin-fixed and embedded tissue sections (IF-P), as well as of immunohistochemistry (IHC) and immunofluorescence (IF) staining, is to detect the presence of antigens using the antigen-antibody interaction. This technique is little- known in surgical pathology for it has primarily been used in experimental studies. This article aims to review the basic concepts of IF-P, and identify its advantages and disadvantages compared with IF and IHC, and its possible applications in the surgical pathology field.
La inmunohistoquímica (IHQ) y la inmunofluorescencia (IF) son técnicas fundamentales en el campo de la patología quirúrgica, ya sea para el diagnóstico de múltiples patologías o para conocer la expresión de una determinada proteína en un tumor específico con impacto pronóstico y/o terapéutico1.
Tradicionalmente en la patología quirúrgica la utilidad de la IF ha sido en tejidos criopreservados, mientras que la IHQ ha sido utilizada en tejidos fijados e incrustados en parafina. Sin embargo, existe otra técnica poco conocida en la patología quirúrgica, la cual es híbrida entre estas dos y es conocida como inmunofluorescencia en tejidos fijados y preservados en parafina (IF-P). Esta técnica ha sido descrita desde los años 60 del sigloXX2 y, al igual que la IHQ y la IF, el objetivo de la IF-P es localizar los antígenos a través de la unión antígeno-anticuerpo en tejido fijado e incrustado en parafina. Su utilidad ha sido principalmente en estudios experimentales3. Por tal motivo, el objetivo de este artículo es revisar los conceptos básicos de la IF-P, conocer sus ventajas y desventajas frente a la IF y la IHQ, al igual que las posibles aplicaciones en el campo de la patología quirúrgica.
Protocolos y factores que afectan la interpretaciónA igual que en la IHQ y en la IF, en la IF-P existen dos métodos de detección del antígeno4: ya sea con marcaje conjugado directo, en donde el anticuerpo primario está marcado con un fluorocromo con especificidad para el antígeno, o con un método conjugado indirecto (sándwich), en donde el anticuerpo primario reconoce el antígeno y el anticuerpo secundario marcado con un fluorocromo reconoce el anticuerpo primario. Para que exista una mejor especificidad en el reconocimiento del anticuerpo primario con el secundario se han implementado técnicas como la unión de proteínas como la biotina y la avidina4.
En la literatura se han descrito una variedad de protocolos para la IF-P, bien sea con marcaje conjugado directo, o bien indirecto2,5-10. En la tabla 1 mostramos los dos tipos de protocolos. Hasta la fecha no se conocen las ventajas de una técnica frente a la otra en IF-P. En IHQ es conocido que el método directo tiene la desventaja de tener mayor inespecificidad para la detección de un antígeno específico, además de necesitar mayor concentración de anticuerpo en comparación con el método indirecto4.
Protocolos de inmunofluorescencia en parafina (IF-P)
| Inmunofluorescencia directa |
| Cortes del bloque de parafina de 3 a 4μm en láminas cargadas |
| Dejar toda la noche en el horno a 37°C (o a 60°C por 15min)a |
| Desparafinar y rehidratar el tejido. Xylol, etanol y agua destilada |
| Realizar inmersión del tejido en Tris EDTA pH9 por 30min en temperatura ambienteb o realizar enjuague con EnVision FlexWash Buffer (Dako)a |
| Digestión enzimática con proteinasaK a temperatura ambiente de 15 a 20min |
| Detener la digestión con Tris EDTA a 4°Cb |
| Dejar en Tris EDTA a 4°C por 40minb |
| Enjuagar en PBS durante 10minb |
| Aplicar anticuerpos policlonales conjugados con FITC. Incubar durante 2hb o 30mina en una cámara húmeda en la oscuridad |
| Enjuagar en PBS 40°C por 10mina |
| Montar la lámina con glicerina o con vectashield |
| Almacenar las láminas a 4°C y protegidas de la luz hasta su visualización con microscopio confocal |
| Inmunofluorescencia indirecta |
| Realizar cortes del bloque de parafina de 3 a 4μm en láminas cargadas |
| Dejar toda la noche en el horno a 37°C (o a 60°C por 15min) |
| Desparafinar y rehidratar el tejido. Xylol, etanol y agua destilada |
| Recuperación antigénica por calor a 92°C aproximadamente durante 25min en buffer citrato de sodio 0,01M pH6 en vaporera (10min con EDTA-borato pH9,0c) |
| Bloquear con BSA 5% o caseína 0,25% en PBS1× |
| Delinear cada corte histológico con el lápiz hidrófobo |
| Incubar con el anticuerpo primario (uno o varios) en PBS1× a 4°C en una cámara húmeda en la oscuridadd |
| Enjuagar 3 veces con PBS1× por 5min |
| Incubar con el anticuerpo secundario (uno o varios) y DAPI por 1h a temperatura ambiente y protegido de la luz |
| Enjuagar 3 veces con PBS1× por 5min |
| Montar la lámina con glicerina o con vectashield |
Como en la mayoría de técnicas de laboratorio, es necesario estandarizar la prueba según el anticuerpo. El protocolo puede variar en tiempos de recuperación de antígeno, en tiempos de bloqueo, concentración del anticuerpo y en tiempos de conjugación del anticuerpo primario. Por lo tanto, al igual que en la IHQ, existen una serie de variables que hay que considerar al momento de realizar e interpretar una IF-P. En la tabla 2 se resumen estas posibles variables, y cada una de ellas es fundamental para obtener el resultado esperado. Hay que resaltar la relevancia que tiene la fase preanalítica. Dentro de ella se debe considerar el uso de un fijador adecuado de tejidos con apropiadas concentración y tiempo de fijación. Es fundamental evitar la sobrefijación del tejido. En la fase analítica es primordial utilizar un adecuado anticuerpo primario, para lo cual se pueden utilizar bases de datos online (tabla 3), literatura publicada y la información suministrada por las industrias11. Es primordial conocer el tipo de clon que se está utilizando en el anticuerpo primario (si es el mismo de la literatura publicada), la especie del reactivo (ratón, cabra, conejo, etc.), la dilución de la concentración, y la localización del anticuerpo en el tejido. De esta forma se logran disminuir los falsos positivos y negativos. Las bases de datos online son de mucha utilidad para escoger los controles positivo y negativo según la expresión proteica a nivel tisular.
Protocolo de estandarización
| Fase preanalítica |
| Retraso en poner las muestras en fijador |
| Tipo de fijador |
| Tiempo de fijación |
| Tipo y tiempo de descalcificación |
| Tipo de parafina |
| Tiempos y concentraciones de los reactivos del procesador de tejidos |
| Tiempo y temperatura al montar el tejido en la lámina |
| Selección de los anticuerpos primarios (clon, monoclonal o policlonalidad), la especie del reactivo (ratón, cabra, conejo, etc.), además de conocer si tiene utilidad para la IF-P indirecta (según las indicaciones de la casa industrial) |
| Selección del anticuerpo secundario (la especie del reactivo debe ser la misma del primario) |
| Conocer el color que emite el anticuerpo secundario (según el espectro de onda) |
| Optimización de los anticuerpos (cada anticuerpo tiene diferente concentración y diferente tiempo de incubación) |
| Concentraciones de las soluciones para la recuperación del antígeno y del bloqueo |
| Fase analítica |
| Conocer la localización del anticuerpo a nivel tisular y de esta manera evitar los falsos positivos y negativos |
| Utilizar controles positivos y negativos en cada prueba |
| Tener conocimiento del uso de microscopia con fluorescencia y de los softwares para evitar la autofluorescencia |
Datos online
| http://www.proteinatlas.org |
| http://www.antibodyregistry.org |
| http://www.biocompare.com/antibodies (South San Francisco, California) |
| http://www.antibodyresource.com (Cambridgeshire, Reino Unido) |
| http://www.antibodypedia.com (Solna, Suecia) |
Fuente: tabla modificada de Gown11.
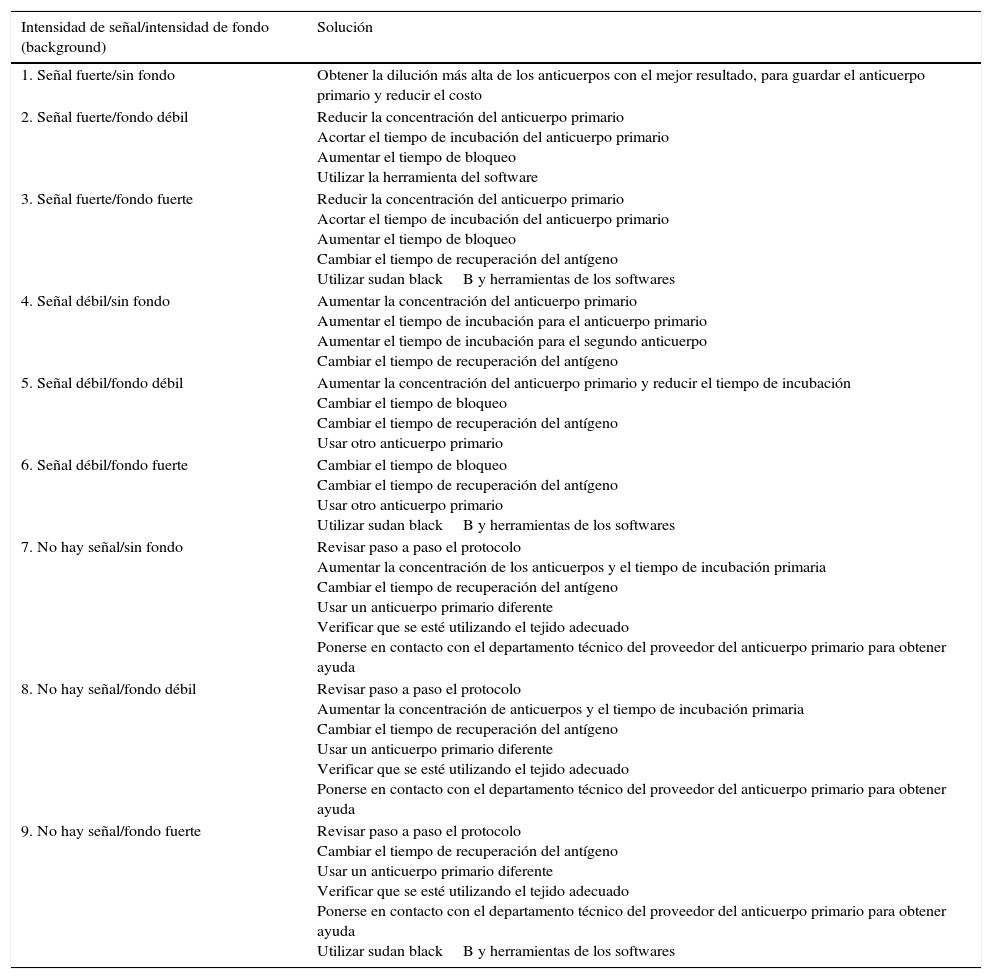
Hay diferentes escenarios que pueden surgir al momento de estandarizar un anticuerpo en IF-P, como lo son obtener una señal fuerte o débil, o no obtenerla; y cada uno de estos asociados a presencia fuerte o débil de fondo (background), o ausencia de fondo. En la tabla 4 mostramos las posibles soluciones12.
Escenarios al estandarizar un anticuerpo en inmunofluorescencia en parafina (IF-P)
| Intensidad de señal/intensidad de fondo (background) | Solución |
|---|---|
| 1. Señal fuerte/sin fondo | Obtener la dilución más alta de los anticuerpos con el mejor resultado, para guardar el anticuerpo primario y reducir el costo |
| 2. Señal fuerte/fondo débil | Reducir la concentración del anticuerpo primario Acortar el tiempo de incubación del anticuerpo primario Aumentar el tiempo de bloqueo Utilizar la herramienta del software |
| 3. Señal fuerte/fondo fuerte | Reducir la concentración del anticuerpo primario Acortar el tiempo de incubación del anticuerpo primario Aumentar el tiempo de bloqueo Cambiar el tiempo de recuperación del antígeno Utilizar sudan blackB y herramientas de los softwares |
| 4. Señal débil/sin fondo | Aumentar la concentración del anticuerpo primario Aumentar el tiempo de incubación para el anticuerpo primario Aumentar el tiempo de incubación para el segundo anticuerpo Cambiar el tiempo de recuperación del antígeno |
| 5. Señal débil/fondo débil | Aumentar la concentración del anticuerpo primario y reducir el tiempo de incubación Cambiar el tiempo de bloqueo Cambiar el tiempo de recuperación del antígeno Usar otro anticuerpo primario |
| 6. Señal débil/fondo fuerte | Cambiar el tiempo de bloqueo Cambiar el tiempo de recuperación del antígeno Usar otro anticuerpo primario Utilizar sudan blackB y herramientas de los softwares |
| 7. No hay señal/sin fondo | Revisar paso a paso el protocolo Aumentar la concentración de los anticuerpos y el tiempo de incubación primaria Cambiar el tiempo de recuperación del antígeno Usar un anticuerpo primario diferente Verificar que se esté utilizando el tejido adecuado Ponerse en contacto con el departamento técnico del proveedor del anticuerpo primario para obtener ayuda |
| 8. No hay señal/fondo débil | Revisar paso a paso el protocolo Aumentar la concentración de anticuerpos y el tiempo de incubación primaria Cambiar el tiempo de recuperación del antígeno Usar un anticuerpo primario diferente Verificar que se esté utilizando el tejido adecuado Ponerse en contacto con el departamento técnico del proveedor del anticuerpo primario para obtener ayuda |
| 9. No hay señal/fondo fuerte | Revisar paso a paso el protocolo Cambiar el tiempo de recuperación del antígeno Usar un anticuerpo primario diferente Verificar que se esté utilizando el tejido adecuado Ponerse en contacto con el departamento técnico del proveedor del anticuerpo primario para obtener ayuda Utilizar sudan blackB y herramientas de los softwares |
Fuente: tabla modificada de Lin y Chen12.
Las ventajas que tiene la IF-P frente a la IHQ son: i) mejor visualización de la localización del antígeno a nivel intracelular; ii) realizar tinción con dos o más colores en una misma muestra, cabe destacar que con la IHQ se puede realizar tinción dual en tejido parafinado13, sin embargo, su visualización no es tan precisa a nivel intracelular como la IF-P, y iii) realizar co-localización en un mismo componente intracelular, de esta manera se pueden visualizar marcadores múltiples en un mismo tejido realizando reconstrucciones tridimensionales y evitando imágenes contaminadas por la luz emitida fuera de foco, las cuales ocasionan falsos negativos.
Las ventajas que tiene la IF-P frente a la IF son: i) los tejidos preservados en parafina conservan su arquitectura morfológica, lo cual permite una mejor visualización ultraestructural; ii) los tejidos utilizados para IF deben estar criopreservados, lo cual causa dificultad para orientar la pieza; iii) existen algunos tejidos como el adiposo, hueso, y cartílago que son difíciles de manipular al momento de realizar criosección, y iv) la preservación del tejido en IF-P debe ser con un fijador y no criopreservado; esto permite una mejor accesibilidad al tejido, tanto para el cirujano como para el laboratorio de patología.
Las desventajas que tiene la IF-P frente a las otras dos técnicas convencionales son: i) la disponibilidad de tener un microscopio de fluorescencia, preferiblemente confocal; ii) la intensidad de la fluorescencia es menor en la IF-P en comparación con la IF convencional9, y iii) la autofluorescencia no específica del tejido, la cual podría tener errores diagnósticos; esta es secundaria a la reacción cruzada que tienen los aldehídos de la solución de fijación (formaldehído o glutaraldehído) con las proteínas derivadas del tejido y aminoácidos14. En donde más se ha observado autofluorescencia es en aquellos tejidos ricos en flavinas y flavoproteínas endógenas, en aquellos con abundante nicotinamida adenina dinucleótido fosfato (NADPH abreviada en su forma oxidada y NADPH+ en la reducida), y con pirofirinas y lipofuscina. Estos tejidos son principalmente el colágeno, la elastina y la mucina. Esta fluorescencia se reconoce principalmente a nivel intracelular en los lisosomas y en la mitocondria14,15. Para evitar esta autofluorescencia se ha propuesto utilizar sudan blackB14-16, fotoblanqueo o citrato cúprico17; otros autores recomiendan usar sudan blackB con dosis bajas de luz ultravioleta15. Otras formas de evitar la autofluorescencia es el uso de diferentes softwares computacionales, asociados con la visualización en microscopios confocales2,7.
Aplicación en el campo de la patología quirúrgicaHasta el momento no se conoce cuál es la indicación de la IF-P en el campo de la patología quirúrgica. Se ha propuesto que esta técnica podría tener implicaciones diagnósticas en dos contextos.
El primero de ellos en nefropatología, en donde la IF es fundamental para el diagnóstico definitivo histopatológico. Este campo de la patología, a diferencia de las otras, requiere una adecuada correlación entre los hallazgos observados en la microscopia de luz, en la electrónica y en la IF. Para tal motivo, es fundamental obtener tres biopsias con adecuado material. Sin embargo, en algunas ocasiones, el diagnóstico no se logra realizar por falta de material (ausencia de unidades glomerulares o la posibilidad de tener una biopsia pequeña la cual no es suficiente para enviar a los tres métodos diagnósticos). En estos casos es posible utilizar la muestra de luz (muestra incrustada en parafina) con presencia de unidades glomerulares para el estudio de IF. Para esto se ha propuesto la IF-P como método de salvamento diagnóstico y también se ha considerado como método para desenmascarar antígenos9,10. Messias et al.9 evaluaron 304 biopsias renales incrustadas en parafina, y utilizaron un método de IF-P directa con los diferentes anticuerpos utilizados en biopsias renales (IgA, IgG, IgM, C3, C4, C1q, fibrinógeno, y cadenas livianas kappa y lambda), observando que la IF-P fue útil como técnica de salvamento con contribución diagnóstica en el 11,6% de los pacientes con nefropatía, y que en el 30,4% esta técnica contribuyó en el diagnóstico. Además encontraron que esta IF-P asociada a digestión con pronasa puede ser útil para desenmascarar antígenos, observando que en el 26,2% de los casos el diagnóstico cambió después de aplicar esta técnica. Este procedimiento de desenmascarar antígenos a través de enzimas de digestión podría tener utilidad en las biopsias renales, cutáneas e incluso en casos de amiloidosis10. Sin embargo, son necesarios más estudios para conocer las indicaciones para utilizar esta técnica y los posibles falsos positivos y negativos en la interpretación.
La segunda utilidad con posible implicación clínica que se le ha atribuido a la IF-P es realizar un diagnóstico y un tratamiento individualizado. Es conocido que en oncología la localización a nivel celular tiene importancia diagnóstica, como por ejemplo con el HER-218,19. Con la ventaja que tiene la IF-P indirecta para lograr realizar múltiples epítopes en un mismo corte y en varios compartimentos celulares (núcleo, citoplasma o membrana), además de una mejor visualización ultraestructural, se podría conocer en una determinada entidad si la localización celular tiene importancia diagnóstica y/o pronóstica8. De esta manera se lograría diferenciar subfenotipos de enfermedades. Por ejemplo, en un determinado tumor con expresión basolateral tiene peor pronóstico y/o se asocia con alguna anormalidad genética determinada, o un determinado tumor con expresión apical tiene mejor respuesta al tratamiento dirigido.
ConclusiónEste método diagnóstico poco conocido por los patólogos puede tener utilidades diagnósticas. Es poco conocida la posibilidad que existe de realizar IF en tejido preservado en parafina, sin embargo, hay que recordar que la hibridación fluorescente in situ (FISH) se realiza en tejido preservado en parafina para la detección de alteraciones genéticas; de hecho, en la actualidad se está combinando la FISH con otras técnicas citogenéticas20.
La IF-P tiene algunas ventajas y desventajas, como lo mencionamos antes. Hay que considerar que la IF-P tiene las ventajas de las dos técnicas (IF e IHQ), como lo son: mayor accesibilidad a la muestra, preservación de las características estructurales, realizar una tinción multicolor con múltiples anticuerpos en un mismo corte y en varios compartimentos de una misma célula de interés, asociados con una mejor visualización ultraestructural. Sin embargo, es necesario estandarizar estas pruebas en cada laboratorio de patología y realizar más estudios para conocer cuál es el contexto más favorable para realizar la IF-P frente a la IHQ y la IF.
Es conocido que la patología en los últimos años ha cobrado una gran importancia en la patología personalizada, y por ende en la patología molecular. Por lo tanto, el patólogo moderno debe tener la capacidad de realizar diagnósticos con pruebas moleculares en el contexto de la morfología21. Así, estas ayudas diagnósticas, como las pruebas de inmunotinción (IHQ, IF, IF-P), tienen que ir en conjunto con las pruebas moleculares para llegar a un diagnóstico adecuado con implicaciones pronósticas22.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores expresan su agradecimiento a la Dra. María Julieta González, investigadora de la Universidad de Chile. De la misma manera, al grupo de laboratorio del Centro de Estudios de Enfermedades Autoinmunes de la Universidad del Rosario.
Este trabajo es parte de la convocatoria interna de semilleros de investigación de la Fundación Universitaria de Ciencias de la Salud, Bogotá, Colombia, en donde los Dres. Paula Moreno y Julián Jiménez fueron partícipes.