Identificar interacciones medicamentosas de los anticonvulsivantes de primera línea con antipsicóticos y/o antidepresivos y su impacto en el paciente con epilepsia en el Hospital de San José, Bogotá, que asistieron a la consulta externa desde el 1 de junio del 2015 hasta el 30 de abril del 2016.
Materiales y métodosEstudio descriptivo para identificar las interacciones medicamentosas en pacientes con epilepsia. Se incluyó a 26 pacientes ≥ 18 años con los criterios de la International League Against Epilepsy en terapia con antiepilépticos de primera línea asociados a medicamentos antipsicóticos y/o antidepresivos; se excluyó a embarazadas y aquellos con alteración hepática y renal. El análisis descriptivo se realizó por medio de frecuencias absolutas y relativas para las variables cualitativas, y para las cuantitativas medianas y rangos intercuartílicos.
ResultadosLa mediana de edad fue 49 años (RIC: 33-57), 14 (53,8%) eran mujeres. Antecedentes relevantes: hipoxia perinatal y traumatismo craneoencefálico en 5 (19,2%). La monoterapia anticonvulsivante más frecuente fue carbamazepina en 8 casos (30,8%). Dos que recibían carbamazepina presentaron leucopenia. Ninguno tuvo elevación de enzimas hepáticas. Los niveles séricos de los anticonvulsivantes en la mayoría se hallaron dentro del rango terapéutico.
Discusión y conclusionesSe describieron múltiples combinaciones de anticonvulsivantes con antipsicóticos y/o antidepresivos sin documentar toxicidad hepática, ni alteraciones hematológicas graves que indiquen cambio de terapia; la mayoría de los niveles séricos de anticonvulsivantes estaban dentro del rango terapéutico.
Identify drug interactions of old antiepileptic drugs with antidepressants and antipsychotics and its impact on the patient with epilepsy at the Hospital de San José in outpatient appointment from June 1st, 2015 to the april 30th, 2016.
Material and methodsA descriptive study was conducted to identify drugs interactions in patients diagnosed with epilepsy. The study involved patients over 18 years old with a diagnosis of epilepsy according to the International League Against Epilepsy criteria in therapy with first line antiepileptic drugs associated with antipsychotic drugs or/and antidepressants, excluded pregnant women, patients with hepatic and renal impairment. The statistic analysis of qualitative variables was performed using absolute and relative frequencies. Quantitative variables were analysed using medians and interquartile ranges.
ResultsWe included 26 patients with a median age of 49 years (IQR: 33-57), 14 were women (53.8%). The most relevant conditions on past medical history were perinatal hypoxia and brain trauma, both diagnosed on 5 patients (19.2%). The most frequently anticonvulsant monotherapy used was carbamazepine, which was prescribed on 8 patients (30.8%). Only two patients receiving carbamazepine presented leucopenia. None of the patients presented elevated liver enzymes. Anticonvulsant serum levels in most therapies were within the therapeutic range.
Discussion and conclusionsWe described multiple combinations of anticonvulsants with antipsychotics and/or antidepressants. No liver toxicity or serious hematologic abnormalities that could suggest a change on the therapy was documented. Furthermore, most anticonvulsants serum concentration remained within the therapeutic range.
La epilepsia es una enfermedad definida en la práctica clínica según la International League Against Epilepsy (ILAE) como una enfermedad neurológica con la presencia de 2 o más crisis convulsivas que se presenten en más de 24 h por separado o una crisis convulsiva no provocada con una alta probabilidad al menos del 60% de recurrencia dentro de los siguientes 10 años. Se puede hacer diagnóstico de epilepsia cuando se tiene caracterizado un síndrome epiléptico1.
Esta enfermedad neurológica aumenta su incidencia con la edad, lo que acarrea un problema de salud en el grupo etario de adultos mayores, ya que estos presentan más comorbilidades, lo que conlleva mayores interacciones farmacocinéticas; en orden de frecuencia, se encuentran los antidepresivos, los antipsicóticos, las benzodiacepinas, los suplementos tiroideos, los antiácidos, los bloqueantes de calcio, la warfarina y, por último, la cimetidina2.
Los parámetros farmacocinéticos que se alteran con los anticonvulsivantes son las tasas de absorción y de excreción de un medicamento o metabolito. Las interacciones más importantes cambian la cinética de sistemas enzimáticos que metabolizan los medicamentos por el citocromo p450, las glucuronil transferasas y las epóxido hidrolasas. Por otro lado, se encuentra el desplazamiento de un medicamento de su proteína de unión en la sangre impactando los niveles séricos de la medicacion3.
El citocromo p450 es un sistema que involucra una serie de enzimas oxidativas con un grupo hem en el sitio activo; este sistema tiene isoenzimas tales como 1A2, 2C9, 2C19 y 3A4, que son inducidas por la carbamazepina, fenitoína y fenobarbital, provocando aumento de la tasa de depuración para todos los componentes que utilicen estas vías; lo contrario sucede cuando una enzima se inhibe, la tasa de depuración de su sustrato se reduce; un ejemplo es la carbamazepina que induce su propio metabolismo, por lo que es frecuente encontrar en los pacientes que inician terapia con carbamazepina, niveles sanguíneos de carbamazepina más elevados en pocos días comparados con aquellos con toma prolongada. Los inductores enzimáticos p450 toman días a semanas para actuar sobre el blanco enzimático, a diferencia de las enzimas inhibidoras que tienen un efecto inmediato3.
La carbamazepina, la fenitoína y el fenobarbital inducen las uridin glucuronil transferasas; por el contrario, el ácido valproico las inhibe4. Los pacientes que toman en forma crónica carbamazepina van a necesitar altas dosis de lamotrigina para alcanzar la misma concentración sanguínea que un paciente que no la toma. Por otro lado, cuando se adiciona ácido valproico a una dosis de 500mg a la terapia con lamotrigina se debe realizar una reducción del 50% de esta última para evitar toxicidad por la misma3.
La enzima microsómica epóxido hidrolasa es una clave importante para el metabolismo de la carbamazepina a carbamazepina 10, 11 epóxido, teniendo este metabolito algunas propiedades anticonvulsivantes pero con mayor componente de toxicidad. El ácido valproico es un inhibidor de esta enzima; por esta razón, en el paciente que toma carbamazepina crónicamente puede generar un aumento en los niveles séricos de carbamazepina 10, 11 epóxido, dando como resultado síntomas característicos de neurotoxicidad por carbamazepina, mientras los niveles séricos son normales3,5.
Sobre la fenitoína, el ácido valproico posee 2 mecanismos por los cuales genera interacciones farmacocinéticas: uno de ellos es que al inhibir el CYP2C9 inhibe la depuración de fenitoína y el otro es el desplazamiento de unión a proteínas, incrementando ambos la fracción libre de fenitoína, que con el tiempo tiende a llegar a los niveles basales6.
Se describirán en este estudio las interacciones medicamentosas reflejadas en los cambios en los niveles séricos de los anticonvulsivantes de primera línea al ser administrados conjuntamente con antipsicóticos, antidepresivos y su impacto en el paciente con epilepsia en el Hospital de San José de Bogotá7.
Materiales y métodosSe llevó a cabo un estudio descriptivo. Se incluyó a pacientes con diagnóstico de epilepsia según la definición de la ILAE y atendidos en el Servicio de Neurología del Hospital de San José entre junio del 2015 y abril del 2016. Se tuvo en cuenta a pacientes mayores de 18 años en tratamiento con antiepilépticos de primera línea (fenitoína, carbamazepina, ácido valproico, fenobarbital) asociados a medicamentos antipsicóticos y/o antidepresivos (inhibidores selectivos de la receptación de serotonina y antidepresivos tricíclicos). Se excluyó a aquellos con antecedentes de alteraciones hepáticas o de enfermedad renal y pacientes embarazadas.
La información se recolectó mediante la revisión de historias clínicas, declaración del paciente y registros de laboratorio. Se recogió información relacionada con datos sociodemográficos, antecedentes clínicos como patológicos personales y familiares, además de antecedentes farmacológicos. Se registraron datos de laboratorio como hemograma, niveles séricos de anticonvulsivantes y transaminasas.
Análisis estadísticoEl análisis descriptivo se realizó en términos de frecuencias absolutas y relativas para las variables cualitativas y por medio de medianas y rangos intercuartílicos para las variables cuantitativas. Los datos se analizaron utilizando el programa Stata 13®. Esta investigación fue aprobada por el Comité de Ética e Investigación de la Fundación Universitaria de Ciencias de la Salud (FUCS), Bogotá.
ResultadosDescripción de la muestra de participantesFueron reclutados 26 pacientes con una mediana de edad de 49 años (RIC 33-57). Del total, 14 (53,8%) fueron mujeres. Todos los participantes tenían diagnóstico de epilepsia focal sintomática o focal de etiología indeterminada. Los antecedentes personales patológicos de importancia más frecuentes relacionados con este tipo de epilepsia fueron traumatismo craneoencefálico e hipoxia perinatal en 5 pacientes cada uno (19,2%), seguido de hipertensión arterial en 4 (15,3%); también se registraron otros antecedentes, como hipotiroidismo en 5 (19,2%), retardo mental leve-moderado en 2 pacientes (7,7%) y retraso en el desarrollo psicomotor en 2 (7,7%). Cabe anotar que, a pesar del uso de antidepresivos y/o antipsicóticos en los participantes, solo 2 de ellos tenían diagnóstico de trastorno depresivo y uno de esquizofrenia. La mayoría de los pacientes presentaron adecuado control de la enfermedad (96,1%), es decir, 25, con frecuencia ictal mayor a un año documentada en 20 casos (76,1%). Estas características pueden observarse en la tabla 1.
Descripción de la muestra de los pacientes
| Variable | Descripción, n = 26 (%) |
|---|---|
| Variables sociodemográficas | |
| Género | |
| Femenino | 14 (53,8) |
| Masculino | 12 (46,2) |
| Tipo de crisis focal | 26 (100) |
| Frecuencia ictal | |
| Una vez cada 15 días | 1 (3,8) |
| Cada 2 meses o más | 5 (19,2) |
| Cada año o mas | 20 (76,9) |
| Adecuado control de la enfermedad | 25 (96,1) |
| Antecedentes personales patológicos | |
| Hipertensión arterial | 4 (15,3) |
| Trastorno depresivo | 2 (7,7) |
| Traumatismo craneoencefálico | 5 (19,2) |
| Enfermedad cerebrovascular | 0 |
| Neuroinfección | 1 (3,8) |
| Hipoxia perinatal | 5 (19,2) |
| Diabetes mellitus | 0 |
| Otros antecedentes | |
| Esquizofrenia | 1 (3,8) |
| Gastritis | 1 (3,8) |
| Hipotiroidismo | 5 (19,2) |
| Retardo mental leve-moderado | 2 (7,7) |
| Malformación cavernosa temporal izquierda | 1 (3,8) |
| Meningioma resecado | 1 (3,8) |
| Retardo en el desarrollo psicomotor | 2 (7,7) |
| Antecedentes familiares | |
| Epilepsia | 3 (11,5) |
| Enfermedad cerebrovascular | 1 (3,8) |
| Hipertensión arterial | 5 (19,2) |
| Enfermedad psiquiátrica | 0 |
| Variable | Mediana (RIC) |
| Edad (años) | 49 (33-57) |
| Años de diagnóstico | 22,5 (8-35) |
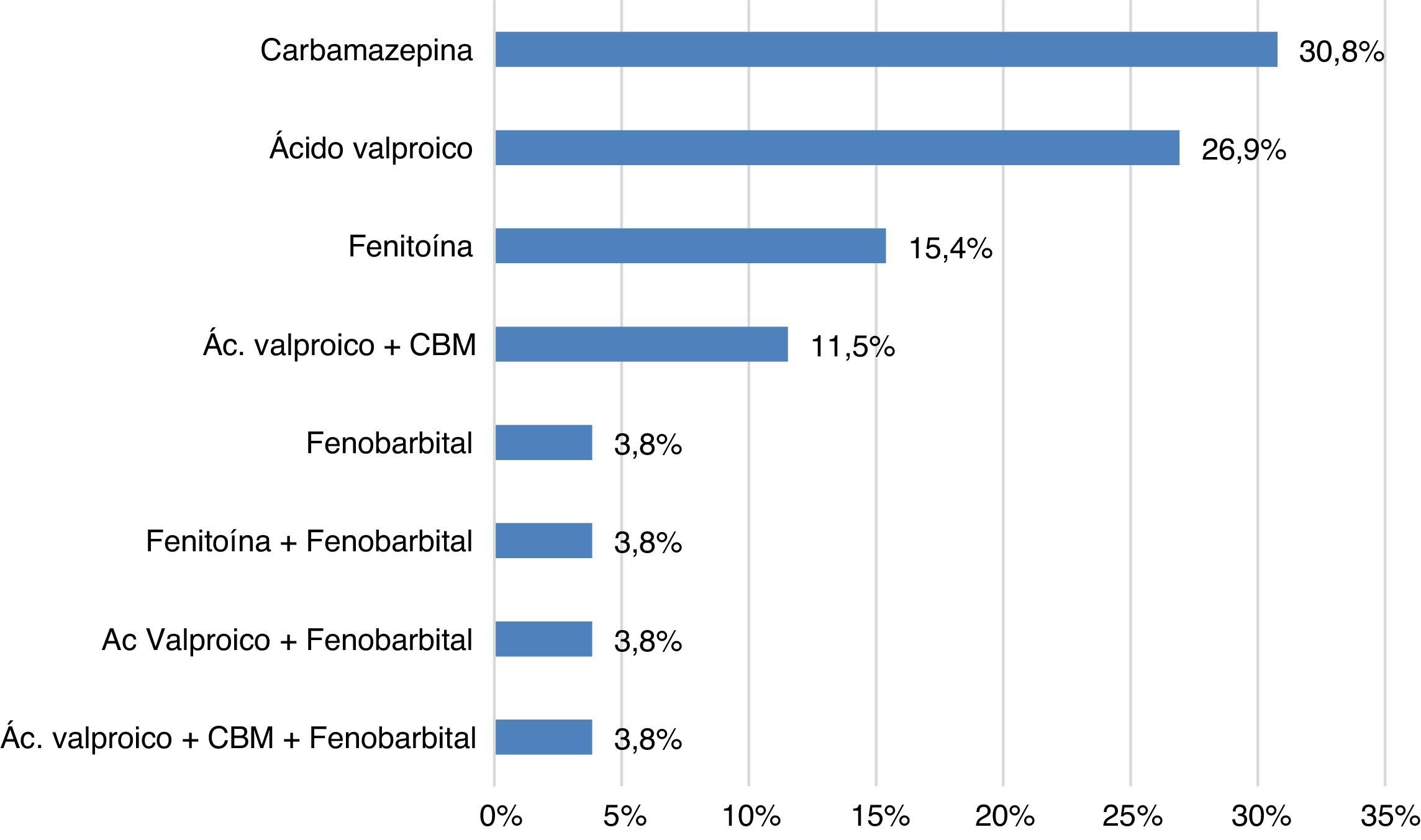
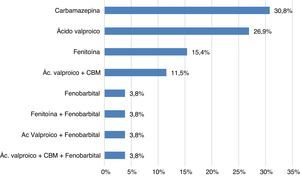
En cuanto a los pacientes con tratamiento anticonvulsivante en monoterapia encontrados en el estudio (fig. 1), en orden de frecuencia está la carbamazepina en 8 de ellos (30,8%), seguida de ácido valproico en 7 (26,9%), fenitoína en 4 casos (15,4%) y, por último, fenobarbital en uno (3,8%). Se encontró como terapia combinada anticonvulsivante con más frecuencia ácido valproico-carbamazepina en 3 pacientes (11,5%) seguida de fenitoína-fenobarbital en uno (3,8%), ácido valproico-fenobarbital en uno (3,8%) y ácido valproico-fenobarbital-carbamazepina en uno (3,8%).
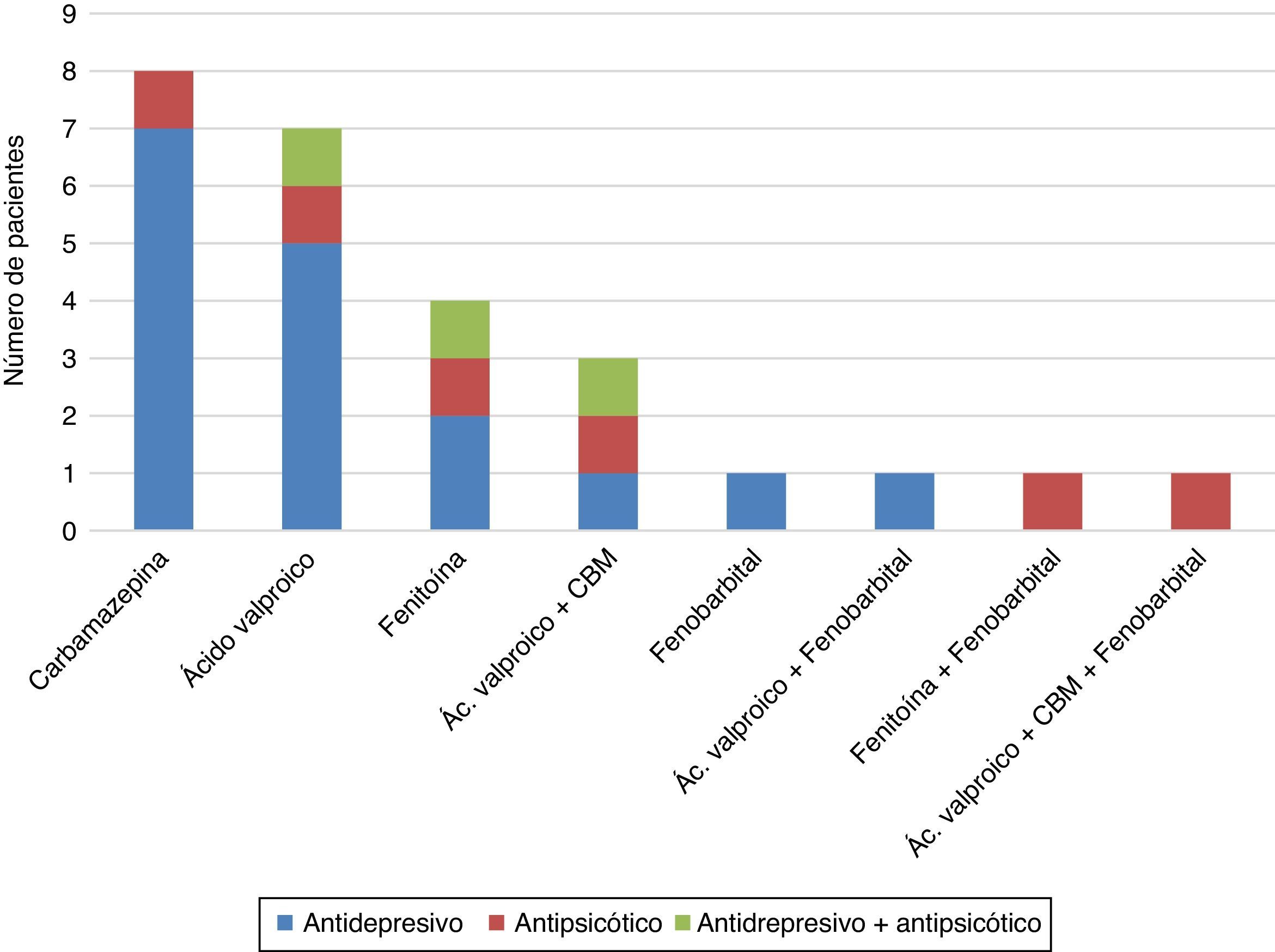
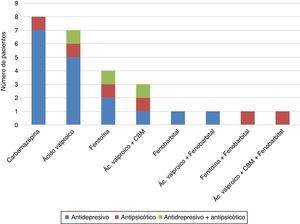
La combinación de anticonvulsivantes con antidepresivos se evidenció en 17 del total de los participantes (fig. 2), seguido de la combinación de anticonvulsivante con antipsicótico en 6 y, por último, la terapia anticonvulsivante con antipsicóticos y antidepresivos se documentó en 3. En pacientes recibiendo carbamazepina como monoterapia la combinación más común con antidepresivo fue con fluoxetina (6 de 7 pacientes), uno con amitriptilina y uno recibía antipsicótico (quetiapina). En cuanto a la monoterapia con ácido valproico, 5 recibían fluoxetina, un paciente recibía clozapina y uno recibía quetiapina y fluoxetina. En la terapia con fenitoína, 2 pacientes recibían tratamiento con antidepresivo (amitriptilina y fluoxetina), uno recibía antipsicótico (haloperidol) y uno terapia combinada con sertralina y clozapina, y por último, el paciente que recibía fenobarbital como monoterapia se documentó su combinación con el antidepresivo fluoxetina.
Respecto al uso de terapia combinada de anticonvulsivantes, en el estudio los pacientes que recibían ácido valproico y carbamazepina fueron uno que recibía antidepresivo (fluoxetina), uno con adición de antipsicótico (haloperidol) y otro además de antidepresivo (escitalopram) también tomaba antipsicótico (risperidona). Otras terapias combinadas de anticonvulsivantes en el estudio fueron ácido valproico y fenobarbital en un paciente asociado con antidepresivo (sertralina); otro en terapia con fenitoína y fenobarbital con haloperidol, y uno con ácido valproico, carbamazepina y fenobarbital con pipotiazina palmitato (fig. 1).
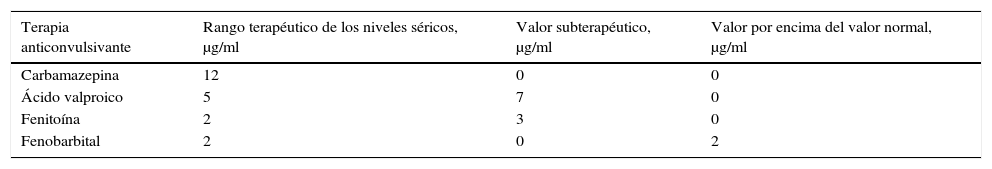
Los pacientes que recibían carbamazepina independientemente de la terapia combinada con antipsicótico y/o antidepresivo tenían los niveles séricos de carbamazepina dentro del rango normal de acuerdo con los valores descritos en la tabla 2. En la terapia con ácido valproico, 7 de 12 pacientes presentaron niveles en valores subterapéuticos, de los cuales 3 recibían como antidepresivo fluoxetina y los otros 4 incluían, aparte de la terapia con antidepresivo y/o antipsicótico, otro u otros anticonvulsivantes: el primero de ellos carbamazepina y haloperidol; el segundo carbamazepina, fenobarbital y pipotiazina palmitato; el tercero recibía carbamazepina y fluoxetina, y el cuarto fenobarbital y sertralina.
Valores terapéuticos de los niveles séricos de los anticonvulsivantes
| Terapia anticonvulsivante | Rango terapéutico de los niveles, séricos μg/ml |
|---|---|
| Carbamazepina | 4-12 |
| Ácido valproico | 50-150 |
| Fenitoína | 10-20 |
| Fenobarbital | 10-30 |
Modificado de Schachter7.
Por otro lado, respecto a los niveles séricos de los pacientes con fenitoína, se evidenciaron valores subterapéuticos en 3 de 5 pacientes, uno de ellos estaba en terapia con fluoxetina, otro con clozapina y sertralina, y el tercero estaba con haloperidol y fenobarbital.
Por último, en los pacientes en terapia con fenobarbital que fueron la minoría, se documentaron valores de niveles séricos de fenobarbital por encima del normal en 2 de 4 participantes; uno recibía fenitoína con haloperidol y otro ácido valproico, carbamazepina y pipotiazina palmitato. En ninguno apareció un valor subterapéutico (tabla 3).
Uso de anticonvulsivantes en los pacientes de acuerdo con los niveles séricos
| Terapia anticonvulsivante | Rango terapéutico de los niveles séricos, μg/ml | Valor subterapéutico, μg/ml | Valor por encima del valor normal, μg/ml |
|---|---|---|---|
| Carbamazepina | 12 | 0 | 0 |
| Ácido valproico | 5 | 7 | 0 |
| Fenitoína | 2 | 3 | 0 |
| Fenobarbital | 2 | 0 | 2 |
En cuanto a toxicidad hepática asociada a interacciones medicamentosas definida como elevación de más de 3 veces el límite superior normal8, no se encontraron alteraciones en las enzimas hepáticas en ningún caso. Por otro lado, solo 2 que venían recibiendo tratamiento con carbamazepina presentaron leucopenia.
DiscusiónLa interacción medicamentosa se da cuando un medicamento actúa sobre el metabolismo de otro que se ha administrado en forma conjunta y tiene potencial riesgo de alterar la efectividad o concentración de alguno de los principios activos con desenlaces predecibles o no, en una o varias de las patologías que se pretenden tratar9. Las diferentes especialidades en las diversas áreas de la ciencia médica proveen de un manejo mayor puntualizado de patrones delimitados de la enfermedad facilitando una terapia más efectiva y veraz de la misma; sin embargo, también ha generado una brecha inmensa en el desconocimiento y falta de interés en las interacciones medicamentosas a la hora de tratar varias comorbilidades, lo que presenta un riesgo potencial en el balance de las mismas, como se ha descrito desde los 70, donde se observó que a mayor número de medicamentos suministrados a un paciente, mayor interacción farmacológica, lo que, por ende, genera menor eficacia en los tratamientos instaurados e incluso con consecuencias catastróficas, incluyendo la muerte, como se describió en 1984 en el Servicio de Urgencias de un hospital de Nueva York, cuando se administró meperidina y haloperidol a una paciente de 18 años que recibía manejo con inhibidores de la monoaminoxidasa, ocasionándole la muerte10. Se ha encontrado una importante asociación entre epilepsia y patologías psiquiátricas, así como un aumento de la prevalencia de estas en las últimas décadas11. Por ejemplo, Ettinger et al. estudiaron los síntomas de depresión y trastorno bipolar encontrando los síntomas bipolares elevados en pacientes con epilepsia (12,2%) comparado con pacientes con migraña (7,2%)11,12. El objetivo de este trabajo fue identificar interacciones medicamentosas de los anticonvulsivantes de primera línea con antipsicóticos y/o antidepresivos, y su impacto en el paciente con epilepsia en el Hospital de San José.
De todos los pacientes del estudio que recibían ya sea terapia con antidepresivos y/o antipsicóticos, solo 3 de ellos tenían patología psiquiátrica definida lo que hace evidente el uso de estos medicamentos en patologías de origen no psiquiátrico, como se encuentra descrito en la literatura, tales como dolor neuropático, migraña y fibromialgia13.
Las anormalidades hematológicas tienden a ocurrir durante los primeros 2 a 3 meses de inicio del tratamiento y son en la mayoría transitorias, como es el caso de la terapia con carbamazepina, en donde al inicio se puede documentar leucopenia de forma transitoria en el 10-20% de los pacientes; no obstante, puede persistir en cerca de 2%14. En este estudio la presencia de leucopenia se vio en 2 de 12 casos que recibían carbamazepina.
La monoterapia anticonvulsivante con carbamazepina se documentó con mayor frecuencia; esto está relacionado con que todos los pacientes del estudio tenían epilepsia focal sintomática o de origen indeterminado. Un paciente venía en manejo con carbamazepina y quetiapina, presentando niveles de carbamazepina en rango terapéutico. Se conoce que la carbamazepina disminuye la concentración máxima al 80%, reduce el área bajo la curva en un 87% de la quetiapina e incrementa la depuración oral en 7,5 veces de la misma. Estos datos fueron documentados en un estudio de farmacocinética en 18 pacientes con patología psiquiátrica15. Por ello se debe tener en cuenta que ante una enfermedad psiquiátrica concomitante no debe administrarse quetiapina de manera conjunta con inductores potentes, como lo es la carbamazepina, ya que daría como resultado una pérdida de la actividad de este medicamento antipsicótico16,17.
La mayoría de los anticonvulsivantes de primera línea son inductores enzimáticos (carbamazepina, fenitoína y fenobarbital), por lo tanto, estimulan el metabolismo y reducen las concentraciones séricas de la mayoría de los anticonvulsivantes coadministrados. Esto se ve con el ácido valproico; en promedio se documenta una reducción del 50-75% de sus niveles séricos5. En el estudio de 5 pacientes que recibían ácido valproico en combinación con anticonvulsivantes inductores enzimáticos, 4 de ellos presentaron niveles subterapéuticos.
La combinación de ácido valproico con fenobarbital causa una elevación de los niveles séricos de fenobarbital secundaria a la inhibición de CYP2C9 y/o CYP2C19 que genera el ácido valproico; se recomienda disminuir la dosis de fenobarbital por encima del 30% para este tipo de terapia combinada5,18. En el estudio solo un paciente presentaba esta combinación de anticonvulsivante asociado con sertralina, que es también inhibidor de isoenzimas CYP, en quien se encontraron niveles de fenobarbital normales, teniendo en cuenta que la dosis en este caso era de 100mg (baja). Otro paciente, aparte de la terapia con ácido valproico y fenobarbital, recibía carbamazepina asociada a pipotiazina palmitato (sustrato CYP2D6-CYP3A4), en donde se documentaron también niveles séricos de ácido valproico bajos, como en el paciente descrito antes, pero con niveles de fenobarbital alto; cabe anotar que venía recibiendo una dosis mayor de fenobarbital de 300mg.
Otra combinación en la que se pueden ver incrementados los niveles séricos de anticonvulsivantes es la de ácido valproico y carbamazepina3. En el estudio, 3 pacientes presentaron esta combinación asociada con fluoxetina, otro paciente a haloperidol y el último a escitalopram y risperidona; sin embargo, los niveles de carbamazepina en todos los casos se encontraron dentro de la normalidad. En nuestro medio no se hacen mediciones de carbamazepina10,11 epóxido que es el metabolito que se eleva en la terapia combinada ácido valproico-carbamazepina y causa neurotoxicidad.
La combinación de fenitoína y fenobarbital (2 inductores enzimáticos) puede aumentar la concentración plasmática de fenobarbital y disminuir la de fenitoína19. Solo un paciente tenía esta terapia asociada a haloperidol (sustrato CYP1A2, CYP3A4), encontrando los niveles séricos de fenobarbital aumentados y de fenitoína disminuidos, como se describió antes. Teniendo en cuenta que el fenobarbital y la fenitoína son inductores de isoenzimas CYP (1A2, 2C9, 2C19 y 3A4), se necesitan mayores dosis de haloperidol para lograr un adecuado control con este medicamento.
En la monoterapia con fenitoína asociada con fluoxetina se han reportado casos que indican que puede aumentar los niveles de la primera causando toxicidad, atribuyéndole esto a la fluoxetina, ya que esta tiene un efecto inhibitorio CYP2C920. En el estudio se documentó un paciente con esta combinación de medicamentos pero los niveles de fenitoína se encontraron con valor subterapéutico.
Se ha descrito también que la adición de fluoxetina en pacientes que venían recibiendo ácido valproico puede aumentar los niveles séricos de ácido valproico causando toxicidad; esto también se atribuye a la fluoxetina por poseer un efecto inhibitorio CYP2C920. Por el contrario, en el estudio había 5 pacientes recibiendo esta terapia, 3 de ellos con niveles en valor subterapéutico y 2 dentro del rango de normalidad.
El ácido valproico en combinación con clozapina presenta un leve incremento de las concentraciones de esta última, ya que el ácido valproico inhibe la conversión de clozapina a norclozapina vía CYP1A2 o CYP3A415. Los niveles séricos de ácido valproico con esta combinación en un paciente fueron normales.
En el presente estudio existieron varias limitaciones, una de ellas está en relación con los niveles séricos de los medicamentos anticonvulsivantes, los cuales fueron realizados en diferentes laboratorios clínicos de la ciudad, debido a que las entidades promotoras de salud (EPS) son diferentes y envían a sus pacientes a centros distintos. Por otro lado, los pacientes en la consulta externa son trasladados en varias oportunidades a causa de la asignación cambiante que las EPS realizan a los hospitales, dificultando la recolección de los datos. Todos los participantes incluidos en el estudio venían en manejo con medicamentos anticonvulsivantes de primera línea, pero el advenimiento de nuevos anticonvulsivantes con menos efectos adversos ha hecho posible el cambio de terapia; por tal razón, el número de participantes en el estudio es reducido. En cuanto a la recolección de los datos cabe anotar que el desconocimiento del paciente y del cuidador acerca de la patología y también de la terapia actual, además del déficit o deterioro cognitivo como comorbilidad de los pacientes con epilepsia, lleva a que se generen más barreras para la recolección de la información.
ConclusionesEn la consulta externa de neurología es frecuente encontrar polimedicación dadas las múltiples comorbilidades con las que puede cursar el paciente con epilepsia y muchas de ellas tienen potencial riesgo de interacciones, las cuales en algunas oportunidades son tenidas en cuenta a la hora de analizar el control clínico de su enfermedad. Por otro lado, el difícil control de varios de estos pacientes enmarca la administración de varios medicamentos anticonvulsivantes olvidando que esto puede generar toxicidad, perdiendo incluso la actividad antiepiléptica al no hacerlo en forma adecuada.
El medicamento anticonvulsivante que con mayor frecuencia cursaba con niveles séricos subterapéuticos fue el ácido valproico, debido a su combinación con inductores enzimáticos potentes, como la carbamazepina y el fenobarbital. Pero en general, la mayor parte de los niveles anticonvulsivantes se hallaron dentro del rango terapéutico.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaramos no presentar conflictos de intereses.