A função primordial do ciclo menstrual é promover a capacidade reprodutiva da mulher e alterações nesse ciclo impactam na fertilidade feminina. A obesidade é frequentemente associada a alterações do ciclo menstrual.
ObjetivoAvaliar se existe diferença do dia da ovulação entre pacientes com índice de massa corpórea (IMC) normal e aquelas com sobrepeso ou obesidade em pacientes inférteis que não apresentam síndrome de ovários policísticos.
MétodosEstudo transversal feito em ambulatório de reprodução humana. Foram avaliados dois grupos, um com 71 pacientes com IMC normal e outro de 45 pacientes com IMC que indicava sobrepeso/obesidade. Foi analisado a seguir o dia da ovulação das pacientes de cada grupo. As amostras incluíram pacientes de 18 a 38 anos, sem síndrome de ovários policísticos, com as variáveis que pudessem interferir na ovulação pareadas, o que garantia a homogeneidade dos grupos.
ResultadosAs pacientes com sobrepeso ou obesidade tiveram a ovulação em média no 14,62° dia do ciclo e as pacientes com IMC normal em média no 14,21° dia. Não houve significância estatística entre os grupos.
ConclusãoNão houve diferença estatística do dia da ovulação entre as pacientes com IMC normal e aquelas com sobrepeso ou obesidade, que não apresentavam outras comorbidades que pusessem afetar a fertilidade.
The primary function of the menstrual cycle is to promote the reproductive capacity of women and changes in this cycle impact on female fertility. Obesity is often associated with changes in the menstrual cycle.
ObjectiveAssess whether there is difference between ovulation's day in patients with normal BMI and those with overweight or obesity in infertile patients without Polycystic Ovary Syndrome.
MethodsCross‐sectional study in Human Reproduction Outpatient Clinic. Two groups, one with 71 patients with normal BMI and the other with 45 patients with a BMI indicating overweight/obesity. It was next analyzed the day of ovulation of patients in each group. The samples included patients 18‐38 years without Polycystic Ovary Syndrome, whith the variables that could interfere with ovulation, matched, ensuring the homogeneity of the groups.
ResultsPatients with overweight or obese had an average ovulation in 14.62° day of the cycle, and patients with normal BMI average at 14.21° day, with no statistical significance between groups.
Conclusionthere was no statistical difference of day of ovulation among patients with normal BMI and those with overweight or obesity, which had no other comorbidities that would put affect fertility.
A menstruação é a descamação endometrial cíclica decorrente das interações dos hormônios produzidos pelo hipotálamo, pela hipófise e pelos ovários, que formam o chamado eixo hipotálamo‐hipofisário‐ovariano. A integridade desse eixo é essencial para a ovulação regular e consequentemente para um ciclo menstrual regular. Fatores extraeixo podem influenciar nesse sistema complexo de retroalimentação.1 Como a função primordial do ciclo menstrual é promover a capacidade reprodutiva da mulher, alterações nesse ciclo impactam na fertilidade feminina.
A obesidade é um dos fatores extraeixo hipotálamo‐hipofisário‐ovariano que pode influenciar no ciclo menstrual. Ela pode ser conceituada como uma doença caracterizada pelo acúmulo excessivo de gordura corporal, devido a balanço energético positivo, acarreta repercussões na saúde, com perda importante na qualidade e no tempo de vida.2 Nos Estados Unidos da América, 68% da população adulta apresentam sobrepeso e 34,9% estão obesos.3 Segundo o Ministério da Saúde do Brasil, no conjunto da população adulta das capitais brasileiras a prevalência do excesso de peso é de 52,5%, maior entre homens (56,5%) do que entre mulheres (49,1%). A obesidade entre as mulheres nas capitais brasileiras é de 16% (BRASIL, 2014).4
As causas da obesidade são multifatoriais e resultam de interação de fatores genéticos, metabólicos, sociais, comportamentais e culturais. Vários distúrbios fisiopatológicos são causados pela obesidade, principalmente nas pessoas com índice de massa corpórea (IMC) acima de 30kg/m2. Podem ser citados os distúrbios cardiovasculares, endócrinos e metabólicos, respiratórios, gastrointestinais, dermatológicos, musculoesqueléticos e psicossociais, neoplasias, aumento do risco cirúrgico e anestésico, diminuição da agilidade física e distúrbios na gestação e na fertilidade, como ausência de ovulação.5 Muitos estudos, porém, se limitam a pacientes com sobrepeso e obesidade associados à síndrome de ovários policísticos. Devido à crescente prevalência de sobrepeso e obesidade, é importante investigar os seus efeitos sobre a saúde reprodutiva das mulheres e melhor quantificar a força de associação com o dia da ovulação e a irregularidade menstrual.6
O tema deste estudo é a avaliação do dia da ovulação e sua relação com o IMC em pacientes inférteis e o objetivo da pesquisa é avaliar se existe diferença do dia da ovulação entre pacientes com IMC normal e aquelas com sobrepeso ou obesidade em pacientes inférteis que não apresentam síndrome de ovários policísticos.
RevisãoCiclo menstrualO ciclo menstrual pode ser dividido em três fases: fase folicular ou proliferativa, a ovulação propriamente dita e a fase lútea ou secretória. A fase lútea tem duração fixa de 14 dias, enquanto a fase folicular pode variar em um ciclo normal. A ovulação é que define a regularidade do ciclo. Tanto fatores extras quanto intraovarianos regulam a foliculogênese, deve haver um equilíbrio entre eles.7 Qualquer desequilíbrio entre os fatores extras e intraovarianos pode resultar em uma foliculogênese anormal.8
Dentre os fatores extraovarianos, um dos mais importantes, se não o mais, é a ação do hipotálamo, que secreta em pulos o hormônio regulador das gonadotropinas (GnRH), que é transportado para a hipófise anterior. Nessas células são produzidos, armazenados e secretados o hormônio folículo estimulante (FSH) e o hormônio luteinizante (LH). Esses hormônios estimulam os ovários a desenvolver um folículo dominante, que secreta níveis crescentes de estrogênio, que por sua vez proliferam o endométrio. O estrógeno, por sua vez, inibe a secreção das gonadotrofinas na hipófise anterior e por inibição indireta no hipotálamo (retroalimentação negativa) diminui os níveis de LH e FSH. Acima de certo nível de estrógeno a retroalimentação negativa é revertida e a liberação de LH da hipófise é estimulada. Esse “pico de LH” desencadeia a ovulação. Após a ovulação, as células foliculares remanescentes no ovário luteinizam‐se e forma‐se o corpo lúteo, que secreta estrógeno, mas predominantemente progesterona. Esse hormônio, por sua vez, diferencia o endométrio em tecido secretor e esponjoso, necessário para a implantação do óvulo fertilizado. Caso não ocorra essa implantação, a gonadotropina coriônica humana não é produzida e o corpo lúteo involui. A queda dos níveis de estrógeno e progesterona derivados do corpo lúteo provoca a descamação do endométrio e, consequentemente, a menstruação. Alterações nesse sistema podem resultar em alterações na ovulação, que levará a alterações do ciclo menstrual.1,9,10
Infertilidade, obesidade e ciclo menstrualA Organização das Nações Unidas define saúde reprodutiva como um completo bem‐estar físico, mental e social, e não meramente a ausência de doença ou enfermidade em todos os aspectos relacionados ao sistema reprodutivo e às suas funções e aos seus processos.11
A infertilidade é uma doença do sistema reprodutivo, definida pela incapacidade de se conseguir uma gravidez clínica após 12 meses ou mais de uma relação sexual regular e desprotegida.12–14 Mulheres acima de 35 anos, porém, devem ser encaminhadas para a propedêutica de infertilidade após seis meses de tentativa de engravidar sem sucesso.12,15
A Organização Mundial de Saúde estima que 48,5 milhões de casais no mundo são inférteis e que entre 1990 e 2010 a prevalência de infertilidade primária e secundária pouco mudou na maior parte do planeta.16 Estima‐se que 7,4% dos casais americanos sejam inférteis e que no mundo até 15% das pessoas tenham algum distúrbio de fertilidade, principalmente em nações industrializadas.17 A infertilidade deve, portanto, ser considerada como um processo de doença merecedor de investigação e de tratamento.
A obesidade é frequentemente associada a alterações do ciclo menstrual. Ela levaria ao aumento da duração da fase folicular e ao alongamento o ciclo menstrual e cerca de 30 a 47% das mulheres com sobrepeso e obesas teriam ciclos menstruais irregulares.18 Essa irregularidade tem associação tanto com o aumento do índice de massa corpórea quanto com a obesidade central. Vários estudos encontraram associações entre excesso de peso ou obesidade e menstruação irregular em mulheres.19,20 Nas pacientes ovulatórias, a fase lútea ou secretória do ciclo é relativamente fixa em torno de 14 dias.7 Portanto, alterações intra ou extraovarianas que influenciam na ovulação ocorrerão na primeira fase do ciclo. Por exemplo, alterarão o dia da ovulação.
MetodologiaEstudo transversal feito no Laboratório de Reprodução Humana do Hospital das Clínicas da Universidade Federal de Goiás, que atende pacientes do Sistema Único de Saúde (SUS). A todas as pacientes foram solicitados os seguintes exames bioquímicos: FSH entre o 2° e o 4¿ dia do ciclo, LH, prolactina, TSH, estradiol, sorologia para HIV I e II, HbsAg, anti‐HCV, imunofluorescência IgG para clamídia, VDRL, anti‐HBC IgG e IgM, HTLV I e II e sorologia para citomegalovírus. A monitoração da ovulação foi feita entre o 2° e o 5° dia do ciclo, com novas avaliações a partir do 10° dia do ciclo até ocorrer a ovulação, ou até o 16° dia caso não ocorra desenvolvimento de folículos dominantes ou colapso folicular. O equipamento de ultrassonografia usado foi o modelo LOGIQ P6da General Electric (GE).
Foram avaliados 456 laudos de monitoração ecográfica da ovulação feita entre janeiro de 2011 e dezembro de 2015. Foram incluídas no estudo as pacientes com infertilidade havia pelo menos um ano, com exame completo de monitoração da ovulação, idade entre 18 e 38 anos completos, ausência de folículos acima de 10mm no 1° exame da monitoração, soma de número de folículos antrais entre seis e 24 contados entre o 2° e o 5° dia do ciclo, ausência de ooforectomia, ausência de miomas acima de 40mm e/ou submucosos e/ou de endometriomas. Foram então selecionadas 154 pacientes que ovularam no ciclo monitorado. Em um segundo momento, foi acessado o prontuário completo da paciente e foram aplicados os critérios de exclusão. Consolidaram‐se 118 pacientes.
A presença de ovulação foi considerada apenas naqueles ciclos em que o folículo alcançou pelo menos 16mm de diâmetro. O cálculo do dia da ovulação foi feito de acordo com o protocolo sugerido por Mikolajczyk et al. (2008).21 Caso o folículo tenha alcançado diâmetro maior ou igual a 18mm, o dia da ovulação foi considerado como o dia imediatamente após o maior diâmetro folicular alcançado, antes de ser detectado o colapso do folículo. No caso do diâmetro folicular ter sido entre 16 e18mm, o segundo dia após o exame antes do colapso foi considerado o dia da ovulação. Se o intervalo entre esses exames fosse maior do que cinco dias, a paciente seria excluída do estudo. Considerou‐se colapso folicular o desaparecimento do folículo ou a diminuição de pelo menos 70% do diâmetro.
Os critérios de inclusão foram aplicados no momento da avaliação dos laudos de monitoração da ovulação. Foram critérios de inclusão: pacientes com infertilidade havia pelo menos um ano, com exame completo de monitoração da ovulação, idade entre 18 e 38 anos completos, ausência de folículos acima de 10mm no 1° exame da monitoração, soma de número de folículos antrais entre seis e 24 contados entre o 2° e o 5° dia do ciclo, ausência de cistectomia ou ooforectomia prévia, ausência de miomas acima de 40mm e/ou submucosos e/ou de endometriomas.
As pacientes foram separadas em dois grupos: aquelas com IMC normal e aquelas com sobrepeso e obesidade. Foram avaliadas a variáveis: idade, idade da menarca, tempo de tentativa de engravidar (tempo de exposição). Os antecedentes obstétricos foram: paridade, gestações e abortamentos espontâneos prévios. Os parâmetros do ciclo durante a monitoração da ovulação analisados foram: contagem de folículos antrais entre o 2° e o 5° dia do ciclo, presença de miomas e/ou endometriomas, presença ou não de ovulação, dia da ovulação e diâmetro máximo do folículo alcançado em milímetros nas pacientes. Os exames sanguíneos catalogados foram o hormônio folículo estimulante (FSH) entre o 2° e o 4° dia do ciclo, prolactinemia e hormônio estimulante da tireoide (TSH).
Selecionados os grupos, foram avaliados os prontuários das pacientes e aplicados nesse momento os critérios de exclusão: mulheres com dosagem do hormônio folículo estimulante (FSH) acima de 10UI/L, diagnóstico de endometriose estádios III e IV, TSH menor do que 0,4 ou acima de 4,5mU/L, prolactinemia acima de 20ng/mL, diagnóstico de síndrome de ovários policísticos, tabagistas ou aquelas que relataram ingerir bebidas alcoólicas com frequência.
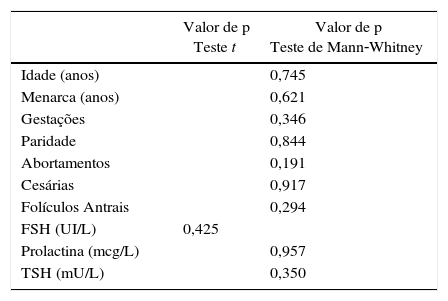
Para a comparação do grupo das pacientes com IMC normal e aquelas com sobrepeso ou obesidade, eles devem ter características semelhantes para não influenciar na avaliação das variáveis de estudo. Ambos os grupos devem ter reserva ovariana semelhante, avaliadas neste estudo pela idade, pelo FSH e pela contagem de folículos antrais por meio da ultrassonografia entre o 2° e o 5° dia do ciclo. Verificou‐se que as amostras dos grupos também eram semelhantes segundo a idade da primeira menstruação (menarca), o número de gestações, de partos, abortamentos e cesarianas, a quantidade de folículos antrais contada entre o 2° e o 5° dia do ciclo, relato de LTB e o valor dos exames laboratoriais de FSH (UI/L), prolactina (mcg/L) e TSH (mU/L).
Todos os critérios de inclusão e exclusão se baseiam no fato que são fatores que influenciam o ciclo menstrual e a fertilidade da mulher e podem se tornar fatores confundidores.
Para as análises estatísticas, foi usado o programa SPSS 22.0. Para a avaliação do pareamento os dados foram submetidos ao testes de Shapiro‐Wilk, cálculo do desvio padrão e valor de Z para avaliação do tipo de distribuição dos dados: normal ou não normal. A seguir foi aplicado o teste de t de Student para variáveis de distribuição normal e o de Mann‐Whitney para as de distribuição não normal. O teste usado para avaliar se o dia da ovulação era diferente entre os grupos de IMC normal e com sobrepeso ou obesidade foi o de qui‐quadrado de Pearson.
ResultadosA avaliação das variáveis propostas para garantir a homogeneidade entre os grupos de IMC normal e sobrepeso/obesidade demonstrou que as médias estavam pareadas (tabela 1).
Valores de p dos testes t, de Mann‐Whitney e de Fisher para avaliação do pareamento das variáveis
| Valor de p Teste t | Valor de p Teste de Mann‐Whitney | |
|---|---|---|
| Idade (anos) | 0,745 | |
| Menarca (anos) | 0,621 | |
| Gestações | 0,346 | |
| Paridade | 0,844 | |
| Abortamentos | 0,191 | |
| Cesárias | 0,917 | |
| Folículos Antrais | 0,294 | |
| FSH (UI/L) | 0,425 | |
| Prolactina (mcg/L) | 0,957 | |
| TSH (mU/L) | 0,350 |
FSH, hormônio folículo estimulante; TSH, hormônio estimulante da tireoide.
p=0,005.
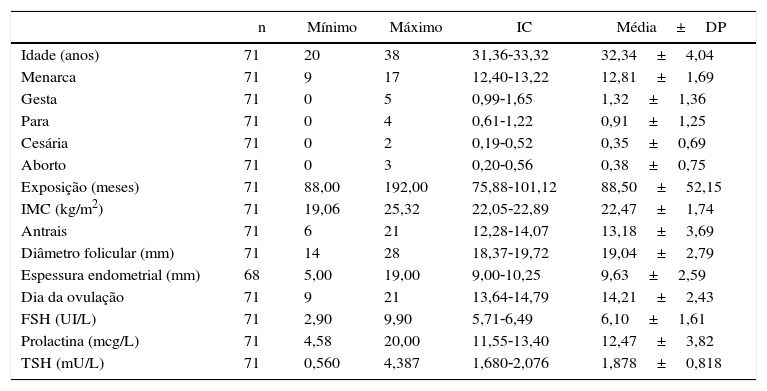
A média de idade das pacientes que tinham IMC dentro da normalidade foi de 32,34 anos; a primeira menstruação (menarca) ocorreu entre 9 e 17 anos, com média de 12,81; tinham tido até cinco gestações (média=1,32); até quatro partos (média=0,91), até duas cesarianas (média=0,35); até três abortamentos prévios (média=0,38) e tentavam engravidar (exposição) entre 88 e 192 meses (média=88,50). O IMC variou de 19,06 a 25,32kg/m2 (média=22,47kg/m2). A contagem de folículos antrais foi entre seis e 21 (média=13,18). A ovulação aconteceu entre o 9° e o 21° dia do ciclo (média=14,21° dia), o diâmetro máximo alcançado do folículo antes de se romper foi de 14 a 28mm (média=19,04mm) e a espessura endometrial máxima medida antes da rotura do folículo foi de 9,63mm. Nos exames bioquímicos, a dosagem de FSH das pacientes do grupo controle foi de 2,90 a 9,9UI/L (média=6,10UI/L), a de prolactina de 4,58 a 20 mcg/L (média=12,47mcg/L) e a de TSH de 0,560 a 4,387mU/L (média=1,878mU/L) (tabela 2).
Características das pacientes com IMC normal. Lab Rep HC/UFG 2015
| n | Mínimo | Máximo | IC | Média±DP | |
|---|---|---|---|---|---|
| Idade (anos) | 71 | 20 | 38 | 31,36‐33,32 | 32,34±4,04 |
| Menarca | 71 | 9 | 17 | 12,40‐13,22 | 12,81±1,69 |
| Gesta | 71 | 0 | 5 | 0,99‐1,65 | 1,32±1,36 |
| Para | 71 | 0 | 4 | 0,61‐1,22 | 0,91±1,25 |
| Cesária | 71 | 0 | 2 | 0,19‐0,52 | 0,35±0,69 |
| Aborto | 71 | 0 | 3 | 0,20‐0,56 | 0,38±0,75 |
| Exposição (meses) | 71 | 88,00 | 192,00 | 75,88‐101,12 | 88,50±52,15 |
| IMC (kg/m2) | 71 | 19,06 | 25,32 | 22,05‐22,89 | 22,47±1,74 |
| Antrais | 71 | 6 | 21 | 12,28‐14,07 | 13,18±3,69 |
| Diâmetro folicular (mm) | 71 | 14 | 28 | 18,37‐19,72 | 19,04±2,79 |
| Espessura endometrial (mm) | 68 | 5,00 | 19,00 | 9,00‐10,25 | 9,63±2,59 |
| Dia da ovulação | 71 | 9 | 21 | 13,64‐14,79 | 14,21±2,43 |
| FSH (UI/L) | 71 | 2,90 | 9,90 | 5,71‐6,49 | 6,10±1,61 |
| Prolactina (mcg/L) | 71 | 4,58 | 20,00 | 11,55‐13,40 | 12,47±3,82 |
| TSH (mU/L) | 71 | 0,560 | 4,387 | 1,680‐2,076 | 1,878±0,818 |
DP, desvio padrão; FSH, hormônio folículo estimulante; IC, intervalo de confiança; IMC, índice de massa corpórea; TSH, hormônio estimulante da tireoide.
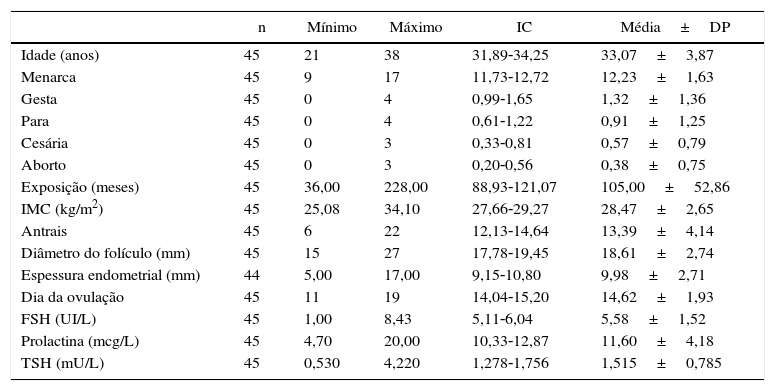
Os resultados das variáveis das pacientes que apresentaram IMC de sobrepeso e obesidade estão relacionados na tabela 3. A média de idade foi de 33,07 anos; a primeira menstruação (menarca) ocorreu entre nove e 17 anos, com média de 12,23; tinham tido até 45 gestações (média=1,32); até quatro partos (média=0,91), até três cesarianas (média=0,57); até três abortamentos prévios (média=0,38) e tentavam engravidar (exposição) entre 36 e 228 meses (média=105). O IMC variou de 25,08 a 34,10kg/m2 (média=28,47kg/m2). A contagem de folículos antrais foi entre seis e 22 (média=13,39). A ovulação aconteceu entre o 11° e o 19° dia do ciclo (média=14,62° dia), o diâmetro máximo alcançado do folículo antes de se romper foi de 15 a 27mm (média=18,61mm) e a espessura endometrial máxima medida antes da rotura do folículo foi de 9,98mm. Nos exames bioquímicos, a dosagem de FSH das pacientes do grupo controle variou de 10 a 8,43UI/L (média=5,58UI/L), a de prolactina de 4,70 a 20 mcg/L (média=11,60mcg/L) e a de TSH de 0,530 a 4,220mU/L (média=1,515mU/L).
Características das pacientes com sobrepeso/obesidade. Lab Rep HC/UFG 2015
| n | Mínimo | Máximo | IC | Média±DP | |
|---|---|---|---|---|---|
| Idade (anos) | 45 | 21 | 38 | 31,89‐34,25 | 33,07±3,87 |
| Menarca | 45 | 9 | 17 | 11,73‐12,72 | 12,23±1,63 |
| Gesta | 45 | 0 | 4 | 0,99‐1,65 | 1,32±1,36 |
| Para | 45 | 0 | 4 | 0,61‐1,22 | 0,91±1,25 |
| Cesária | 45 | 0 | 3 | 0,33‐0,81 | 0,57±0,79 |
| Aborto | 45 | 0 | 3 | 0,20‐0,56 | 0,38±0,75 |
| Exposição (meses) | 45 | 36,00 | 228,00 | 88,93‐121,07 | 105,00±52,86 |
| IMC (kg/m2) | 45 | 25,08 | 34,10 | 27,66‐29,27 | 28,47±2,65 |
| Antrais | 45 | 6 | 22 | 12,13‐14,64 | 13,39±4,14 |
| Diâmetro do folículo (mm) | 45 | 15 | 27 | 17,78‐19,45 | 18,61±2,74 |
| Espessura endometrial (mm) | 44 | 5,00 | 17,00 | 9,15‐10,80 | 9,98±2,71 |
| Dia da ovulação | 45 | 11 | 19 | 14,04‐15,20 | 14,62±1,93 |
| FSH (UI/L) | 45 | 1,00 | 8,43 | 5,11‐6,04 | 5,58±1,52 |
| Prolactina (mcg/L) | 45 | 4,70 | 20,00 | 10,33‐12,87 | 11,60±4,18 |
| TSH (mU/L) | 45 | 0,530 | 4,220 | 1,278‐1,756 | 1,515±0,785 |
DP, desvio padrão; FSH, hormônio folículo estimulante; IC, intervalo de confiança; IMC, índice de massa corpórea; TSH, hormônio estimulante da tireoide.
As pacientes com sobrepeso ou obesidade tiveram a ovulação entre o 11° e o 19° dia do ciclo, com média no 14,62° dia do ciclo, e as pacientes com IMC normal entre o 9° e 21° dia do ciclo, em média no 14,21°dia. Não houve significância estatística entre os grupos (tabela 4).
DiscussãoAs pacientes com sobrepeso e obesidade foram agrupadas devido a haver baixa quantidade de pacientes com obesidade I e II e nenhuma com obesidade III, pois há uma orientação do serviço de diminuir o IMC antes da feitura até mesmo da investigação da infertilidade.
Para a comparação do grupo das pacientes com IMC normal com o grupo das pacientes com sobrepeso ou obesidade, eles devem ter características semelhantes para não influenciar na avaliação das variáveis de estudo. Ambos os grupos devem ter reserva ovariana semelhante, avaliadas neste estudo pela idade, pelo FSH e pela contagem de folículos antrais por meio da ultrassonografia entre o 2° e o 5° dia do ciclo.22 Outros fatores podem influenciar a ovulação, como a função tireoidiana e níveis séricos de prolactina. Por esse motivo, tanto os valores de TSH quanto da prolactinemia foram verificados quanto ao pareamento. Apesar de a idade da primeira menstruação (menarca) e o número de gestações (gesta), de partos (paridade), de abortamentos e de cesarianas não terem uma relação direta com a reserva ovariana ou com a possibilidade de ovulação durante o ciclo ovulatório, consideramos importante avaliar o pareamento também dessas variáveis, para garantir a homogeneidade dos grupos.
Para diminuir o possível viés na função ovariana causada pela endometriose, optamos por não incluir as pacientes com endometriose. Não incluímos aquelas pacientes em que no início da monitoração basal da ovulação apresentavam 12 ou mais folículos em pelo menos um dos ovários e excluímos aquelas em que ao se analisar o prontuário havia diagnóstico de síndrome de ovários policísticos. Também não incluímos pacientes com miomas acima de 5cm, cistectomizadas ou ooforectomizadas, pois essas últimas têm diminuição da reserva ovariana e alterações na ovulação.23
Devido à possibilidade de interferência do tabagismo no ciclo ovariano,17,24,25 e à impossibilidade de quantificar o número de cigarros fumados ao dia e por quantos anos, todas as pacientes tabagistas foram excluídas do estudo. Também foram excluídas as pacientes que relataram uso de bebidas alcoólicas, pois a ingestão de álcool pode causar anovulação e disfunção na fase lútea.17,26–28
Outra possibilidade de vícios em estudos caso‐controle refere‐se ao viés de seleção por incorreções ou limitações no delineamento do estudo, o que afeta a comparabilidade entre os grupos. Um dos motivos deve‐se ao fato de que os princípios da comparabilidade na seleção de controles geralmente são influenciados pelo princípio da eficiência, ou seja, disponibilidade de recursos e tempo. O viés de seleção foi atenuado pela rigidez dos critérios de inclusão e de exclusão. O viés do observador foi atenuado, pois além do pareamento houve cegamento quanto à seleção dos grupos IMC normal e sobrepeso/obesidade e o dia em que ocorreu a ovulação.
O ciclo menstrual pode ser considerado como um evento cíclico, com o seu ápice na ovulação e seu término na ausência de fecundação e descamação endometrial. Envolve mecanismos anatômicos e funcionais complexos com macro e microrregulação, muitos dos quais ainda pouco conhecidos ou mesmo totalmente desconhecidos. Muitos fatores podem influenciar esse ciclo em diversos níveis hormonais e celulares e a obesidade, como uma doença que envolve alterações metabólicas e fisiológicas, está associada à disruptura do controle do ciclo. Ao mesmo tempo em que para menstruar há necessidade de um nível mínimo de gordura corporal, a obesidade está associada a menarca mais precoce, ciclos mais longos e ou irregulares.18,29–31
Apesar de a maioria das mulheres obesas não apresentar infertilidade, a obesidade influencia o controle do ciclo e a ovulação, impacta negativamente na fertilidade feminina31 e mesmo após o controle da irregularidade menstrual esse impacto parece persistir.32,33 Com o aumento da prevalência de crianças e mulheres com sobrepeso e obesidade, a associação desses sobre o ciclo menstrual, a regularidade menstrual e consequentemente sobre a fertilidade, adquire cada vez mais maior importância.
Nosso estudo não corroborou, porém, a suspeita de ovulação tardia nas pacientes com sobrepeso/obesidade, pois não houve diferença estatística do dia da ovulação entre as pacientes com IMC normal e aquelas com sobrepeso ou obesidade, apesar de a associação do excesso de peso com ciclos menstruais irregulares ser bem estabelecida na literatura.20 Haveria um aumento da duração da fase folicular, já que a fase lútea é relativamente fixa. Poucos estudos, porém, avaliaram o dia da ovulação monitorado, compararam pacientes com IMC normal e com sobrepeso ou obesidade, como o de Legro et al. (2012).18 Eles observaram que a fase folicular das pacientes obesas diminuiu após cirurgia bariátrica. Muitos estudos, ainda, incluem ou não excluem com cuidado a presença de síndrome de ovários policísticos, que é uma síndrome com estreita relação com a obesidade. Consideramos que somente o fato de a paciente apresentar sobrepeso ou obesidade, sem outras comorbidades, não seria fator suficiente por si para a ovulação ocorrer tardiamente.
Não há uma relação de causa e efeito estabelecida entre sobrepeso e infertilidade, pode ser possível que ambos sejam sintomas de uma mesma patologia. Apesar de a obesidade diminuir a fertilidade, não está claro quanto de perda de peso poderia incrementá‐la nas pacientes com IMC acima do normal. A prova da eficácia da redução de peso é ainda limitada devido à falta de grandes estudos controlados, bem como relação custo‐eficácia.34 No momento, não há diretrizes baseadas em evidências sobre o tratamento de fertilidade em mulheres subférteis com sobrepeso e obesidade. Na Holanda, em alguns centros de tratamento, em caso de excesso de peso feminino o tratamento não é feito e orientações para diminuir os níveis de IMC diferem entre clínicas. Em outros centros de fertilidade as mulheres com sobrepeso ou obesas são tratadas independentemente do seu IMC. A Sociedade Britânica de Fertilidade aconselha informar às mulheres com IMC de 30kg/m2 que elas tendem a demorar mais tempo para engravidar e àquelas com esse mesmo IMC e que não estão ovulando que perder peso aumenta as chances de concepção. Embora não haja suficiente evidência convincente de que a redução de peso, eventualmente, leva a mais gestações espontâneas, objetiva‐se diminuir as complicações do excesso de peso na gestação.14,35
Fica aberta aos médicos e aos serviços de reproduções estabelecidos no Brasil a determinação de protocolos de tratamento, desde que respeitada essa resolução. Na feitura do tratamento em pacientes com sobrepeso e obesidade, deve‐se então levar em conta a chance de possibilidade de sucesso, o risco de saúde a que essa paciente estaria exposta tanto durante o tratamento de infertilidade e os riscos possíveis ao feto e ao recém‐nascido. Todos os devidos esclarecimentos desses riscos devem ser comunicados e documentados, quando da decisão de se fazer o tratamento. Reforça‐se, portanto, a necessidade de estabelecimento de protocolos de decisões, de risco e de tratamento em cada situação específica, notadamente nas situações de sobrepeso e obesidade, e a associação ou não de ambas a outras comorbidades na paciente em questão.
LimitaçõesEm nosso estudo, e como acontece na maioria dos serviços de investigação da infertilidade, a monitoração da ovulação é feita em um único ciclo e pode haver variações entre o crescimento folicular de ciclos de uma mesma mulher21 e avaliação equivocada nas avaliações de um ciclo isoladamente.
Apesar dos cuidados para não serem incluídas pacientes com SOP, essa é uma entidade polimorfa e caso a paciente não tenha tido diagnóstico clínico prévio ou ovários com aspecto policístico ao exame ecográfico, situações subclínicas podem não ter sido detectadas.
ConclusãoNão houve diferença estatística do dia da ovulação entre as pacientes com IMC normal e aquelas com sobrepeso ou obesidade, que não apresentavam outras comorbidades que pusessem afetar a fertilidade.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.