Abordar a infertilidade masculina causada pela microdeleção no cromossomo Y e apresentar possíveis tratamentos por meio das técnicas de reprodução humana assistida.
MétodosLevantamento de dados da literatura científica na área da medicina reprodutiva.
ResultadosQuando comparadas com outras causas de infertilidade, as microdeleções do cromossomo Y são relativamente frequentes. O cromossomo Y é essencial para a determinação sexual masculina e no seu braço longo há regiões responsáveis pela espermatogênese. São elas AZFa, AZFb e AZFc. Essas regiões podem ser deletadas e por conter múltiplos genes essenciais para a espermatogênese podem causar infertilidade masculina. Graças aos avanços da medicina, hoje vários casos de infertilidade são tratáveis por meio das técnicas de reprodução assistida. Dentre as técnicas, a MSOME se destaca por ser uma metodologia que seleciona apenas espermatozoides morfologicamente normais para serem usados na inseminação e aumentar as chances de gestação.
ConclusõesA infertilidade masculina tem aumentado consideravelmente nos últimos anos e as causas genéticas são uma das grandes consequências disso. As microdeleções do cromossomo Y podem causar desde uma oligozoospermia leve a uma azoospermia, a depender da região AZF afetada. Para as causas mais leves, o casal pode recorrer a algumas técnicas de reprodução assistida e para as causas mais graves a solução para o casal pode ser usar gametas doados.
Address male infertility caused by microdeletions on Y chromosome and present possible treatment through assisted human reproduction techniques.
MethodsSurvey data from the scientific literature in the field of reproductive medicine.
ResultsWhen compared with other causes of infertility, the microdeletions on Y chromosome are the relatively frequent. The Y chromosome is essential for male sex determination and there are in his long arm regions responsible for spermatogenesi, it's they AZFa, AZFb and AZFc. Such regions may be deleted causing male infertility by contain multiple genes essential for spermatogenesis. Thanks to advances in medicine, now several cases of infertility are treatable through assisted reproduction techniques. Among the techniques, the MSOME stands out as a methodology that selects only morphologically normal sperm to be used in insemination increasing the chances of pregnancy.
ConclusionsMale infertility has increased considerably in recent years and the genetic causes are one of the major consequences of this. Y chromosome microdeletions can cause mild oligozoospermia or azoospermia depending on the AZF region affected. For lighter causes, the couple may use some assisted reproductive techniques and to the most serious causes the solution to the couple is using donated gametes.
A fertilidade é basicamente o funcionamento adequado dos sistemas reprodutivos femininos e masculinos. A função desse sistema é sintetizar gametas, ou seja, óvulos, espermatozoides e os hormônios envolvidos na reprodução.1 Dessa forma, a infertilidade é definida como uma doença dos órgãos reprodutores que leva à incapacidade de um casal de se reproduzir após 12 meses de relações sexuais desprotegidas. Pode ter causas femininas, masculinas, ambas ou ideopáticas (sem causas aparentes). Essa dificuldade na reprodução atinge cerca de 20% da população, o homem é responsável por 50 a 70%.2
Etiologicamente, a infertilidade masculina pode estar relacionada com causas genéticas e/ou não genéticas. Dentre as causas não genéticas podem se considerar alguns hábitos (sedentarismo, tabagismo, droga), produtos químicos, alguns medicamentos, dentre outras. Já entre as causas genéticas se destacam as anomalias numéricas e estruturais dos cromossomos sexuais, as mutações no gene CFTR (Cystic Fibrosis Transmembrane Conductance Regulator) e as pequenas deleções (microdeleções) do cromossomo Y.2,3
Quando comparadas com outras causas de infertilidade, as microdeleções do cromossomo Y são relativamente frequentes (7 a 10%) e isso aumenta com o grau de comprometimento da espermatogênese.4 No braço longo do cromossomo Y (Yq), localizam‐se três regiões denominadas “azoospermia factors” (AZF), AZFa, AZFb e AZFc, importantes na fertilidade masculina por apresentar genes que são expressos na espermatogênese. Na microdeleção do Y, uma ou mais dessas regiões podem estar ausentes ou deletadas e, a depender da região AZF afetada, a infertilidade pode ser mais ou menos grave. Vão desde a síndrome de células de sertoli (deleção do AZFa) à hipoespermatogênese (deleção do AZFc) e passam pela parada da maturação dos genomas na meiose (deleção do AZFb).5,6 No braço curto do cromossomo Y (Yp) está localizado o gene SRY, que é fundamental para a diferenciação e o crescimento testicular e quando deletado também pode causar infertilidade.4
A pesquisa da microdeleção do cromossomo Y é crucial para definir a etiologia da falência da espermogênese, assim como fornecer informações importantes a respeito do tratamento clinico mais apropriado do paciente infértil.4
Por meio de uma revisão de literatura nas bases de dados Medline, Lilacs, Pubmed e Scielo foram selecionados 55 artigos. Desses, foram usados 42 dos últimos 40 anos, com as palavras chaves: “Infertilidade masculina”, “infertility”, “male/genetics”, “microdeleções no cromossomo Y”, “tratamentos da infertilidade” e “técnicas de reprodução assistida”. Os artigos foram revisados e os principais aspectos são apresentados a seguir.
Este trabalho teve como objetivo abordar e discutir as microdeleções no cromossomo Y e sua relação com a infertilidade masculina.
Infertilidade masculinaA fertilidade masculina envolve processos complexos e delicados desde o período fetal até a puberdade. Apesar dos distintos hábitos e culturas pelo mundo, tem‐se notado um aumento significativo na infertilidade masculina, que pode ser causada por algumas interferências (físicas, químicas ou hormonais) durante as fases de desenvolvimento do indivíduo.7–9
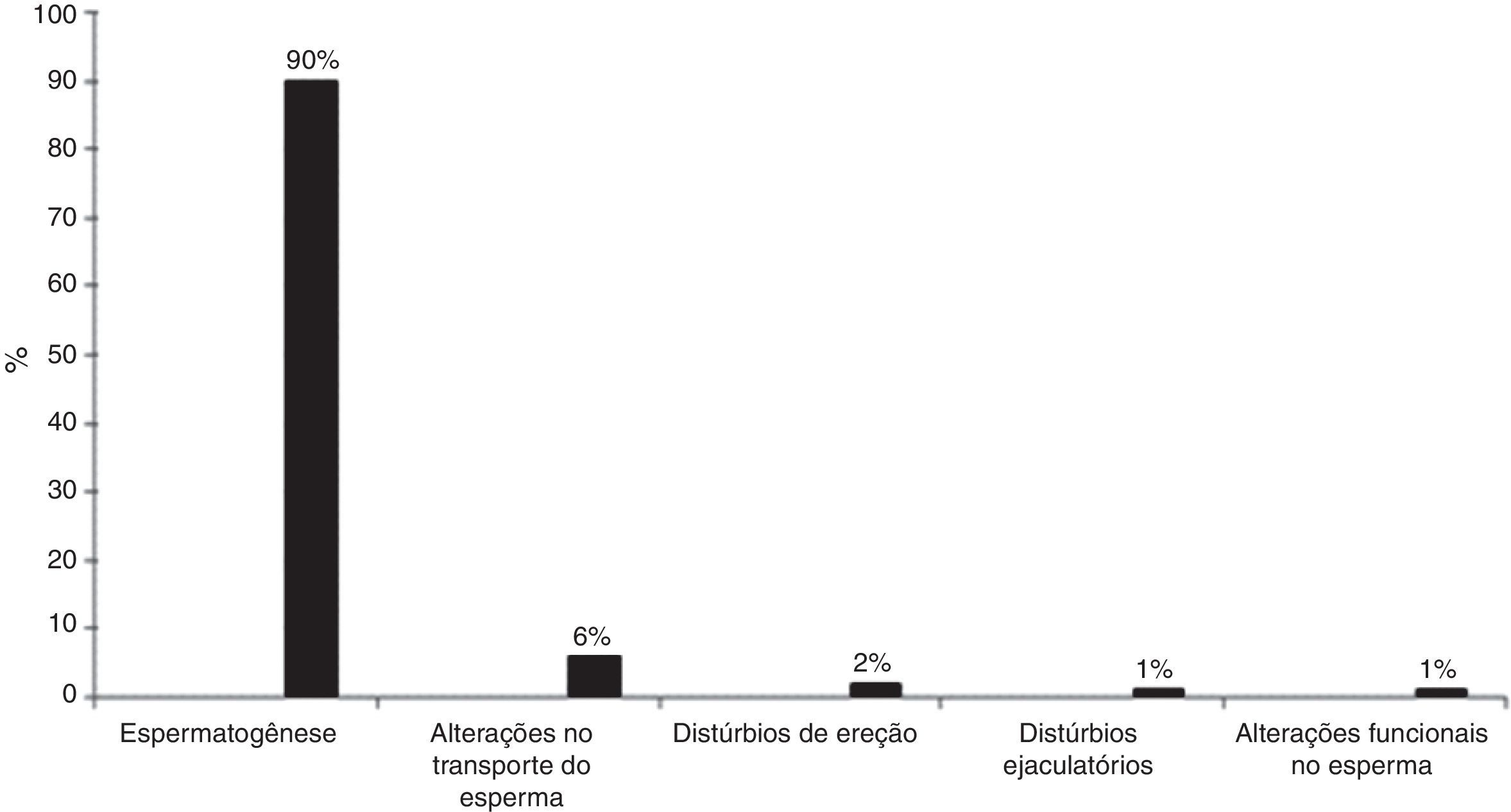
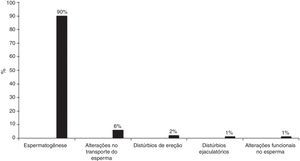
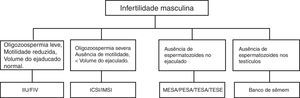
Cerca de 10% dos homens em idade reprodutiva são inférteis. Podem ter ausência de esperma (azoospermia), diminuição no número (oligozoospermia), alteração da forma (teratozoospermia), da capacidade de motilidade (astenozoospermia) ou da vitalidade (necrospermia).10,11 As causas mais comuns de infertilidade masculina estão representadas na figura 1.
Somente a microscopia eletrônica (ME) é capaz de analisar algumas anormalidades frequentemente associadas à teratozoospermia, astenozoospermia e infertilidade idiopática que não são detectáveis pela microscopia óptica (MO). Apesar de a análise seminal por meio da MO estabelecida pela Organização Mundial de Saúde (OMS) ser uma metodologia simples e eficaz, ela apresenta limitações, principalmente na análise morfológica, na qual não é possível observar defeitos em estruturas como a cromatina, o acrossoma, a teca perinuclear, a mitocôndria e o axonema. A análise ultraestrutural de espermatozoides por microscopia eletrônica é descritiva, detalhada e rigorosa, com imagens tridimensionais, em que se aplicam aos casos clínicos de astenozoospermia grave associada à teratozoospermia e podem ser uma ferramenta para a compreensão de casos de infertilidade idiopática.12,13
Dentre as causas associadas com a espermatogênese estão as anomalias cromossômicas. As anomalias mais frequentes são: síndrome de Klinefelter (XXY), translocações robertsonianas, translocações equilibradas, mutações no gene CFTR e anomalias estruturais do cromossomo Y (7‐10%). Há indícios também de que cerca de 8% dos homens inférteis apresentam anomalias cromossômicas na meiose 2. Assim, cerca de 20% dos homens inférteis têm aberrações cromossômicas em nível mitótico ou meiótico.3,14
Microdeleções do cromossomo YOs cromossomos X e Y evoluíram de um par de autossomos normal que deixou de recombinar entre si há milhares de anos. Ao longo do tempo, a ausência de recombinação permitiu que essas regiões geneticamente isoladas acumulassem mutações, deleções, inserções e sequências repetitivas, em favor da sua diferenciação.15 O cromossomo Y é constituído basicamente por regiões não recombinantes, denominadas de MSY (male‐specific Y) e aproximadamente um terço da eucromatina dessas regiões consiste em sequências capazes de estabelecer recombinação homóloga não alélica (RHNA) entre si.16 Uma vez que não existe no genoma humano qualquer contrapartida para o emparelhamento mitótico e a recombinação meiótica das regiões MSY, estima‐se que essa arquitetura molecular incomum tenha evoluído no sentido de proteger a integridade genética do cromossomo Y. Por outro lado, a junção permanente de duas regiões espacialmente separadas pode resultar na perda de todo o material cromossômico intermédio. Assim, a RHNA é a principal responsável pela maioria dessas microdeleções, não visíveis citogenicamente.17
O cromossomo Y é essencial para determinação sexual masculina, formação e manutenção de células germinativas. O Yp é responsável pelo desenvolvimento testicular e o Yq pelos fatores envolvidos na espermatogênese.18,19
As microdeleções no Yq são as causas genéticas mais comuns da infertilidade masculina ocasionada pela falha espermatogênica. Porém nem todos os homens com deleções no cromossomo são inférteis. Estudos citogenéticos sugerem que as microdeleções do Yq sejam os fatores responsáveis por 10‐15% das azoospermia não obstrutiva, oligozoospermia severa e oligozoospermia leve.20,21
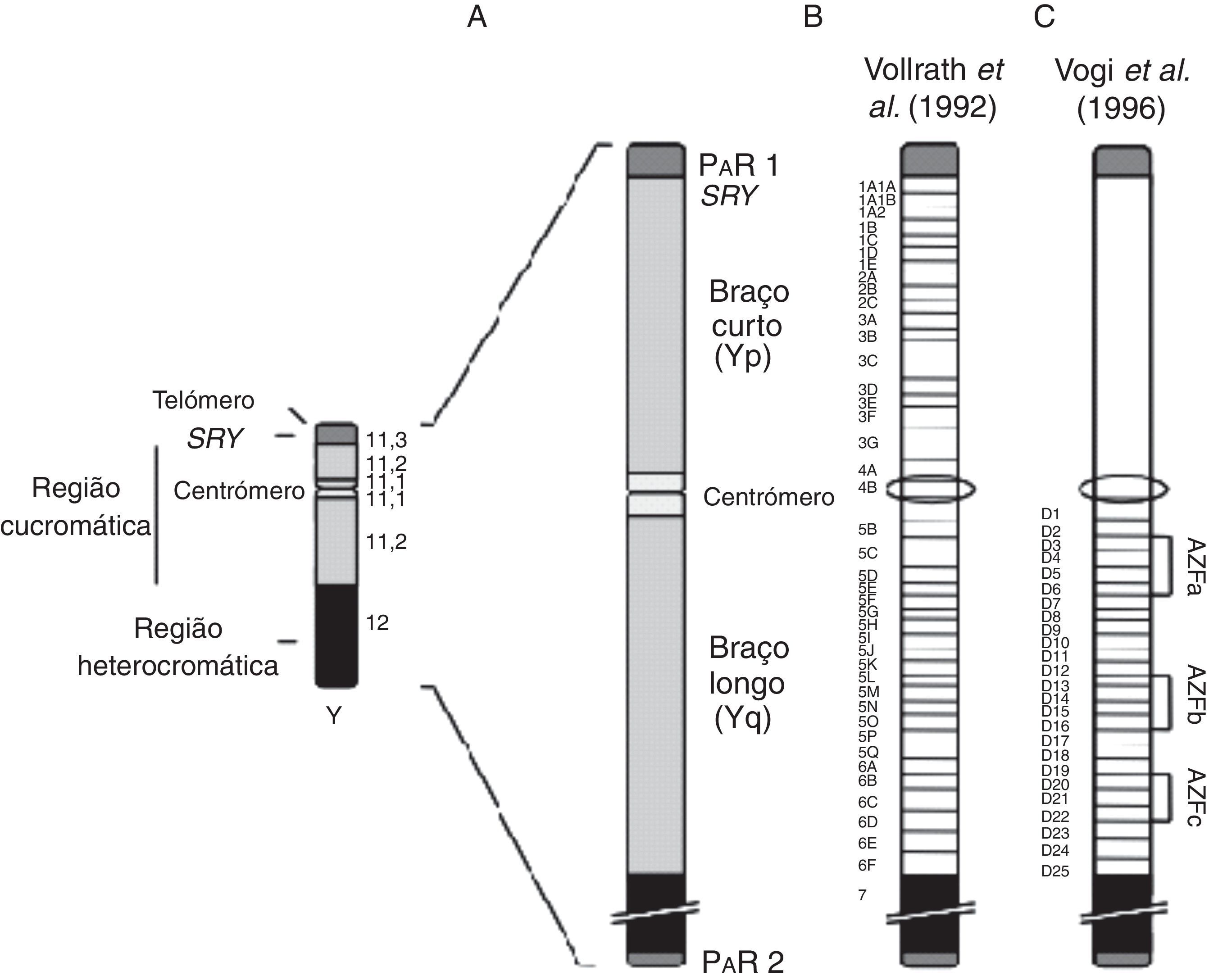
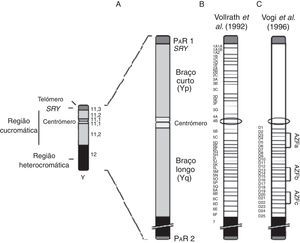
As áreas do Yq, responsáveis pela espermatogênese, foram denominadas de AZF e estão localizadas no intervalo 5‐6 do cromossomo. A região AZF (fig. 2) é dividida em 43 intervalos (fig. 2B) e três sub‐regiões (fig. 2C), o que explica a existência de múltiplos genes, cada um deles responsável por uma etapa da espermatogênese. As sub‐regiões são denominadas de AZFa, AZFb e AZFc, localizadas na parte proximal (D3‐D6), parte mediana (D13‐16) e na parte distal (D20‐D22), respectivamente. Recentemente, estudos demonstram microdeleções em outra região, AZFd, que seria responsável pela oligozoospermia leve.18,20
As microdeleções do Y podem abranger uma ou mais dessas regiões e a depender das regiões afetadas a espermatogênese pode ser mais ou menos grave.5
Apesar de ainda não se saber ao certo o tipo de microdeleção e a gravidade espermatogênica, a região AZFa contém dois genes codificadores: DDX3Y e USP9Y, flanqueados por dois elementos retrovirais que estabelecem recombinação homóloga não alélica (RHNA) entre si.17 O gene DDX3Y codifica uma helicase de RNA dependente de adenosina trifosfato, cuja deleção foi associada a disfunções em fases pré‐meióticas da espermatogênese. Por sua vez, o gene USP9Y codifica uma protease envolvida na regulação do metabolismo proteico em espermatides e as deleções que o envolvem foram associadas a disfunções em fases pós‐meióticas.24 As microdelecções completas de AZFa resultam em uma síndrome de células de sertoli (SO) e causam uma aplasia das células germinativas.2 Pacientes com SO têm níveis de LH (hormônio luteinizante) e testosterona normais, porém têm altos níveis de FSH (hormônio folículo estimulante).25 Já a deleção de AZFb provoca uma parada na meiose I (MA) que é caracterizada pela presença de células germinativas que não completaram o desenvolvimento espermatogênico e pararam no estado espermatócito primário.26
As microdeleções resultam do processo de recombinação homóloga entre sequências de DNA (ácido desoxirribonucleico) repetitivas que ocorrem anormalmente no braço longo do cromossomo Y. Isso pode explicar o fato de a região AZFc ser a mais deletada nos homens inférteis, por ser rica em blocos de DNA repetitivos e flanqueada pela região Yq12, também altamente repetitiva.18 A deleção da AZFc condiciona a hipoespermatogênese (HP), quer essa curse com uma oligozoospermia severa ou azoospermia secretora.2 A deleção completa de AZFc remove oito famílias de genes, incluindo todos os membros da família de genes DAZ (deletado em azoospermia).27 O gene DAZ é expresso especificamente no tecido testicular, onde codifica a proteína “repetição DAZ” que se liga ao RNA (ácido ribonucleico). A função dessa proteína ainda é desconhecida, mas ela pode estar envolvida no processamento e tráfego do mRNA entre o núcleo e citoplasma.28,29
Outro fator importante, localizado no Yp11.3, é o gene SRY (Sex‐Determinig Region on Y), responsável pela diferenciação e pelo crescimento testicular. O SRY está situado próximo à fronteira pseudoautossômica do cromossomo Y e é expresso no início do desenvolvimento das células do cordão germinativo antes da diferenciação dos testículos. O SRY codifica uma proteína ligada ao DNA que provavelmente é um fator de transcrição. Então, por todos os critérios genéticos e de desenvolvimento, o SRY é equivalente ao gene TDF (Testis‐Determining Factor) localizado entre o gene ZFY (zinc‐finger protein) e a região pseudoautossômica no cromossomo Y.5,30,31
As microdeleções não são detectáveis por meio de cariotipagem usual, para pesquisa das microdeleções são usadas técnicas como cariótipo com bandas em alta resolução, reação em cadeia da polimerase (PCR), hibridização fluorescente in situ (Fish) Microarray.32,33
A literatura indica que se devem pesquisar microdeleções no cromossomo Y em todo o homem com concentração espermática inferior a cinco milhões de espermatozoides/mL,4 ou seja, em casos de severa oligozoospermia e azoospermia. O estudo das causas genéticas pode permitir indicar o melhor tratamento entre as técnicas de reprodução assistidas, além de possibilitar o surgimento de novas técnicas e abordagens de futuras investigações no campo da fertilidade masculina.34
TratamentoAs maiorias dos indivíduos portadores de microdeleções recorre às técnicas de reprodução assistida (TRAs) para ultrapassar a infertilidade. No entanto, se os espermatozoides desses indivíduos transportarem a microdeleção, essa será inevitavelmente transmitida aos descendentes do sexo masculino.27 Por essa e outras razões, todo casal que apresenta anomalias genéticas deve recorrer ao aconselhamento genético, que tem como objetivo fornecer informações objetivas a respeito das probabilidades de transmissão para os descendentes.35
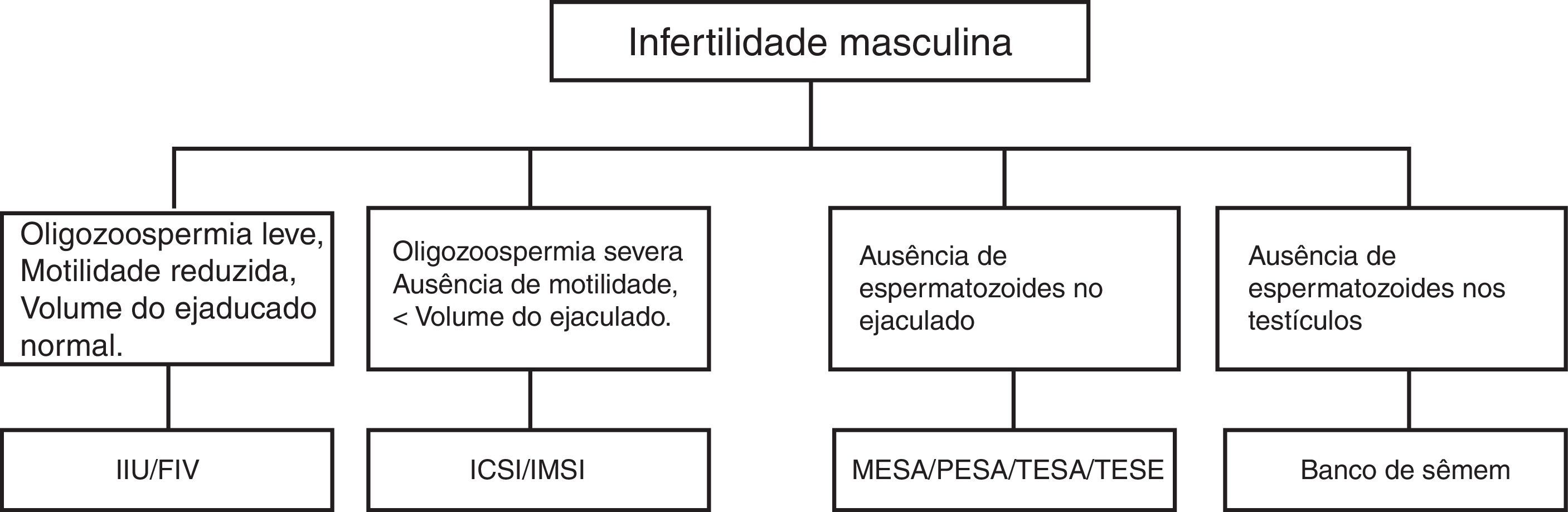
Os avanços da medicina na década de 70 possibilitaram descobertas relacionadas à genética molecular e à reprodução humana assistida, permitem que os casais com problemas na reprodução tenham filhos com o auxílio das técnicas de reprodução assistida (TRAs) (fig. 3).36
Causas e possíveis tratamentos para a infertilidade masculina.
IIU, inseminação intrauterina; FIV, fertilização in vitro; ICSI, injeção intracitoplasmática de espermatozoide; MESA, aspiração microcirúrgica de espermatozoides de epidídimo; PESA, aspiração percutânea de espermatozoides de epidídimo; TESA, aspiração percutânea de espermatozoides do testículo; TESE, extração por biópsia de espermatozoides do testículo.
As TRAs podem ser classificadas em intracorpórea, extracorpórea, homólogas e heterólogas. As intracorpóreas são as inseminações artificiais, nas quais a fecundação ocorre dentro da mulher. As extracorpóreas são as fertilizações in vitro (FIV), nas quais a fecundação acontece fora do corpo da mulher. As homólogas usam os gametas no próprio casal e as heterólogas usam gametas de doadores.37,38
Nos casos de microdeleções do cromossomo Y em que haja apenas oligozoospermia, é possível usar as TRAs extracorpóreas, como a MSOME (motile sperm organelle morphology examination). Nessa metodologia, os espermatozoides não corados, móveis, são observados em tempo real com lentes Normaski e objetivas especificas que permitem uma maior ampliação do espermatozoide (> 6.000X) e passam por uma criteriosa análise de suas organelas, especialmente a presença de vacúolos nucleares que estão associados a danos no DNA.39,40
A MSOME facilitou o desenvolvimento da injeção intracitoplasmática de espermatozoides morfologicamente selecionados (IMSI), na qual somente os espermatozoides portadores de um núcleo estritamente definido como morfologicamente normal é selecionado para inseminação, para um melhor resultado do que a ICSI convencional, por focar na correlação entre danos ao DNA e anormalidades morfológicas do espermatozoide e aumentar as chances de sucesso na implantação e gestação.41
Nos casos em que o homem tiver ausência de espermatozoides nos testículos, há a opção de o casal optar pela TRA heteróloga e usar os espermatozoides de um doador na fecundação.42
Considerações finaisA infertilidade masculina tem aumentado significativamente nos últimos anos devido a fatores genéticos (mutações cromossomais) e não genéticos (alguns hábitos). As causas mais comuns estão associadas a falhas na espermatogênese, que pode causar desde uma oligozoospermia a uma azoospermia.
Quando comparada com outras causas de infertilidade, a microdeleção do Y é relativamente frequente. No braço longo do cromossomo Y, há algumas regiões responsáveis pelas etapas da espermatogênese, AZFa, AZFb e AZFc, que podem ser deletadas e a depender de qual e quantas forem deletadas a infertilidade pode ser mais ou menos grave.
Um processamento mais preciso da qualidade seminal e das características genéticas, pode contribuir para um diagnóstico precoce e facilitar o tratamento do paciente. Caso isso não seja possível, uma técnica de reprodução assistida que pode ser usada é a IMSI (injeção intracitoplasmática de espermatozoides morfologicamente selecionados). Essa técnica foca na correlação entre danos ao DNA e anormalidades morfológicas do espermatozoide e aumenta as chances de sucesso na implantação e gestação. Já para as causas nas quais haja uma azoospermia, a opção do casal é recorrer a bancos de sêmem e usar gametas doados para a inseminação.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.