A síndrome dos ovários policísticos (SOP) é uma desordem endócrina comum que afeta 5 a 10% das mulheres em idade reprodutiva. A associação entre síndrome metabólica e alterações relacionadas à glicose e insulina é frequente em pacientes com SOP, eleva o risco cardiovascular dessas pacientes. O LAP é um índice de risco cardiovascular emergente que se baseia na combinação da circunferência abdominal (CA) e triglicérides (TGL) em jejum e reflete de forma simples a acumulação lipídica em adultos.
ObjetivosO presente estudo avaliou as possíveis correlações entre síndrome metabólica e o LAP nos parâmetros metabólicos e reprodutivos de pacientes com SOP.
Materiais e MétodosO estudo incluiu 299 pacientes portadoras de SOP, definida pelos critérios de Rotterdam, acompanhadas no Ambulatório de Hiperandrogenismo do Hospital das Clínicas da Universidade Federal de Minas Gerais (HC‐UFMG).
Foram avaliados(1) dosagens séricas de triglicérides, testosterona total, glicemia de jejum e duas horas após sobrecarga de 75 gramas de dextrosol (GPD), TSH; (2) cálculo do LAP; (3) cálculo do índice de Ferriman; (4) avaliação do volume dos ovários; (5) medida da circunferência abdominal e (6) presença ou não de síndrome metabólica.
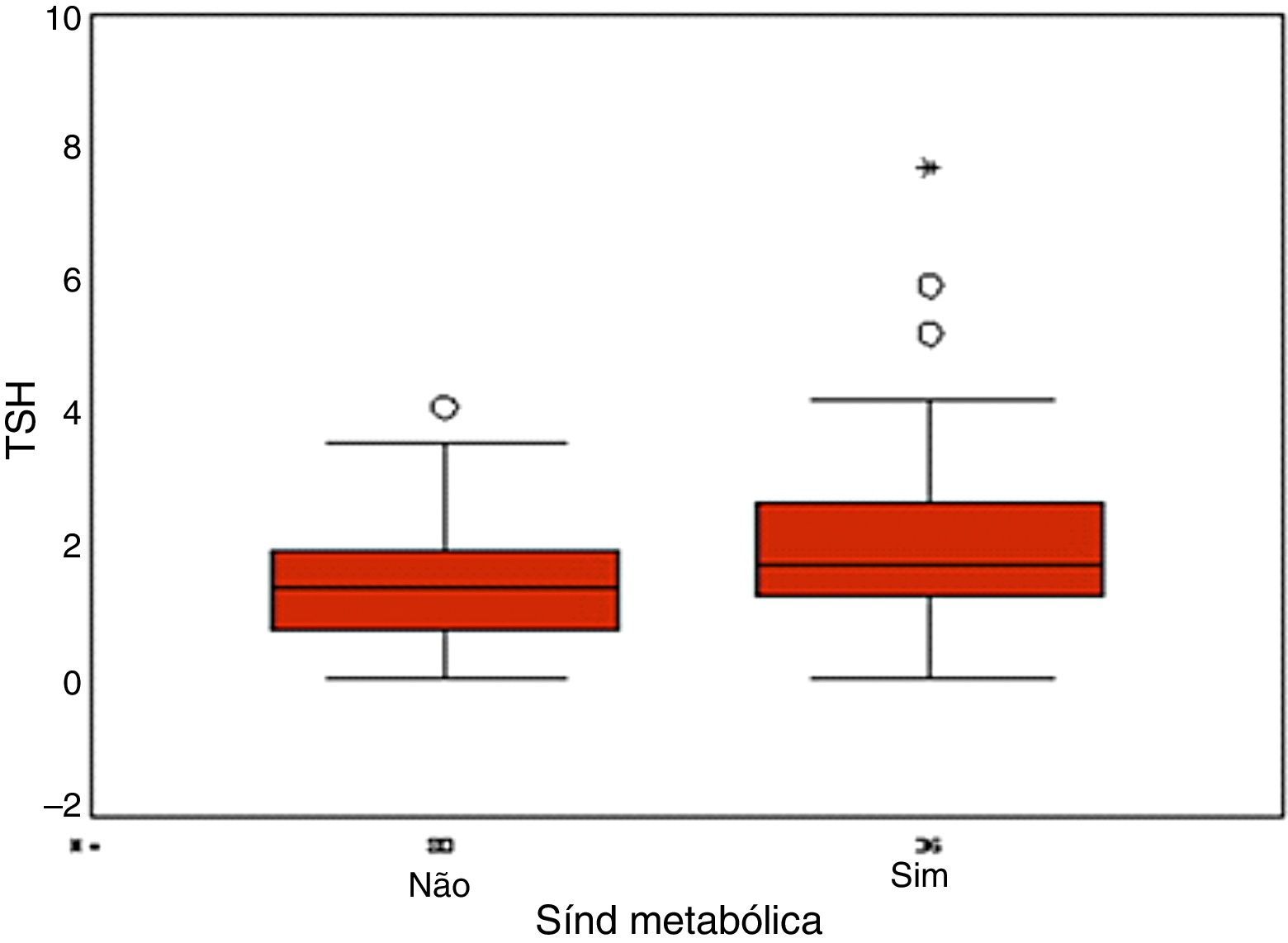
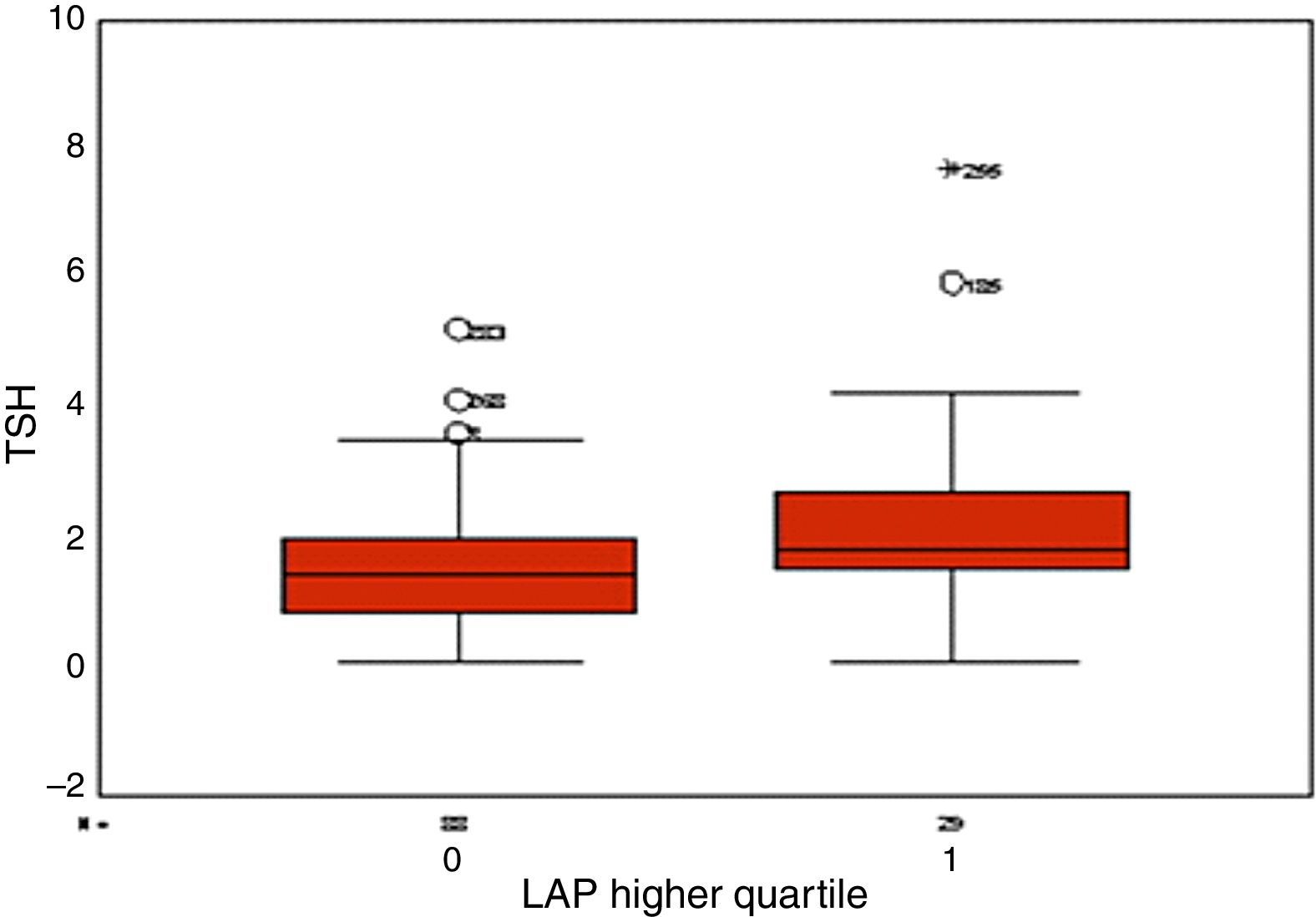
ResultadosA média do LAP foi 60,9 e a mediana 51,3. Pacientes com ou sem síndrome metabólica quando comparadas entre si não apresentaram diferenças quanto a volume ovariano, testosterona total, índice de Ferriman, glicemia de jejum e pós‐dextrosol. As mulheres com síndrome metabólica tiveram valores de TSH mais altos do que as mulheres sem síndrome metabólica. Já as mulheres no quartil superior do LAP tiveram TSH, índice de Ferriman e GPD maiores do que as mulheres nos quartis inferiores de LAP.
ConclusõesOs valores mais elevados do LAP sugeriram boa correlação desse índice com resistência insulínica. Os valores de TSH mais elevados em pacientes com síndrome metabólica e LAP no quartil superior em pacientes com SOP representam um dado novo na literatura que precisa ser mais bem estudado.
Polycystic Ovary Syndrome (SOP) is a common endocrine disorder that affects 5‐10% of women of reproductive age. The association between metabolic syndrome and changes related to glucose and insulin is frequent in patients with SOP, increasing the cardiovascular risk of these patients. The LAP is an emerging cardiovascular risk based on the combination of waist circumference (WC) and triglycerides (TGL) and fasting simply reflects the lipid accumulation in adults.
ObjectivesThis study examined the possible correlation between metabolic syndrome or LAP and reproductive and metabolic parameters in patients with SOP.
Materials and MethodsThe study included two hundred ninety‐nine patients with SOP, defined by the Rotterdam criteria followed at HC‐UFMG who had assessed their levels of triglycerides, total testosterone, fastingand two hours after 75 grams of overload dextrosol (GPD), TSH, LAP, Ferriman index, ovarian volume and abdominal circumference, and the presence or absence of metabolic syndrome.
ResultsThe mean LAP was 60.9 and the median 51.3. Patients with and without metabolic syndrome when compared to each others howed no differences in ovarian volume, total testosterone, Ferriman, fastingand post‐dextrosol. Women with metabolic syndrome had higher TSH levels than women without metabolic syndrome. The women in the top quartile of the LAP had TSH, Ferriman and GPD higher than women in the lower quartiles of LAP.
ConclusionsThe higher values of LAP suggested good correlation of this index with insulin resistance. TSH levels were higher in patients with metabolic syndrome and LAP in the top quartile in SOP patients represent a new element in the literature and needs to be better studied.
A síndrome dos ovários policísticos (SOP) é uma desordem endócrina heterogênea caracterizada por hiperandrogenismo e anovulação crônica.1 Trata‐se de afecção de caráter multifatorial e poligênico que afeta 5 a 10% das mulheres em idade reprodutiva.1–3 Cerca de 50 a 70% das pacientes com SOP têm resistência insulínica e síndrome metabólica, o que aumenta o risco de diabete tipo II e doenças cardiovasculares nessas mulheres.3–7 Os mecanismos envolvidos na correlação entre essa desordem e o risco cardiovascular não estão completamente esclarecidos. A hiperandrogenemia parece ser uma causa importante. Entretanto, outros fatores, como disfunção tireoidiana, também podem estar associados.8
Alguns estudos descreveram que mulheres com SOP podem apresentar níveis mais altos de TSH, que, apesar de estar dentro da faixa da normalidade, podem contribuir para a manifestação da síndrome nessas pacientes,6,9 além de uma possível associação entre hipotireoidismo subclínico e SOP.6–12 Parece existir ainda associação entre níveis de TSH e sensibilidade insulínica, assim como alta prevalência de hipotireoidismo subclínico em mulheres portadoras de SOP e síndrome metabólica.12–14 Também já foi demonstrada alta prevalência de SOP em jovens eutireoideias portadoras de tireoidite autoimune, o que sugere a presença de outros fatores envolvidos no fenótipo da síndrome além da disfunção da tireoide, como, por exemplo, autoimunidade.15–17A síndrome metabólica (SM) é definida por determinados critérios associados a elevado risco de doenças coronarianas e diabetes mellitus tipo II.18 Pacientes com três ou mais dos seguintes fatores serão diagnosticados como portadores da síndrome metabólica: circunferência abdominal >88cm em mulheres; hipertrigliceridemia ≥ 150mg/dL; HDL<50 em mulheres; pressão arterial ≥130/85mmHg e glicemia de jejum ≥ 110mg/dL.19
Como a SOP está associada com intolerância à glicose, bem como ao aumento do risco cardiovascular, é possível supor que, em várias dessas pacientes, poderiam ser encontradas características da SM. Já foi descrito que a prevalência de SM em portadoras de SOP varia de 33 a 43%, cerca de duas vezes a observada em mulheres da população geral, na mesma faixa etária e IMC, independentemente da etnia.20,21
O LAP (lipid accumulation product ou produto da acumulação lipídica) é um índice de risco cardiovascular emergente que se baseia no produto da circunferência abdominal (CA) pelo valor de triglicérides (TGL) em jejum. Tem se revelado um marcador confiável para doença cardiovascular em adultos, supera outros preditores desse risco, como o IMC, até nas pacientes portadoras de SOP.22–26 Já foi demonstrado que nessas pacientes o índice LAP foi significativamente maior quando comparado com o grupo controle. Os valores também foram maiores nas portadoras de SOP com síndrome metabólica em relação àquelas sem síndrome metabólica.18 Além disso, o LAP foi citado como importante preditor de intolerância à glicose em pacientes com SOP.20
O presente estudo tem como objetivo avaliar as possíveis correlações entre síndrome metabólica e/ou LAP e parâmetros metabólicos em pacientes com SOP.
Material e métodosO estudo incluiu 299 pacientes portadoras de SOP, diagnosticadas pelos critérios de Rotterdam, entre 18 a 40 anos, acompanhadas no Ambulatório de Hiperandrogenismo do Laboratório de Reprodução Humana do Hospital das Clínicas da Universidade Federal de Minas Gerais (UFMG). Foram excluídas pacientes que apresentaram outras causas de hiperandrogenismo/anovulação como: hiperplasia congênita de suprarrenal (HCSR), hiperprolactinemia, disfunções da tireoide e tumores produtores de androgênios.
Segundo consenso de Rotterdam, dois dos três critérios a seguir devem estar presentes para definição da síndrome dos ovários policísticos: anovulação crônica, evidência clínica ou laboratorial de hiperandrogenismo, imagem ultrassonográfica de ováriospolicísticos.27
As pacientes foram submetidas à avaliação clínica e laboratorial dos seguintes parâmetros: valores de triglicérides, testosterona total, glicemia de jejum e duas horas após sobrecarga de 75 gramas de dextrosol (GPD), TSH, LAP, índice de Ferriman, volumes ovarianos e circunferência abdominal.
A presença ou não de SM foi considerada conforme os critérios descritos anteriormente. O LAP foi calculado pela fórmula matemática descrita por Kahn, na qual LAP=[CA (cm) – 58] X [TGL (mmol/L)].28 O valor maior do que 34,5 se correlaciona com resistência insulínica e aumento do risco cardiovascular.25,28,29
Para as análises estatísticas foram usadas, além das análises descritivas (frequências, percentuais, médias, desvio‐padrão), análises comparativas. Dentre as análises comparativas, foram usados os testes t de Student, para comparação das médias de dois grupos independentes e o teste qui‐quadrado para comparações de variáveis categóricas, além de uma estratificação dos dados em quartis que foi apresentada no formato de Box‐plot. Para a análise estatística e construção do Box‐plot foi usado o programa SPSS®, e para as demais figuras e tabelas foi usado o Microsoft Excel®. Foram consideradas relações estatísticas significativas aquelas que apresentaram valor p menor ou igual a 0,05.
ResultadosEntre as 299 pacientes estudadas, a média do LAP foi 60,9, enquanto a mediana foi de 51,3. Pacientes com ou sem síndrome metabólica quando comparadas entre si não apresentaram diferenças estatisticamente significativas quanto a volume ovariano, testosterona total, índice de Ferriman, glicemia de jejum e pós‐dextrosol (tabela 1).
Análise segundo presença ou não de síndrome metabólica e de acordo com valor do LAP – média pelo teste de Mann‐Whitney
| Variáveis | Síndrome metabólica | LAP | ||
|---|---|---|---|---|
| Sim | Não | Quartis superiores | Quartis inferiores | |
| Glicemia de jejum | 124,98 | 112,99 | ||
| Glicemia 2 horas após 75 gramas de dextrosol | 64,57 | 46,84 | ||
| Testosterona | 62,29 | 60,41 | 68,08 | 60,04 |
| TSH | 70,93 | 52,91 | 74,48 | 53,90 |
As mulheres com síndrome metabólica tiveram valores de TSH maiores do que as mulheres sem síndrome metabólica, porém dentro da faixa da normalidade (fig. 1). Já as mulheres no quartil superior do LAP tiveram TSH (fig. 2), índice de Ferriman (fig. 3) e GPD (fig. 4) maiores do que as mulheres nos quartis inferiores de LAP.
A síndrome dos ovários policísticos, caracterizada por disfunção ovulatória, hiperandrogenismo e ovários policísticos no seu fenótipo clássico, é a endocrinopatia mais prevalente em mulheres em idade reprodutiva.2 A SOP é também considerada uma disfunção metabólica, já que vários fatores de risco para doença cardiovascular, incluindo síndrome metabólica, diabetes mellitus tipo II, dislipidemia, obesidade abdominal e hipertensão, podem estar presentes.3–7 Apesar de a evidência de eventos cardiovasculares em mulheres portadoras de SOP ser ainda limitada, estudos recentes sugerem maior probabilidade desses eventos na presença da SOP clássica. Portanto, a identificação precoce da presença dos fatores de risco nessas pacientes se faz necessária.8,30
O índice LAP, que associa a medida da cintura abdominal e valores de triglicérides, foi inicialmente proposto em 2005, com dados da National Health and Nutrition Examination Survey (NHANES III), e se mostrou melhor preditor para risco cardiovascular quando comparado com o IMC.28 Os valores mais elevados do LAP encontrados neste estudo sugeriram boa correlação desse índice com resistência insulínica, considerando que as mulheres que se encontravam no quartil superior do LAP apresentaram valores de GPD mais altos do que aquelas nos quartis inferiores do LAP. Esses resultados corroboram estudos anteriores que demonstraram relação importante entre o HOMA IR, marcador de sensibilidade à insulina, e o LAP em pacientes com SOP.2,22,25
Uma associação entre níveis mais elevados de TSH e resistência insulínica já foi descrita anteriormente em pacientes com SOP.6,9 Em nosso estudo foram encontrados valores de TSH mais elevados, porém dentro da faixa da normalidade, em pacientes com síndrome metabólica e LAP no quartil superior em pacientes com SOP. Esses resultados representam um dado novo na literatura que precisa ser mais bem estudado.
As limitações encontradas nesse estudo são inerentes a um estudo transversal e devido à falta do grupo controle. Portanto, são ainda necessários estudos prospectivos, com grupo controle e maior número de pacientes estudadas, para exclusão de possíveis fatores de confusão e confirmação dos resultados encontrados.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.