Historia
En 1981 se informó sobre un grupo de hombres homosexuales -previamente sanos- con neumonía por Pneumocystis carinii y sarcoma de Kaposi. Dos años después se identificó el agente causal: un retrovirus a la postre denominado virus de la inmunodeficiencia humana o VIH y tres años después se describió el VIH-2 en EU. En 1985 se desarrolló la primera prueba diagnóstica para el VIH-1 y en 1987 ya se contaba con el primer antiretroviral: zidovudina (AZT). El tratamiento evolucionó y nueve años después se dispuso del tratamiento combinado, conocido como antirretroviral altamente efectivo (HAART, por sus siglas en inglés), con el que cambió radicalmente la historia natural de la enfermedad, reduciendo significativamente la mortalidad, la progresión a SIDA y las hospitalizaciones.1,2
El origen
Estudios filogenéticos sugieren que el VIH evolucionó a partir de un lentivirus que de manera natural infecta a primates africanos: el virus de la inmunodeficiencia en simios (VIS). Contrario a la impresión de que el VIS no ocasiona inmunodepresión, estudios recientes sugieren que en simios ocasiona un síndrome parecido al de inmunodeficiencia adquirida humana, con sus respectivos efectos negativos en la salud, reproducción y sobrevida de los chimpancés.3
Epidemiología
La infección por el VIH se ha diseminado todos los países del planeta. Hasta diciembre de 2010, había 33 millones de personas viviendo con infección por VIH/SIDA, y más de 35 millones habían muerto desde el inicio de la epidemia. De los 33 millones, más de la mitad son mujeres, 2.5 millones son niños y 22.5 millones viven en África. Sólo en 2009, hubo 2.6 millones de casos nuevos y 1.8 millones de muertes por esta causa. Se estima que diario se infectan 7000 personas, la mayoría de los cuales son jóvenes, mujeres y niños.4
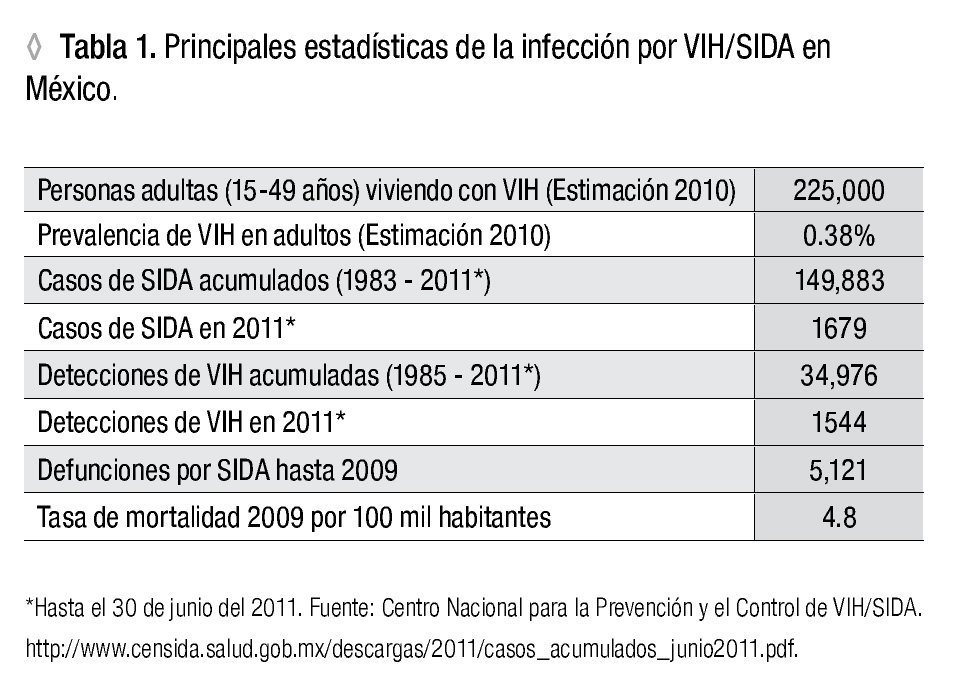
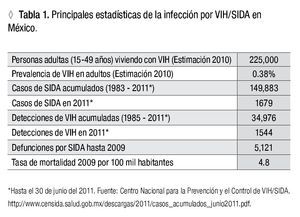
Aproximadamente 10% de la población mundial vive en el sub Sahara; sin embargo, esta región tiene 64% de la población mundial con infección por VIH. Todos los países en esta región tienen prevalencia de infección por VIH por arriba de 5%, y algunos de 25%. Después de Africa, la región del Caribe tiene le segunda mayor prevalencia de infección por VIH.5 En la Tabla 1 se muestran las estadísticas principales de la infección por VIH/SIDA en México.
Mecanismos de transmisión
Los principales mecanismos de transmisión son:
Contacto sexual: Aproximadamente 80% de todos los casos son adquiridos por relaciones heterosexuales.
Parenteral: La adicción a drogas intravenosas es una de las principales causas de infección por VIH en Europa central y oriental, y en algunos países de Asia.6 La prevalencia de infección por VIH entre adictos a drogas intravenosas se ha estimado entre 20% y 40%.7
Perinatal: Debido a la elevada prevalencia de infección por VIH en mujeres, el riesgo de transmisión perinatal es alto. El producto puede infectarse in útero, al nacimiento o durante la amamantación. La transmisión de madre a hijo origina 90% de los casos de infección infantil.
Etapas de la infección por el virus de la inmunodeficiencia humana
Transmisión del virus: La infección por el VIH se adquiere por vía sexual, exposición a sangre contaminada o transmisión perinatal. La frecuencia de estos modos de transmisión varía entre países y su contribución relativa ha cambiado con el tiempo. Los factores de riesgo para transmisión del VIH son la carga viral, ausencia de circuncisión, presencia de enfermedades de transmisión sexual ulceradas, número de parejas sexuales, relación sexual sin protección y factores genéticos. La eficiencia de transmisión es aproximadamente la misma de hombres a mujeres que de mujeres a hombres; sin embargo, la transmisión es cuatro veces mayor en pacientes con úlceras genitales.
Infección primaria: También llamada infección aguda por VIH o síndrome de seroconversión aguda. La presencia de síntomas durante la infección primaria ocurre en muchos pacientes y cuando estos duran más de 14 días parece correlacionar con una progresión más rápida a SIDA.8
Igualmente una viremia persistentemente detectable o niveles plasmáticos elevados (>1 x 105 Eq/mL) después de la infección primaria son predictores importantes para el desarrollo de SIDA.
Seroconversión: Esta ocurre entre las cuatro y 10 semanas después de la exposición y 95% ha seroconvertido a los seis meses.
Etapa de latencia clínicacon o sin linfadenopatía generalizada persistente: El periodo de enfermedad temprana comprende los seis meses posteriores a la seroconversión. Durante este periodo asintomático, la exploración física es generalmente negativa, excepto por la posible "linfadenopatía generalizada persistente", definida como adenomegalias en por lo menos dos sitios no contiguos, en las cuales se pueden identificar altas concentraciones de VIH. El tejido linfoide es el mayor reservorio de VIH debido a que filtran y "atrapan" virus libres y linfocitos CD4 infectados. Con la progresión de la enfermedad, la arquitectura del ganglio se pierde y más VIH es liberado al torrente sanguíneo.9 En esta etapa asintomática existe una elevada replicación viral con destrucción de un promedio de 109 linfocitos CD4 diario.10 Después del primer año, la pérdida de linfocitos CD4 varía de 30 a 90/ mm3 cada año. La vida media del VIH en suero es 1.2 días, cerca de 24 horas intracelularmente, y aproximadamente seis horas extracelularmente.
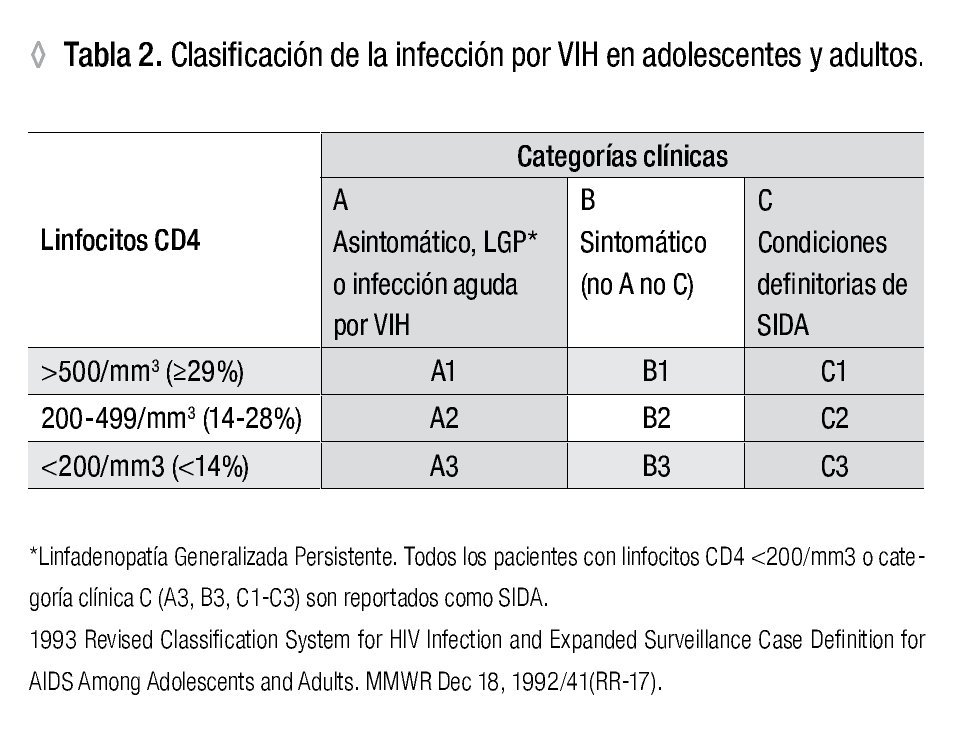
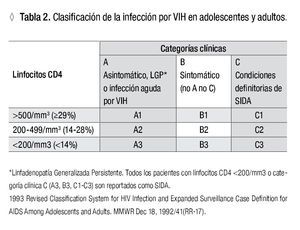
Infección sintomática temprana: Previamente conocida como 'complejo relacionada a SIDA' y más recientemente correspondiente a la Clase B de la clasificación de los CDC de 1993 (Tabla 2). Estas condiciones clínicas no son exclusivas de la infección por VIH, y no son definitorias de SIDA.
SIDA (linfocitos CD4 menor de 200/mm3 con o sin síntomas): Las condiciones definitorias de SIDA se enumeran en la Tabla 3, de acuerdo con la clasificación de los CDC de 1993. El tiempo promedio desde el inicio de la inmunodepresión severa (<200 linfocitos CD4/mm3) a la aparición de una condición clínica definitoria de SIDA es de 12 a 18 meses en personas sin tratamiento antirretroviral.
Infección avanzada por el VIH: caracterizada por linfocitos CD4 menor de 50/mm3. Sin tratamiento antirretroviral el promedio de sobrevida es de 12 a 18 meses.
Situaciones especiales
Algunos pacientes pueden permanecer estables y asintomáticos por varios años sin tratamiento antirretroviral. Los mecanismos por los cuales ocurre este tipo de control natural se desconocen, pero parecen ser altamente efectivos.
Pacientes no progresores: Para que un paciente se considere no progresor, lo que ocurre en 4% a 7% de los casos, debe tener por lo menos 10 años con infección por VIH, ningún tratamiento antirretroviral, ausencia de síntomas y linfocitos CD4 >500/mm3.11
Controladores elite: Son individuos con infección por VIH con carga viral no detectable y niveles altos de linfocitos CD4. Ninguno de 63 individuos con esta condición registrados en los Institutos Nacionales de Salud en Estados Unidos han progresado después de un promedio de seguimiento de 19 años.12
Tratamiento antiretroviral
Gracias al esfuerzo de múltiples organizaciones (UNAIDS, OMS, The Global Fund for AIDS, Tuberculosis and Malaria así como al PEPFAR -Presidents´s Emergency Plan for AIDS Relief-, entre otras) hacia finales de 2009 la cobertura de tratamiento antirretroviral en países de bajos y medianos ingresos alcanzó 35% de un total de 15 millones de individuos que lo necesitan.13,14 El desarrollo de antirretrovirales genéricos ha incrementado su disponibilidad en algunos países en desarrollo.
Inicio del tratamiento
Un aspecto que ha recibido mucha atención es cuándo iniciar el tratamiento antirretroviral en pacientes asintomáticos. Hay fuerte evidencia de que el tratamiento debe iniciarse antes de que el conteo de linfocitos CD4 baje de 350/mm3, y quizá antes que baje de 500; con lo anterior se ha evitado la progresión a SIDA y muerte más efectivamente. Una ventaja adicional del tratamiento temprano es la reducción del riesgo de transmisión del VIH a otros. En un estudio prospectivo observacional en África, las parejas VIH negativas de individuos con tratamiento antirretroviral tuvieron cinco veces menos probabilidades de adquirir la infección comparados con aquellos cuyas parejas sexuales no lo estaban recibiendo. Las guías de tratamiento de la OMS de 2010 recomiendan que todos los pacientes asintomáticos con un conteo de linfocitos CD4 de <350 cel/mm3 inicien tratamiento antirretroviral.15
Actualmente las opciones de tratamiento recomendadas en pacientes vírgenes a tratamiento y asintomáticos, están basados en:16
a. Un inhibidor no nucleósido de la transcriptasa reversa: tenofovir/emtricitabina más efavirenz; o
b. Inhibidores de proteasa: atazanavir más tenofovir/emtricitabina o da runavir más tenofovir/emtricitabina. (Estos dos esquemas requieren de un "booster" con ritonavir); o
c. Inhibidor de integrasa: raltegravir más tenofovir/emtricitabina.
Para las pacientes embarazadas: zidovudina/ lamivudina más lopinavir más ritonavir o abacavir más lamivudina más efavirenz o atazanavir.
Tratamiento en pacientes previamente tratados
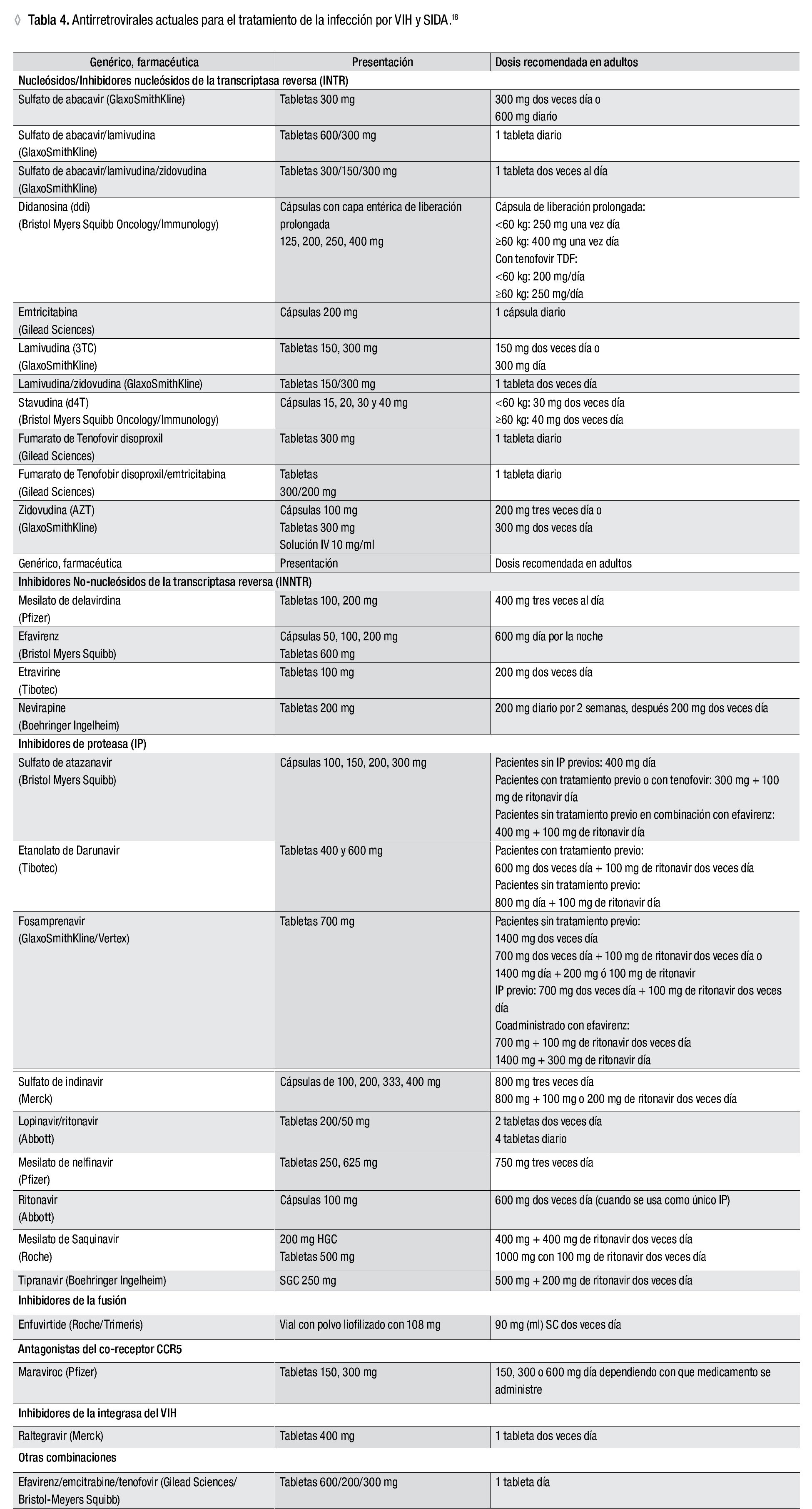
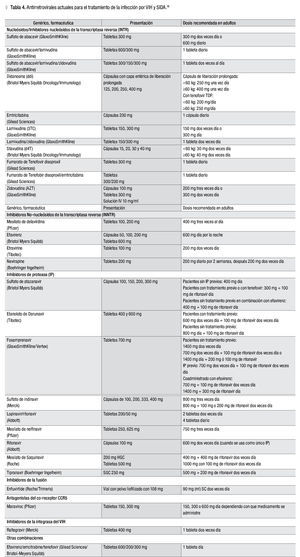
Con el uso de los nuevos antirretrovirales se han logrado tasas de supresión viral sin precedentes. Por ejemplo, en el estudio TRIO, 86% de los pacientes tratados con raltegravir, etravirine y darunavir (más otro si estaba indicado) lograron cargas virales no detectables.17,18 Después de 24 años de haberse desarrollado el primer antirretroviral, el número y efectividad de los actuales antirretrovirales es francamente asombroso. En la Tabla 4 se enumeran la mayoría de los antirretrovirales disponibles a la fecha.
Monitoreo del tratamiento
El seguimiento por laboratorio puede alertar al clínico con respecto a efectos adversos del tratamiento, la emergencia de resistencia o la disminución de linfocitos CD4, y con ello establecer cambios en el tratamiento antirretroviral oportunamente. Las guías iniciales de la OMS recomendaban que la determinación de linfocitos CD4 podría ser suficiente para monitorizar la respuesta al tratamiento farmacológico; sin embargo, actualmente es claro que es necesaria la determinación de carga viral para poder cambiar el tratamiento antiviral con conteos más altos de linfocitos CD4. Las guías de la OMS de 2006 indican que la determinación de carga viral es un parte importante de los criterios de falla al tratamiento. No recomienda cambiar el tratamiento antirretroviral a menos que la carga viral sea mayor de 10 000 copias/mL.19
Adherencia al tratamiento
Para logar la supresión viral y evitar el desarrollo de resistencia, se requiere un alto nivel de adherencia al tratamiento,20 lo cual es más difícil de lograr en países en desarrollo donde frecuentemente el número de médicos especialistas es insuficiente.21
Eficacia del tratamiento antiretroviral
Esta opción terapéutica es altamente efectiva aún en países en desarrollo: reduce la morbilidad y mortalidad significativamente. En casi 20 000 pacientes de un grupo de cohortes en África, América Latina y Asia, el tratamiento antirretroviral incrementó el promedio basal de linfocitos CD4 de 114 a 395 células/mm3 después de cinco años de seguimiento,22 y en una cohorte del Programa Nacional de Tratamiento Antirretroviral Gratis, la mortalidad disminuyó de 22.6 muertes a cuatro muertes por cada 100 personas/año después de seis meses de tratamiento.23 La resistencia a antirretrovirales es una causa importante de falla a tratamiento, la cual es causada por el desarrollo de mutaciones que se acumulan cuando la supresión viral es incompleta.
Factores de mal pronóstico
Los que incrementan la posibilidad de muerte en pacientes que inician tratamiento antirretroviral son: conteo bajo de linfocitos totales, edad avanzada, anemia, bajo peso corporal, bajo conteo de linfocitos CD4 previos al tratamiento, e infección avanzada.24
Tolerabilidad del tratamiento
Existe poca información con respecto a la tolerabilidad del tratamiento en países en desarrollo. En un estudio realizado en Kenia, la incidencia acumulada a los 12 meses fué de 78% en pacientes que iniciaron un tratamiento compuesto por stavudina, lamivudina y nevirapina. Las causas más comunes fueron la neuropatía periférica y las interacciones con el tratamiento antituberculoso.25
Uno de los efectos adversos más comunes en pacientes que inician el tratamiento antirretroviral es la hepatotoxicidad por nevirapina.
Tuberculosis e infección por VIH
La infección por VIH es el factor de riesgo más importante de tuberculosis, por lo que en las mismas regiones donde la infección por VIH es altamente prevalente, la segunda se ha incrementado. Por ejemplo, en Zimbawe el número de pacientes tratados por tuberculosis cada año se ha incrementado 10 veces desde el inicio de la epidemia de la infección por VIH.26 A nivel mundial es poco probable que este problema pueda controlarse en el corto plazo, considerando el incremento de casos con tuberculosis multidrogorresistente y con multidrogorresistencia extendida. De modo concomitante, la infección por VIH acelera la progresión de la TB y esta incrementa dramáticamente la mortalidad en pacientes con inmunodeficiencia avanzada. Si bien el tratamiento antirretroviral y antituberculoso administrados conjuntamente mejoran la sobrevida, puede complicarse por el Síndrome Inflamatorio de Reconstitución Inmunológica y la interacción/toxicidad farmacológica que pueden ocasionar interrupción del mismo.
Malaria e infección por VIH
La salud pública de algunas regiones de África se ha deteriorado aún más por la convergencia de estas dos epidemias. La infección por VIH incrementa el riesgo de desarrollar malaria, y esta a su vez incrementa la replicación del VIH.
Conclusión
La infección por VIH y el SIDA a 30 años de su aparición en la medicina, han tenido una diseminación mundial, pero los recursos diagnósticos y terapéuticos y las estrategias educativas y preventivas han modificado su impacto en la salud pública. El diagnóstico temprano y los nuevos medicamentos antiretrovirales han convertido la evolución inicialmente fatal en un padecimiento infeccioso crónico controlable.
Correspondencia: Dr. José Juan Terrazas Estrada.
Seris y Zaachila SN, Colonia La Raza, C.P. 02990, Delegación Azcapotzalco, México, D. F.
Teléfono: 57821088, ext: 23050.
Correo electrónico: juan.terrazas@imss.gob.