Introducción
La rinitis y el asma de origen alérgico figuran entre las causas más frecuentes de inflamación crónica del tracto respiratorio. En las últimas décadas, la prevalencia de ambas enfermedades se ha visto notablemente incrementada en varios paises.1,2 La rinitis se caracteriza por la presencia de estornudos (especialmente en salva), rinorrea, prurito y obstrucción nasal del flujo de aire, en tanto que el asma afecta a vías respiratorias bajas y ocasiona episodios de sibilancias, dificultad respiratoria y tos, generalmente en la noche o temprano por la mañana.1,2 En estas patologías alérgicas, existe una respuesta inmune aberrante, con incremento de la inmunoglobulina E (IgE) frente a agentes ambientales comunes (alergenos), como ácaros del polvo doméstico, hongos, pólenes y proteínas de animales; fenómeno que se conoce como sensibilización atópica. Posteriormente, el contacto del aero-alergeno con IgE específica provoca en los individuos sensibilizados la liberación de histamina y otros mediadores secretados por células cebadas y basófilos, que conducen a la aparición inmediata de los síntomas respiratorios. En la fase tardía, diversas células y citocinas del sistema inmune, son efectores de la inflamación crónica y participan en la producción de cambios histológicos y funcionales que caracterizan a estas enfermedades: la hiperreactividad y el remodelamiento de las vías aéreas.3,4 El predominio en la respuesta inmune de linfocitos T (LT) efectores CD4+ con fenotipo T helper 2 (Th2) es un factor fundamental en el desarrollo de atopia, ya que secretan citocinas como interleucinas (IL) 4, 5, 9 y 13 que inducen la síntesis de IgE y el infiltrado celular en el sitio inflamatorio.2-4 Actualmente, existe gran interés en conocer la función que cumplen en las manifestaciones alérgicas diferentes poblaciones de células con capacidad regulatoria, como la de un subgrupo de LT que expresa la cadena α del receptor de IL-2 (CD25).5,6 Aunque inicialmente la población T CD4+CD25+ fue relacionada al mantenimiento de la autotolerancia,7 el rol fisiológico que desempeña en la respuesta alérgica en humanos se ha demostrado en el síndrome de desregulación autoinmune, poliendocrinopatía y enteropatía ligado al cromosoma X (IPEX), en el que existe un marcado fenotipo alérgico.8 En este síndrome, hay alteraciones de células T CD4+CD25+ debido a mutaciones en el gen FOXP3 (forkhead box p3), regulador del desarrollo y función de este linaje celular.8-10 Los LTCD25+ supresores constituyen en humanos 5% a 10% de los linfocitos CD4+ de sangre periférica y se denominan células T reguladoras naturales (nTreg).7,9,10 Se ha comprobado que un porcentaje importante de LT CD4+ circulantes que carecen de actividad reguladora, en su mayoría células activadas, expresan el marcador CD25. Se ha identificado dentro de los LT CD4+CD25+ una pequeña subpoblación (1% a 2%) fuertemente supresora que muestra una alta expresión de CD25 (CD25high) que la diferencia de células activadas CD25+.11 Es indiscutible que el fenotipo supresor de células TCD4+CD25+ depende de la expresión de FOXP3, tanto que la deleción génica de este factor lleva a la pérdida de la capacidad regulatoria de las células, mientras que su expresión ectópica en linfocitos CD25-FOXP3- les confiere dicha capacidad.9,10,12 Aunque es un marcador altamente específico de la población Treg, FOXP3 presenta la desventaja de requerir fijación y permeabilización de las células para su identificación.9,10 Recientes estudios en humanos muestran que la expresión de la cadena α del receptor de IL-7, CD127, permite discriminar entre células Treg y T efectoras activadas circulantes, ya que estas últimas mantienen una elevada expresión del marcador luego de su activación, lo que no ocurre en LT CD4+ con capacidad regulatoria (CD127low). Se ha demostrado que la mayoría de las células CD4+CD25+CD127low son FOXP3+, incluyendo aquellas con una expresión baja de CD25 y que, además, poseen una fuerte actividad supresora in vitro.13,14 Por lo tanto, CD127 podría resultar un marcador superficial de utilidad, que en conjunto con CD25, permita aislar linfocitos Treg en sangre periférica con alto grado de pureza.
En el tratamiento de la rinitis y asma alérgicas, la inmunoterapia específica con alergenos (ITEA) es el único método que modifica la hipersensibilidad.15 Se han documentado algunos cambios en parámetros inmunológicos asociados a la ITEA, como disminución de IgE alergeno-específica e incremento de IgG4 específica y reducción del infiltrado de células inflamatorias en la mucosa respiratoria. Estas modificaciones se atribuyen a la inducción de células Treg en respuesta a la terapia.15-18
Experimentos en animales han mostrado la participación de células Treg en el desarrollo y la severidad del asma.19,20 En humanos, estudios sobre la relación entre el número o función de células Treg CD4+CD25+ y la condición alérgica aportan diferentes resultados.21-26 Son escasos los datos acerca de esta población regulatoria en pacientes sometidos a ITEA.18
Objetivo
Determinar la asociación entre número de células Treg en sangre periférica, identificadas como CD4+CD25+CD127low, y la manifestación de rinitis; la correlación de estas células con la IgE sérica, porcentajes eosinófilos en sangre periférica y en secreción nasal y niveles de Proteína C Reactiva ultrasensible (hs-PCR), considerada esta última marcador de inflamación crónica.27
Investigar si el porcentaje de células T CD4+CD25+CD127low se modifica luego de un año del tratamiento con ITEA.
Métodos
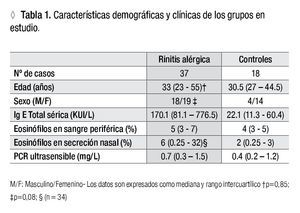
Pacientes: Se estudiaron 37 pacientes con rinitis alérgica diagnosticados según los criterios vigentes,1 quienes mostraron sensibilización a ácaros o pólenes, o ambos, mediante pruebas cutáneas por punción (prick tests). Los pacientes fueron admitidos por el Servicio-Cátedra de Alergia e Inmunología del Hospital Nacional de Clínicas, Universidad Nacional de Córdoba, Argentina entre mayo de 2009 y marzo de 2011. Se excluyó del estudio a los pacientes que presentaran alguna de las siguientes características: polisensibilizados (ácaros, pólenes, hongos y epitelio de gato y/o perro); que hubieran iniciado ITEA previo a este estudio; embarazadas; otras afecciones o co-morbilidades (afecciones pulmonares o de vías aéreas superiores de evolución crónica, afecciones autoinmunes, infecciones crónicas). En el grupo control participaron 18 individuos adultos voluntarios, sin antecedentes familiares ni personales alérgicos, pareados por edad y sexo. Todos los participantes del estudio dieron su consentimiento informado por escrito. El protocolo fue aprobado por el Comité de Ética del Hospital Nacional de Clínicas, Universidad Nacional de Córdoba.
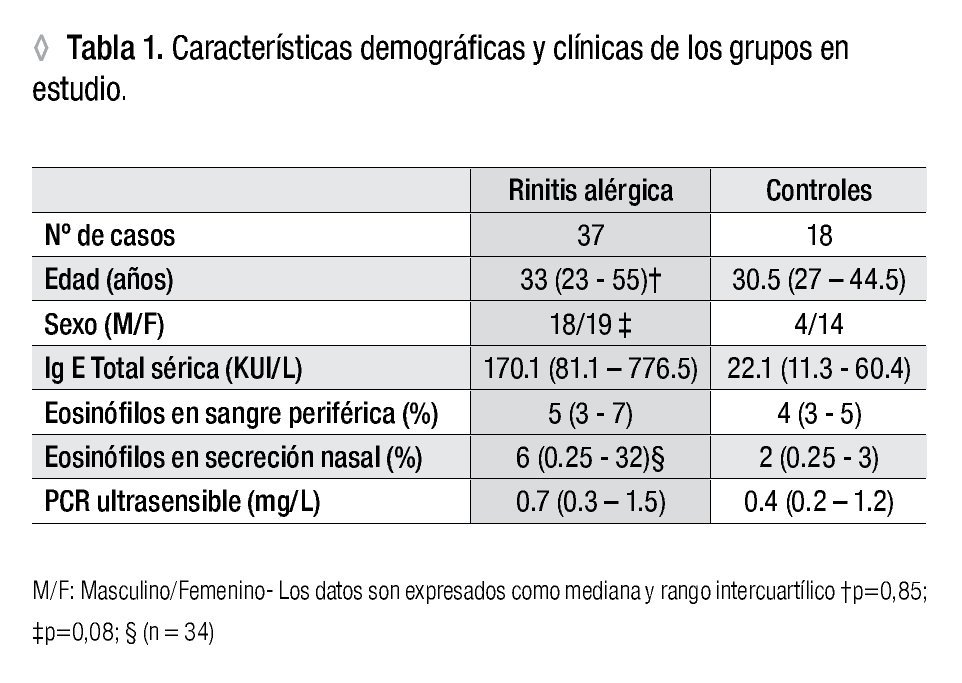
Muestras: Para la identificación de las subpoblaciones linfocitarias, la IgE sérica total, los eosinófilos periféricos y la proteína C reactiva, la muestra sanguínea se obtuvo por punción venosa convencional y la muestra de secreción nasal mediante un hisopo en ambas fosas nasales. Durante la toma de las muestras, los pacientes sólo tomaban antihistamínicos. A 10 pacientes apegados a la ITEA por un período cercano a un año (12.5 ± 3.47 meses) se les extrajo nueva muestra de sangre y secreción nasal. Los datos demográficos y clínicos de pacientes y controles se muestran en la Tabla 1.
Pruebas cutáneas por punción: Se practicaron a los 37 pacientes con extractos de 20 alergenos glicerinados: ácaros (Dermatophagoides pteronys-sinus, Dermatophagoides farinae y Blomia tropicalis), polvo de casa, cucaracha (Periplaneta americana), epitelio de gato (Felis domesticus), y perro (Canis familiaris), pólenes y hongos (Allergo-Pharma). Se usó histamina como control positivo y vehículo como control negativo. La lectura de pápula y eritema se realizó a los 15 minutos de la colocación del alergeno. Un diámetro de la pápula mayor a 3 mm fue considerado resultado positivo.28
Inmunoterapia específica con aeroalergenos: Se realizó por inyección subcutánea de dosis crecientes del alergeno relevante (aquel que presentó mayor tamaño de la pápula en las pruebas cutáneas), formulado en base acuosa (Alergo-Pharma). La administración se realizó bajo la pauta convencional, comenzando desde 10 PNU (unidades de nitrógeno proteico) hasta alcanzar la dosis máxima tolerada por el paciente.29
Cuantificación de IgE sérica total. Se cuantificó inmunoglobulina E en sueros de pacientes y controles mediante ELISA (RADIM, Italia). El procedimiento se realizó según las instrucciones del fabricante. Los resultados se reportaron en KUI/L.
Determinación de PCR ultrasensible: La valoración de PCR sérica se realizó por método inmunoturbidimétrico de alta sensibilidad potenciado con látex (hs-PCR), (Bayer Health Care) empleando un autoanalizador SIEMMENS (USA).
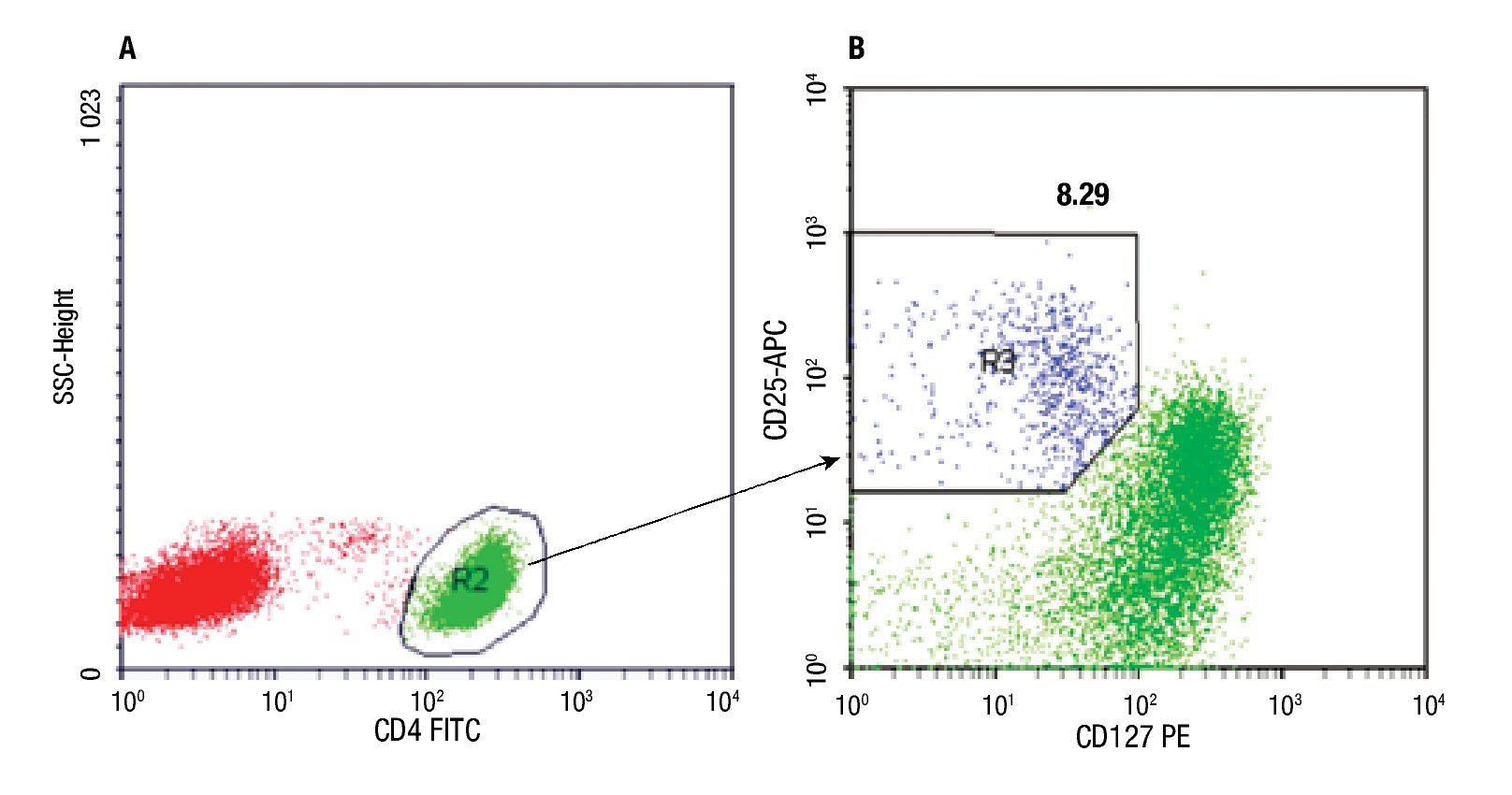
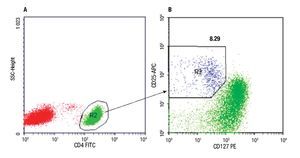
Determinación de linfocitos T CD4+CD25+CD127low. El número de linfocitos T CD4+CD25+CD127low fue determinado por citometría de flujo, en muestra de sangre entera anticoagulada con EDTA, mediante inmunomarcación de las células con anticuerpos monoclonales unidos a flurocromos: anti CD4-FITC (clon OKT4), anti CD25-APC (clon BC96) y anti CD127-PE (clon eBioRDR5), (eBioscience, U.S.A). El procedimiento de inmunomarcación consistió en: incubación de 70 μL de la muestra de sangre con 5 μL de cada anticuerpo durante 30 minutos a temperatura ambiente en oscuridad, lisado de los glóbulos rojos por agregado de solución de 2 mL de NH4Cl e incubación durante 15 min en oscuridad, lavado y nueva suspensión de las células en PBS. Una vez finalizada la técnica de marcación, se procedió de inmediato a la adquisición de los datos en citómetro FCSCalibur de cuatro colores (Becton-Dickinson, U.S.A.). En todas las muestras se contó un mínimo de 50 000 eventos. Para el análisis de los datos se empleó el programa CellQuestPro (Becton-Dickinson, USA) y el procedimiento descrito en la Figura 1.
◊ Figura 1. Los gráficos corresponden a un experimento. A- Los linfocitos CD4+ (R2) fueron seleccionados en la región de linfocitos totales (R1) identificados por sus parámetros físicos FS vs. SS (tamaño vs granularidad) (gráfico no mostrado). B- La población CD25+CD127low (R3) fue identificada y cuantificada en la región de linfocitos CD4+ (R2). El porcentaje de células TCD4+CD25+CD127low obtenido se indica sobre R3.
Eosinófilos en sangre periférica y secreción nasal: Se determinó el porcentaje de eosinófilos en sangre periférica y en secreción nasal por recuento diferencial en 100 elementos de la serie blanca en frotis teñidos con May-Grunwald-Giemsa empleando microscopio óptico (Leitz-Wetzlar, Alemania). Se realizaron dos frotis por cada paciente, tanto de sangre como de secreción nasal, y se informó el promedio de los porcentajes hallados en ambos extendidos.
Análisis estadístico: Los datos numéricos de los grupos en estudio se expresaron como mediana y rango intercuartílico, excepto para los porcentajes de células T CD4+CD25+CD127low que se expresaron como media y desviación estándar. Se usó la prueba de Mann-Whitney para la comparación entre dos grupos independientes, y para las muestras pareadas la prueba de Wilcoxon o la prueba t-pareada según correspondió. La prueba exacta de Fisher se aplicó para comparar la distribución de sexos en los grupos. Para el análisis de correlación se aplicó el coeficiente r de Spearman.
Un valor de p <0.05 se consideró estadísticamente significativo. El análisis estadístico fue realizado empleando el software GraphPad Instat3 (USA).
Resultados
Comparación de parámetros inmunológicos entre pacientes y controles: Los niveles de IgE sérica total y los porcentajes de eosinófilos en sangre y en secreción nasal fueron significativamente mayores en los pacientes que en los controles (p <0.0001, p = 0.04 y p = 0.01, respectivamente); en cambio, no hubo diferencia significativa en las concentraciones de hs-PCR entre ambos grupos (p = 0.25).
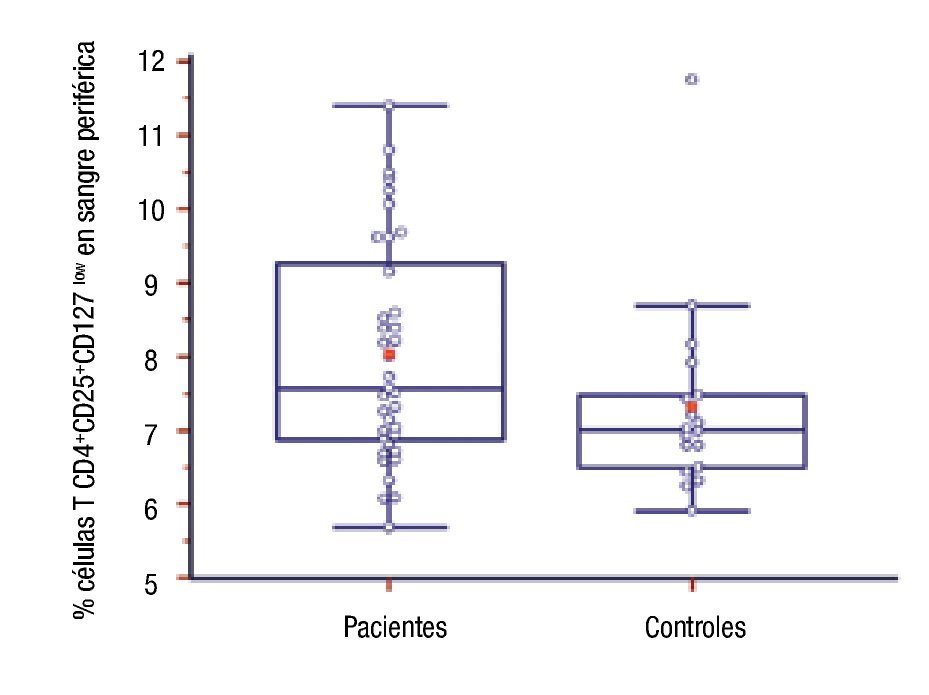
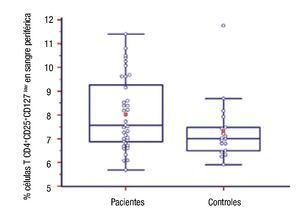
Número de células T CD4+CD25+CD127low en pacientes: Se compararon los porcentajes de células regulatorias T CD4+CD25+CD127low en sangre periférica de pacientes y controles. La diferencia entre ambos grupos fue estadísticamente significativa, fue mayor el número de esas células en el grupo de pacientes (8.03 ± 1.51 vs. 7.32 ± 1.31, p = 0.03) (Figura 2).
◊ Figura 2. Porcentaje de células T CD4+CD25+CD127low de pacientes y controles. La línea media transversal del box marca la mediana.
Correlación de los distintos parámetros inmunológicos con el número de células T CD4+CD25+CD127low en pacientes y controles: Se analizó la correlación entre el porcentaje de células T CD4+CD25+CD127low y concentración de IgE sérica, porcentajes de eosinófilos en sangre y secreción nasal y concentración sérica de hs-PCR de los pacientes. En ningún caso observamos correlación (respectivamente: r = 0.32, p = 0.06; r = 0.18, p = 0.29; r = -0.01, p = 0,95; r = -0.15, p = 0.38). La correlación de células TCD4+CD25+CD127low con esas mismas variables fue investigada, además, en el grupo control obteniéndose valores no significativos (IgE: r = 0.07, p = 0.79; eosinófilos en sangre: r = 0.38, p = 0,12; eosinófilos en moco nasal: r = 0.33, p = 0.18; hs-PCR: r = 0.12, p = 0.63).
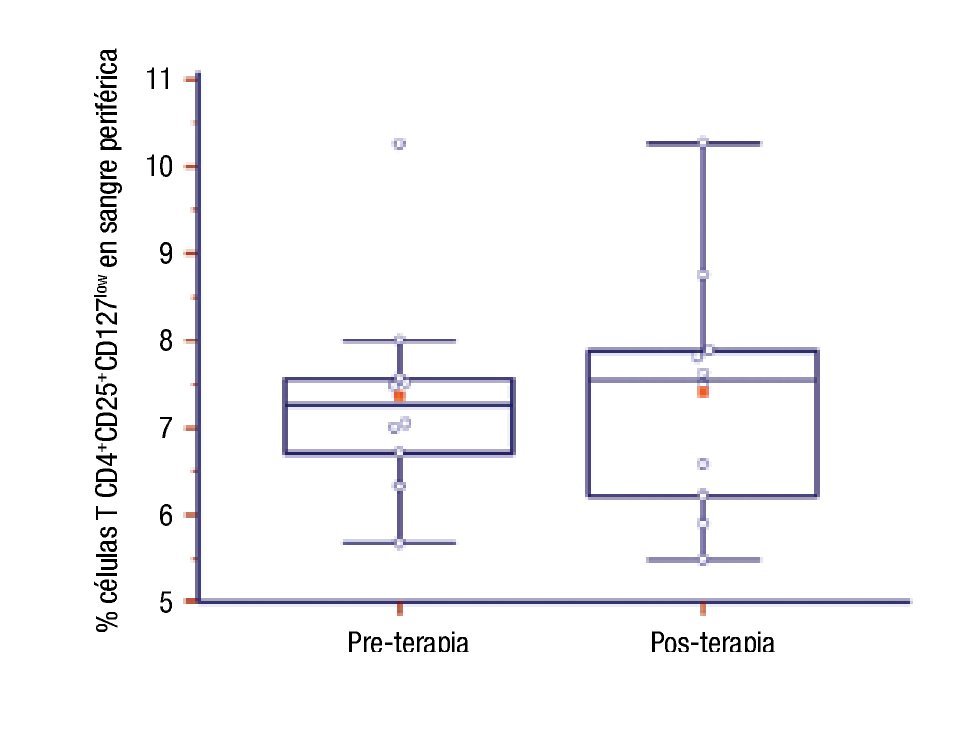
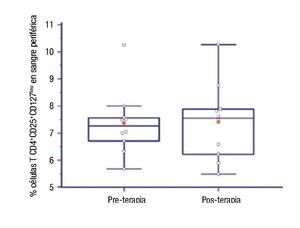
Número de células TCD4+CD25+CD127low en pacientes con inmunoterapia: Se compararon los porcentajes de células TCD4+CD25+CD127low basales y aproximadamente un año después de ITEA en diez pacientes. No encontramos diferencia estadísticamente significativa (pre: 7.36 ± 1.22 vs. post: 7.39 ± 1.43; p = 0.94) (Figura 3).
◊ Figura 3. Porcentaje de células T CD4+CD25+CD127low de pacientes al inicio (pre) y al año de la inmunoterapia (posterior).
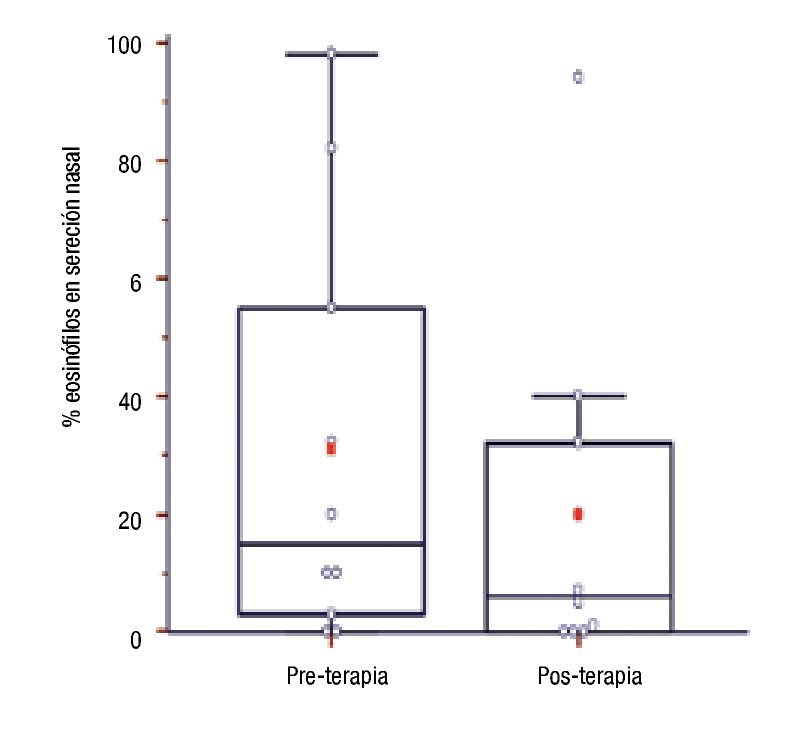
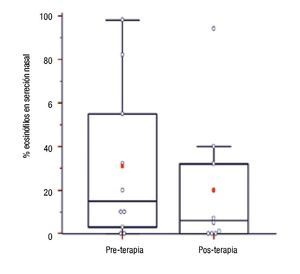
Concentración de IgE sérica total, eosinófilos periféricos y en secreción nasal y PCR ultrasensible en pacientes con inmunoterapia: Se compararon los niveles de IgE sérica, porcentajes de eosinófilos en sangre periférica y en secreción nasal, y hs-PCR sérica luego de 12.5 ± 3.47 meses de tratamiento con los valores basales en 10 pacientes. No hubo diferencia estadísticamente significativa para valores de IgE sérica (pre: 114.35 [75.23 - 338.98] vs. post: 136.1 [62.25 - 212.35]; p = 0.28), porcentajes de eosinófilos sanguíneos (pre: 7[3.5 - 7] vs. post: 4.5 [2 - 5]; p = 0.13) y concentraciones séricas de hs-PCR (pre: 0.5 [0.33 - 2.20] vs. post: 0.2 [0.1 - 1.3]; p = 0.49). En cambio, los porcentajes de eosinófilos en secreción nasal fueron significativamente menores en muestras pos tratamiento ITEA (pre: 15 [4.75 - 49.25] vs. post: 6 [0.25 - 29]; p = 0.02) (Figura 4).
◊ Figura 4. Porcentaje de eosinófilos en secreción nasal de pacientes al inicio (previo) y al año de la inmunoterapia (posterior).
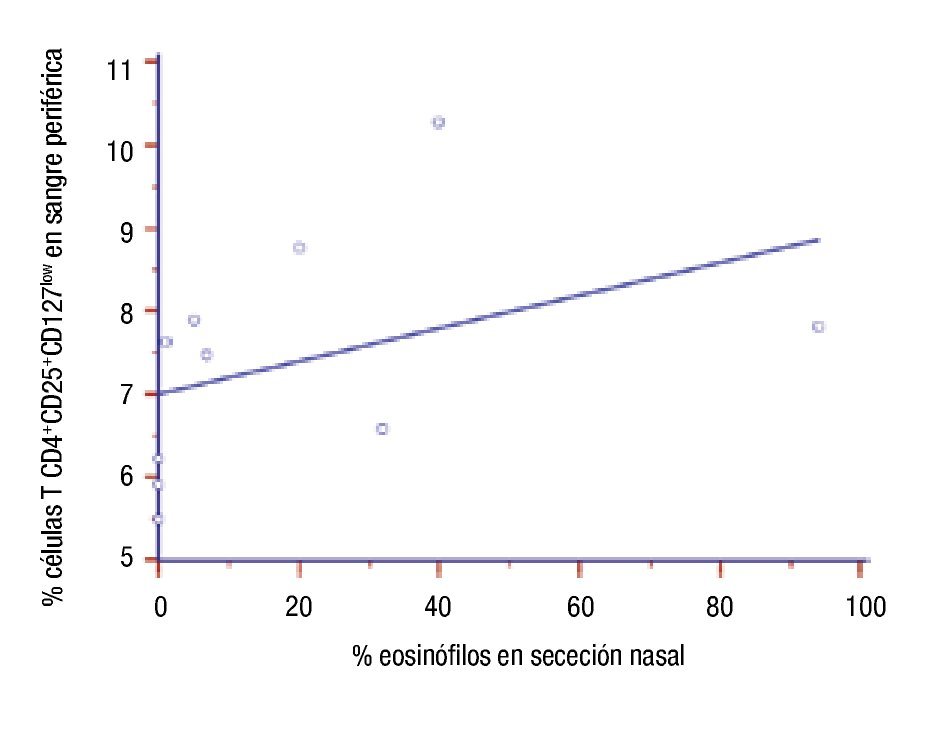
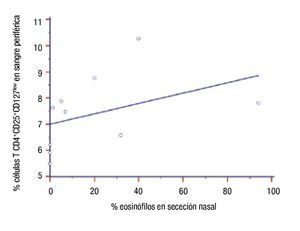
Correlación de parámetros inmunológicos con el número de células TCD4+CD25+CD127low en pacientes con inmunoterapia: Se determinó la correlación entre número de células TCD4+CD25+CD127low con valores de IgE sérica, porcentajes de eosinófilos en sangre y en secreción nasal y niveles séricos de hs-PCR posterior al año de tratamiento con ITEA. No hubo correlación del número de esas células con valores de IgE (r = -0.006, p >0.9), con el porcentaje de eosinófilos sanguíneos (r = 0.449, p = 0.19), y con niveles hs-PCR en suero (r = 0.12, p = 0.73). En cambio encontramos correlación de las células TCD4+CD25+CD127low con eosinófilos en secreción nasal (r = 0.718, p = 0.02) (Figura 5). Además, la correlación fue analizada entre esas variables y el porcentaje de células TCD4+CD25+CD127low en los 10 pacientes antes del inicio de la inmunoterapia. No hubo correlación entre el nivel de esas células y: concentraciones de IgE en suero (r = 0.29, p = 0.43), porcentaje de eosinófilos en sangre (r = 0.32, p = 0.37), porcentaje de eosinófilos en secreción nasal (0.26, p = 0.47), y niveles séricos de hs-PCR (r = 0.37, p = 0.30).
◊ Figura 5. Correlación del porcentaje de células T CD4+CD25+CD127low con el porcentaje de eosinófilos en los pacientes al año de inmunoterapia.
Discusión
Algunos estudios han sido diseñados para investigar si los defectos en el número o en la función de las células Treg (CD4+CD25+) en humanos están relacionados al desarrollo y la severidad de enfermedades atópicas. Sin embargo, los resultados de estudios en pacientes asmáticos o con rinitis alérgica, son discordantes.
En este estudio encontramos un porcentaje de células TCD4+CD25+CD127low en sangre periférica de pacientes adultos con rinitis alérgica sin tratamiento, levemente superior al de la población control. En concordancia con nuestro hallazgo, se ha descrito un aumento del número de células Treg (CD4+CD25+) en sangre de pacientes con asma comparado con controles no atópicos.21 Algunos autores, en cambio, han reportado un número equivalente de células Treg en sangre periférica de pacientes atópicos y de controles sanos.22,23 Inclusive, en un trabajo reciente, en el que se identificó la población regulatoria a través de la expresión de mismos marcadores utilizados en este estudio (CD4+CD25++CD127low) en sangre periférica de pacientes con rinoconjuntivitis alérgica y en individuos sanos, la cantidad de las células halladas entre ambos grupos no presentó diferencia significativa.24 En cambio, otras investigaciones han reportado cantidades disminuidas de células Treg en sangre periférica en individuos alérgicos.25,26 En niños con asma y rinitis alérgica se demostró un porcentaje menor de células CD4+CD25+ y CD4+CD25high que en niños sanos.25 Una debilidad de nuestro estudio es no haber evaluado la intensidad y frecuencia de los síntomas y su asociación con el número de células T CD4+CD25+CD127low.
Un factor que podría contribuir a la diferencia de resultados obtenidos en las distintas investigaciones sobre el número de células Treg en pacientes con enfermedades alérgicas, es la selección de marcadores de superficie con los que esas células son identificadas. En nuestro trabajo se reconoció la población T regulatoria según el grado de expresión en la superficie celular de tres marcadores (CD4, CD25 y CD127); sin embargo, la mayoría de los estudios que reporta la bibliografía, lo hacen sólo a través de CD4 y CD25.21-23,25,26
Con respecto a la eficacia de la inmunoterapia y el posible rol que tendrían las células Treg en ella podemos decir que, aunque los pacientes de nuestra investigación refirieron mejoría en sus síntomas cuando fueron evaluados al año de inmunoterapia, los parámetros inmunológicos analizados permanecieron sin cambios significativos con respecto a los valores hallados al inicio de la terapia, excepto el porcentaje de eosinófilos en mucosa nasal que presentó una disminución significativa al año de ITEA. Estos hallazgos concuerdan con algunos informes que señalan disminución de la IgE sérica total y específica después del primer año de inmunoterapia.16,17 Debido a que el número de células T CD4+CD25+CD127low se mantuvo estable luego de un año de ITEA, mientras que los síntomas y los eosinófilos en secreción nasal mostraron una disminución, se podría pensar que los mecanismos de acción de la ITEA no se relacionan con un aumento de la población Treg.
Conclusiones
En base a los resultados obtenidos en este estudio se podría inferir que el incremento de las células Treg en sangre periférica es una respuesta fisiológica que trata de limitar la inflamación crónica de las vías aéreas en las patologías estudiadas, y que los efectos moderadores de la respuesta alérgica causados por la inmunoterapia no se deben a la inducción de células Treg, al menos tras un periodo corto de inmunoterapia.
Agradecimientos
Los autores agradecen a los Dres. Virginia Rivero (Centro de Investigación en Bioquímica Clínica -CIBICI-CONICET- Departamento de Bioquímica Clínica, Facultad de Ciencias Químicas, Universidad Nacional de Córdoba) y Juan Carlos Copioli (Profesor Titular Cátedra de Clínica Médica I, Facultad de Ciencias Médicas, Universidad Nacional de Córdoba, Argentina) por el asesoramiento científico y técnico brindado en la realización de este estudio.
Correspondencia: Cristina del Valle Acosta.
José Guardado 748 (CP 5016) Bº Villa San Isidro. Ciudad de Córdoba, Provincia de Córdoba - Argentina.
Correo electrónico: cristinacosta68@hotmail.com.