Describimos el caso de una paciente con mutación genética pero sin criterios diagnósticos para el síndrome de Brugada que fue programado para colonoscopia con sedación. El manejo anestésico del síndrome de Brugada debe ser muy cuidadoso y dado el riesgo y las circunstancias se consideró tratar a la paciente como si lo tuviera, realizando el procedimiento bajo anestesia general. Exponemos las consideraciones y manejo anestésico que se realizó.
We describe the case of a patient with a genetic mutation but no diagnostic criteria for Brugada syndrome, who was scheduled for a colonoscopy with sedation. Anesthetic management of Brugada syndrome must be very careful so because of the risk and the circumstances of this patient, she was treated as if she has the syndrome and programmed under general anesthesia. We describe the anesthetic management and considerations.
El síndrome de Brugada (SB) fue descrito en 1992 como un cuadro de muerte súbita en pacientes con patrón electrocardiográfico de bloqueo de rama derecha y supradesnivel ST persistente en precordiales derechas, sin anormalidades cardiacas estructurales1. Se relaciona con una mutación del gen SCN5A (locus 3p21), que codifica para el canal de sodio cardiaco y se transmite de forma autosómica dominante2.
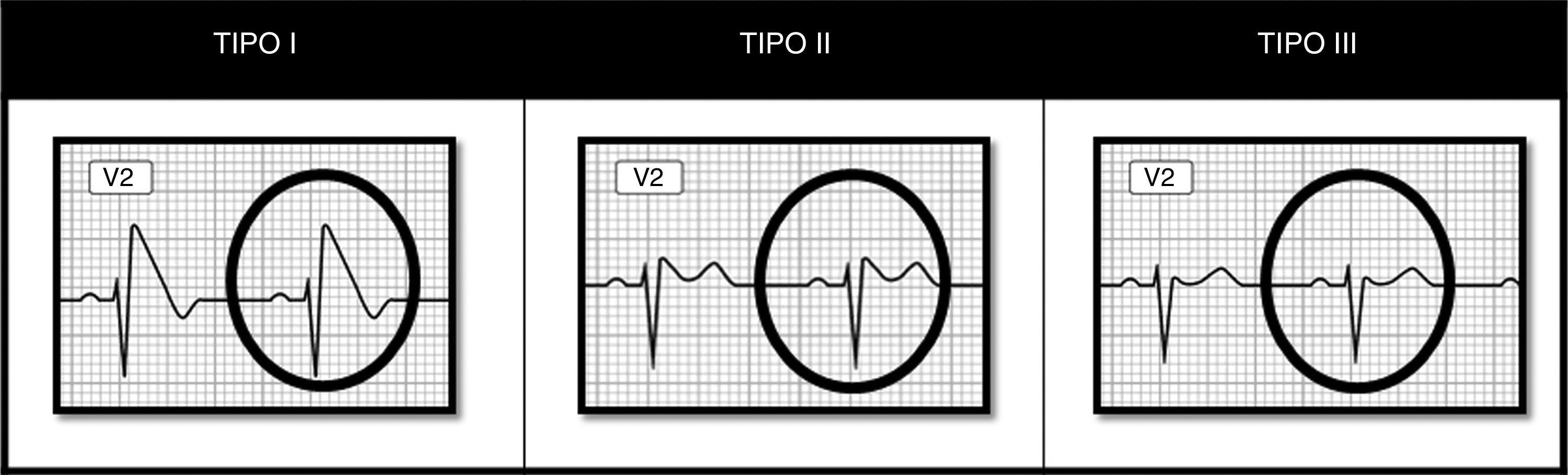
Se reconocen 3 patrones (fig. 1):
Tipo I. Es diagnóstico del síndrome per se. Se caracteriza por elevación descendente del ST mayor de 2mm, con onda T negativa.
Tipo II. La elevación del ST, mayor de 2mm, tiene forma peculiar denominada en «silla de montar» o «lomo de sable». La onda T es positiva o bifásica.
Tipo III. La elevación del ST es menor de 2mm y presenta cualquiera de las 2 configuraciones anteriores. La onda T es positiva.
Aunque los 3 patrones pueden observarse en el mismo paciente en diferentes momentos, solo el tipo I se considera diagnóstico, pero debe asociarse con al menos uno de los siguientes criterios clínicos: fibrilación ventricular documentada, taquicardia ventricular polimórfica documentada, inducibilidad de arritmias ventriculares durante el estudio electrofisiológico, síncope o respiración agónica nocturna, historia familiar de muerte súbita en edad previa a los 45 años o patrón ECG tipo I en otros miembros de la familia3.
Los pacientes con SB son en su mayoría asintomáticos, pero entre el 17-42% de ellos presentan síncope o muerte súbita como consecuencia de una arritmia ventricular en algún momento de su vida. Las arritmias aparecen característicamente en situaciones de predominio vagal, como el reposo o incluso el descanso nocturno. Presenta una mayor expresividad con un fenotipo 8-10 veces más frecuente en varones que en mujeres2. Ciertos fármacos (tabla 1) o un estado febril pueden también desencadenar el patrón I e inducir arritmias.
Fármacos a evitar y fármacos desaconsejados en pacientes con síndrome de Brugada
| Grupo farmacológico | Fármacos a evitar | Fármacos desaconsejados |
|---|---|---|
| Antiarrítmicos | Ajmalina | Amiodarona |
| Flecainida | Cibenzolina | |
| Pilsicainida | Disopiramida | |
| Procainamida | Lidocaína | |
| Propafenona | Propranolol | |
| Verapamilo | ||
| Psicotrópicos | Amitriptilina | Carbamazepina |
| Clomipramina | Ciamemazina | |
| Desimipramina | Doxepina | |
| Litio | Fluoxetina | |
| Loxapina | Imipramina | |
| Nortriptilina | Maprotilina | |
| Trifluoperazina | Perfenazina | |
| Fenitoína | ||
| Tioridazina | ||
| Antianginosos | Diltiazem | |
| Nicorandil | ||
| Nifedipino | ||
| Nitroglicerina | ||
| Anestésicos | Bupivacaína | |
| Propofol | ||
| Otros | Acetilcolina | Difenhidramina |
| Edrofonio | ||
| Cocaína | Indapamida | |
| Ergonovina |
Dado que el patrón ECG de los pacientes con SB es variable e incluso puede ser transitoriamente normal, el uso de pruebas farmacológicas de provocación con bloqueadores del canal de sodio se ha hecho rutinario. La ajmalina es el más eficaz, pero por cuestión de disponibilidad se suele realizar con flecainida, a pesar de que presenta sensibilidad, especificidad y valor predictivo negativo menores.
Se considera que se trata de SB si, tras la prueba de provocación aparece o se acentúa el patrón ECG tipo I.
La quinidina a altas dosis reduce la ocurrencia de eventos y la recurrencia de estos. En caso de cirugías programadas sería recomendable comenzar su administración hasta lograr la impregnación, para conseguir una mayor estabilidad.
Los fármacos antiarrítmicos como amiodarona y betabloqueantes no son efectivos. El tratamiento de elección definitivo en pacientes sintomáticos es implantar un desfibrilador automático implantable (DAI).
Caso clínicoMujer de 76 años, 70kg, programada para colonoscopia ambulatoria bajo cuidados anestésicos por sintomatología digestiva inespecífica. Es portadora de mutación del gen A, pero nunca se le realizó el test de flecainida. Una hija presentaba SB tipo I asintomático y un hijo asintomático, con ECG anormal, pero el test de flecainida no resultó concluyente. Se encontraba en tratamiento con latanoprost tópico por glaucoma crónico simple y lorazepam. Analítica normal, salvo leve incremento de TSH con FT4 normal y discreta hiperferritinemia.
Presenta un ECG basal con ritmo sinusal a 56lpm, QRS estrecho con eje normal, PR 210mseg, QTc y repolarización normales.
El anestesiólogo responsable unos días previos a la fecha programada, realizó una interconsulta con cardiología. El cardiólogo, tras valorar el caso, consideró que no existía inconveniente para realizar el procedimiento y recomendó la monitorización del ritmo cardiaco, así como evitar el uso de fármacos que se conocen asociados a incremento de los trastornos de repolarización en este síndrome.
El anestesiólogo, con los datos disponibles, decidió que la colonoscopia se realice en quirófano. Plantea anestesia general con intubación orotraqueal y vigilancia en URPA previamente al alta domiciliaria.
Se colocaron electrodos en el tórax, conectados a un desfibrilador. Se monitorizó PANI, SpO2, EtCO2, temperatura, TOF, BIS y ECG, incluyendo V2. Se colocó manta térmica (de aire caliente) bajo sábana para mantener la normotermia. Se preoxigenó y se administró atropina 0,8mg, midazolam 1mg y fentanilo 150μg. La inducción se realizó con sevoflurano y rocuronio 45mg. La intubación orotraqueal se efectuó sin dificultad con tubo flexometálico 7.
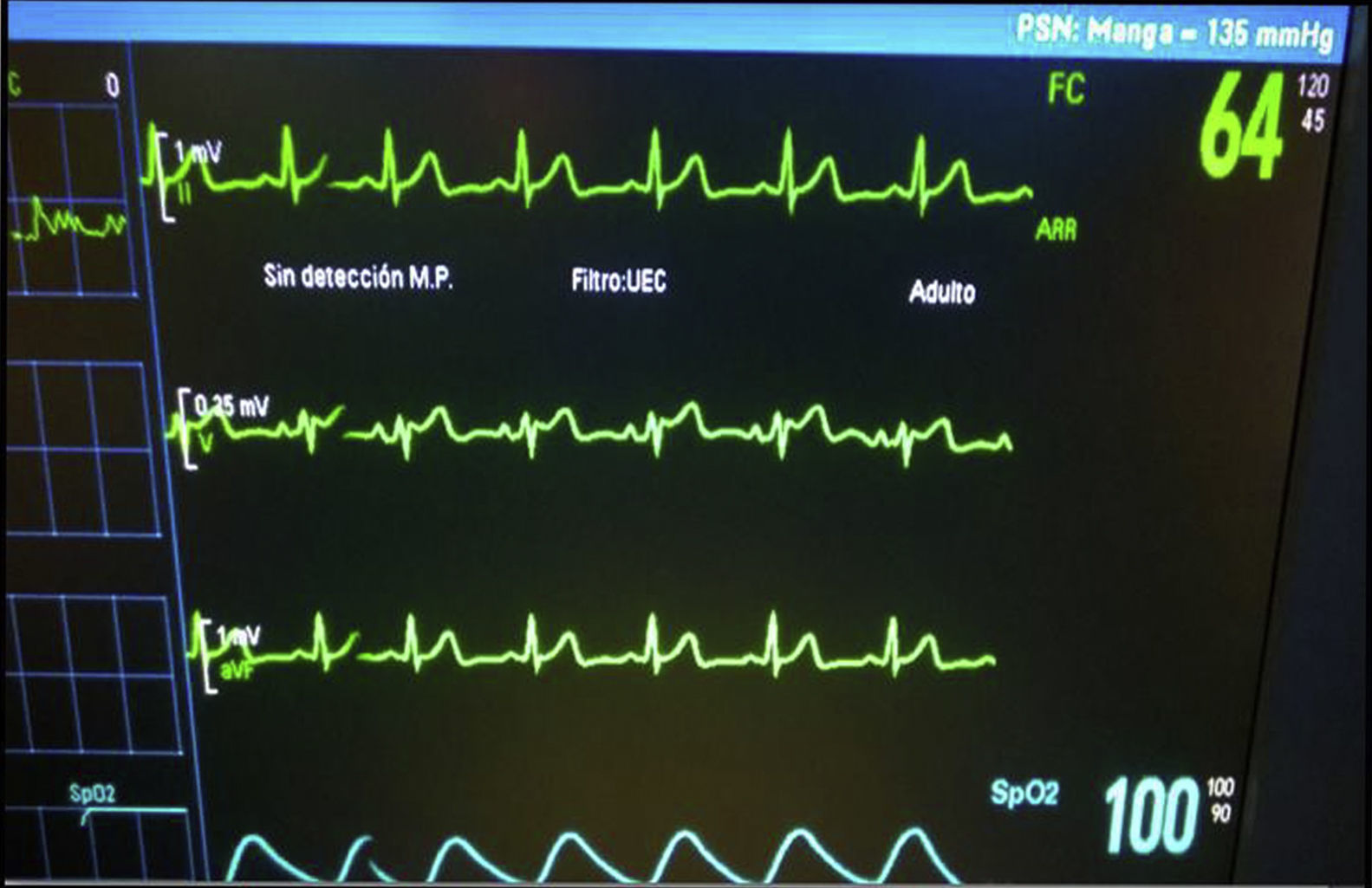
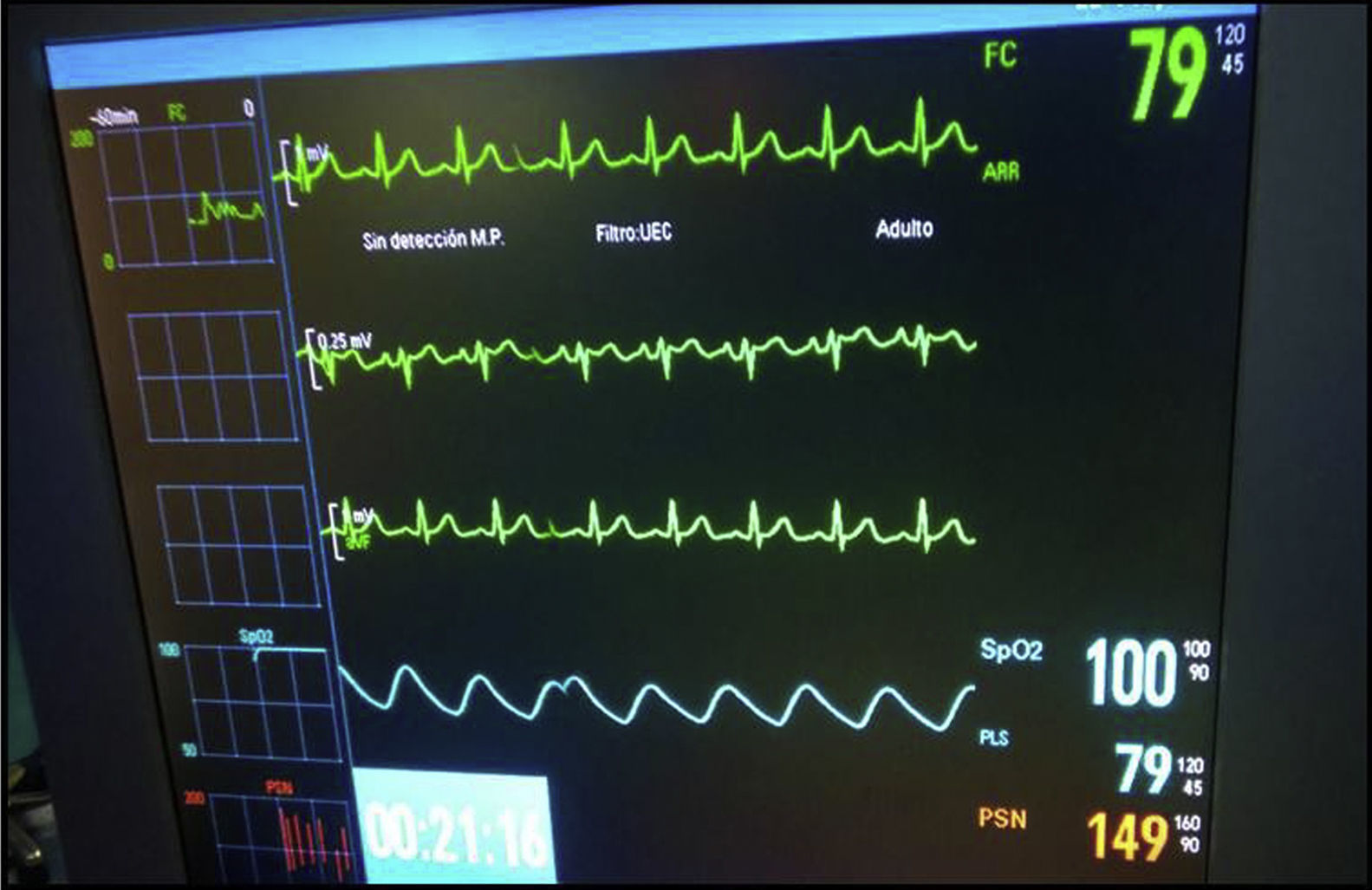
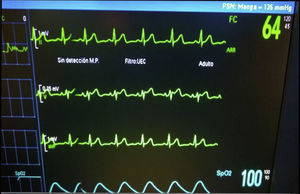
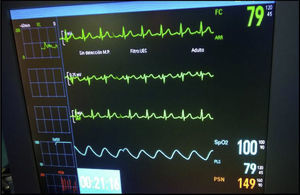
Se inició colonoscopia en decúbito lateral izquierdo. Mantiene FC superior a 65lpm, con algunos momentos de elevación de ST en V2, con patrón ECG tipo II en «silla de montar» o «lomo de sable», en los momentos de menor FC (fig. 2). Se requirió una nueva dosis de atropina 0,7mg, subiendo la FC a 80lpm, recuperando el ECG basal (fig. 3).
El colonoscopio sufrió una rotura en colon ascendente. Además, la técnica resulta dificultosa por las angulaciones y curvas del colon. Por todo ello, el procedimiento se prolongó, hasta llegar a 1h y 11min. Se extirpó un pólipo con pinza y otro, en sigma, con asa/cauterio sin cambios en el monitor.
Previamente a la extubación se administran dexametasona 4mg como profilaxis de NVPO y dexketoprofeno 50mg. La extubación tras sugammadex 150mg se realiza sin incidencias. Pasa a URPA, después a UCA y finalmente alta a domicilio.
DiscusiónEn el caso que nos ocupa, la paciente presentó la mutación genética del SB, una hija diagnosticada y un hijo con test de flecainida no concluyente. En el ECG basal presentó bloqueo AV de primer grado, siendo cardiológicamente asintomática y cardiología nunca consideró oportuno realizar test de flecainida.
Sin embargo, se sabe que el patrón ECG de los pacientes con SB es variable e incluso puede ser transitoriamente normal. Por tanto, con la mutación genética presente, no es descartable que presentara SB, aunque no se haya realizado su diagnóstico. Como ya se ha comentado, la expresividad del gen en mujeres es menor que en varones y nunca ha relatado síntomas que en la mayoría de pacientes sintomáticos suelen aparecer antes de los 50 años.
Teniendo en cuenta todas estas consideraciones junto con la recomendación del cardiólogo consultado de evitar los fármacos listados en la página web www.brugadadrugs.org4, que incluye al propofol, se pensó como altamente recomendable un manejo de la situación distinto al habitual.
Durante el procedimiento se comprobó cómo a pesar de una correcta hipnosis y analgesia, durante los estímulos vagotónicos (insuflación de aire) se reproducía un patrón tipo II en el registro ECG, que tras atropina se normalizaba.
A pesar de que la paciente no estaba diagnosticada de SB siguiendo los criterios vigentes, con la mutación genética presente y la observación de un patrón tipo II, no se descarta que si se realizara estudio electrofisiológico o test de flecainida pudiera diagnosticársele. De cualquier modo, estas pruebas diagnósticas no se consideraron indicadas, ante la falta de síntomas y edad de la paciente, ya que no hubieran modificado su tratamiento definitivo.
Recientemente se ha publicado un caso en el que se diagnosticó SB tras administración subaracnoidea de prilocaína5. Si ya pensábamos que la actuación llevada a cabo bajo anestesia general en quirófano, monitorización y vigilancia perioperatoria, por cuestiones de seguridad de la paciente, fue adecuada, después de revisar dicho caso, nuestra creencia se ha visto reforzada. Esto es así porque el SB se asocia a fibrilación ventricular/muerte súbita que puede desencadenarse por diversos factores: estimulación adrenérgica (respuesta al estrés quirúrgico), incremento del tono vagal, alteraciones hidroelectrolíticas y algunos fármacos. Todos estos factores se asocian comúnmente a una colonoscopia. También es importante mantener la normotermia.
Aunque nuestra paciente no tenía colocado un DAI, algunos pacientes con SB sí lo tendrán cuando se presenten en quirófano, por lo que es oportuno conocer su manejo. Esto incluiría la desactivación previa del DAI y el acceso inmediato a una posible desfibrilación, hasta la reactivación del DAI. En caso de urgencia, con imposibilidad para desactivación se aplicaría un imán y se retiraría al acabar el procedimiento. Se desaconseja también el empleo de electrocauterio monopolar, empleando preferentemente el bipolar. En nuestro servicio, estas actuaciones están protocolizadas y consensuadas con el servicio de cardiología.
El conocimiento y aplicación individualizada de los cuidados a suministrar, tanto en anestesias generales o regionales, como en sedaciones es lo que faculta y diferencia a los anestesiólogos, respecto a las sedaciones practicadas por no anestesiólogos. El anestesiólogo debe ser el único profesional que asuma estas competencias, toda vez que el Programa de Formación de la Especialidad de Aparato Digestivo no recoge la formación en sedación como una competencia y el Programa de Medicina Intensiva solo recoge la formación para la sedación en pacientes críticos, nunca en pacientes ambulatorios.
Como conclusión, en el manejo y cuidado anestésico de procedimientos diagnósticos y terapéuticos debe primar la seguridad del paciente, y ser realizado por el profesional formado específicamente para ello, por encima de costumbres, conveniencias y rutinas, siempre proporcionando una atención multidisciplinar y un trabajo en equipo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores firmantes declaran no presentar ningún conflicto de intereses.