El transportador de Zn8 (ZnT8), identificado como el cuarto autoantígeno inmunodominante en la diabetes mellitus (DM) tipo 1, presenta un polimorfismo en el residuo 325 (Arg/Trp). Sin embargo, aún no se encuentra suficientemente definido el papel de este residuo en la inmunorreactividad de los autoanticuerpos anti-ZnT8 (ZnT8A). En este contexto, el objetivo del presente trabajo involucró la detección y caracterización inmunoquímica de los ZnT8A en DM tipo 1 empleando diferentes variantes antigénicas de ZnT8 con Arg o Trp en la posición 325, o bien construcciones quiméricas con ambos aminoácidos en dicha posición.
Materiales y métodosSe evaluaron 100 sueros de pacientes argentinos con reciente diagnóstico de DM tipo 1. La determinación de ZnT8A se realizó mediante el ensayo de unión de radioligando, utilizando distintas variantes antigénicas: ZnT8-Arg325, ZnT8-Trp325, ZnT8-Arg-Trp325, ZnT8-Arg-Arg325 y ZnT8-Trp-Trp325. Paralelamente se determinó la presencia de los otros marcadores de autoinmunidad para DM por ensayo de unión de radioligando.
ResultadosDe los 100 pacientes estudiados, 65 fueron ZnT8A+ para al menos alguna de las variantes antigénicas empleadas. Ocho reconocieron todas las formas recombinantes de ZnT8. La mayoría (56) resultaron positivos para el heterodímero (ZnT8-Arg-Trp325), 25 de los cuales reconocieron además el homodímero ZnT8-Arg-Arg325 y el monómero ZnT8-Arg325. Nueve pacientes presentaron únicamente ZnT8A como marcador de autoinmunidad. Por otro lado, los niveles de señales obtenidos con el heterodímero fueron significativamente mayores a los niveles alcanzados empleando cualquiera de las otras variantes antigénicas (mediana 17,99 vs. 10,71; 6,32; 5,66 y 4,44 SD scores para ZnT8-Arg325, ZnT8-Trp325, ZnT8-Arg-Arg325 y ZnT8-Trp-Trp325, respectivamente; p<0,05, test t de Mann-Whitney).
ConclusionesSe logró caracterizar inmunoquímicamente los ZnT8A presentes en pacientes argentinos con DM tipo 1 empleando diferentes variantes antigénicas de ZnT8. Se observó que la incorporación de ZnT8A, en combinación con los marcadores clásicos, incrementa la sensibilidad diagnóstica de autoinmunidad. La reactividad exclusiva de ZnT8A por las variantes antigénicas que contienen arginina en el residuo 325 evidencia la existencia de epítopes dependientes del aminoácido presente en dicho residuo. Además, la aplicación de variantes diméricas reveló la existencia de epítopes definidos por la estructura cuaternaria de ZnT8. La construcción heterodimérica fue la que mostró la mejor combinación de sensibilidad y especificidad a los fines del screening rutinario de ZnT8A.
The aim of this study involved the detection and immunochemical characterisation of ZnT8 autoantibodies (ZnT8A) in new-onset type 1 Argentinian diabetic patients.
Material and methodsOne hundred sera from type 1 diabetic patients were tested for ZnT8A. The antigens employed were obtained using cDNA plasmids encoding the C-terminal domains of ZnT8 carrying 325Arg, 325Trp and 3 dimeric constructs (ZnT8-Arg-Trp325, ZnT8-Arg-Arg325 and ZnT8-Trp-Trp325). ZnT8A were assessed by radioligand binding assay (RBA). Other islet-autoantibodies were also tested by RBA.
ResultsAmong the 100 type 1 diabetic patients, the prevalence of ZnT8A was 65.0%, 8 recognized all recombinant forms of ZnT8. Most patients (56) were positive for the heterodimer (ZnT8-Arg-Trp325), being 25 of them also positive for the homodimer ZnT8-Arg-Arg325 and monomer ZnT8-Arg325. Single reactivity against ZnT8A was found in 9.0% of the group. Besides, the highest signal values were obtained with the heterodimeric variant (median 17.99 vs. 10.71, 6.32, 5.66 and 4.44 SD scores for ZnT8-Arg325, ZnT8-Trp325, ZnT8-Arg-Arg325 y ZnT8-Trp-Trp325, respectively; p < 0.05, Mann-Whitney t test).
ConclusionImmunochemical characterisation of ZnT8A present in type 1 Argentinian diabetic patients was accomplished, employing different variants of ZnT8. An increased detection of autoimmunity was found when ZnT8A was employed in combination with the other islet-autoantibodies. The presence of autoantibodies that recognized only constructions containing Arg reveals the existence of epitopes dependent of the amino acid present at residue 325. Furthermore, application of dimeric constructions revealed the existence of quaternary structure–defined epitopes which were recognized by type 1 diabetic patients. Finally, the highest combined sensitivity and specificity for routine screening of ZnT8A was accomplished with the heterodimeric construction.
La diabetes mellitus (DM) y sus complicaciones constituyen la tercera causa de muerte en los países industrializados, después de las enfermedades cardiovasculares y el cáncer. Alrededor del 5-6% de la población mundial padece alguna de las formas de esta enfermedad, la cual muestra una tendencia de crecimiento continuo. La DM constituye un grupo heterogéneo de enfermedades, las cuales conducen a una elevación de la glucosa en sangre. Se distinguen 2 tipos principales de la enfermedad: la DM tipo 1 y la DM tipo 2. Sin embargo, en algunos casos es difícil diferenciar entre las 2 variantes principales1. Así, se han propuesto nuevas categorías, entre ellas, la diabetes autoinmune latente del adulto (conocida como LADA por su sigla en inglés) para identificar a un subgrupo de pacientes adultos que sufren un proceso autoinmune e inicialmente no requieren insulina pero pueden requerirla poco tiempo después del diagnóstico2. Aunque los síntomas agudos y a veces letales de la diabetes pueden ser controlados, las complicaciones tardías de la enfermedad exhiben alta morbilidad y reducen significativamente las expectativas de vida.
La principal causa de la DM tipo 2 es una resistencia de los tejidos periféricos a la acción de la insulina, asociada a un grado variable de disfunción secretoria. Ambas causas, a su vez, se correlacionan con la presencia de determinantes genéticos y factores ambientales, de ahí que la DM tipo 2 haya sido definida como una enfermedad poligénica y multifactorial.
La DM tipo 1 se clasifica como autoinmune (tipo 1A) o idiopática (tipo 1B). La DM tipo 1A es un trastorno de origen autoinmune que presenta un importante componente de autoagresión celular, acompañado de una serie de marcadores humorales que sirven principalmente para la detección prodrómica de la enfermedad y para el apoyo diagnóstico3. La tolerancia hacia componentes propios de las células beta pancreáticas productoras de insulina puede quebrarse, luego del ataque de los linfocitos T citotóxicos, tal vez como un evento secundario a la agresión de ciertos virus beta-citotrópicos. Además de los agentes ambientales existe contribución de la constitución genética, principalmente a través del sistema HLA que interviene en la presentación antigénica4–6. La mayoría de los pacientes con reciente diagnóstico de DM tipo 1A tiene en circulación autoanticuerpos dirigidos contra diferentes antígenos de las células beta pancreáticas, exhibiendo especificidades hacia la insulina y proinsulina (IAA/PAA), hacia la glutamato decarboxilasa (GADA) y la tirosina fosfatasa IA-2 (IA-2A). Estos 3 marcadores presentes en el pródromo de la enfermedad son altamente predictivos, ya que denuncian la instalación de una agresión autoinmune que conducirá luego de un tiempo variable a su expresión clínica7. Por otra parte una fracción minoritaria de los pacientes con DM tipo 1 no muestran evidencia de autoinmunidad por lo cual se los clasifica como DM tipo 1B8.
En el año 2007 fue descripto un nuevo autoantígeno: la isoforma 8 del transportador de Zn (ZnT8) específico de célula beta9–11. El ZnT8 participa en el transporte de Zn2+ desde el citoplasma hacia el interior del gránulo de secreción de insulina. La presencia del catión es esencial para el almacenamiento de la insulina, como hexámero con 2 cationes Zn2+, y para la secreción de la hormona frente al estímulo de glucosa12. El gen codificante para ZnT8 se ubica en el cromosoma 8q24.11, contiene 8 exones y codifica una proteína de 369 aminoácidos.
Los ensayos para los marcadores IAA, GADA, e IA-2A pueden ser ubicados en el percentil 99 de los controles, y aproximadamente el 90% de los niños que comienzan con DM expresan positividad para algunos de ellos13. Con la determinación de ZnT8A el porcentaje se incrementa aproximadamente al 96%, disminuyendo el número de casos de la denominada DM tipo 1B. El principal epítope de ZnT8 involucrado en el reconocimiento de los autoanticuerpos se localiza en el dominio C-terminal de la molécula (aa 268-369)9. En esta región existen 2 variantes polimórficas en el residuo 325 (Arg/Trp)14, razón que llevó a algunos autores a analizar la asociación entre la reactividad de los ZnT8A y el polimorfismo SLC30A815. Sin embargo, aún no se encuentra suficientemente definido el papel de este residuo en la inmunorreactividad de este marcador.
En este contexto, el objetivo del presente trabajo involucró la detección y caracterización inmunoquímica de los ZnT8A provenientes de pacientes argentinos infanto-juveniles con reciente diagnóstico de DM tipo 1. Para ello se emplearon diferentes variantes antigénicas recombinantes de ZnT8, ya sea con Arg o Trp en la posición 325, o bien construcciones quiméricas que contenían ambos aminoácidos en dicha posición. El objetivo final fue establecer si el residuo 325 del ZnT8 es un determinante clave para definir la inmunorreactividad de los ZnT8A y obtener información acerca del papel de los dímeros en la génesis de estos autoanticuerpos.
Materiales y métodosSerotecasLas muestras de sangre fueron colectadas de individuos luego de un ayuno de 8h y el suero correspondiente se almacenó a −20°C hasta su evaluación.
Se evaluaron las siguientes serotecas:
- •
Individuos controles normales provenientes de donantes de sangre sanos sin historia personal o familiar de enfermedades autoinmunes provistos por el Servicio de Hemoterapia del Hospital de Clínicas «José de San Martín», UBA (Programa con aprobación de los Comités de Investigación y Docencia, y de Ética del mismo Hospital). Dichos sueros fueron utilizados para determinar el cut off en cada uno de los ensayos.
- •
Pacientes argentinos infanto-juveniles con recientes diagnóstico de DM tipo 1, diagnosticados según el criterio de la OMS (N=100)3, provenientes de un programa local establecido con el Servicio de Nutrición del Hospital Nacional de Pediatría R. Gutiérrez (Buenos Aires, Argentina). Dicho programa cuenta con la participación de 15 centros de salud ubicados en Ciudad Autónoma de Buenos Aires, Gran Buenos Aires e interior del país. El programa contó con la aprobación del Comité de Ética de dicho hospital. Las muestras ingresaron al Servicio desde mayo de 2013 hasta marzo de 2015, dicho grupo incluyó 49 mujeres y 51 varones, la edad media al diagnóstico fue de 10±4 años y el rango etario 1-17 años.
El ADN codificante para el dominio C-terminal de ZnT8 (aa 268-369) conteniendo en la posición 325 Arg o Trp fue gentilmente cedido por el Dr J. Hutton del Barbara Davis Center of Childhood Diabetes, University of Colorado, EE. UU. Asimismo, 3 construcciones diméricas de ADN codificantes para Arg-Arg325, Trp-Trp325 y Arg-Trp325 fueron sintetizadas por GenScript (Piscataway, EE. UU.) y ligadas al vector p-ALTER-Ex1 (Promega, Madison, EE. UU.) en los sitios PstI/XbaI. La identidad de las moléculas de ADN se confirmó por secuenciación.
Los antígenos radiactivos [35S]-ZnT8-Arg325, [35S]-ZnT8-Trp325, [35S]-ZnT8-Arg-Arg325, [35S]-ZnT8-Trp-Trp325 y [35S]-ZnT8-Arg-Trp325 se sintetizaron mediante un sistema de expresión eucariota libre de células. Para ello, el ADN codificante para cada una de las construcciones se transcribió y tradujo simultáneamente in vitro empleando un sistema de lisado de reticulocitos de conejo en presencia de [35S]-Metionina (actividad específica 1.175 Ci/mmol, New England Nuclear, Boston, MA, EE. UU.) durante 90min a 30°C. Los productos de traducción se sembraron en una columna PD10 (Sephadex G25, Amersham Biosciences, Nueva Jersey, EE. UU.) para remover la [35S]-Metionina libre. Como control de calidad, las proteínas marcadas radiactivamente se analizaron por SDS-PAGE y fluorografía.
Protocolo de radioligand binding assay para la detección de ZnT8APara determinar la presencia del ZnT8A en los sueros de pacientes bajo estudio se optimizó e implementó un radioligand binding assay (RBA). Aproximadamente 10.000cpm del trazador ([35S]ZnT8-Arg325, [35S]ZnT8-Trp325, [35S]ZnT8-Arg-Arg325, [35S]ZnT8-Trp-Trp325 o [35S]ZnT8-Trp-Arg325) se incubaron con alícuotas de 5μl de sueros humanos (en un volumen final de 60μl en buffer RBA: Tris-HCl 20mM; NaCl 0,15M; Tween 20 0,15%; aprotinina 0,1%; BSA 0,1%; pH 7,4) durante toda la noche a 4°C. Posteriormente, a cada muestra se le agregó 50μl de proteína A-Sepharose 4B FF (Amersham Biosciences, Piscataway, NJ, EE. UU.) 50% en buffer RBA y las suspensiones se incubaron durante 2h a temperatura ambiente, en agitación continua. Las muestras fueron centrifugadas y los precipitados conteniendo los inmunocomplejos se lavaron 4 veces con buffer RBA, se resuspendieron en 100μl de SDS 1% y los sobrenadantes fueron transferidos a viales para ser contados en un contador automático de centelleo líquido (Liquid Scintillation Analyzer Model Tri-Carb 2810TR, Perkin Elmer, MA, EE. UU.).
Los resultados se expresaron como porcentajes de unión (B%) con respecto a las cuentas totales agregadas en el ensayo, o como unidades de precisión: SD scores (SDs=(B% suero analizado – B% media de los controles normales)/desvío estándar controles normales)
Se procesaron simultáneamente 30 sueros humanos normales para calcular el cut off como la media más 3 desvíos estándar.
Detección de IAA/PAA, GADA e IA-2A por radioligand binding assaySe realizó la búsqueda de los otros marcadores serológicos de autoinmunidad para la DM en los sueros en estudio. Se determinaron los marcadores IAA/PAA16, GADA17 e IA-2A18 por los métodos radiométricos de referencia.
Análisis estadísticoLos análisis estadísticos se realizaron empleando el programa de computación GraphPadPrism, versión 6.03 para Windows (GraphPad Software, San Diego California, EE. UU., www.graphpad.com).
Para obtener los niveles de corte de los RBA, primero se evaluó la distribución de los datos correspondientes a los sujetos controles normales. Para ello se realizó el test de normalidad de D’Agostino y Pearson. Los resultados de los sueros controles siguieron una distribución normal. Por lo tanto, para todos los ensayos, se consideró como valor de corte la media más 3 desvíos estándar de los resultados obtenidos con los controles normales.
Para evaluar la existencia de diferencias significativas entre los niveles de señales obtenidos con las diferentes construcciones antigénicas de ZnT8 se aplicó el test de Mann-Whitney.
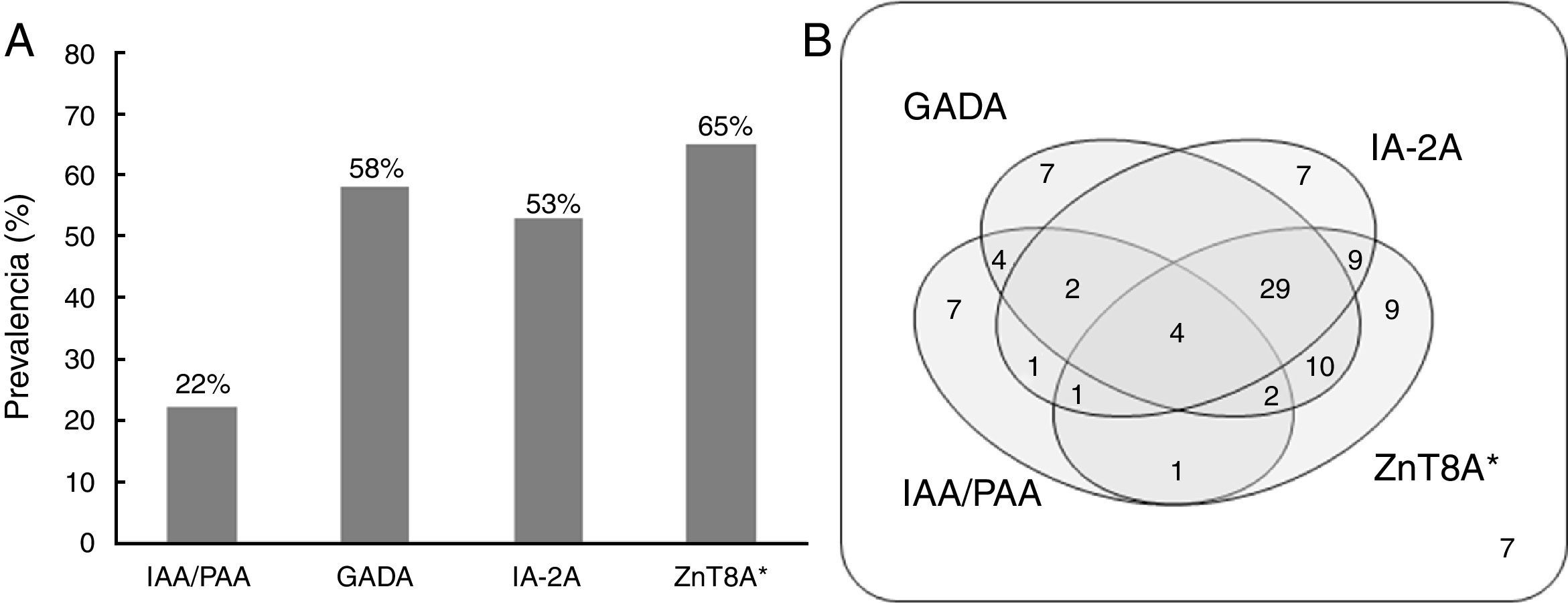
ResultadosDetección de ZnT8A en forma conjunta con los otros marcadores de autoinmunidadEmpleando el método de referencia se determinó la prevalencia de ZnT8A, calculada como el porcentaje de pacientes diabéticos detectados como positivos, en forma conjunta con la de los otros marcadores de autoinmunidad. De los 100 pacientes estudiados el 22% fue IAA/PAA+, el 58% GADA+, el 53% IA-2A+ y el 65% fue ZnT8A+ para al menos alguna de las variantes antigénicas empleadas (fig. 1A).
A) Histograma de prevalencias relativas para los marcadores IAA/PAA, GADA, IA-2A y ZnT8A empleando los respectivos RBA en 100 muestras de pacientes argentinos con DM tipo 1. B) Sensibilidad conjunta de los marcadores. Las regiones de intersección indican el porcentaje de pacientes positivos para las diferentes combinaciones de autoanticuerpos. ZnT8A* representa la reactividad frente a [35S]-ZnT8-Arg325, [35S]-ZnT8-Trp325, [35S]-ZnT8-Arg-Arg325, [35S]-ZnT8-Trp-Trp325 y [35S]-ZnT8-Arg-Trp325.
Asimismo se analizó la sensibilidad combinada de los 4 marcadores (fig. 1B). Es de destacar que 9 pacientes con DM tipo 1 fueron positivos solo para ZnT8A y que la inclusión de dicho marcador disminuyó el porcentaje de pacientes que dieron negativo para los 4 autoanticuerpos a solo un 7%, reduciendo el número de casos de DM tipo 1B o idiopática.
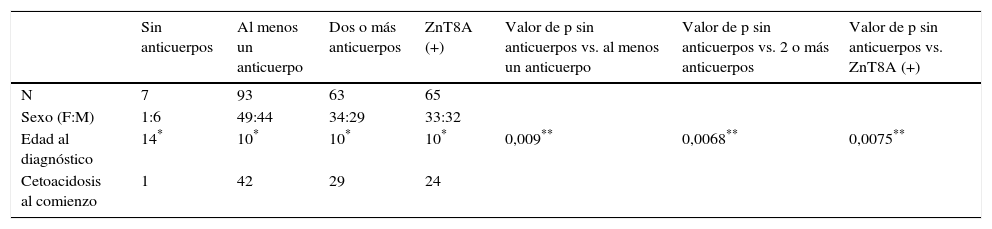
Por otro lado, en la tabla 1 se muestra el análisis de las características clínicas de los pacientes de acuerdo a la presencia de autoanticuerpos. Se observó que la edad de diagnóstico fue significativamente menor en el grupo de pacientes que presentaban al menos un autoanticuerpo que en el grupo donde no tenían ningún marcador de autoinmunidad positivo.
Características clínicas de pacientes con DM tipo 1 y su relación con la presencia de autoanticuerpos
| Sin anticuerpos | Al menos un anticuerpo | Dos o más anticuerpos | ZnT8A (+) | Valor de p sin anticuerpos vs. al menos un anticuerpo | Valor de p sin anticuerpos vs. 2 o más anticuerpos | Valor de p sin anticuerpos vs. ZnT8A (+) | |
|---|---|---|---|---|---|---|---|
| N | 7 | 93 | 63 | 65 | |||
| Sexo (F:M) | 1:6 | 49:44 | 34:29 | 33:32 | |||
| Edad al diagnóstico | 14* | 10* | 10* | 10* | 0,009** | 0,0068** | 0,0075** |
| Cetoacidosis al comienzo | 1 | 42 | 29 | 24 |
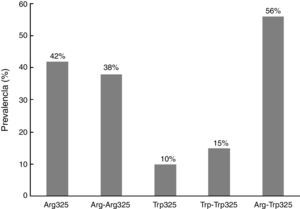
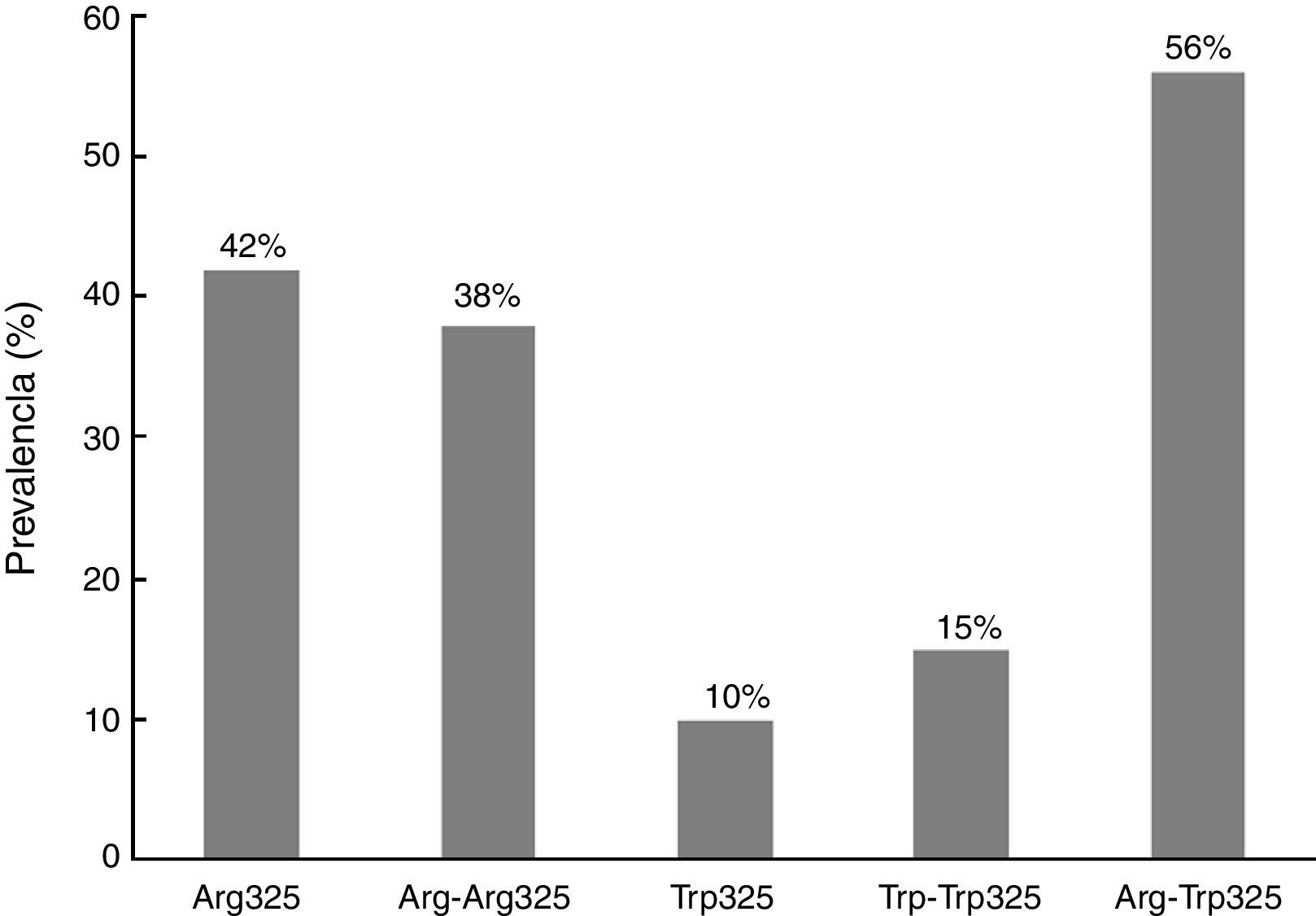
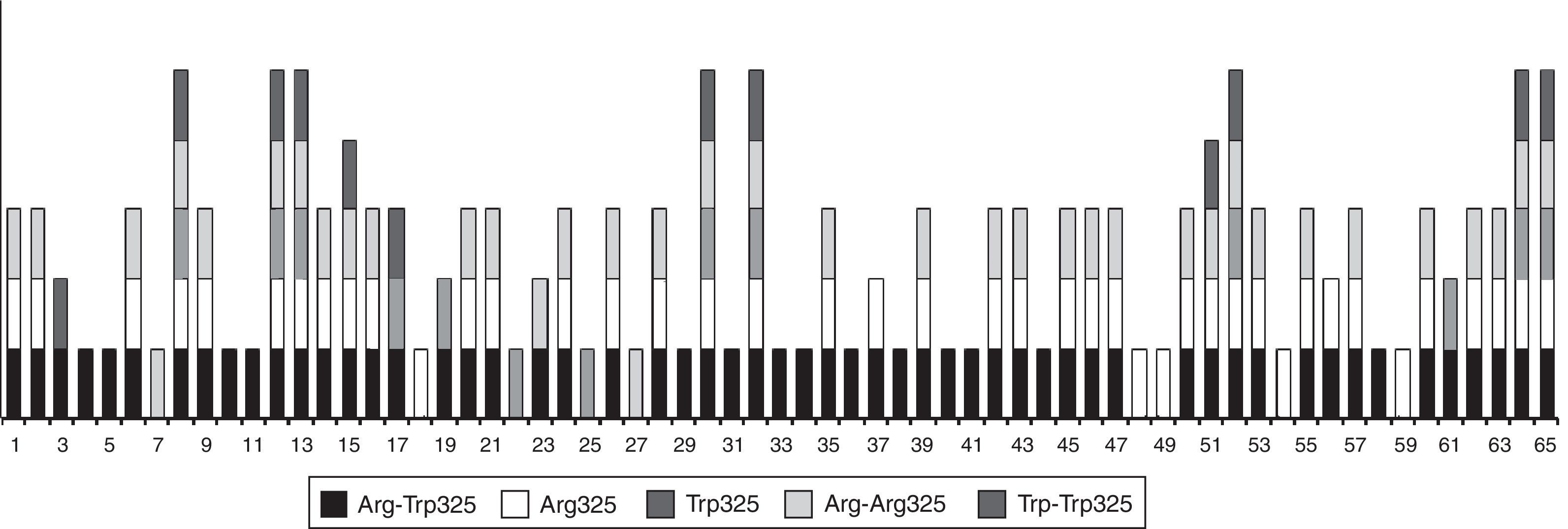
Empleando las diferentes construcciones antigénicas recombinantes de ZnT8, se calculó la prevalencia obtenida con cada una de las variantes empleadas (fig. 2). Por otro lado, en la figura 3 se representan los 65 pacientes ZnT8A+, de los cuales 8 reconocieron todas las formas recombinantes de ZnT8. La mayoría (56) resultaron positivos para el heterodímero (ZnT8-Arg-Trp325), 25 de los cuales reconocieron además el homodímero ZnT8-Arg-Arg325 y el monómero ZnT8-Arg325.
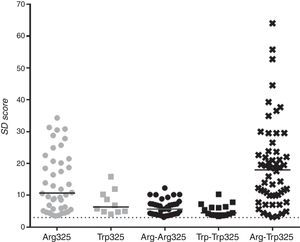
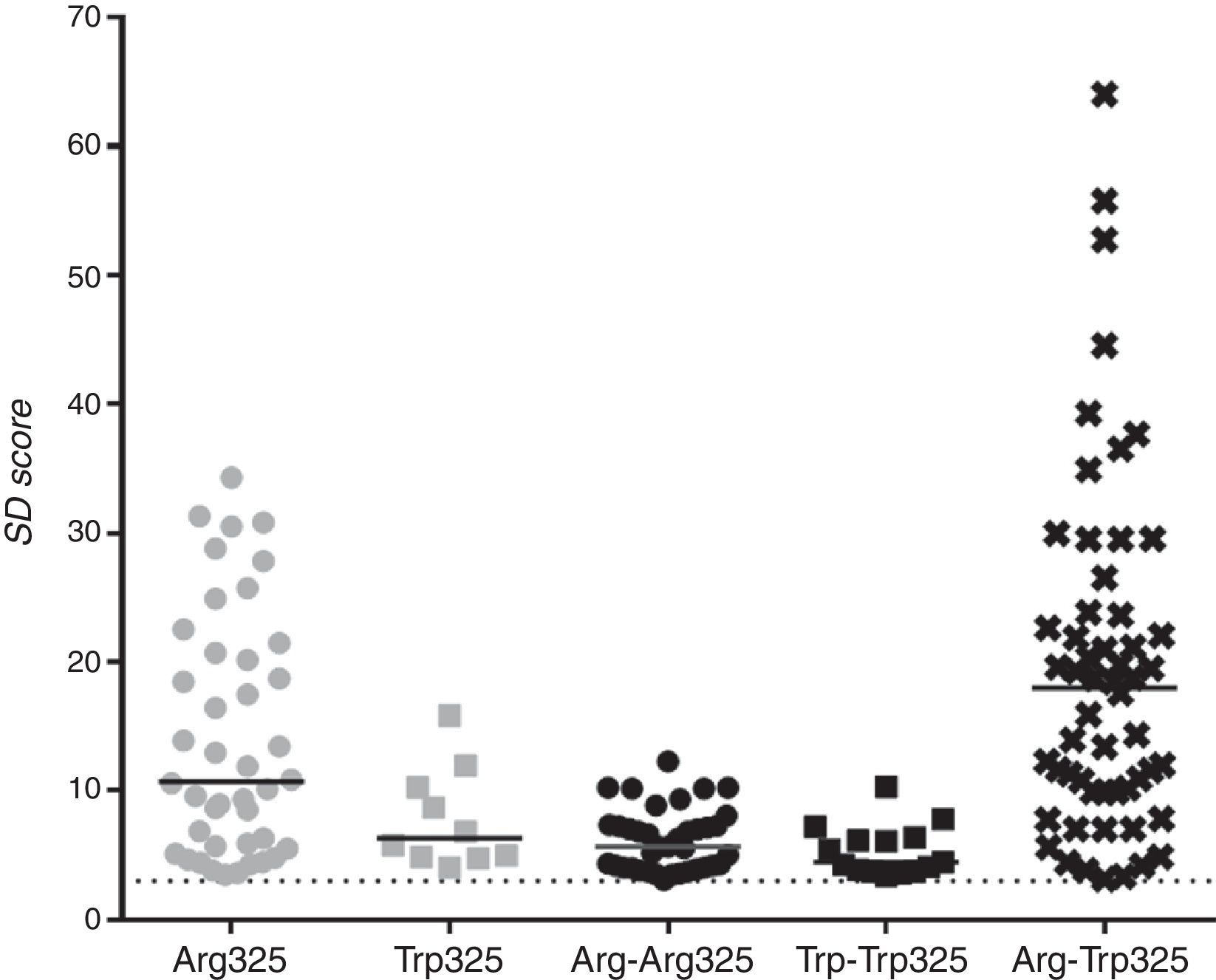
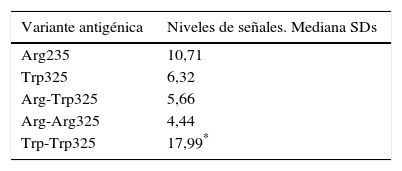
Para un análisis más profundo se analizaron los sueros ZnT8A positivos para cada una de las variantes y se compararon los niveles de señales (fig. 4 y tabla 2). Los niveles de señales obtenidos con el heterodímero fueron significativamente mayores a los niveles alcanzados empleando cualquiera de las otras variantes antigénicas (mediana 17,99 vs. 10,71; 6,32; 5,66 y 4,44 SD scores para ZnT8-Arg325, ZnT8-Trp325, ZnT8-Arg-Arg325 y ZnT8-Trp-Trp325, respectivamente; p<0,05, test t de Mann-Whitney).
Medianas de los SDs obtenidos con cada una de las construcciones empleadas
| Variante antigénica | Niveles de señales. Mediana SDs |
|---|---|
| Arg235 | 10,71 |
| Trp325 | 6,32 |
| Arg-Trp325 | 5,66 |
| Arg-Arg325 | 4,44 |
| Trp-Trp325 | 17,99* |
En el año 2007, Hutton y sus colaboradores identificaron al ZnT8 como el cuarto autoantígeno inmunodominante en DM tipo 1. Con relación a este nuevo marcador se ha descripto que el 60-80% de la población caucásica con DM tipo 1 y el 50-60% de la población Japonesa con comienzo agudo de DM presentan ZnT8A9. En el presente trabajo hemos estudiado a 100 pacientes argentinos con reciente diagnóstico de DM tipo 1, de los cuales el 65% fueron ZnT8A positivos. Estos resultados están en concordancia con el perfil descripto anteriormente. También se observó que la incorporación de ZnT8A, en combinación con los marcadores clásicos, incrementa la sensibilidad diagnóstica de autoinmunidad de un 84% a un 93%, ratificando que ZnT8A constituye un marcador humoral adicional a la tríada ya existente (IAA/PAA, GADA e IA-2A). Además, a diferencia de lo que ocurre con GAD e IA-2, ZnT8 es un antígeno específico de célula beta por lo que la detección de ZnT8A pone en evidencia un daño específico de dichas células.
En relación con los epítopes reconocidos por los ZnT8A, se ha descripto que el 80% de los sueros de pacientes con DM tipo 1 ZnT8A positivos reconocen el domino C-terminal de ZnT8 (residuos 268-369) resultando muy poco frecuente la presencia de anticuerpos que reconozcan al fragmento N-terminal (residuos 1-74)19. Por otro lado, en el extremo carboxilo de ZnT8 se describió un polimorfismo no sinónimo (rs1326634 G>T), existiendo 2 variantes polimórficas en el residuo 325 (Arg/Trp)14. Acorde con estos estudios, en este trabajo evaluamos el reconocimiento específico de ZnT8A presentes en sueros de pacientes con DM tipo 1 utilizando construcciones monoméricas del dominio C-terminal que contienen Arg o Trp en el residuo 325 y construcciones diméricas con Arg-Arg, Trp-Trp o Arg-Trp en los residuos 325. Se logró así diferenciar subpoblaciones de autoanticuerpos según sus inmunorreactividades frente a las variantes antigénicas de ZnT8 empleadas. De los 65 pacientes ZnT8A positivos, 25 (38,50%) presentaron autoanticuerpos que solo reconocieron las construcciones que contienen el aminoácido arginina en el residuo 325. Esto pone en evidencia la existencia de epítopes dependientes del aminoácido presente en dicha posición. Los resultados obtenidos son concordantes con reportes previos publicados por Kawasaki et al.15, quienes concluyen que el residuo 325 es clave en la autorreactividad para ZnT8 y que el genotipo SLC30A8 es un determinante importante en la especificidad del autoanticuerpo. Asimismo, el descubrimiento de sueros ZnT8A positivos que reconocen la construcción monomérica con Arg y las 3 construcciones diméricas (siendo negativos para el monómero con Trp) confirma no solo la existencia de epítopes dependientes del residuo 325 sino también de otros epítopes aportados por la estructura dimérica. Esta observación pone en evidencia la existencia de epítopes conformacionales discontinuos presentes en las construcciones diméricas de ZnT8, los cuales son reconocidos por los ZnT8A, emulando el posible mecanismo de la respuesta inmune desencadenada in vivo por la estructura cuaternaria de este autoantígeno.
En conclusión, se logró abordar la caracterización inmunoquímica de los ZnT8A presentes en pacientes argentinos con DM tipo 1, empleando diferentes variantes antigénicas de ZnT8. Se observó que la construcción heterodimérica fue la que mostró la mejor combinación de sensibilidad y especificidad a los fines del screening rutinario de ZnT8A, así como la que denotó el más amplio rango dinámico. Cabe destacar que es de sumo interés la inclusión de la determinación de ZnT8A en pacientes con comienzo dudoso de DM tipo 1 ya que permite disminuir el porcentaje de DM tipo 1B o idiopática. Asimismo, la inclusión de este marcador en individuos de riesgo (familiares en primer grado de pacientes con DM tipo 1) es esencial, en los ensayos terapéuticos (trials) de predicción y prevención de la DM tipo 1.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no poseer conflictos de intereses.
Agradecemos a la doctora Adriana Roussos (Servicio de Nutrición del Hospital Nacional de Pediatría Gutiérrez) y a los siguientes centros de salud la provisión de sueros de pacientes diabéticos: Hospital de Niños Pedro de Elizalde, Fundación Hospitalaria, Hospital de Niños de San Justo, OSPERYH, Hospital Universitario Austral (Pilar), Hospital San Juan de Dios (Haedo), Hospital «Narciso López» (Lanús), Hospital Interzonal General De Agudos «Luisa C. de Gandulfo» (Lomas de Zamora), Hospital Municipal Materno Infantil «Dr. Carlos Gianantonio» (San Isidro), Hospital de Pediatría «Claudio Zin» (Malvinas Argentinas), Hospital Municipal de Pediatría «Federico Falcón» (Del Viso), Hospital Posadas (El Palomar), Hospital Italiano «Agustín Rocca» de San Justo, Hospital de Endocrinología «Dr. Arturo Oñativia» (Salta). Asimismo agradecemos al Servicio de Hemoterapia del Hospital de Clínicas «José de San Martín» la provisión de sueros humanos normales y Este trabajo fue financiado en parte por los subsidios otorgados por UBA (UBACyT 20020110100146), CONICET (PIP 0256) y ANPCyT (PICT-2008-0998).




![A) Histograma de prevalencias relativas para los marcadores IAA/PAA, GADA, IA-2A y ZnT8A empleando los respectivos RBA en 100 muestras de pacientes argentinos con DM tipo 1. B) Sensibilidad conjunta de los marcadores. Las regiones de intersección indican el porcentaje de pacientes positivos para las diferentes combinaciones de autoanticuerpos. ZnT8A* representa la reactividad frente a [35S]-ZnT8-Arg325, [35S]-ZnT8-Trp325, [35S]-ZnT8-Arg-Arg325, [35S]-ZnT8-Trp-Trp325 y [35S]-ZnT8-Arg-Trp325. A) Histograma de prevalencias relativas para los marcadores IAA/PAA, GADA, IA-2A y ZnT8A empleando los respectivos RBA en 100 muestras de pacientes argentinos con DM tipo 1. B) Sensibilidad conjunta de los marcadores. Las regiones de intersección indican el porcentaje de pacientes positivos para las diferentes combinaciones de autoanticuerpos. ZnT8A* representa la reactividad frente a [35S]-ZnT8-Arg325, [35S]-ZnT8-Trp325, [35S]-ZnT8-Arg-Arg325, [35S]-ZnT8-Trp-Trp325 y [35S]-ZnT8-Arg-Trp325.](https://static.elsevier.es/multimedia/03264610/0000005300000003/v1_201610230101/S032646101630016X/v1_201610230101/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)