La enfermedad hepática grasa no alcohólica comprende un espectro de afecciones hepáticas que va desde la simple esteatosis a la esteatohepatitis, fibrosis y hasta cirrosis. Su prevalencia aumenta con la edad, la obesidad y está fuertemente asociada con la presencia de síndrome metabólico y aumento de la mortalidad cardiovascular y por enfermedades malignas. Se produce por una acumulación de triglicéridos en los hepatocitos relacionada con insulinorresistencia hepática y muscular. Su presencia se asocia con aumento de transaminasa glutámico-oxaloacética o glutamico-pirúvica, aunque esta última puede no estar elevada en la enfermedad avanzada. Existen 5 índices utilizados para el diagnóstico de esteatosis hepática: SteatoTest, fatty liver index, NAFLD liver fat score, lipid acumulation product y hepatic steatosis index, mientras que para esteatohepatitis contamos con el NASH test, NASH diagnostics, NASH score y HAIR (Hypertention, increased ALT and IR o Insulin resistence). En estadios de fibrosis el índice transaminasa glutamicooxáloacetica-glutamicopiruvica aumenta, así como la ferritina en sangre y el valor del NAFLD fibrosis score, siendo de alta especificidad para el diagnóstico. La ecografía abdominal tiene una gran disponibilidad, pero su sensibilidad diagnóstica es menor cuando existen grados leves de infiltración grasa hepática. La tomografía computada tiene una especificidad del 100% cuando el contenido graso es mayor al 30% pero la radiación emitida no permite un uso frecuente. La resonancia magnética con espectroscopia constituye el método de elección para la detección y cuantificación de contenido de grasa hepática. La biopsia hepática es un método invasivo que permite una clasificación pronóstica adecuada de la enfermedad, pero por sus complicaciones solo debe realizarse en pacientes seleccionados: aquellos con riesgo elevado de esteatohepatitis o riesgo de fibrosis por laboratorio o clínica, o con otras enfermedades hepáticas coexistentes. La identificación temprana de enfermedad hepática grasa no alcohólica permite la implementación de medidas tempranas para disminuir la morbimortalidad asociada a esta condición.
Non-alcoholic fatty liver disease (NAFLD) includes a spectrum of liver diseases ranging from steatosis to steatohepatitis, fibrosis and cirrhosis. Its prevalence increases with age and with obesity, and is strongly associated with the presence of metabolic syndrome and increased cardiovascular and malignant diseases. It is caused by an accumulation of triglycerides in liver hepatocytes and muscles, and related to insulin resistance. Its presence is associated with the increase of alanine aminotransferase (alt), although it may not be elevated in advanced disease. There are 5 indexes used for the diagnosis of hepatic steatosis: SteatoTest, fatty liver index, NAFLD liver fat score, lipid accumulation product and hepatic steatosis index, whereas for esteatohepatitis the NASH test, NASH diagnostics, as well as the non-alcoholic steatohepatitis (NASH) score and HAIR (hypertension, ALT, and insulin resistance). In stages of fibrosis AST-ALT index increases as well as ferritin in blood and the NAFLD fibrosis score, which has a high specificity for diagnosis. Abdominal ultrasound is widely available, but its diagnostic sensitivity is lower when there are mild degrees of hepatic fatty infiltration. Computed tomography has a specificity of 100% when fat content is greater than 30%, but the radiation emitted prevents frequent use. Magnetic resonance spectroscopy is the method of choice for the detection and quantification of liver fat content. Liver biopsy is an invasive method that enables appropriate prognostic classification of the disease, but has some complications, and should only be performed in selected individuals: high risk of steatohepatitis or fibrosis risk of laboratory or clinical or other co-existing liver disease. Early identification of NAFLD allows early measures to be implemented in order to reduce morbidity and mortality associated with this condition.
La enfermedad hepática grasa no alcohólica (EHGNA) se define por la presencia de infiltración grasa en el hígado en ausencia de consumo de alcohol y de otras causas secundarias de enfermedad crónica hepática (tabla 1). Es una condición clínica que comprende un amplio espectro de daño hepático que se extiende desde esteatosis a esteatohepatitis no alcohólica (EHNA), fibrosis hasta cirrosis (tabla 2). La mayoría de los pacientes suelen permanecer asintomáticos hasta el desarrollo de cirrosis, considerado el último estadio de la enfermedad.
Otras causas de esteatosis
| Otras causas de esteatosis (o secundarias) |
|---|
| Enfermedad hepática grasa alcohólica Enfermedad hepática grasa inducida por drogas Hígado graso asociado a virus de hepatitis C (genotipo 3). Otros: -Hemocromatosis -Hepatitis autoinmune -Enfermedad celíaca -Enfermedad de Wilson -Lipoatrofia -A/hipobetalipoproteinemia -Hipopituitarismo -Hipotiroidismo -Nutrición parenteral, ayuno -Errores congénitos del metabolismo (enfermedad de Wolman, deficiencia de lipasa ácida lisosomal) |
Adaptada de European Association for the Study of the Liver (EASL), European Association for the Study of Diabetes (EASD), (EASO) European Association for the Study of Obesity19.
Enfermedad hepática grasa no alcohólica. Subclasificación
| Enfermedad | Subclasificación |
|---|---|
| Enfermedad hepática grasa no alcohólica (EHGNA)a | HÍGADO GRASO NO ALCOHÓLICO *Pura esteatosis *Esteatosis e inflamación lobular leve ESTEATOHEPATITIS NO ALCOHÓLICA *EHNA temprana: ausencia o fibrosis leve (FO-F1) *EHNA fibrótica: fibrosis significativa (≥ F2) o avanzada (≥F3, puentes fibróticos) *EHNA–cirrosis (F4) Carcinoma hepatocelular |
a También llamada «primaria» y asociada a factores de riesgo metabólico/componentes del síndrome metabólico.
Adaptada de European Association for the Study of the Liver (EASL), European Association for the Study of Diabetes (EASD), European Association for the Study of Obesity (EASO)19.
La prevalencia e incidencia mundial son variables dependiendo de la población estudiada. Los datos son muy diversos debido a que el diagnóstico depende del método y criterio utilizado1. Se estima que en Estados Unidos la prevalencia en la población general varía de un 3 al 23%2. En población latina la prevalencia evaluada por ecografía hepática fue de 15% en México3 y en Brasil, entre mujeres obesas, 33%4.
Entre los factores de riesgo para el desarrollo de la EHGNA que modifican su prevalencia se encuentran la edad, el estilo de vida y el índice de masa corporal (IMC). En relación a la edad, un estudio de autopsias estimó una prevalencia de EHGNA de 9,6% en niños y adolescentes (entre 2 y 19 años). La prevalencia de hígado graso se incrementó con la edad desde 0,7% entre los niños de 2 a 4 años hasta 17,3% en adolescentes de 15 a 19 años5. En adultos, un estudio observacional de 7.371 individuos demostró que la prevalencia de EHGNA fue de 26,7% en mayores de 60 años mientras que en menores de 60 años fue de 22,8% evaluada por ecografía6.
En relación a la asociación de la enfermedad grasa hepática con el IMC elevado, aproximadamente el 58% de los individuos con sobrepeso y el 90% con obesidad mórbida, presenta EHGNA7. De todas maneras no está claro si la infiltración grasa precede al desarrollo de las alteraciones del metabolismo de la glucosa y de los lípidos o se desarrolla de manera concomitante.
En cuanto a la asociación de EHGNA con otras enfermedades, se ha demostrado que en personas con diabetes tipo 2 la prevalencia se eleva al 70% y en aquellos con dislipidemia puede alcanzar el 80%8.
Los pacientes con EHGNA tienen más riesgo de padecer enfermedad coronaria, disfunción ventricular izquierda, hipertrofia y/o falla cardíaca, arritmias y enfermedad valvular que los pacientes sin EHGNA9,10. También presentan otros marcadores de riesgo cardiovascular como incremento en la concentración de proteína C reactiva, calcificaciones arteriales y aumento del grosor de la íntima arterial11,12.
El 30-40% de los pacientes con EHGNA tienen fibrosis hepática avanzada al momento del diagnóstico y 10-15% cirrosis establecida. Aquellos que desarrollan cirrosis pueden presentar solo estigmas cutáneos (eritema palmar, nevus) o características que se relacionan con la severidad del cuadro como ictericia, ascitis, edema, sangrado gastrointestinal y encefalopatía13.
La tasa de progresión de EHGNA a cirrosis o carcinoma hepatocelular es baja. Sin embargo, dada la elevada prevalencia de hígado graso en la población general, en pacientes con algún grado de obesidad y en pacientes con diabetes tipo 2, la esteatosis hepática se ha transformado en la primera causa de cirrosis o carcinoma hepatocelular en los países desarrollados.
El riesgo de muerte en pacientes con EHGNA es mayor que en la población general, teniendo siempre en cuenta que la asociación en mayor o menor grado con componentes de síndrome metabólico suma morbimortalidad. Estudios prospectivos han demostrado que los eventos cardiovasculares son la principal causa de muerte14,15. El estudio de Matteoni, prospectivo con 8 años de seguimiento y que incluyó a 132 pacientes con EHGNA encontró que la tasa de mortalidad fue de 36%, y la mayor parte de las muertes fueron originadas por complicaciones cardiovasculares16. Otras causas de muerte de estos pacientes fueron la cirrosis y el cáncer7.
El objetivo de esta revisión es exponer los métodos complementarios disponibles para diagnosticar EHGNA.
Enfermedad hepática grasa no alcohólica: fisiopatogeniaEl primer cambio en la EHGNA es una acumulación de lípidos –en especial triglicéridos– en los hepatocitos. El estrés oxidativo resultante de la oxidación mitocondrial de los ácidos grasos provenientes del metabolismo de los triglicéridos y el aumento de citoquinas inflamatorias son considerados factores causales de inflamación, fibrosis y daño hepático17. Dado que la mayoría de los pacientes con EHGNA tienen además síndrome metabólico (SM), algunos autores consideran a la EHGNA como un componente del SM; ambos están estrechamente asociados con elevados niveles de insulina.
En el estudio de D¿Ádamo (2010) utilizaron un clamp euglucémico hiperinsulinémico para demostrar que adolescentes obesos con gran contenido de grasa hepática tenían menor sensibilidad a la insulina en hígado y músculo esquelético y un defecto temprano en la secreción de insulina por la célula beta que fue independiente de la grasa visceral y el contenido de grasa miocelular18.
Evaluacion inicial ante sospecha de enfermedad hepática grasa no alcohólicaLa guía para el manejo de EHGNA de la Asociación Europea para el Estudio del Hígado, Asociación Europea para el Estudio de la Diabetes y la Asociación Europea para el Estudio de la Obesidad19 propone la evaluación inicial de los pacientes en quienes se sospecha EHGNA con los siguientes parámetros:
Interrogatorio:
- •
Ingesta de alcohol <20g/día en mujeres y<30g/día en hombres.
- •
Historia personal y familiar de diabetes, hipertensión y enfermedades cardiovasculares.
- •
Infección por hepatitis B y/o hepatitis C.
- •
Ingesta de fármacos asociados a esteatosis.
Examen físico:
- •
IMC, circunferencia de cintura, cambios en el peso corporal.
Estudios complementarios:
- •
Enzimas hepáticas (TGO, TGP, GGT).
- •
Glucemia de ayuno, HBA1c, PTOG, insulina de ayuno, índice HOMA.
- •
Hemograma.
- •
Colesterol total, colesterol HDL, triglicéridos, ácido úrico.
- •
Ecografía hepática.
Si bien existen muchos marcadores de inflamación, no hay determinaciones de laboratorio aisladas específicas de hígado que permitan detectar esteatosis. La alanina aminotransferasa o glutamato-piruvato transaminasa (TGP) ha sido utilizada como screening para el diagnóstico. Puede estar levemente elevada, pero no más de 2 o 3 veces del valor del límite superior del método. Sin embargo, las transaminasas no son marcadores confiables de EHNA puesto que pueden ser normales aún en casos de fibrosis avanzada20,21. En un estudio efectuado en la división de Endocrinología del hospital Durand el 70% de los pacientes portadores de esteatosis hepática ecográfica tenían TGP normal. La sensibilidad y especificidad de la TGP elevada para el diagnóstico de EHNA reportada es 45 y 85%, respectivamente22. Se han propuesto valores de corte que reflejen mejor la normalidad en diferentes poblaciones pero aún no han sido globalmente aceptados.
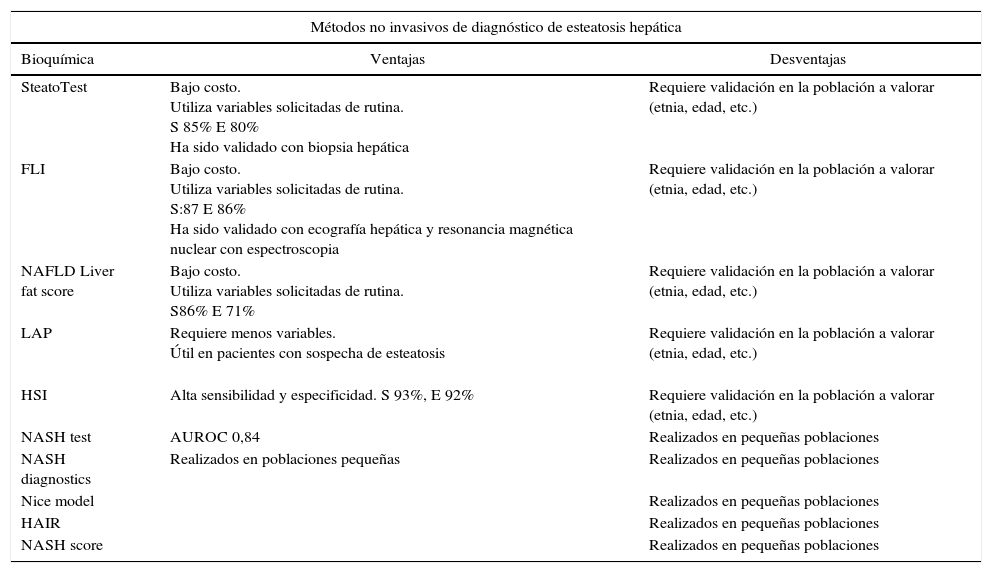
Métodos diagnósticos de EHGNA
| Métodos no invasivos de diagnóstico de esteatosis hepática | ||
|---|---|---|
| Bioquímica | Ventajas | Desventajas |
| SteatoTest | Bajo costo. Utiliza variables solicitadas de rutina. S 85% E 80% Ha sido validado con biopsia hepática | Requiere validación en la población a valorar (etnia, edad, etc.) |
| FLI | Bajo costo. Utiliza variables solicitadas de rutina. S:87 E 86% Ha sido validado con ecografía hepática y resonancia magnética nuclear con espectroscopia | Requiere validación en la población a valorar (etnia, edad, etc.) |
| NAFLD Liver fat score | Bajo costo. Utiliza variables solicitadas de rutina. S86% E 71% | Requiere validación en la población a valorar (etnia, edad, etc.) |
| LAP | Requiere menos variables. Útil en pacientes con sospecha de esteatosis | Requiere validación en la población a valorar (etnia, edad, etc.) |
| HSI | Alta sensibilidad y especificidad. S 93%, E 92% | Requiere validación en la población a valorar (etnia, edad, etc.) |
| NASH test | AUROC 0,84 | Realizados en pequeñas poblaciones |
| NASH diagnostics | Realizados en poblaciones pequeñas | Realizados en pequeñas poblaciones |
| Nice model | Realizados en pequeñas poblaciones | |
| HAIR | Realizados en pequeñas poblaciones | |
| NASH score | Realizados en pequeñas poblaciones | |
| Índices de fibrosis hepática | Ventajas | Desventajas |
|---|---|---|
| NFS | Identifica candidatos adecuados para la biopsia | Baja sensibilidad y especificidad. |
| ELF | Alta especifidad (98%) | Baja sensibilidad |
| Imágenes | Ventajas | Desventajas |
|---|---|---|
| Ecografía | Alta disponibilidad, bajo costo. Operador dependiente | No es útil en grados leves. No distingue entre fibrosis y esteatosis. Baja especificidad |
| Elastografia (fibroscan) | Distingue grados de fibrosis | Poco accesible. Alto costo |
| TC | Rápido no operador dependiente | Exposición a radiación |
| RM | Alta especificidad | Alto costo. Baja disponibilidad |
| Métodos invasivos de diagnóstico de esteatosis hepática | ||
|---|---|---|
| Ventajas | Desventajas | |
| Biopsia hepática | Método de referencia (gold standard) | Complicaciones severas por el procedimiento |
AUROC: área bajo la curva ROC; E: especificidad; ELF: enhanced liver fibrosis panel; FLI: fatty liver index; HAIR: hipertensión; HSI: hepatic steatosis index; LAP: lipid accumulation product; NFS: NAFLD fibrosis score; RM: resonancia magnética nuclear; S: sensibilidad; TC: tomografía computada.
En cuanto a la relación entre ambas transaminasas, cuando el cociente TGO/TGP es mayor a 0,8 permite sospechar estadios avanzados como la fibrosis.
En ocasiones puede observarse elevación de enzimas y proteínas tales como γ GT (GGT), α2 macroglobulina, haptoglobina, apolipoproteína A y TIMP1, pero ninguna es marcador específico de EHGNA. Los niveles séricos aumentados de ferritina se consideran un predictor independiente de fibrosis hepática avanzada en pacientes con EHGNA.
Las citokinas proinflamatorias, tales como factor de necrosis tumoral alfa (TNF-α) e interleukina 6 (IL-6), se encuentran elevadas en pacientes con EHNA en comparación con pacientes que presentan hígado graso sin inflamación23.
Se han investigado niveles circulantes de citokeratina 18 (CK 18) como nuevos biomarcadores de esteatohepatitis en pacientes con EHGNA. La CK 18 es un producto de degradación resultante de la apoptosis de los hepatocitos mediada por caspasa 3. En el primer estudio, se incluyeron 39 pacientes con EHGNA y valores de CK 18 de 395 U/l los cuales mostraron alta sensibilidad y especificidad para diagnosticar EHNA24. Posteriormente se realizó un estudio de validación incluyendo 139 pacientes con EHNA confirmada con biopsia hepática25. Por el mismo método en un estudio de cohorte multiétnico, la sensibilidad y especificidad de la CK 18 para diagnosticar EHNA fue de 58 y 68%, respectivamente26. Sin embargo, aún no hay un valor de corte establecido y el ensayo no está disponible comercialmente.
Índices de esteatosis hepáticaSe han desarrollado 5 diferentes índices para diagnosticar y cuantificar esteatosis:
- •
SteatoTest: comprende las 6 variables del FibroTest-ActiTest (α 2 macroglobulina, haptoglobina, apolipoproteína A, GGT, bilirrubina total y TGP) más IMC, colesterol total, triglicéridos y glucemia, ajustados por sexo y edad. Un valor de 0,3 tiene una sensibilidad ≥ 85% para diagnosticar hígado graso y un resultado de 0,7 tiene una especificidad de 80%27. Este test ha sido validado con biopsia hepática en 494 pacientes con obesidad severa28.
- •
Fatty liver index (FLI): incluye IMC, circunferencia de cintura, triglicéridos y GGT. Un valor <30 descarta esteatosis con una sensibilidad de 87% y un valor predictivo negativo de 0,2 mientras que un score >60 se considera indicativo de presencia de esteatosis con una especificidad de 86% y un valor predictivo positivo de 4,329. Estos scores fueron validados con ecografía hepática y resonancia magnética nuclear con espectroscopia.
- •
NAFLD liver fat score se construye con 5 variables: SM, diabetes mellitus tipo 2, insulina de ayuno, TGP y ratio TGO/TGP. Un valor de –0,640 predice aumento del contenido de grasa hepática con una sensibilidad del 86% y una especificidad del 71%30.
- •
Lipid accumulation product (LAP) incluye 3 variables: circunferencia de cintura, triglicéridos y género31. En este modelo el incremento en un punto se asoció en un riesgo de 4,28 (IC 95% 3,2 a 5,5) de presentar esteatosis severa (diagnosticada por ecografía).
- •
Hepatic steatosis index (HSI) se basa en 3 variables: ratio TGO/TGP, IMC y diabetes. Un valor <30 tiene una sensibilidad de 93% para diagnóstico de esteatosis y un valor>36 descarta esteatosis con una especificidad de 92% validado por ecografia32.
Se han propuesto también modelos predictivos combinando parámetros clínicos y de laboratorio para diagnosticar EHNA. El NashTest incluye 12 parámetros y tiene un índice de sensibilidad y especificidad por curva ROC de 0,84. Otros modelos predictivos son el NASH diagnostics (citokeratina 18, adiponectina y resistina), Nice model (TGP, citokeratina 18 y la presencia de SM), HAIR (HTA; TGP e IR) y el NASH score (genotipo PNPLA3, TGO e insulina)33,34. Sin embargo, la mayoría de estos scores se estudiaron en poblaciones pequeñas, muy seleccionadas y todavía no han sido validados en grandes grupos poblacionales.
Índices de fibrosis hepáticaLa progresión de la enfermedad hepática no conduce inevitablemente a la fibrosis ya que múltiples factores provocan cambios en el hígado de manera dinámica. La identificación y cuantificación de la fibrosis son clínicamente importantes ya que la fibrosis se asocia con una evolución clínica desfavorable.
Se han desarrollado varios modelos predictivos de fibrosis usando parámetros clínicos y medición de subrogantes del proceso fibrogénico. Entre ellos el NAFLD fibrosis score (NFS) y el enhanced liver fibrosis panel (ELF) son ejemplos de parámetros clínicos y bioquímicos que permiten predecir fibrosis severa en EHGNA con alta exactitud. De ellos, el NFS es el mejor validado. Se calcula utilizando 6 variables (edad, IMC, presencia o ausencia de hiperglucemia, recuento de plaquetas, albúmina y ratio TGO/TGP) que fueron asociadas significativamente con fibrosis severa y/o cirrosis en pacientes con EHGNA confirmada por biopsia. Es útil para identificar pacientes con enfermedad hepática severa que podrían beneficiarse con una biopsia hepática35,36. Un NFS>0,676 identifica la presencia de fibrosis avanzada con una sensibilidad y especificidad de 33 y 98%, respectivamente.
ImágenesLos estudios por imágenes son métodos no invasivos que permiten la evaluación cualitativa y cuantitativa de la grasa hepática37. Entre ellos se encuentran la ecografía, la tomografía computada (TC), la resonancia magnética (RM) y la elastografía.
EcografíaLa ecografía abdominal es el estudio de imágenes utilizado con más frecuencia para identificar hígado graso debido a su gran disponibilidad, seguridad, no invasividad, bajo costo y exactitud en el diagnóstico38. El procedimiento diagnóstico compara la ecogenicidad del riñón derecho con el parénquima hepático. El hígado sin esteatosis muestra una ecoestuctura homogénea similar a la corteza renal y al parénquima esplénico. El hígado graso tiene una ecogenicidad mayor (más brillante) que la corteza renal y el bazo debido a la acumulación intracelular de vacuolas grasas. En la EHGNA también puede observarse hepatomegalia y alteraciones en las estructuras vasculares. Los grados de esteatosis ecográfica se definen cualitativamente con una escala de 4 puntos: grado 0, sin esteatosis; grado 1, leve; grado 2, moderada y grado 3, severa39.
La ecografía es útil para diagnosticar esteatosis de grados 2 y 3 pero es menos efectiva para grado 1. Por otra parte, no permite distinguir entre fibrosis y esteatosis hepática40.
La sensibilidad para detectar esteatosis es del 93% cuando el hígado tiene más de 33% de grasa; diferentes estudios mostraron una especificidad entre 84-95%.
El índice sonográfico hepatorrenal es conocido como el ratio entre el nivel de brillo medio del riñón derecho y el hígado y ha sido sugerido como medida de esteatosis. Un estudio mostró una sensibilidad del 100% y una especificidad del 91% con un valor de corte de 1,49 con esteatosis>5%41.
A pesar de todos los beneficios de la ecografía hepática, la misma tiene sus limitaciones, como el pequeño campo de observación, la sensibilidad limitada en pacientes obesos, la imposibilidad de distinguir el grado de fibrosis, cirrosis o EHNA, la dependencia del operador y del equipo y la baja sensibilidad cuando la presencia de esteatosis es menor a 20-30%.
Tomografía computadaLa evaluación de la esteatosis hepática por TC depende de los valores atenuados denominados unidades Hounsfield (Hus) del parénquima hepático. El mejor método tomográfico para calcular la grasa hepática es la TC sin contraste, que permite una evaluación más cuantitativa de la atenuación hepática. El grado de disminución de la atenuación es el mejor determinante del grado de contenido de grasa hepática42.
La TC tiene una sensibilidad de 82% y una especificidad de 100% para diagnosticar esteatosis hepática cuando el contenido de grasa es ≥ 30%43. Aunque la TC es un método rápido, no operador dependiente, se debe tener en cuenta la radiación a la que se expone a los pacientes. Al igual que la ecografía, la TC es bastante exacta para diagnosticar esteatosis grado 2-3, pero no para detectar esteatosis grado 1. Por otro lado, la atenuación del parénquima hepático puede verse afectada por otros factores, como la presencia de exceso de hierro y glucógeno, drogas como la amiodarona y el metotrexate o hepatitis tóxica aguda y cirrosis44.
Resonancia magnéticaLa resonancia magnética es el método de diagnóstico por imágenes más sensible para detección del incremento de grasa intrahepática. Se ha encontrado buena correlación entre RM e histología en pacientes con EHGNA y puede detectar esteatosis con solo 3% de contenido graso45. El grado de infiltración grasa puede ser calculado con técnicas de cambio químico (CSI) o espectroscopia (MRS). La RM con CSI y con MRS tiene mayor precisión diagnóstica que el ultrasonido y la TC, alcanzando una exactitud cercana al 100%46.
Como desventajas se encuentran el elevado costo y la baja disponibilidad de espectroscopía ya que solo los equipos más modernos tienen este hardware, que se utiliza principalmente en estudios de investigación.
ElastografíaAunque métodos de diagnóstico por imágenes como la ecografía, la TC y la RM pueden evaluar esteatosis hepática, ninguno de ellos puede evaluar fibrosis y EHNA. La evaluación no invasiva de fibrosis y EHNA puede ser realizada midiendo la elasticidad del tejido mediante la velocidad de la onda por ecografía y RM. Para ecografía existen diferentes técnicas: elastografía transitoria, elastografía de onda supersónica y elastografía de impulso de fuerza de radiación acústica (ARFI). La elastografía transitoria (FibroScan) es realizada con pulso ultrasonográfico. Consta de una sonda emisora-receptora que emite dos tipos de ondas: una onda pulsátil vibratoria que penetra en el tejido hepático y una onda de ultrasonidos que capta la velocidad a la que se propaga la primera onda. Puede detectar cirrosis con alta exactitud pero la precisión disminuye en los estadios con menor fibrosis47. Hay estudios que mostraron alta exactitud para distinguir entre fibrosis hepática severa de fibrosis leve, con sensibilidad de 88,9 a 100% y especificidad de 75 a 100%48,49.
El FibroScan también incluye una nueva tecnología conocida como medición de controlled attenuation parameter (CAP) y ha sido propuesto como un método no invasivo para la detección y medición simultánea de esteatosis hepática. El mecanismo de CAP es la reducción de la amplitud de ultrasonido que puede ser estimada ya que esta es amplificada a través del tejido hepático usando los mismos datos de radiofrecuencia utilizados para estimar la rigidez hepática con Fibroscan. La velocidad está reducida cuando hay infiltración grasa50.
La elastografía transitoria (con o sin CAP) ofrece una alternativa no invasiva a la biopsia para la evaluación de esteatosis y fibrosis hepática, debido a su exactitud diagnóstica51. La elastografía con RM es superior a la elastografía transitoria para evaluar fibrosis y tiene la ventaja de que sus resultados no se ven afectados por la obesidad. Tiene muy alto costo y baja disponibilidad52.
Métodos invasivos de diagnóstico (tabla 3)Biopsia hepáticaLa biopsia hepática es el mejor método para diagnosticar, clasificar y predecir la evolución de la esteatohepatitis no alcohólica. Permite descartar la presencia de otras enfermedades hepáticas causales o concomitantes a la esteatohepatitis53. Sin embargo, es un procedimiento invasivo que puede originar graves complicaciones como dolor, sangrado intraperitoneal, hematoma subcapsular, infección y lesión accidental de otros órganos7.
Se debe considerar la realización de una biopsia hepática en las siguientes situaciones:
- -
Pacientes con esteatosis hepática mayores de 60 años, aquellos que tengan historia familiar de diabetes y en los que presenten riesgo elevado de esteatohepatitis tales como síndrome metabólico o factores de riesgo metabólico (diabetes, hipertensión, obesidad central, triglicéridos elevados o colesterol HDL bajo)54.
- -
Pacientes con esteatosis hepática que presenten riesgo elevado de fibrosis avanzada en el laboratorio (relación TGO/TGP>1, hiperbilirrubinemia, coagulopatía, trombocitopenia) o examen físico que evidencie enfermedad hepática avanzada1,42.
- -
Pacientes con sospecha de esteatosis en quienes otras causas de esteatosis hepática y otras enfermedades hepáticas coexistentes no puedan descartarse por otros métodos no invasivos54.
La EHGNA comprende a) solo esteatosis, b) esteatosis con inflamación lobular o portal sin balonización y c) esteatosis con balonización pero sin inflamación. El diagnóstico de EHNA requiere la presencia conjunta de esteatosis, balonización e inflamación lobular55,56. Otras características histológicas que pueden observarse en la EHNA, pero no necesarias para el diagnóstico son: inflamación portal, infiltrados polimorfonucleares, cuerpos de Mallory- Denk, cuerpos apoptóticos, núcleos con vacuolas claras, esteatosis microvacuolar y megamitocondrias.
La clasificación de Brunt es una escala semicuantitativa para determinar grado y estadio de EHNA57 y valora:
- 1)
El grado de esteatosis: 0= no esteatosis; I =<33%; II= 33-66%; III=>66%.
- 2)
La inflamación hepática (esteatosis hepatocelular, balonización e inflamación acinar o portal): 0=ausencia de inflamación; 1=inflamación portal leve; 2=inflamación portal o intraacinar leve a moderada; 3=inflamación lobular y portal mayor al grado 2.
- 3)
Fibrosis hepática: 0=ausencia de fibrosis; 1=fibrosis perisinusoidal/pericelular leve; 2=fibrosis perisinusoidal/pericelular con fibrosis periportal; 3=fibrosis perisinusoidal/pericelular, fibrosis portal y puentes fibrosos; 4=cirrosis.
Basado en la clasificación de Brunt, Kleiner et al. publicaron en 200555 el sistema de puntuación semicuantitativo NAS (NAFLD activity score).
El total de la puntuación del NAS representa la suma de las puntuaciones para esteatosis, inflamación lobular y balonización, y el rango es de 0-8. La clasificación para esteatosis es 0 a 3, para inflamación lobular 0 a 3 y para balonización hepatocelular es 0 a 2. Interpretación: NAS: ≥ 5 diagnóstico de EHNA; NAS: 3-4 posible EHNA; NAS<3 ausencia de EHNA.
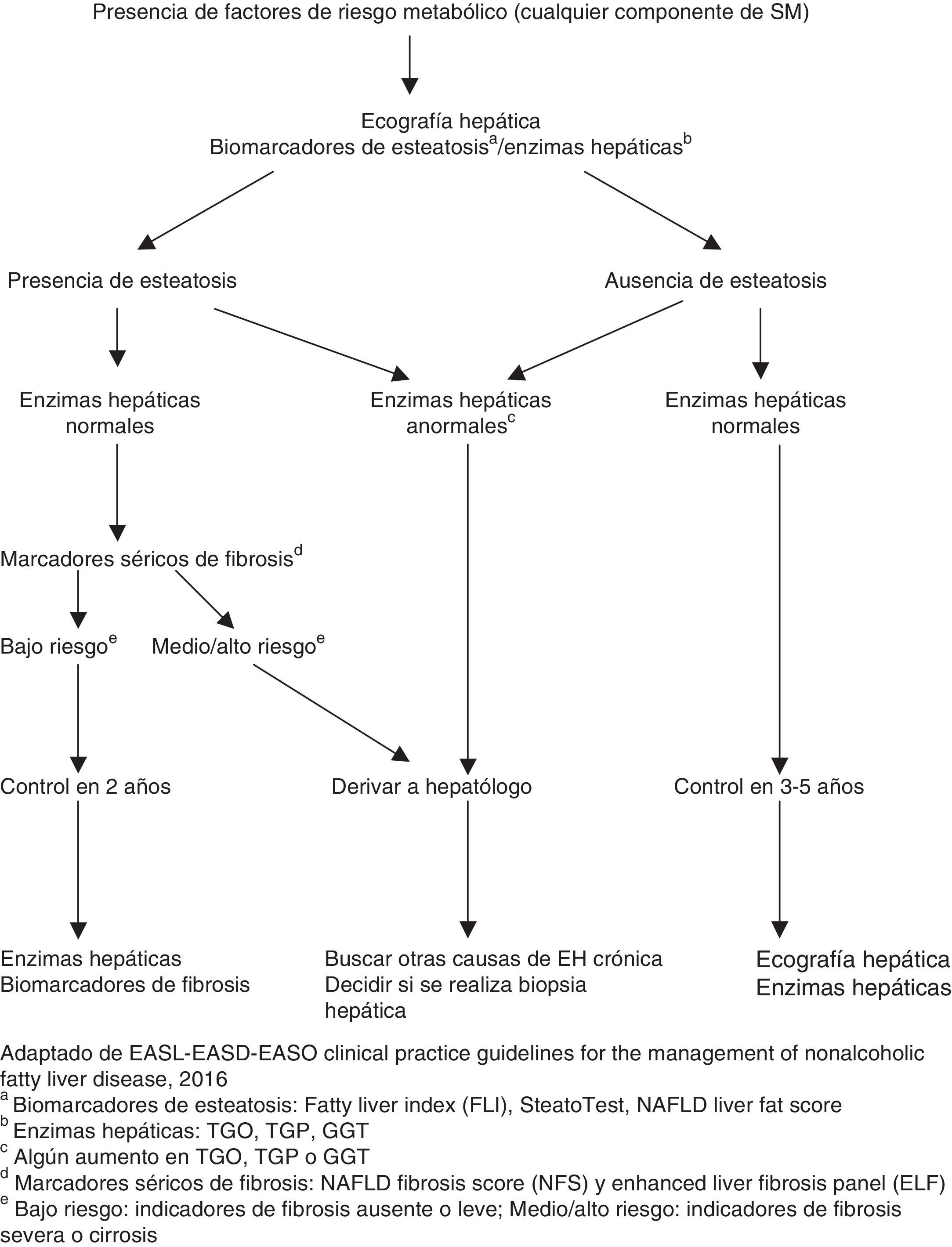
La guía para el manejo de EHGNA de la Asociación Europea para el Estudio del Hígado19 propone utilizar el algoritmo FLIP (fatty liver inhibition of progresión) basado en el score SAF (esteatosis, actividad, fibrosis) para disminuir las variaciones interobservador entre los patólogos, siendo una alternativa con buena reproducibilidad que proporciona una descripción más precisa y completa (fig. 1)58.
Algoritmo de diagnóstico y seguimiento de EHGNA. Adaptada del propuesto por European Association for the Study of the Liver (EASL), European Association for the Study of Diabetes (EASD), (EASO) European Association for the Study of Obesity19.
El aumento de la prevalencia de obesidad y SM condujo a una mayor incidencia de enfermedad hepática severa como fibrosis y/o cirrosis. Este hecho conlleva a la necesidad de conocer el fundamento de diferentes herramientas diagnósticas, sus fortalezas, debilidades y las poblaciones para las cuales cada una es útil.
La evaluación clínica y bioquímica a través de índices como el HSI, FLI o el NAFLD liver fat score permite por su sencillez, bajo costo y buena correlación con las técnicas más complejas, su uso en muestras de estudios epidemiológicos y en la evaluación inicial de los pacientes.
La ecografía es de utilidad para la evaluación inicial por su disponibilidad, pero no permite el diagnóstico en estadios tempranos de la enfermedad, por lo cual –en caso de ser negativa y tener alta sospecha de enfermedad– se debe complementar la evaluación con otros métodos diagnósticos.
La RM con espectroscopía es el método de elección por su sensibilidad y especificidad pero su uso no es costo efectivo.
Finalmente, la biopsia hepática debe ser reservada para indicaciones puntuales debido a que es un método invasivo y conlleva ciertos riesgos, pero permite evitar errores diagnósticos y clasificar correctamente la enfermedad.
La esteatosis hepática puede preceder al diagnóstico de diabetes, hipertensión arterial o dislipidemia; su evaluación resulta fundamental para identificar pacientes de riesgo, no solo de fibrosis y cirrosis hepática, sino también pacientes con mayor riesgo de eventos cardiovasculares. De esta forma, se podrían implementar medidas tempranas de cambios en el estilo de vida que conduzcan a disminuir la morbimortalidad de nuestros pacientes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.