La enfermedad no tiroidea es una entidad que se presenta frecuentemente en los pacientes que se encuentran cursando algún tipo de enfermedad, ya sea crítica o no; y puede manifestarse aun en ausencia de enfermedad tiroidea subyacente, condicionando cambios en el eje tiroideo. Es importante poder reconocer la enfermedad no tiroidea para hacer diagnóstico diferencial con la patología tiroidea verdadera y evaluar si merece ser tratada. Aún no existe consenso acerca de si la enfermedad no tiroidea representa una respuesta fisiológica a una enfermedad sistémica para que disminuyan los requerimientos de energía o si se trata de una condición adaptativa que induce un estado hipotiroideo que finalmente resulta perjudicial a nivel tisular.
Non-thyroidal illness is a disorder that occurs frequently in patients that are experiencing some kind of illness, whether critical or not. It can manifest even in the absence of thyroid dysfunction, leading to changes in the thyroid axis. It is important to detect Non-Thyroidal Illness in order to establish a differential diagnosis with the true thyroid disease and to determine whether treatment is required. Currently, there is still no consensus on whether Non-Thyroidal Illness is a physiological response to a systemic disease to reduce energy requirements or whether it is an adaptive condition that induces a hypothyroid state that ultimately is harmful at the tissue level.
La enfermedad tiroidea es una entidad muy frecuente en la población general, hasta el 50% de las personas en la comunidad tienen nódulos microscópicos, el 3,5% tiene carcinoma papilar oculto, el 15% tiene bocio palpable, el 10% demuestra un nivel de tirotropina (TSH) anormal y el 5% de las mujeres tienen hipotiroidismo o hipertiroidismo1. Por lo tanto, también la patología tiroidea es prevalente en los pacientes internados en quienes además existe la enfermedad no tiroidea (ENT), que se caracteriza por cambios del eje tiroideo en pacientes que están cursando algún tipo de enfermedad y cuyo significado no está aclarado aún.
Es habitual la solicitud de interconsulta al servicio de Endocrinología por alteraciones del perfil tiroideo durante la hospitalización, siendo la ENT la entidad más frecuente que se evidencia en los pacientes internados por patología crítica (44%2 al 70%3, según diferentes series) y no crítica. Por lo tanto, es importante poder reconocerla y definir si es un estado adaptativo o no, y si merece ser tratado.
La ENT puede afectar a pacientes con y sin enfermedad tiroidea subyacente. Existe controversia acerca de si la misma representa una respuesta fisiológica a una enfermedad sistémica, haciendo que disminuyan los requerimientos de energía o de si se trata de una condición adaptativa que induce un estado hipotiroideo que es dañino a nivel tisular. Lo que es sabido es que la ENT es un factor de riesgo independiente de mortalidad4, pero eso no explica si su relación es causal.
El objetivo de este trabajo es analizar las modificaciones en el eje hipotálamo-pituitario- tiroideo (HPT) en la enfermedad crítica tanto aguda como crónica, discutir los aspectos diagnósticos, así como su distinción de los trastornos primarios graves de la tiroides en pacientes en la Unidad de Cuidados Intensivos (UCI), y finalmente, plantear si el tratamiento de la misma resultaría o no beneficioso. Las perspectivas a futuro permitirán dilucidar si dicha intervención modificaría el pronóstico del paciente internado.
GeneralidadesLas modificaciones dentro del eje HPT se caracterizan típicamente por la presencia de bajos niveles de triyodotironina total (T3), dando lugar al término «síndrome de T3 baja». Pacientes enfermos con baja T3 sérica son considerados como clínicamente eutiroideos, y como consecuencia surge la expresión «síndrome del eutiroideo enfermo». Sin embargo, «enfermedad no tiroidea» es actualmente el término que se utiliza más comúnmente para describir los cambios típicos en las concentraciones de hormona tiroidea (HT) que pueden surgir después de cualquier enfermedad aguda o crónica que no es causada por una anormalidad intrínseca en la función de la tiroides5.
Fisiopatología de la enfermedad no tiroideaVarias explicaciones conceptuales de la ENT han sido descriptas en la literatura6: a) las alteraciones de la HT en suero se deben a los inhibidores de las proteínas de unión a tetrayodotironina (T4), y las pruebas no reflejan adecuadamente los niveles de hormonas libres; b) en la ENT, los niveles de T3 en la pituitaria son normales debido a una preservación de la desyodación local de T4 a T3 y, en este sentido, la pituitaria se encuentra en estado eutiroideo, mientras que el resto del cuerpo hipotiroideo; c) los niveles séricos de hormonas son bajos, y los pacientes son bioquímicamente hipotiroideos, pero esta es una respuesta fisiológica beneficiosa y no debe ser alterada por el tratamiento con HT; d) por último, la ENT es en parte una forma de hipotiroidismo secundario, los niveles hormonales séricos y tisulares del paciente son realmente bajos objetivándose un hipotiroidismo, siendo esto probablemente perjudicial para el paciente, y la terapia podría iniciarse si los niveles de T4 en suero están por debajo de 4μg/dl.
Clasificación de la enfermedad no tiroideaPeeters et al.7 diferenciaron la enfermedad en fase aguda y fase crónica, teniendo en cuenta si la duración de la misma fue mayor o menor a 5 días.
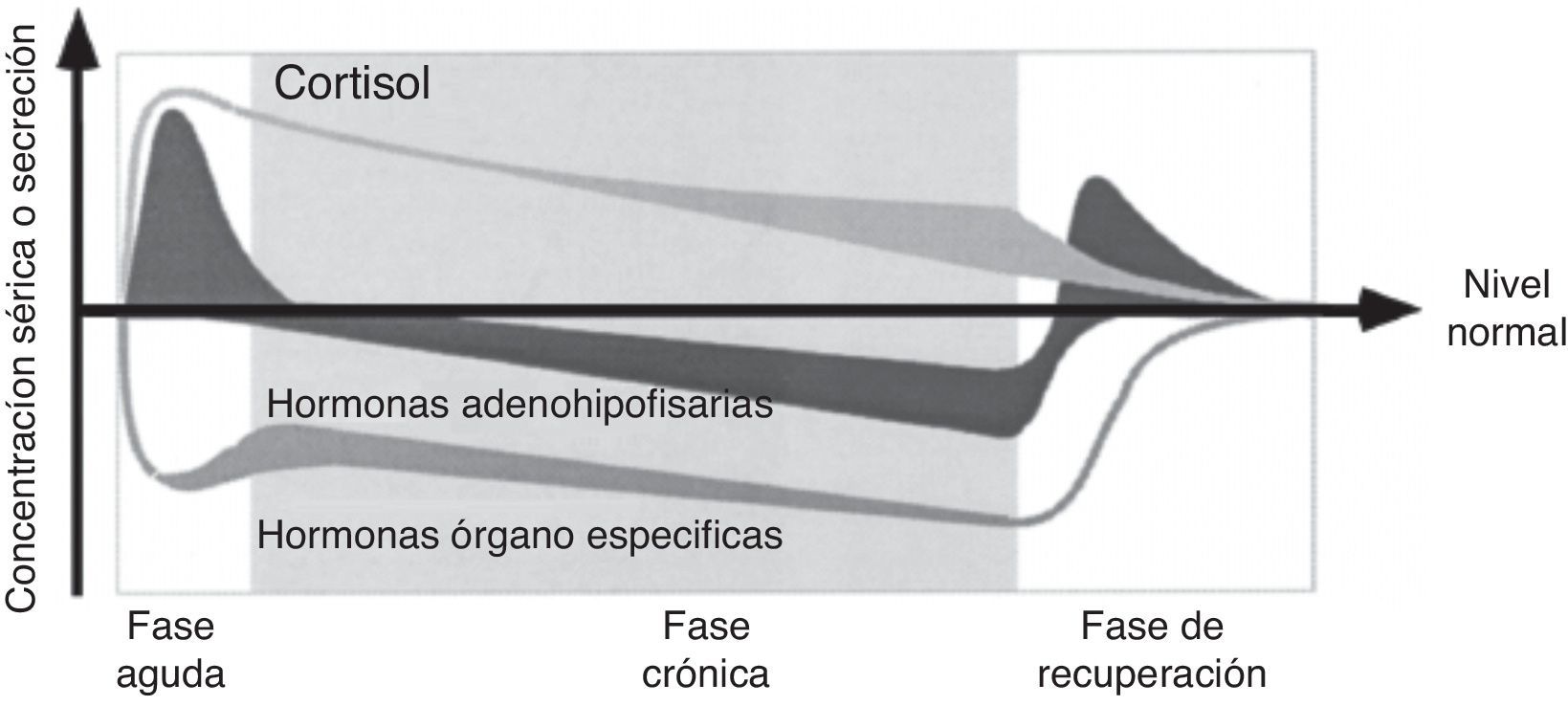
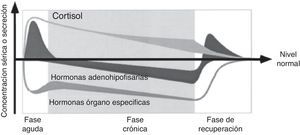
La fase aguda de la enfermedad crítica se caracteriza principalmente por una secreción activa de la glándula pituitaria y una inactivación periférica o inactividad de las hormonas anabólicas. En contraste, la enfermedad crítica prolongada se caracteriza por una función neuroendocrina reducida y la recuperación por la restauración de la sensibilidad de la pituitaria anterior para el control de la retroalimentación disminuida (fig. 1)8.
Concepto simplificado de los cambios dependientes de la hipófisis en el curso de la enfermedad crítica.
Adaptado de van den Berghe et al.8.
Es claro que el nombre ENT durante la enfermedad crítica se refiere a un síndrome con diferentes facetas. La opinión común es que mientras que los cambios observados durante la fase aguda de la enfermedad son beneficiosos, pueden llegar a ser perjudiciales durante la enfermedad crítica prolongada, por lo que la etapa y la gravedad de la enfermedad son un determinante importante de la ENT9.
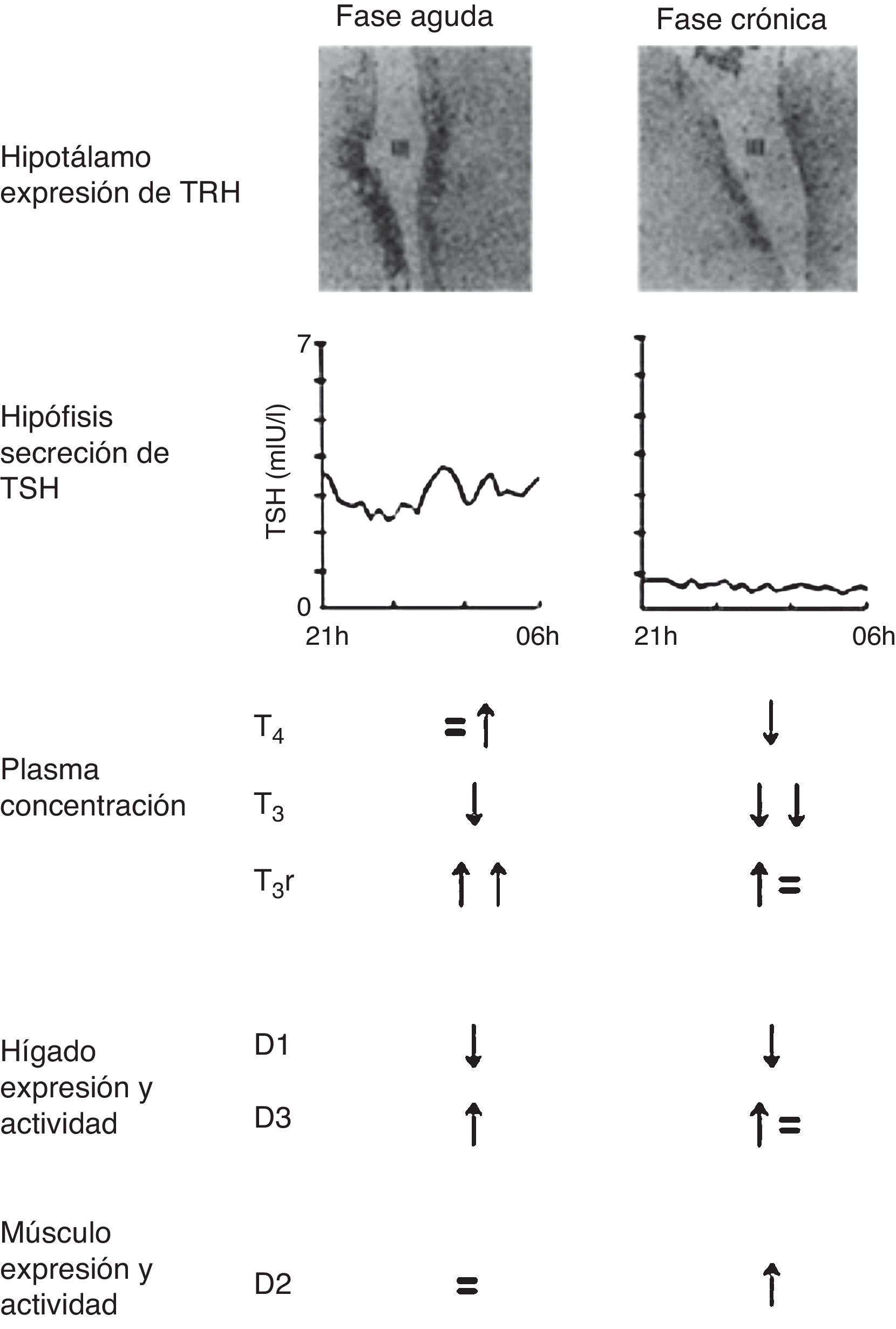
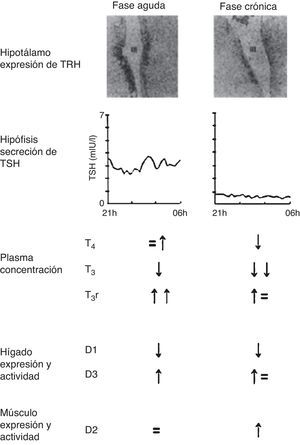
Cambios en el eje hipotálamo-pituitario-tiroideoFase aguda de la enfermedad críticaEsta fase se encuentra dominada por los cambios en la unión de la HT, su captación periférica y alteraciones en la expresión y la actividad de la deiodinasa tipo i (D1) y la deiodinasa tipo iii (D3)10. Se ha demostrado recientemente que al menos parte de estos cambios agudos se logran mediante la restricción concomitante de macronutrientes. Esto resulta en una muy rápida disminución de la cantidad circulante de T3, mientras que las concentraciones plasmáticas de T3 reversa (T3r) aumentan de forma aguda (fig. 2)11. La magnitud de la disminución de la T3 circulante durante las primeras 24 h después de la aparición de la enfermedad aguda refleja la gravedad de la misma y se correlaciona con mortalidad12. Concomitantemente, hay un breve aumento en los niveles de T4 y TSH. La TSH sérica posteriormente regresa a valores normales a pesar de la continua disminución en los niveles de T3, lo que podría ser indicativo de una alteración del punto de ajuste para la retroalimentación dentro del eje HPT13. Los cambios en el eje tiroideo durante la enfermedad crítica aguda están presentes de manera uniforme en todos los tipos de enfermedades agudas y, como ya se ha mencionado, podrían interpretarse como una respuesta beneficiosa y adaptativa14.
Cambios en el eje tiroideo central y periférico en la fase aguda vs la fase crónica de la enfermedad crítica.
Adaptado de Van den Berghe11.
En pacientes en estado crítico prolongado los niveles de T3 circulantes disminuyen aún más y los niveles de T4 comienzan a declinar13. La magnitud de la disminución de las concentraciones plasmáticas de la HT generalmente representa la gravedad de la enfermedad y se asocia con el pronóstico, correlacionando inversamente con la tasa de mortalidad15. A pesar de la T3 sérica baja, y en casos severos también baja T4, los niveles de TSH no incrementan, sino que siguen encontrándose dentro del rango normal o disminuido, con una pérdida de la pulsatilidad nocturna. Esto sugiere que en la fase crónica de la enfermedad crítica los pacientes desarrollan una disfunción neuroendocrina adicional (fig. 2)11, caracterizada por la expresión hipotalámica suprimida de hormona liberadora de tirotropina (TRH), lo que resulta en una menor estimulación de los tirotropos, tras lo cual la liberación de HT se ve afectada14. Durante la enfermedad crítica prolongada, y en presencia de una nutrición adecuada, varias respuestas tisulares podrían interpretarse como compensación a la baja disponibilidad de HT, tales como aumento de la expresión de los transportadores monocarboxilados, la regulación positiva de la actividad de la deiodinasa tipo ii y aumento de la sensibilidad a nivel del receptor16. Dado que en la actualidad muchos pacientes críticos presentan una sobrevida prolongada gracias al advenimiento de nueva tecnología, cabe replantearse si las respuestas hormonales que ocurren en la fase crónica de la ENT realmente consisten en una respuesta adaptativa seleccionada por «naturaleza». Esto plantearía el interrogante acerca de si los niveles circulantes bajos de T3 son protectores en la fase prolongada de la enfermedad grave, o más bien contribuyen a los problemas clínicos, siendo un tema controversial hasta el día de la fecha.
Cambios neuroendocrinos del eje tiroideo durante la enfermedad críticaComo ya fue mencionado, la reducción de la producción de HT puede tener un origen neuroendocrino por una expresión de TRH suprimida. Esto se fundamenta en que la infusión de factores hipotalámicos en estos pacientes críticos puede reactivar el eje tiroideo elevando la secreción de TSH y así aumentar los bajos niveles de T4 y T3 circulantes nuevamente al rango normal. Lo descripto ha sido demostrado sobre todo en la fase prolongada de la enfermedad crítica17; observándose además una respuesta anabólica11.
Cambios periféricos del eje tiroideo durante la enfermedad críticaAunque la HT puede ejercer algunas acciones no genómicas rápidas18, los principales efectos son producidos por la interacción de la T3 con receptores nucleares con el fin de estimular o inhibir la transcripción de los genes regulados por la HT19. Sin embargo, la HT tiene que ser transportada a través de la membrana celular y una vez dentro de la célula puede ser metabolizada por las yodotironinas deiodinasas. El transporte periférico, el metabolismo y la unión al receptor de HT son todos los pasos esenciales para la acción normal de la HT. La reducción de la D1 y la reactivación de la D3 resultan en la caída de la activación e incremento de la inactivación de las HT en los pacientes críticamente enfermos20. Se han documentado dichos cambios en todos estos pasos en los tejidos periféricos de pacientes en estado crítico agudo20-22. Durante la enfermedad crítica prolongada, las alteraciones periféricas persisten, pero la supresión neuroendocrina de la liberación de T4 por la tiroides se convierte en la característica predominante, tal como ya fue mencionado8.
Evaluación de la función tiroidea durante la enfermedadLa evaluación de los parámetros de función tiroidea en enfermedades sistémicas y estrés es compleja, ya que los cambios se producen en todos los niveles del eje HPT4.
Idealmente, la función tiroidea no debería solicitarse durante el transcurso de enfermedades agudas o crónicas, pero en la práctica no siempre se omite la solicitud de HT en estas situaciones, por lo cual los resultados obtenidos deben interpretarse con cautela y sospechar la existencia de ENT más que una verdadera disfunción tiroidea.
TriyodotironinaLa disminución de T3 sérica es la manifestación tiroidea más común de la ENT4; sin embargo, la prevalencia de una baja T3 libre en la enfermedad depende de la metodología utilizada23. La actividad de la enzima D1 en el hígado estaría reducida en la enfermedad grave y esto es sin duda un importante contribuyente a la baja T3 en sangre. Los pacientes que tienen una pequeña caída de T3 en suero, que representa la forma más leve de la ENT, no muestran signos clínicos de hipotiroidismo. Tampoco se ha demostrado que esta disminución de T3 en suero (en ausencia de una caída de T4) tenga un efecto adverso o se asocie con aumento de la mortalidad6.
Triyodotironina reversaLa T3r se encuentra normal o elevada en la ENT y no es un indicador fiable de un suministro anormal de HT. A pesar de que suele esperarse que la T3r se eleve por inducción de la D3, esto no siempre ocurre, y de hecho más comúnmente se encuentra dentro del rango normal, ya que el complejo enzimático para la desyodación de T4 a T3r se reduce. Por el contrario, la degradación de T3r a T2 también se reduce por disminución de la función de la misma enzima D1 que genera T3. Por otro lado, la formación de T3r está limitada por el bajo nivel de sustrato (T4) en el suero y en los tejidos, y por inhibición de la entrada de T4 a las células. Según de Groot24, el tratamiento de pacientes con ENT muestra que cuando se administra T4, se replecionan los niveles de hormonas en suero, con aumento rápido de la generación de T3r, elevándose sus niveles de forma significativa.
TetrayodotironinaEn general, la disminución de T4 se ve en la ENT y puede deberse a la supresión hipotálamo-hipofisaria, la alteración en la captación de yodo, el metabolismo periférico anormal o la disminución de la unión a proteínas transportadoras, tales como la globulina fijadora de tiroxina debido a la escisión de la misma por la proteasa, lo que provoca una pérdida de su actividad de unión a T425. Los niveles séricos de T4 se reducen en la ENT en proporción a la gravedad y duración de la enfermedad26-28.
Tetrayodotironina libre e interferencias en su mediciónUn problema importante en la comprensión de la ENT es en el análisis de datos sobre el nivel de T4 libre, hormona disponible para los tejidos, aunque es la T3 intracelular la que se une a los receptores. Los resultados de los ensayos de T4 libre en la ENT son definitivamente dependientes del método. Ellos pueden estar influidos por diversas variables, incluyendo inhibidores presentes en el suero o el efecto de agentes tales como fármacos, metabolitos o ácidos grasos libres en el suero o el ensayo29. Por lo tanto, la T4 libre puede aparecer baja, normal o elevada, incluso en la misma muestra en función del método de ensayo5.
TirotropinaLa TSH sérica en la ENT suele estar normal o reducida y puede estar marcadamente baja20,27,28. Estos niveles de TSH son inadecuados para la T4 y T3 sérica observada.
Algunos pacientes se encuentran con un nivel de TSH por encima de lo normal y esta elevación ocurre comúnmente de forma transitoria si los pacientes se recuperan de la ENT6. A pesar de los problemas inherentes en la interpretación de la concentración de TSH sérica en pacientes con ENT, sigue siendo la única y mejor prueba para discernir los individuos eutiroideos de aquellos con hiper o hipotiroidismo. El resultado de la prueba debe interpretarse en el contexto de la historia clínica, el examen físico y la administración de agentes farmacológicos30. La discriminación entre un verdadero hipotiroidismo y la ENT es difícil, pero observar el espectro completo de los cambios de la HT y niveles de TSH puede ayudar a diferenciarlos (tabla 1)14.
Esquema simplificado de las alteraciones en los parámetros de hormonas tiroideas en el hipotiroidismo primario, hipotiroidismo central y la enfermedad no tiroidea
| Hipotiroidismo primario | Hipotiroidismo central | ENT | |
|---|---|---|---|
| T4 | Baja | Baja | Normal o baja |
| T3 | Baja o normal/baja | Baja o normal/baja | Baja |
| T3r | Baja o normal | Baja o normal | Elevada o normal |
| TSH | |||
| Muestra única | Elevada | Baja o normal | Normal |
| Secreción pulsátil | Elevada | Baja | Baja |
Adaptado de Mebis y van den Berghe14.
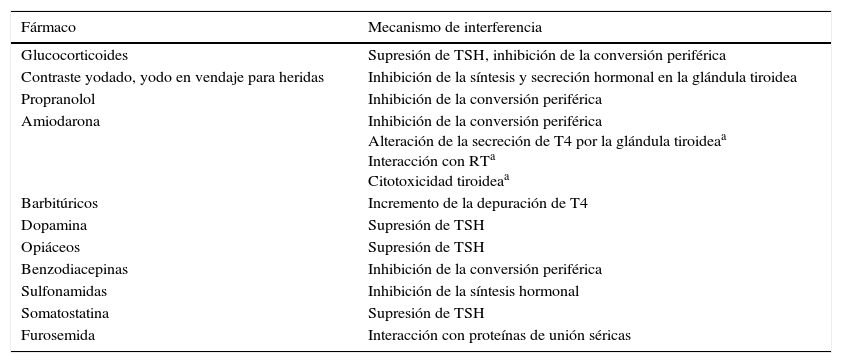
En la UCI, se utiliza una amplia variedad de fármacos que pueden interferir con la fisiología normal de la HT (los más importantes se enumeran en la tabla 2)16,31. Los fármacos pueden interferir con la función tiroidea en diferentes niveles: unión de la HT, el metabolismo, el transporte, la producción y la secreción tiroidea de T4 y la regulación de la secreción de TSH por la hipófisis. Los agentes farmacológicos administrados a pacientes que tienen una enfermedad sistémica pueden confundir la interpretación de las pruebas de la función tiroidea4.
Medicamentos que se utilizan frecuentemente en la UCI y que interfieren con la economía de la HT
| Fármaco | Mecanismo de interferencia |
|---|---|
| Glucocorticoides | Supresión de TSH, inhibición de la conversión periférica |
| Contraste yodado, yodo en vendaje para heridas | Inhibición de la síntesis y secreción hormonal en la glándula tiroidea |
| Propranolol | Inhibición de la conversión periférica |
| Amiodarona | Inhibición de la conversión periférica Alteración de la secreción de T4 por la glándula tiroideaa Interacción con RTa Citotoxicidad tiroideaa |
| Barbitúricos | Incremento de la depuración de T4 |
| Dopamina | Supresión de TSH |
| Opiáceos | Supresión de TSH |
| Benzodiacepinas | Inhibición de la conversión periférica |
| Sulfonamidas | Inhibición de la síntesis hormonal |
| Somatostatina | Supresión de TSH |
| Furosemida | Interacción con proteínas de unión séricas |
Adaptado de Mebis y van den Berghe16.
Durante la fase aguda de la enfermedad, los cambios que ocurren son seleccionados por la naturaleza, conservados a través de la evolución y pueden ser beneficiosos, por lo que no justifica ninguna intervención. Por otro lado, los pacientes con enfermedad crítica prolongada, tal vez deberían considerarse de manera diferente, ya que la condición de cuidado prolongado e intensivo no puede ser una circunstancia para la cual las respuestas se hayan seleccionado por naturaleza, sino que fue creada en las últimas 4 décadas, con el desarrollo de la medicina intensiva moderna con técnicas que han hecho posible mantener a los pacientes vivos que no hubiesen sobrevivido de otro modo. Estos pacientes pueden entrar en una fase prolongada de la enfermedad grave y los cambios hormonales asociados pueden no ser necesariamente ventajosos16. Obviamente, el objetivo de un tratamiento en estos casos no sería el de curar a los pacientes críticamente enfermos con ENT, sino contribuir de alguna manera a su recuperación de la enfermedad crítica. Teóricamente, si los pacientes con ENT se encuentran en realidad hipotiroideos, la normalización de los niveles de HT circulantes podría revertir al menos algunas de las anomalías que tienden a acompañar al hipotiroidismo y no tienen otra explicación evidente3. Por lo tanto, surge la pregunta de si tratar de intervenir y normalizar los parámetros anormales de HT en pacientes con enfermedades prolongadas y, si es así, cómo debería realizarse el tratamiento16.
De todos los cambios durante la ENT, la disminución inducida por la inanición en los niveles de T3 en suero es la más claramente ligada a una respuesta de adaptación a fin de preservar la reserva de proteína total del cuerpo. La privación calórica es el factor inhibidor más común de la D1, los niveles de T3 en suero disminuyen y los de T3r aumentan dentro de las 24 h del inicio de un ayuno. La intervención temprana con la nutrición parenteral puede prevenir completamente el desarrollo de la ENT. Sin embargo, el apoyo nutricional no es sencillo y es controversial32,33.
Por otro lado, existen muy pocos estudios clínicos diseñados para investigar si el reemplazo hormonal es ventajoso, y si es así, cuál preparación (T3 o T4) se debe utilizar. La mayoría de los estudios han mostrado que la administración de T4 o T3 puede ser segura y bien tolerada34,35. Se podría argumentar que debido al incremento de D3 y reducción de D1 en estos pacientes, ni T4 ni T3 son una terapia apropiada debido a la conversión preferencial de T4 a T3r (en lugar de T3) o a la degradación de T324. Además, la infusión prolongada de T3 por sí sola no es ideal, ya que esto tendría riesgo de supresión de la producción endógena de T4, debido a la retroalimentación negativa14. En contraste, y debido a la alta tasa de mortalidad en pacientes en la fase crónica de la ENT con valores de T4 menores a 4μg/dl, se ha indicado que este debe ser considerado un grupo ideal para la administración de HT. En este grupo de pacientes, no parece haber ninguna contraindicación evidente para la terapia de reemplazo, con la posible excepción de aquellos que tienen descompensación cardíaca o arritmias. Incluso en este caso, la evidencia es incierta36. A pesar de algunos trabajos prometedores en modelos humanos y animales, no existe hasta el momento ninguna evidencia convincente para el uso de reemplazo de HT en cualquier paciente con ENT5.
Alternativamente al reemplazo con HT, el tratamiento con péptidos liberadores hipotalámicos puede ser una mejor estrategia, ya que se ha demostrado que la infusión de TRH en pacientes en estado crítico podría reactivar el eje tiroideo estimulando la producción de TSH y la liberación de HT, siendo eficaz en el aumento de los niveles de HT durante el tratamiento a corto plazo. Estos datos son un fuerte apoyo (aunque no una prueba) para el papel de la función hipotalámica disminuida como un factor crucial en la ENT. Curiosamente, cuando la TRH es coinfundida con secretagogos de la hormona de crecimiento (GH) se evitaría un aumento de T3r en la circulación14. De esta forma, se mantendría la retroalimentación negativa ejercida por las HT a nivel de la pituitaria, evitando la sobreestimulación innecesaria del eje tiroideo, por lo que sería un tratamiento potencialmente más seguro que la administración de T337, siendo más fisiológico que reemplazar el déficit de hormona periférica38. Este enfoque para el reemplazo en pacientes críticamente enfermos ha sido indicado por van den Berghe et al.39,40, quienes utilizaron una infusión continua de TRH junto con un secretagogo de GH, restaurando con éxito la concentración tanto de HT como de TSH, y encontraron mejoría en los parámetros catabólicos, con preservación de la pulsatilidad, capacidad de respuesta periférica, e inhibición de la retroalimentación, sin afectar el cortisol sérico. La coadministración de hormona liberadora de GH (GHRP)-2, TRH y hormona liberadora de gonadotropina reactivó los ejes GH, TSH y hormona luteinizante en hombres con enfermedad crítica prolongada y evocó beneficiosos efectos metabólicos que estuvieron ausentes con infusión de solamente GHRP-2 y parcialmente presentes con GHRP-2+TRH24. La respuesta de secreción de GH endógena delinea aún más el paradigma fisiopatológico distinto de la fase crónica de la enfermedad crítica, a diferencia de la fase aguda, que se cree que es principalmente una condición de resistencia a GH8. Estos datos ponen de relieve la importancia de corregir las múltiples deficiencias hormonales en pacientes con enfermedad crítica prolongada para contrarrestar el estado hipercatabólico.
Otra posibilidad será investigar el tratamiento con TSH recombinante humana (TSH rh), porque este es un estímulo fisiológico, similar a la TRH, para la liberación de HT. Un estudio piloto demostró que una dosis baja al día de TSH rh (30μg) en pacientes con hipotiroidismo central fue suficiente para aumentar la concentración de TSH plasmática al rango normal. Por otra parte, este tratamiento mejora la calidad de vida y el sueño de los pacientes41. Aún falta investigar si este enfoque puede ser utilizado en pacientes en la UCI con ENT para normalizar la TSH y HT, y si este tratamiento puede mejorar los resultados clínicos.
Enfermedad no tiroidea en el paciente internado no críticoLa bibliografía revisada se centró en la prevalencia de la ENT y su papel pronóstico en la UCI. Los pacientes enfermos no críticos fuera de la UCI estarían menos estudiados, a pesar de que constituyen la gran mayoría de la población hospitalizada. En este trabajo, se hará una mención especial del adulto mayor hospitalizado no crítico ya que la U.A. Dr. César Milstein, solo atiende a pacientes adultos mayores, y recientemente hemos realizado un estudio para evaluar el valor del nivel de TSH en la incidencia de mortalidad de los pacientes adultos mayores hospitalizados.
Adultos mayores hospitalizadosA medida que envejecemos, los niveles séricos de la HT se modifican. La concentración sérica de T3 tiende a disminuir, mientras que la de T4 permanece sin cambios42. Con respecto a la TSH, la literatura es controvertida. Según algunos autores, los valores de TSH pueden ser menores en los adultos mayores que en el conjunto de la población43. Sin embargo, se ha informado que el envejecimiento desplaza la curva de distribución de TSH y el percentil 97,5 hacia mayores concentraciones44. Todas estas modificaciones crean una gran desventaja para la correcta evaluación e interpretación del estado tiroideo, a través de las determinaciones de las concentraciones hormonales, en adultos mayores.
Es sabido que la ENT es un desorden común en pacientes hospitalizados y que se incrementa con la edad. Ha sido descripta en el 62% de los pacientes hospitalizados por enfermedad crítica en octogenarios45 y en un 66% de pacientes hospitalizados mayores a 60 años46. La prevalencia de alteraciones en las pruebas tiroideas de laboratorio (PTL), incluso sin enfermedad tiroidea previa, es muy alta. Si bien el diagnóstico de hipotiroidismo se concreta en un 2-3% de esta población47, la ENT es el principal hallazgo. Iglesias et al.48 reportaron que entre el total de alteraciones de TSH y/o de las HT en pacientes mayores hospitalizados (74,3%), la mayor parte se encontraba relacionada con la presencia de ENT (62,2%). En contraste, Tognini et al.49, habiendo excluido a aquellos pacientes en la UCI, reportaron una prevalencia de ENT del 31,9% entre 301 adultos mayores hospitalizados, notablemente mayor a la serie reportada por Bossoni et al.50, con una prevalencia entre el 11 y el 18%. Una explicación de esta diferencia es la edad de los pacientes del estudio49 (edad media: 81 años), ya que puede haber una reducción progresiva de la T3 sérica a medida que se incrementa la edad. De tal forma, la ENT es muy común en pacientes añosos hospitalizados con enfermedad aguda, siendo un predictor independiente muy sensible de sobrevida a corto plazo. A pesar de que se ha descripto mayor mortalidad hospitalaria en pacientes con ENT48,49, no está claro si la misma es responsable de este fenómeno o si solo representa un marcador de peor pronóstico51. Dado el incremento de pacientes añosos hospitalizados, a pesar de que las guías actuales no lo justifiquen, la determinación de T3 podría colaborar en la valoración del pronóstico a corto plazo. Por otro lado, el hipotiroidismo podría desempeñar un papel perjudicial en la evolución de los adultos mayores que se internan por alguna otra causa. Sin embargo, recientemente se ha indicado que el hipotiroidismo verdadero, en los adultos mayores hospitalizados, podría ser un marcador de buen pronóstico52, por lo tanto, se podría esperar que los pacientes con TSH elevada durante la internación presenten mejor evolución. Sin embargo, no hay datos disponibles acerca del valor pronóstico que tendrían las pruebas de la función tiroidea durante el período de hospitalización en un adulto mayor. En contraste con esta hipótesis, recientemente hemos observado en un estudio piloto en nuestra institución que valores incrementados de TSH podrían estar relacionados con una peor evolución en adultos mayores hospitalizados. Esta clara controversia es en parte debido a la falta de estudios respecto al valor pronóstico de las PTL, la cual es atribuible a que la evaluación de la función tiroidea no está recomendada, y no es una práctica de rutina en pacientes ancianos hospitalizados47,53. En la actualidad, pese a la alta incidencia de alteraciones en la función tiroidea, a no ser que haya una razón clínica específica para sospechar que la disfunción tiroidea pueda estar contribuyendo a la condición clínica, las PTL deben retrasarse hasta la resolución de la enfermedad54. Sin embargo, si el hipotiroidismo o la ENT tuviesen un impacto detrimental sobre la sobrevida de estos pacientes, se podría plantear en individuos adultos mayores internados, la determinación de PTL en forma universal y, a su vez, de acuerdo con los resultados, considerar una conducta terapéutica de reemplazo hormonal diferente de la actual, que es puramente expectante.
Experiencia sobre el valor pronóstico del aumento de tirotropina en el adulto mayor hospitalizado en una institución de adultos mayoresEn nuestra institución, realizamos recientemente un estudio para evaluar el valor del nivel de TSH en la incidencia de mortalidad de los pacientes adultos mayores hospitalizados. El estudio fue de tipo prospectivo, de cohorte. Para esto, incluimos a todos los pacientes mayores de 60 años ingresados al Servicio de Clínica Médica entre enero del 2013 y del 2014, y se excluyó a aquellos que ingresaron de forma directa a unidad coronaria o de cuidados intensivos, o aquellos que no presentaban el consentimiento informado. Inicialmente, se incluyó a un total de 451 pacientes, a los cuales en el día 1 se les determinó el perfil tiroideo (TSH, T4, T3 y ATPO) y una rutina de laboratorio. Entre el día 1 y el día 8 se fueron de alta o fallecieron 256 pacientes. A los 195 pacientes restantes se les realizó una determinación del perfil tiroideo en el día 8 de internación. Se realizaron las determinaciones en estos días considerando la fase aguda (menor a 5 días de internación) y crónica (mayor a 5 días de internación) de la ENT. Se realizó seguimiento a lo largo de toda la internación, evaluando como evento primario la mortalidad. Las comorbilidades fueron evaluadas a través de los días de internación en la UCI, internaciones previas, antecedentes de enfermedad tiroidea, medicación al ingreso y el score de comorbilidades ACE-27.
Con respecto a los resultados, y comparando entre el grupo que permaneció internado y el que solo fue evaluado al inicio, pudimos dilucidar que aquellos pacientes con evaluación en el día 8 (n=195) mostraron niveles de T3 más bajos (41 [40-52] vs. 49 [40-59] ng/dl, p<0,05), mayor requerimiento de cuidados intensivos (12% vs. 1%, p<0,05) y mayor mortalidad (15% vs. 7%, p<0,05) que aquellos pacientes sin evaluación en día 8 (n=256). Esto era de esperar, por haber presentado internaciones más prolongadas.
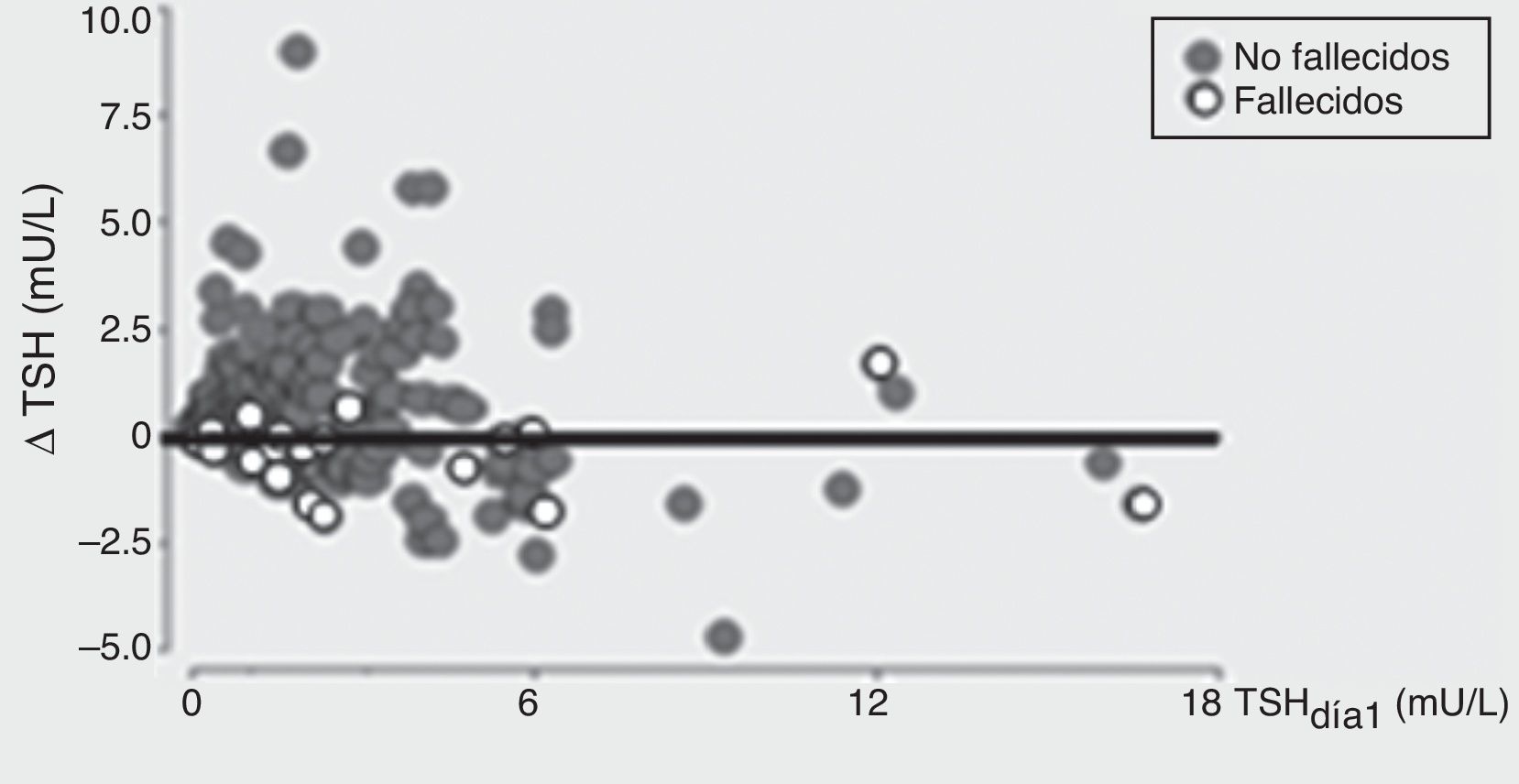
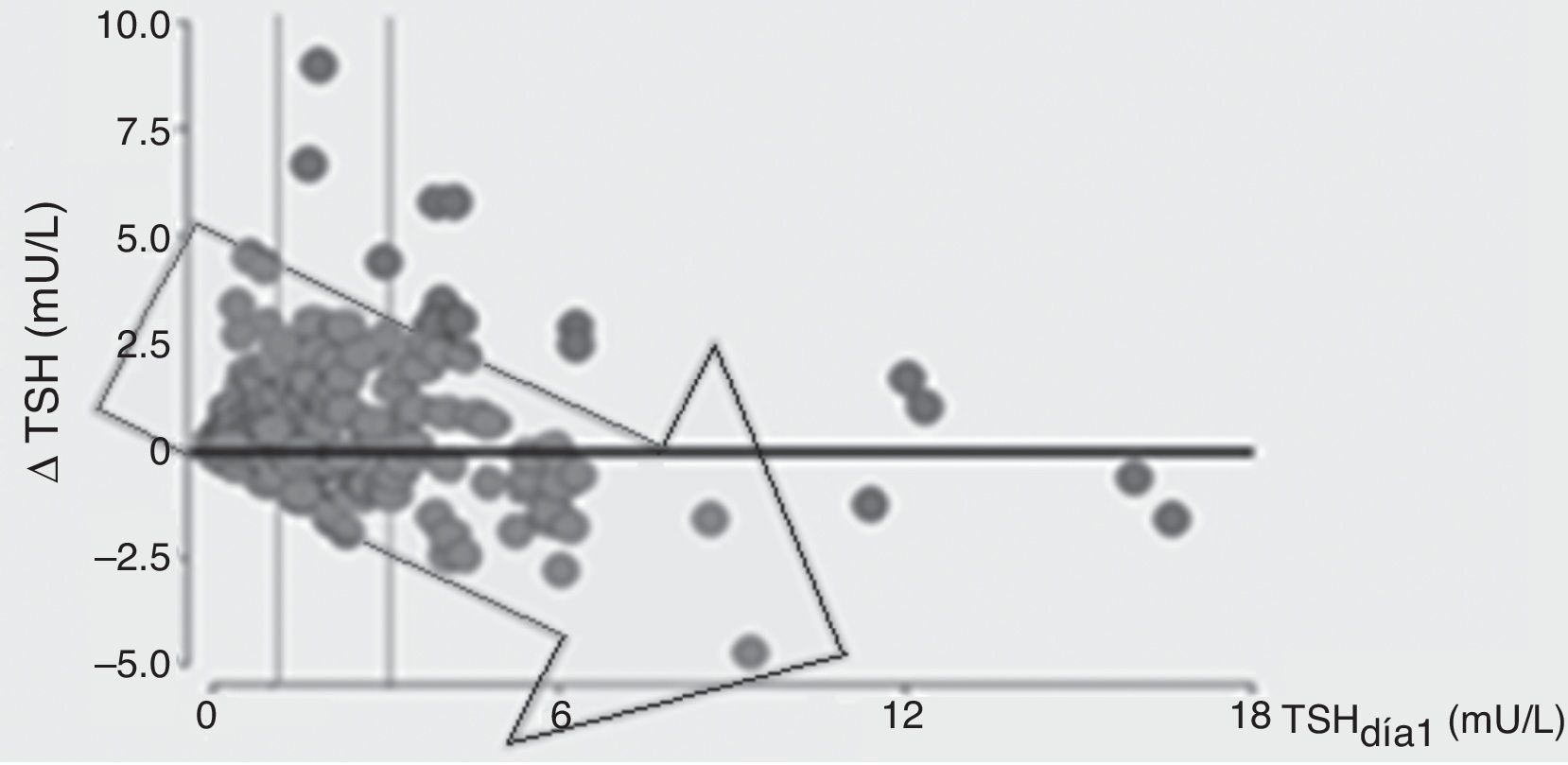
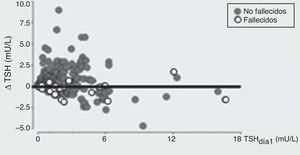
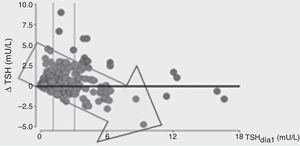
En el grupo que permaneció internado, se demostró que un aumento tanto de TSH como de T4 se asoció independientemente a un menor riesgo de mortalidad (fig. 3). Los cambios de TSH entre el día 8 respecto al día 1 fueron evaluados como delta de TSH (Δ TSH). Los pacientes con menor Δ TSH tuvieron mayor mortalidad. Podemos afirmar que para nuestro trabajo este Δ resultó ser un excelente predictor de mortalidad y quisimos ver cuál era la variable que se asociaba a dicho cambio de niveles de TSH sérica, y pudimos observar que los niveles elevados de TSH en el día 1 estuvieron asociados con una menor capacidad de incrementar la TSH en el día 8, una característica que estuvo asociada con mayor incidencia de mortalidad (fig. 4).
TSH basal y su relación con la capacidad de aumentar la TSH en el día 8: a mayor TSH basal, menor capacidad de incrementar la TSH en día 8 (menor Δ TSH). Se dividió a la población en tercilos según los valores de TSH en día1.
Como conclusión de nuestro estudio, pudimos afirmar que el aumento de TSH durante la internación se asoció a menor mortalidad, tal como suele observarse en la fase de recuperación de la ENT. Sin embargo, niveles más elevados de TSH basales se asociaron a una menor capacidad de incrementar la TSH en el día 8. De los resultados obtenidos, se desprende que en adultos mayores hospitalizados la determinación temprana de los niveles séricos de TSH y su seguimiento a lo largo de la internación podría ser importante para evaluar pronóstico de sobrevida en adultos mayores hospitalizados.
ConclusiónEn la enfermedad, el eje tiroideo está sujeto a numerosos cambios morfológicos y funcionales. Aún se halla en discusión en qué medida esos cambios son adaptativos o perjudiciales. Los argumentos del cribado de la función tiroidea en pacientes con ENT y su eventual tratamiento continúan sujetos a debate.
Teniendo en cuenta las argumentaciones expuestas, la interpretación de la función tiroidea en los pacientes enfermos es dificultosa, ya que los valores séricos de TSH y de HT pueden estar modificados ya sea por la evolución de la enfermedad, por las medicaciones utilizadas, por la metodología analítica o por disfunción tiroidea que también es prevalente. También es importante considerar que estos cambios presentes en la función tiroidea pueden deberse a variaciones fisiológicas que mantienen las funciones vitales básicas a través del ahorro energético.
De tal forma, resulta trascendental conocer las variaciones del eje tiroideo en la ENT, ya que de esta manera se podrá mejorar el cuidado y la calidad de vida de las personas enfermas sin tratar de manera innecesaria a aquellos cuya función tiroidea representa un cambio adaptativo y, por ende, beneficioso para su organismo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no poseer conflictos de intereses.