En varones, el estradiol circula en pequeñas concentraciones (8-40pg/ml), sin estar del todo claras aún sus funciones. En este contexto, es necesario aclarar los efectos de esta hormona en el sexo masculino. Además de estudiarse el posible papel en la reproducción masculina, en los últimos años se ha tratado de encontrar la relación entre sus niveles y los componentes del síndrome metabólico. Sin embargo, la bibliografía existente no aclara si ejerce un papel protector o perjudicial con respecto a dicha patología.
ObjetivosAnalizar las relaciones existentes entre el estradiol y los componentes del síndrome metabólico en una muestra de varones excedidos de peso con síndrome metabólico de la provincia de Mendoza.
MetodologíaSe estudió a 40 varones con sobrepeso u obesidad y síndrome metabólico residentes en la ciudad de Mendoza, con edades entre 53 y 74 años, los cuales fueron evaluados a partir de una consulta médica de rutina. Se determinaron estradiol, testosterona, glucemia en ayunas, insulina en ayunas, índice HOMA, perfil lipídico y ácido úrico. Se evaluó el estado nutricional mediante antropometría: peso, talla, circunferencias, pliegues cutáneos y medidas derivadas. El análisis estadístico se realizó mediante correlación de Pearson o Spearman según la normalidad de las variables y la prueba de la t de Student para muestras independientes. Se utilizó un nivel mínimo de significación de p<0,05.
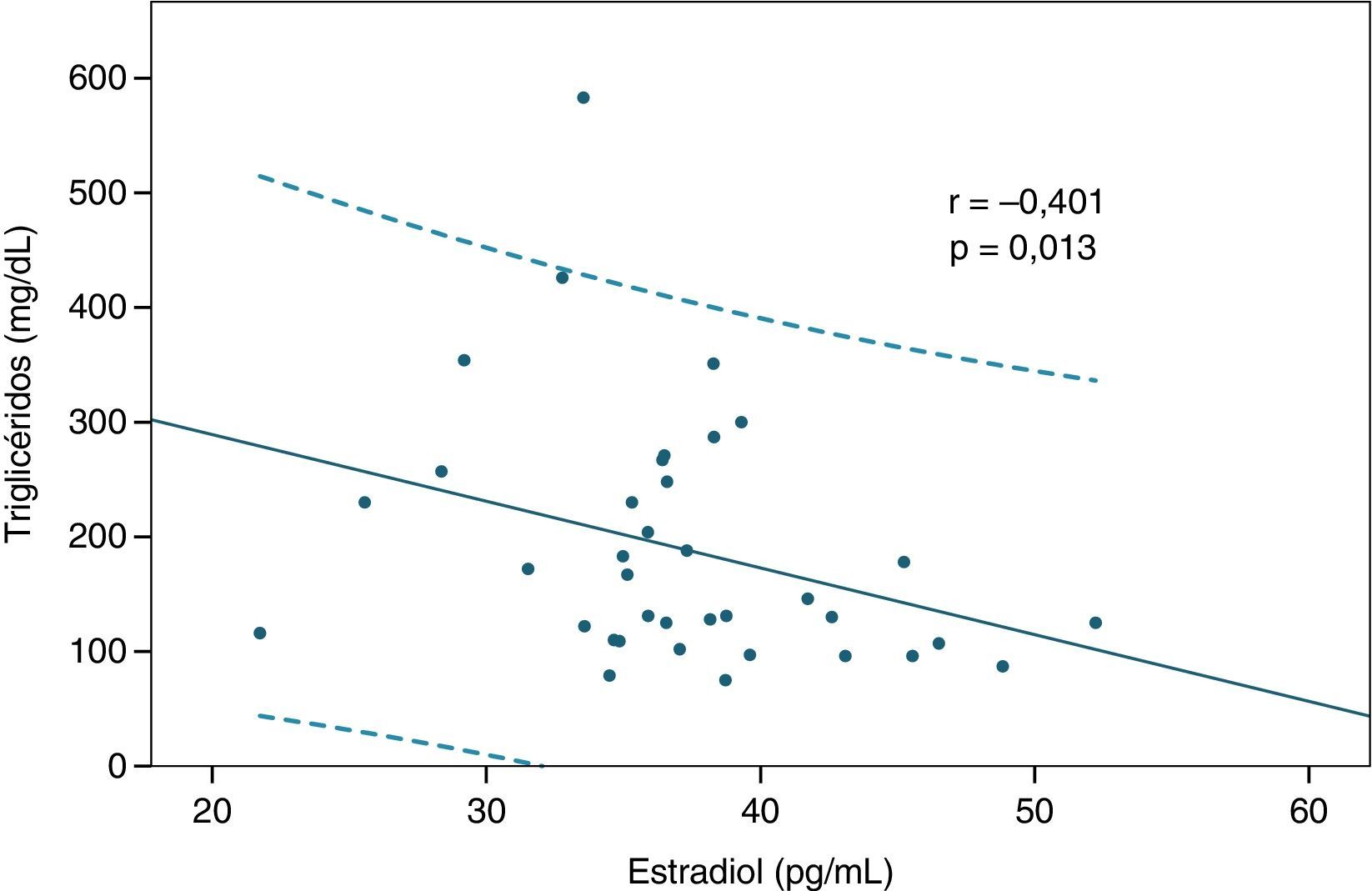
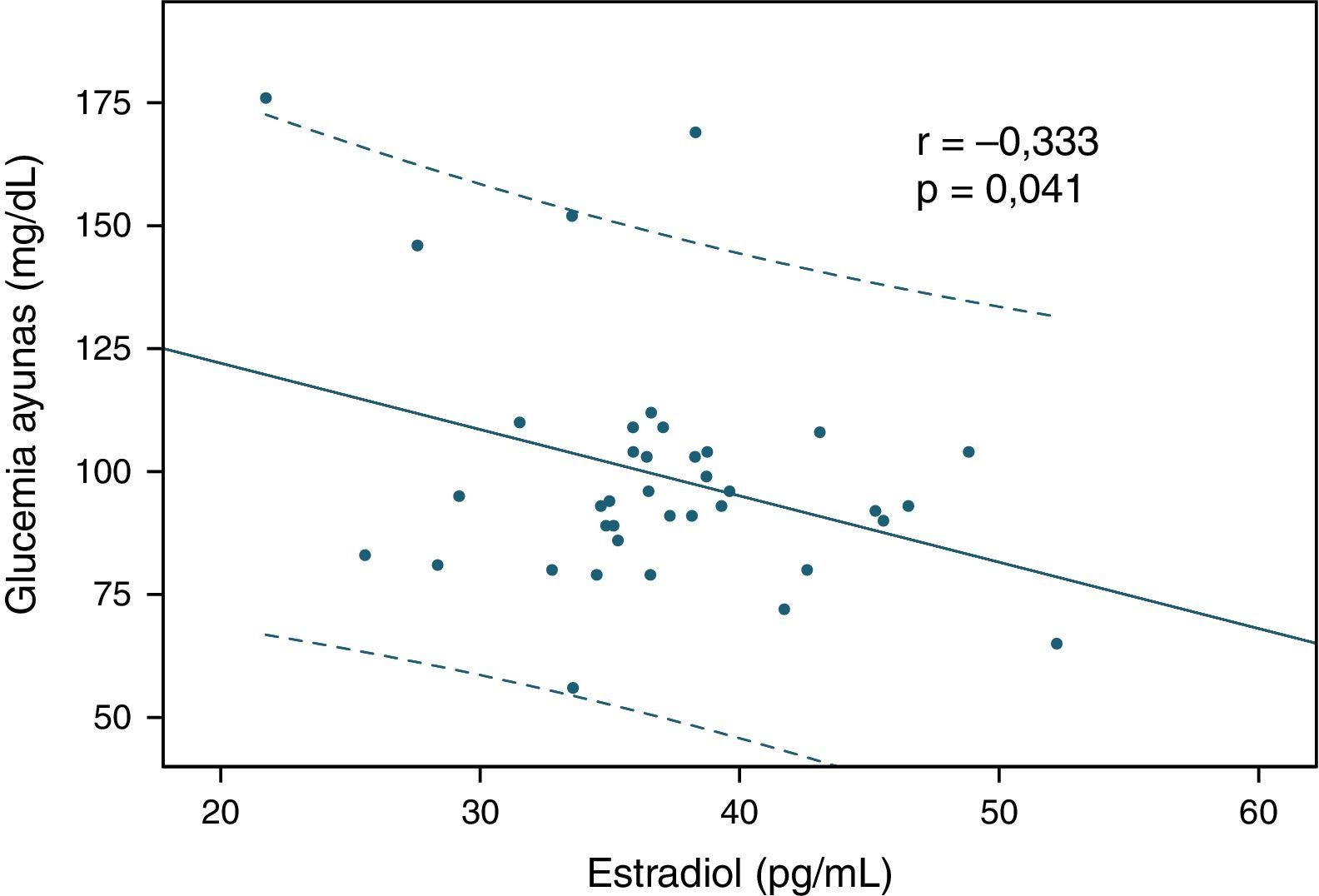
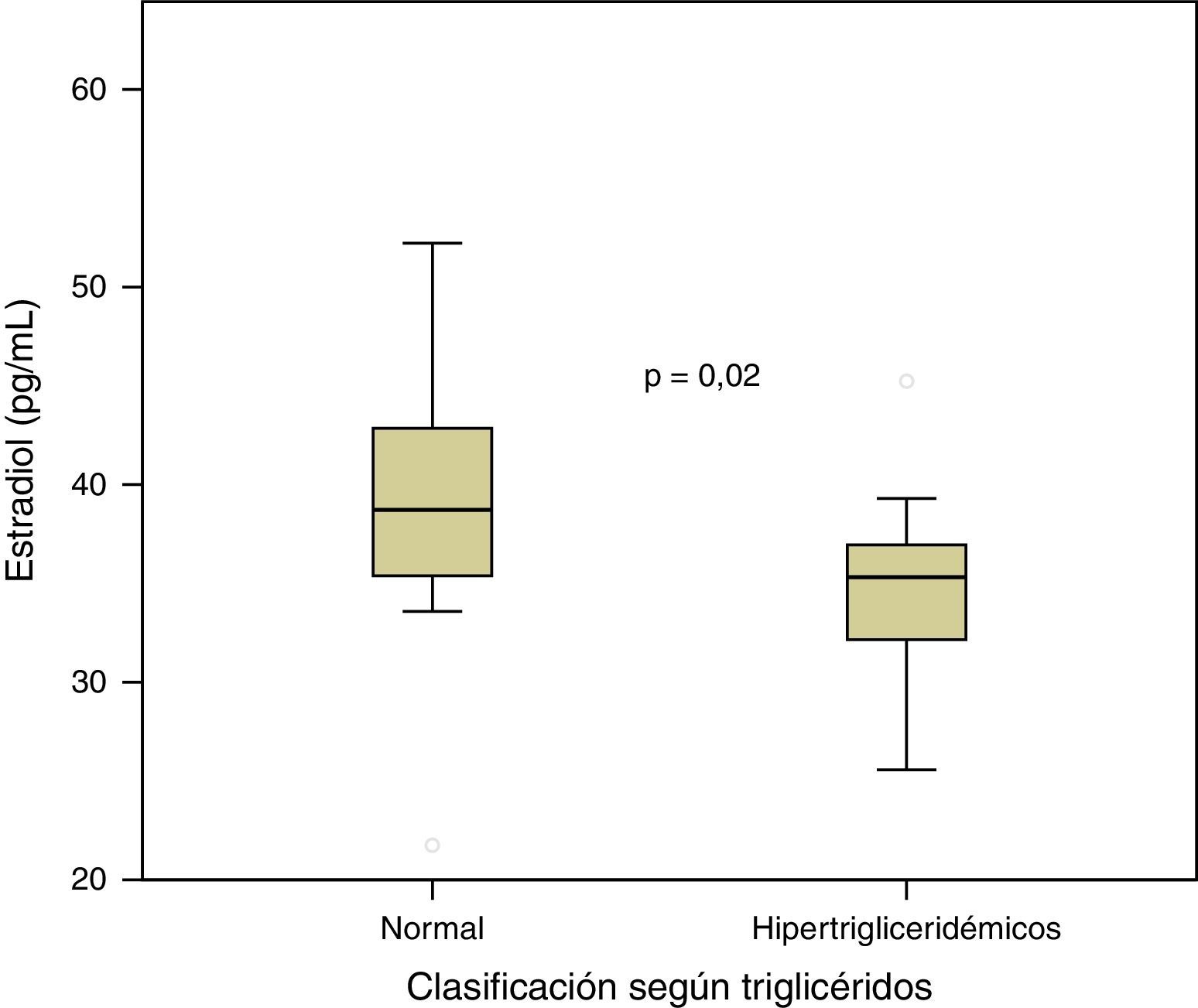
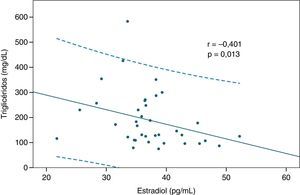
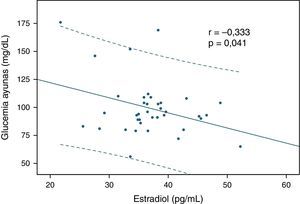
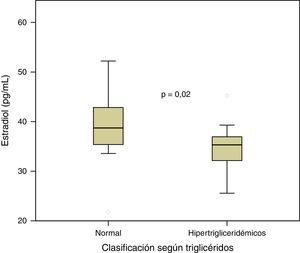
ResultadosLos niveles de estradiol se correlacionaron negativamente con los valores de triglicéridos (r=–0,401; p=0,013) y con la glucemia en ayunas (r= –0,333; p= 0,041). Por otra parte, los individuos normotrigliceridémicos (valor de triglicéridos<150mg/dl) mostraron valores mayores de estradiol que los hipertrigliceridémicos (p=0,02).
ConclusionesLos niveles de estradiol muestran relación inversa con triglicéridos y glucemia en ayunas en varones con síndrome metabólico.
Oestradiol circulates in low concentrations (8-40pg/ml) in males, with its functions still not being entirely clear. In this context, there is a need to determine the effects it has on males. Apart from studying the potential role oestradiol has on male reproduction in recent years, efforts have been made to determine the relationship between oestradiol levels and metabolic syndrome components. Nevertheless, the existing bibliography does not clarify whether oestradiol plays a protective or detrimental role in this condition.
ObjectivesThe present work aimed to analyse the relationship between serum oestradiol levels and metabolic syndrome components in overweight men from Mendoza.
MethodologyThe sample consisted of 40 overweight or obese males, aged 53-74, with metabolic syndrome, and living in the city of Mendoza. Based on a health routine check-up, they were evaluated by determining the levels of oestradiol, testosterone, fasting blood glucose, insulin, HOMA index, lipid profile, and uric acid. Nutritional status was assessed using anthropometric measurements: weight, height, circumferences, and skinfold thickness. Statistical analysis was carried out using Pearson or Spearman correlation according to the normality of variables and the Student t test for independent samples. A minimum level of significance of P<.05 was used.
ResultsOestradiol levels negatively correlated with triglyceride values (r = -0.401; P=.013) and fasting blood glucose (r= -0.333; P=.041). Furthermore, those with normal triglycerides (triglyceride values <150mg/dl) showed higher oestradiol levels compared to those with high triglycerides (P=.02).
ConclusionsOestradiol levels show an inverse relationship as regards triglycerides and fasting blood glucose in men with metabolic syndrome.
El estradiol o 17-β-estradiol es el estrógeno más importante y potente. Aunque el estudio de la hormona se ha centrado en su función como hormona sexual femenina, poco se conoce acerca de su papel como hormona testicular. Existen algunos estrógenos secretados por el testículo, como estrona y estradiol, productos derivados de la androstenodiona y de la testosterona, respectivamente, que son eliminados en la orina y disminuyen con la castración1.
La producción de estradiol a partir de testosterona comprende una serie de reacciones catalizada por la enzima aromatasa, la cual se encuentra en las células de Sertoli y en diversos tejidos, principalmente el adiposo2. Al igual que la testosterona, el estradiol declina significativamente con la edad (en un rango amplio: entre 24 y 90 años)3.
En varones, el estradiol circula en pequeñas concentraciones (8-40pg/ml) y sus efectos están relacionados de manera positiva con la función reproductiva, previniendo la apoptosis de los espermatozoides, efecto observado in vitro4. Por otra parte, la supresión de la producción de estradiol en varones infértiles podría mejorar el análisis de los distintos parámetros del semen, por modificación de la relación tetosterona-estradiol5. Sin embargo, diversos estudios han observado una disminución en el conteo de espermatozoides causada por la exposición a estrógenos en el medio ambiente6.
Además, en los últimos años se ha tratado de encontrar la relación entre los niveles séricos de estradiol y los componentes del síndrome metabólico (SM). De esta manera, se han observado niveles disminuidos de esta hormona en varones con SM, si bien se sabe que en obesos los valores de estradiol son mayores, sin ocasionar signos de feminización7. También se ha encontrado una relación entre metabolismo anormal, incluyendo en este concepto la obesidad y el sobrepeso, al hiperglucemia y la dislipidemia, con una disminución del eje estradiol/globulina transportadora de hormonas sexuales (SHBG) en varones de edad avanzada8. Existe además evidencia del efecto positivo de los estrógenos en el SM en ratas9.
El objetivo del presente trabajo fue analizar las relaciones existentes entre el estradiol y los componentes del SM en una muestra de varones excedidos de peso con SM de la provincia de Mendoza.
Material y métodosPoblación y muestraEl estudio se llevó a cabo en el Laboratorio de Enfermedades Metabólicas y Cáncer de la Universidad Juan Agustín Maza (Mendoza, Argentina). La muestra estuvo constituida por 40 varones con sobrepeso u obesidad y al menos 2 componentes más de SM evaluables desde la bioquímica, con edades comprendidas entre los 53 y los 74 años, residentes en la ciudad de Mendoza. Fueron excluidos los voluntarios que hubiesen participado en algún ensayo clínico o intervención nutricional en los últimos 3 meses, aquellos con patologías endocrinas crónicas diagnosticadas previamente, bajo medicación hipoglucemiante o hipolipidemiante, o con enfermedades crónicas malignas o benignas distintas del SM.
Diseño del estudioLos voluntarios fueron evaluados a partir de una consulta médica de rutina que incluyó revisión de la historia clínica y exploración física, evaluación de la composición corporal mediante antropometría, y un análisis bioquímico de laboratorio. Todos los individuos que participaron del estudio firmaron un consentimiento escrito previamente aprobado por el Comité de Ética del Círculo Médico de Mendoza.
Análisis de laboratorioSe determinaron los siguientes parámetros bioquímicos:
- -
Estradiol (quimioluminiscencia ADVIA Centaur Siemens) Sensibilidad y rango del ensayo: el ensayo Estradiol-6 III de ADVIA Centaur mide concentraciones de estradiol de hasta 1.000pg/ml (3.670pmol/l) con una concentración mínima detectable (sensibilidad) de 7,0pg/ml (25,7pmol/l). La sensibilidad analítica se define como la concentración de estradiol que corresponde al valor de RLU de 2 desviaciones estándar menor que la media de RLU de 20 determinaciones repetidas del estándar cero del ensayo Estradiol-6 III. Comparación de métodos: para 748 muestras en el rango de 10,0 a 908,9pg/ml (36,7 a 3.335,7pmol/l), la relación entre el ensayo Estradiol-6 III de ADVIA Centaur y el ensayo Estradiol-6 de ADVIA Centaur se define por la ecuación: estradiol-6 III de ADVIA Centaur=1,06 (Estradiol-6 de ADVIA Centaur) – 7,74pg/ml coeficiente de correlación (r)=0,986.
- -
Testosterona (quimioluminiscencia ADVIA Centaur Siemens).
- -
Glucemia en ayunas (método enzimático GOD-POD®) (M Wiener S.A.I.C., Argentina)
- -
Insulina en ayunas (enzimoinmunoanálisis), que permitió calcular el índice HOMA según la fórmula HOMA=(insulina [McUI/ml]×glucemia [mg/dl])/405.
- -
Perfil lipídico (método enzimático).
- -
Ácido úrico (método enzimático).
Todos los análisis se realizaron sobre suero obtenido de la extracción de 5ml de sangre de cada paciente.
AntropometríaSe evaluó el estado nutricional por medio de las siguientes medidas antropométricas directas: peso (kg), talla (m) y circunferencias de cintura y cadera (cm), pliegues cutáneos y medidas derivadas, las cuales se efectuaron a primera hora de la mañana y en ayunas. Los voluntarios se encontraban descalzos y con bata de exploración en el momento de la valoración. Se midió peso corporal en una balanza (capacidad 150kg y 100g de precisión, marca CAM, modelo P-1003, Buenos Aires, Argentina). La estatura se midió en el estadiómetro metálico de la misma balanza, con una escala de 1 a 200cm y una precisión de 0,5cm. Con los datos obtenidos se determinaron diferentes parámetros antropométricos indirectos para evaluar el estado nutricional: índice de masa corporal y relación cintura/cadera.
Análisis estadísticoSe utilizó el programa estadístico PASW Statistics 18 para Windows (IBM, Nueva York, EE. UU.). Para la estadística descriptiva se utilizaron la media aritmética como medida de tendencia central y la desviación estándar como medida de dispersión. En lo que respecta a la estadística inferencial para establecer posibles asociaciones entre las distintas variables, se utilizaron los coeficientes de correlación de Pearson y Spearman según el criterio de normalidad de las variables establecido con el test de normalidad de Kolmogórov-Smirnov. Además, se compararon las medias mediante la prueba de la t de Student para muestras independientes. En todos los casos, se utilizó un nivel mínimo de significación de p<0,05.
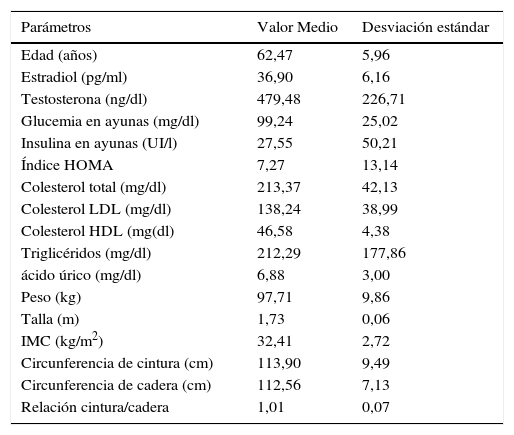
ResultadosEn la tabla 1 se detallan las características generales de la muestra.
Características generales de la muestra
| Parámetros | Valor Medio | Desviación estándar |
|---|---|---|
| Edad (años) | 62,47 | 5,96 |
| Estradiol (pg/ml) | 36,90 | 6,16 |
| Testosterona (ng/dl) | 479,48 | 226,71 |
| Glucemia en ayunas (mg/dl) | 99,24 | 25,02 |
| Insulina en ayunas (UI/l) | 27,55 | 50,21 |
| Índice HOMA | 7,27 | 13,14 |
| Colesterol total (mg/dl) | 213,37 | 42,13 |
| Colesterol LDL (mg/dl) | 138,24 | 38,99 |
| Colesterol HDL (mg(dl) | 46,58 | 4,38 |
| Triglicéridos (mg/dl) | 212,29 | 177,86 |
| ácido úrico (mg/dl) | 6,88 | 3,00 |
| Peso (kg) | 97,71 | 9,86 |
| Talla (m) | 1,73 | 0,06 |
| IMC (kg/m2) | 32,41 | 2,72 |
| Circunferencia de cintura (cm) | 113,90 | 9,49 |
| Circunferencia de cadera (cm) | 112,56 | 7,13 |
| Relación cintura/cadera | 1,01 | 0,07 |
Luego se analizaron las correlaciones entre los valores de estradiol y las variables bioquímicas estudiadas, y se encontraron 2 relaciones significativas. En primer lugar, se observó una correlación inversa significativa entre la hormona y los niveles de triglicéridos (r=–0,401; p=0,013 según correlación de Spearman, fig. 1). También el estradiol se correlacionó negativamente con los valores de glucemia en ayunas (r=–0,333; p = 0,041 según correlación de Pearson, fig. 2). Las relaciones entre estradiol y las demás variables bioquímicas analizadas no fueron significativas.
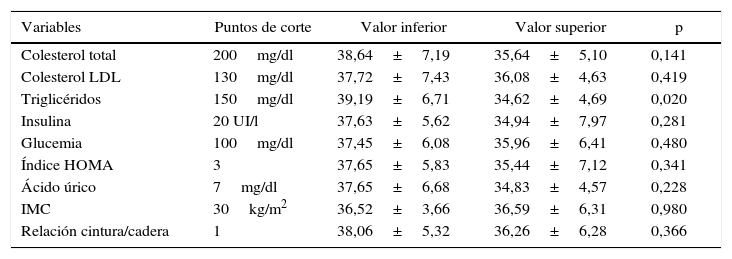
Por otra parte, se compararon los valores de estradiol entre categorías definidas mediante los puntos de corte de las variables relacionadas con el SM, a través de prueba de la t de Student para muestras independientes (tabla 2). De esta manera, los individuos con valores normales de triglicéridos (valor de triglicéridos < 150mg/dl) presentaron mayores niveles de estradiol que aquellos hipertrigliceridémicos (p=0,02), como puede apreciarse en la figura 3. No se observaron diferencias significativas en los niveles de estradiol entre las diferentes categorías de las demás variables analizadas (p>0,05 en todos los casos).
Estradiol según agrupación por variables relacionadas con el síndrome metabólico
| Variables | Puntos de corte | Valor inferior | Valor superior | p |
|---|---|---|---|---|
| Colesterol total | 200mg/dl | 38,64±7,19 | 35,64±5,10 | 0,141 |
| Colesterol LDL | 130mg/dl | 37,72±7,43 | 36,08±4,63 | 0,419 |
| Triglicéridos | 150mg/dl | 39,19±6,71 | 34,62±4,69 | 0,020 |
| Insulina | 20 UI/l | 37,63±5,62 | 34,94±7,97 | 0,281 |
| Glucemia | 100mg/dl | 37,45±6,08 | 35,96±6,41 | 0,480 |
| Índice HOMA | 3 | 37,65±5,83 | 35,44±7,12 | 0,341 |
| Ácido úrico | 7mg/dl | 37,65±6,68 | 34,83±4,57 | 0,228 |
| IMC | 30kg/m2 | 36,52±3,66 | 36,59±6,31 | 0,980 |
| Relación cintura/cadera | 1 | 38,06±5,32 | 36,26±6,28 | 0,366 |
En el presente estudio se pudieron apreciar relaciones significativas entre el estradiol y otros marcadores bioquímicos en varones con exceso de peso y SM. Particularmente, se lo asoció negativamente con los valores de glucemia en ayunas y triglicéridos, indicando una posible actividad protectora de la hormona frente a estos indicadores del SM.
Los mecanismos implicados en esta asociación, al igual que los efectos del estradiol en el organismo masculino, no han sido aclarados del todo, por lo cual muchos estudios de referencia han sido realizados en mujeres posmenopáusicas (las cuales poseen niveles de estradiol similares a los del varón) o en animales de laboratorio.
En general, valores disminuidos de estradiol se han asociado negativamente con el SM8,9,10, mientras que, considerando a la glucemia elevada como uno de sus indicadores, se ha observado que en varones mayores de 70 años el estradiol se asocia negativamente con la edad y la diabetes11. Por otra parte, una investigación ha observado una atenuación por parte del estradiol sobre algunas reacciones neuroendocrinas frente a la hipoglucemia, siendo una de ellas el aumento del metabolismo de la glucosa a nivel hipotalámico por inhibición de la expresión de genes CPT1A y PDK4, que se expresan en situaciones de hipoglucemia disminuyendo su metabolismo12. Otros trabajos postulan una mayor tolerancia a la glucosa como efecto metabólico del estradiol13,14
Por otra parte, en relación con los niveles de triglicéridos, un trabajo en mujeres pre y posmenopaúsicas determinó que, en estas últimas, el aumento posprandial de triglicéridos se atenúa administrando estradiol de manera transdérmica15. Además, esta investigación observó mejoras en la clearance de triglicéridos por administración de dicha hormona, pudiéndose confirmar que los mecanismos son independientes de la formación de tejido celular subcutáneo a partir de los ácidos grasos de la dieta15, siendo aún razón de estudio el mecanismo por el cual se produce este fenómeno. Otras investigaciones demostraron que el estradiol reduce la lipidemia posprandial, posiblemente por un aumento significativo de la clearance de quilomicrones y triglicéridos16, y que en varones sanos tratados con dicha hormona por vía oral disminuyeron los valores de colesterol LDL y triglicéridos, mientras que aumentaron las concentraciones de colesterol HDL17. Si bien en nuestro estudio no se evidenciaron relaciones con esta fracción del colesterol, es relevante mencionar que los valores fisiológicos de estradiol son importantes para mantener los niveles plasmáticos de colesterol HDL, y que tales concentraciones ofrecen una cierta protección, al igual que en las mujeres posmenopáusicas18.
Sin embargo, otras investigaciones han arribado a conclusiones antagónicas, mostrando relaciones diferentes de las apreciadas en nuestro trabajo entre los componentes del SM y el estradiol. Dado que se han observado asociaciones positivas significativas entre el porcentaje corporal de masa grasa, el índice de masa corporal, la circunferencia de cintura y los niveles de estradiol19–21, algunos trabajos plantean que niveles elevados de esta hormona favorecerían la obesidad, la dislipidemia, la ginecomastia, la hiperplasia prostática benigna, la diabetes tipo 2 e inclusive el cáncer de próstata22. Varios estudios indican una relación importante entre los valores de estradiol y el riesgo de diabetes tipo 2 en varones23,24, demostrando elevados niveles de la hormona en individuos diabéticos, comparados a los controles25.
La evidencia aportada por estos trabajos permite pensar en potenciales líneas de estudio que terminen de dilucidar los mecanismos que median la relación entre estradiol y los niveles plasmáticos de triglicéridos y glucemia observados en la presente investigación.
Finalmente, la presente investigación presenta como limitaciones un número reducido de individuos, los cuales, como ya se mencionó, presentan 3 o más criterios de SM, por lo que resultaría útil ver qué sucede en varones que no presentan SM y en rangos de edades más estrechos. Otra limitación fue no contar con los valores de presión arterial y no haber dosado los niveles de SHBG (globulina fijadora de estrógenos), los cuales hubiesen sido de utilidad para comprender los mecanismos hormonales relacionados con el SM en varones. De esta manera, y sumado a la diversidad de resultados contradictorios, el papel que realmente cumple la hormona frente al SM en individuos de sexo masculino continúa aún en discusión.
En este contexto, y según los resultados obtenidos en la presente investigación, se puede concluir que el estradiol se asocia negativamente con los valores de glucemia en ayunas y triglicéridos en varones excedidos de peso y con SM.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesFinalmente se aclara que los autores del presente manuscrito no presentan conflicto de intereses alguno.