Se evaluó la actividad in vitro de la asociación entre ampicilina y ceftriaxona frente a 30 aislamientos de Enterococcus faecalis obtenidos de infecciones invasivas de pacientes atendidos en el Hospital de Clínicas José de San Martín, Ciudad Autónoma de Buenos Aires. Las sinergias entre ampicilina y ceftriaxona se determinaron mediante la técnica de dilución en caldo Müeller-Hinton con el agregado de diferentes concentraciones subinhibitorias de ceftriaxona o sin este. La asociación fue sinérgica en 22/30 aislamientos. En 14/30 aislamientos la asociación disminuyó los valores de concentración inhibitoria mínima (CIM) y de concentración bactericida mínima (CBM); en 6/30 se observó solamente una disminución de la CIM, mientras que en 2 solo se determinó una reducción de la CBM. La actividad bactericida de la asociación fue mayor a bajas concentraciones de ampicilina (menor de 1μg/ml). Se demostró la sinergia in vitro entre ampicilina-ceftriaxona; se confirmó así la utilidad de esta asociación en el tratamiento de infecciones severas causadas por E. faecalis.
In vitro activity of the combination of ampicillin- ceftriaxone against 30 Enterococcus faecalis isolates recovered from invasive infections in patients admitted to Hospital de Clínicas José de San Martin in the city of Buenos Aires was assessed. Ampicillin- ceftriaxone synergies were determined by microdilution in Müeller-Hinton (MH) broth with and without subinhibitory concentrations of ceftriaxone. Synergy was detected in 22/30 isolates. A decrease in both minimum inhibitory concentration (MIC) and minimum bactericidal concentration (MBC) was observed in 14/30 isolates, whereas in 6/30 isolates the decrease was observed in the MIC value and only in the MBC value in the 2 remaining isolates. The bactericidal activity of the combination showed to be higher at low concentrations of ampicillin (< 1μg/ml). We detected in vitro synergy using the ampicillin-ceftriaxone combination and thus, its efficacy was confirmed in the treatment of severe infections by E. faecalis.
Al género Enterococcus le corresponde el tercer lugar como agente etiológico de endocarditis infecciosa (EI), luego de Staphylococcus spp. y Streptococcus spp., con el 10 al 14% de los casos. Aproximadamente el 90% de los episodios de EI provocados por ese género corresponden a Enterococcus faecalis (EF), mientras que menos del 5% son causados por Enterococcus faecium9,11.
La ausencia de actividad bactericida de las penicilinas frente a EF y su impacto clínico en cuanto a fallas de tratamiento en comparación con las EI causadas por estreptococos condujo a la utilización de biterapia (penicilina o ampicilina [AMP] sumada a un aminoglucósido)9. La combinación de AMP o penicilina con un aminoglucósido por un período de 4 a 6 semanas es el tratamiento recomendado en diferentes guías internacionales, entre ellas la de la American Heart Association (AHA) y la de la European Society of Cardiology (ESC), para el tratamiento de la EI causada por EF1,7. Cuando existe alto nivel de resistencia a aminoglucósidos (ANR) o cuando la función renal del paciente no permite la asociación con aminoglucósidos, se propone el uso de otros esquemas, como la combinación entre AMP y ceftriaxona (CRO)5,6. La AHA y la ESC proponen la asociación entre AMP y CRO (AMP-CRO) como terapia combinada alternativa en EI causadas por EF con ANR1,7.
La eficacia in vitro de la AMP-CRO fue descrita por primera vez en la década de los 90 y luego confirmada en modelos de estudio con animales5,6. La acción sinérgica de esta combinación se basa en la saturación total (100%) de las proteínas ligadoras de penicilina (PLP) 2 y 3 por la CRO (a concentraciones<1μg/ml), sumada a la parcial saturación (25%) de las PLP esenciales 4 y 5 por la AMP5,6.
Este trabajo tuvo por objetivo evaluar la actividad in vitro de la asociación AMP-CRO frente a 30 aislamientos de EF obtenidos de infecciones invasivas de pacientes atendidos en el Hospital de Clínicas José de San Martín, CABA.
Se estudiaron en forma prospectiva 30 aislamientos de EF provenientes de infecciones invasivas de pacientes atendidos en el Hospital de Clínicas José de San Martín, Universidad de Buenos Aires, durante el período marzo-setiembre del 2014.
Los aislamientos se obtuvieron de hemocultivos (15), líquidos de derrame (8), materiales óseos (5) y piel, y partes blandas (2).
Las pruebas de sensibilidad y la identificación fueron realizadas con el equipo Phoenix 100, Becton Dickinson and Company®. Se determinó la concentración inhibitoria mínima (CIM) de AMP y CRO por el método de dilución en agar, de acuerdo con las recomendaciones generales del Clinical and Laboratory Standards Institute2.
Los estudios de sinergias entre AMP y CRO se llevaron a cabo utilizando la técnica de dilución en caldo Müeller-Hinton (MHC). Se utilizó un gradiente de concentración de AMP entre 64μg/ml y 0,008μg/ml con el agregado de diferentes concentraciones subinhibitorias de CRO o sin este. Las concentraciones de CRO se escogieron en relación con los niveles de antimicrobiano alcanzados en suero a las dosis habituales (4μg/ml [valle], 30μg/ml [pico] y 10-20μg/ml como valores intermedios). De las diferentes concentraciones de AMP y de las 3 combinaciones de AMP con CRO en las que no se obtuvo desarrollo visible a las 24 h de incubación, se realizaron subcultivos de 100μl de MHC en placas de agar nutritivo, que fueron incubadas 48 h antes de realizar el conteo de los sobrevivientes.
Se consideró un resultado sinérgico cuando se observó una disminución de la CIM y/o de la CBM con la asociación AMP-CRO respecto de la CIM y/o de la CBM del antimicrobiano más activo en más de 2 diluciones. Se definió un aislamiento como tolerante cuando la relación CBM/CIM del antimicrobiano o de la asociación fue mayor o igual que 32. Se consideraron CIM50 y CIM90 las concentraciones que inhibieron el 50 y al 90% de los aislamientos, respectivamente.
En 2 aislamientos, uno que mostró sinergia (aislamiento 21) y otro indiferencia (aislamiento 20) para la asociación estudiada, se evaluó la cantidad de sobrevivientes obtenidos tras 24 h de incubación con diferentes concentraciones de AMP (rango: 0,06μg/ml a 32μg/ml) sola o en combinación con CRO a una concentración final de 10μg/ml. A cada tubo se le adicionó una suspensión de EF con una turbidez equivalente a una dilución de 1/10 del tubo 0,5 de la escala de Mc Farland. Posteriormente, se realizaron los subcultivos de cada dilución a las 24 h. Para ello se retiró una alícuota de 100μl de cada tubo y se hicieron diluciones seriadas en solución fisiológica estéril hasta alcanzar un recuento estimado entre 1.000 y 10UFC/ml. Cada dilución fue sembrada por duplicado en agar nutritivo y se incubó durante 48 h. Las placas consideradas fueron las que presentaron entre 10 y 100 colonias, y el resultado final fue el promedio de ambas mediciones. El límite inferior de detección fue 10UFC/ml.
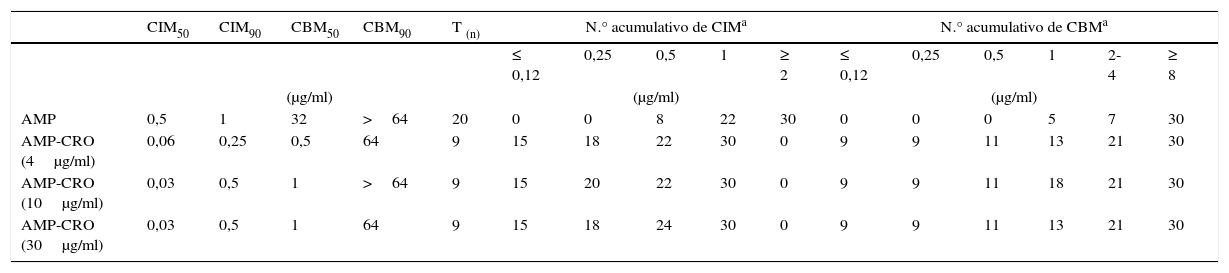
Todos los aislamientos fueron sensibles a AMP (CIM=0,25-1,0μg/ml) y resistentes a CRO (CIM=16-64μg/ml), estos últimos son datos no mostrados. Los valores de CIM50 y CIM90 y el número de aislamientos tolerantes se detallan en la tabla 1. El 45% de los aislamientos presentaron alto nivel de resistencia a los aminoglucósidos (datos no mostrados).
Actividad de la ampicilina y de la combinación ampicilina-ceftriaxona frente a 30 aislamientos de E. faecalis recuperados de infecciones masivas
| CIM50 | CIM90 | CBM50 | CBM90 | T (n) | N.° acumulativo de CIMa | N.° acumulativo de CBMa | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ≤ 0,12 | 0,25 | 0,5 | 1 | ≥ 2 | ≤ 0,12 | 0,25 | 0,5 | 1 | 2-4 | ≥ 8 | ||||||
| (μg/ml) | (μg/ml) | (μg/ml) | ||||||||||||||
| AMP | 0,5 | 1 | 32 | >64 | 20 | 0 | 0 | 8 | 22 | 30 | 0 | 0 | 0 | 5 | 7 | 30 |
| AMP-CRO (4μg/ml) | 0,06 | 0,25 | 0,5 | 64 | 9 | 15 | 18 | 22 | 30 | 0 | 9 | 9 | 11 | 13 | 21 | 30 |
| AMP-CRO (10μg/ml) | 0,03 | 0,5 | 1 | >64 | 9 | 15 | 20 | 22 | 30 | 0 | 9 | 9 | 11 | 18 | 21 | 30 |
| AMP-CRO (30μg/ml) | 0,03 | 0,5 | 1 | 64 | 9 | 15 | 18 | 24 | 30 | 0 | 9 | 9 | 11 | 13 | 21 | 30 |
AMP: ampicilina; AMP-CRO: combinación ampicilina-ceftriaxona; CIM50: concentración mínima que inhibe al 50% de los aislamientos; CIM90: concentración mínima que inhibe al 90% de los aislamientos; T(n): número de aislamientos tolerantes.
La asociación AMP-CRO fue sinérgica en 22/30 aislamientos (73,3%). Los resultados de sinergia o indiferencia determinados fueron independientes de la concentración de CRO utilizada. En 14/30 aislamientos estudiados (46,6%), la asociación AMP-CRO disminuyó al mismo tiempo los valores de CIM y de CBM; en 6/30 (20%) se observó solamente una disminución de la CIM, mientras que en 2 aislamientos se determinó una baja en la CBM (tabla 1).
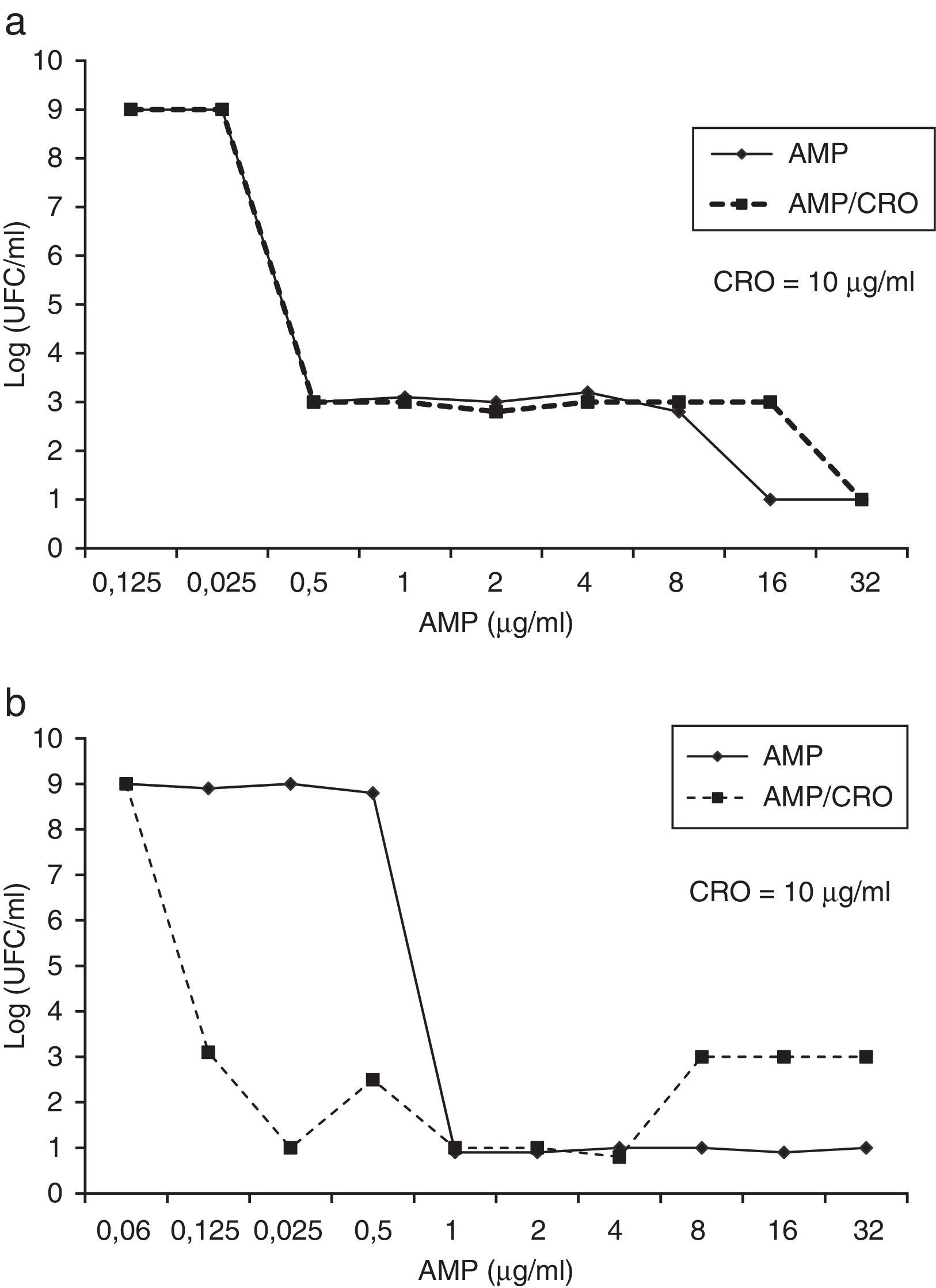
En la figura 1 se muestran las curvas de letalidad a 24 h con gradiente de concentración de AMP; en ellas se detalla el efecto de las diferentes concentraciones de AMP en la asociación con CRO y se observa indiferencia en todas las concentraciones ensayadas (excepto con 16μg/ml) en el aislamiento 20, mientras que en el aislamiento 21 la sinergia solo se detecta en concentraciones sub-CIM (< 1μg/ml); hay indiferencia entre 1μg/ml y 4μg/ml y antagonismo a concentraciones de AMP ≥ 8μg/ml.
Curva de letalidad con gradiente de concentración de AMP (0,06-32μg/ml) sola o combinada con CRO (10μg/ml) a las 24 h de incubación. a) Aislamiento E. faecalis 20. CIM AMP=1μg/ml, CBM AMP=8μg/ml, CIM CRO=64μg/ml, CIM AMP-CRO=1μg/ml, CBM AMP-CRO=1μg/ml. b) Aislamiento E. faecalis 21. CIM AMP=0,5μg/ml, CBM AMP=64μg/ml, CIM CRO=32μg/ml, CIM AMP-CRO=0,03μg/ml, CBM AMP-CRO=2μg/ml.
La endocarditis infecciosa causada por EF fue descrita por primera vez en 1899. Si bien su tasa de mortalidad no ha cambiado en las últimas décadas, aumentó la resistencia a los antimicrobianos considerados de primera línea para su tratamiento. De esta manera, la asociación AMP-CRO se convierte en una alternativa terapéutica en los casos con alta resistencia a los aminoglucósidos10,11,13.
A diferencia de lo que se observa en las asociaciones entre AMP y aminoglucósidos, en las que se logra una fuerte sinergia bactericida, en las asociaciones entre betalactámicos, los resultados in vitro presentan resultados más dispares3,5,6,12. Gavaldá et al. evidenciaron el efecto sinérgico in vitro entre AMP y CRO en 2/10 aislamientos estudiados, mientras que, independientemente de los resultados mencionados, obtienen una buena respuesta en endocarditis experimental en modelos animales, con porcentajes de cura del 67%5,6. En 2008, Pasticci et al. obtuvieron resultados in vitro en los cuales no lograron disminuir el valor de la CIM a AMP al utilizar la asociación AMP-CRO en ninguno de los 5 aislamientos ensayados12.
Nosotros determinamos la presencia de sinergia en el 73,3% de los aislamientos. La disminución de la CIM se observó en 20/30 aislamientos (66,6%), mientras que en 16/30 (53,3%) se determinó un descenso en los valores de la CBM. Estos porcentajes fueron superiores a los informados por otros autores4-6,8.
Los resultados en nuestro trabajo fueron independientes de la concentración de CRO empleada, lo que indicaría que la capacidad sinérgica de AMP-CRO sería constante en los diferentes momentos del tratamiento (pico, valle, intermedio).
Con la dosis recomendada de 2g de AMP cada 4 h para el tratamiento de la EI, la concentración libre del antimicrobiano en suero en el pico es de 38μg/ml, aproximadamente, y alcanza a las 4 h una concentración de 4μg/ml11. En nuestro trabajo, los niveles séricos de AMP cubren el 100% de los aislamientos o el 20% de los mismos si se toman en cuenta los valores de CIM o de CBM, respectivamente. Cuando este antimicrobiano se combina con CRO, alcanza a cubrir el 100 y el 66,6% de los aislamientos, respectivamente. Los antimicrobianos betalactámicos son dependientes del tiempo; actúan de manera eficaz cuando su concentración en el sitio de infección se encuentra por encima de la CIM durante un determinado período entre dosis, por lo tanto, es evidente que los mejores resultados se obtendrían al utilizar terapia combinada AMP-CRO.
Diferentes autores han determinado mayor actividad bactericida de la asociación AMP-CRO a concentraciones de AMP por debajo de su CIM5,6,12. Este fenómeno estaría relacionado con el «efecto paradójico o efecto Eagle» y es atribuido por algunos autores a un defecto en la actividad autolítica intrínseca de esta especie bacteriana15. Por lo tanto, utilizar dosis superiores de AMP no aumentaría la eficacia del tratamiento, sino todo lo contrario.
Las curvas de letalidad de 24 h representan un barrido de la actividad de la asociación AMP-CRO a diferentes concentraciones de AMP. En el aislamiento 21 se observa claramente que la asociación AMP-CRO es más activa a bajas concentraciones de AMP (menores de 1μg/ml), mientras que a concentraciones superiores el efecto es indiferente y a concentraciones máximas detectamos antagonismo (fig. 1). De manera similar, Euba et al. en 2009 describen que la mayoría de las cepas de EF presenta un «efecto paradójico o efecto Eagle» y encuentran que en la asociación AMP-CRO la bactericida es mayor en concentraciones de AMP por debajo de la CIM3. La presencia de este efecto sería responsable de los malos resultados obtenidos in vitro en los estudios realizados con concentraciones superiores a la CIM de AMP (4 o 5 múltiplos de la CIM), los cuales son los valores más utilizados en las curvas de letalidad.
Es probable que un aislamiento de EF recuperado de un paciente con diagnóstico de EI posea resistencia a los aminoglucósidos y sea esta la causa del ANR observado en nuestro hospital14. Para casos como estos, la terapia combinada de AMP-CRO es una opción alentadora.
Del presente trabajo surge que en la gran mayoría de los aislamientos de EF estudiados se demuestra la sinergia in vitro entre AMP-CRO. Si bien en la actualidad no contamos con pruebas estandarizadas para evaluar dicha asociación, los resultados preliminares indican que la actividad in vitro de la sinergia AMP-CRO estaría fuertemente influenciada por el «efecto paradójico o efecto Eagle» y, a diferencia de lo que sucede en otras situaciones, los estudios de sinergia y curvas de letalidad con estos antimicrobianos y para esta especie bacteriana deberían diseñarse con concentraciones de antimicrobianos subinhibitorias.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo fue subsidiado mediante el Proyecto UBACYT 20020130100167BA de la Secretaría de Ciencia y Técnica de la Universidad de Buenos Aires
Conflicto de interesesNo existe.