Las cactáceas son la vegetación característica de las zonas áridas en México, donde las lluvias son escasas, la evapotranspiración es elevada y la fertilidad de los suelos es baja. Las plantas han desarrollado estrategias fisiológicas como la asociación con microorganismos en la zona de la rizósfera para incrementar la captación de nutrientes. En el presente trabajo se obtuvieron 4 aislados bacterianos de la rizósfera de Mammillaria magnimamma y Coryphantha radians, los que fueron nombrados como QAP3, QAP19, QAP22 y QAP24 e identificados genéticamente como pertenecientes al género Bacillus. Estos aislados exhibieron in vitro propiedades bioquímicas como solubilización de fosfatos, producción de ácido indolacético y actividad ACC deaminasa, que se relacionan con la promoción del crecimiento de las plantas. Dicha promoción fue ensayada inoculando semillas de M. magnimamma y evaluando luego algunos parámetros. Se encontró que todos los aislados incrementaron la germinación desde un 17% hasta un 34,3% (con respecto a las semillas testigo sin inocular); el aislado QAP24 fue el que presentó el mayor efecto en este sentido y permitió la germinación de todas las semillas viables (84,7%) 3 días antes que en el testigo. La inoculación de este aislado en plantas de Mammillaria zeilmanniana mostró un efecto positivo sobre la floración: en 2 meses dentro del período de un año se detectó un incremento en el número de plantas en floración con respecto a las plantas testigo, de hasta el 31,0% en uno de ellos. Se concluye que los aislados de Bacillus spp. caracterizados poseen potencial para ser empleados en programas de conservación de especies vegetales de zonas áridas.
Cacti are the most representative vegetation of arid zones in Mexico where rainfall is scarce, evapotranspiration is high and soil fertility is low. Plants have developed physiological strategies such as the association with microorganisms in the rhizosphere zone to increase nutrient uptake. In the present work, four bacterial isolates from the rhizosphere of Mammillaria magnimamma and Coryphantha radians were obtained and named as QAP3, QAP19, QAP22 and QAP24, and were genetically identified as belonging to the genus Bacillus, exhibiting in vitro biochemical properties such as phosphate solubilization, indoleacetic acid production and ACC deaminase activity related to plant growth promotion, which was tested by inoculating M. magnimamma seeds. It was found that all isolates increased germination from 17 to 34.3% with respect to the uninoculated control seeds, being QAP24 the one having the greatest effect, accomplishing the germination of viable seeds (84.7%) three days before the control seeds. Subsequently, the inoculation of Mammillari zeilmanniana plants with this isolate showed a positive effect on bloom, registering during two months from a one year period, an increase of up to 31.0% in the number of flowering plants compared to control plants. The characterized Bacillus spp. isolates have potential to be used in conservation programs of plant species from arid zones.
La mayoría del territorio mexicano está constituido por zonas áridas y semiáridas, donde las lluvias son escasas y la evapotranspiración supera la precipitación, con poca cobertura vegetal y condiciones que favorecen la erosión del suelo17. La vegetación característica de estas zonas incluye la familia de las cactáceas, de las cuales se han reportado 669 especies, 518 de estas son endémicas19.
Los suelos en estos ecosistemas son poco fértiles debido al bajo contenido de nitrógeno (N), fósforo (P) y materia orgánica, a menudo esto es un factor limitante para el desarrollo de las plantas12. En este aspecto, las comunidades microbianas de la rizósfera desempeñan un papel fundamental, ya que algunas poblaciones pueden contribuir a la nutrición y el crecimiento de las plantas a través de actividades bioquímicas como la fijación biológica de nitrógeno, la solubilización de fosfatos y la producción de ácido indolacético, una hormona que induce el crecimiento de los pelos radicales14,40. Los microorganismos que presentan estos efectos sobre las plantas son definidos como promotores del crecimiento vegetal15; entre los géneros bacterianos más estudiados con esta actividad se encuentran Azospirillum, Pseudomonas, Citrobacter y Bacillus. Algunas cepas de estos microorganismos aisladas de la rizósfera de cultivos de cereales y hortalizas ya han sido comercializadas. Estos mismos géneros también han sido descritos como parte del nicho ecológico de la rizósfera de diversas cactáceas, entre ellas Mammillaria fraileana, Opuntia ficus indica, Stenocereus pruinosus, Stenocereus stellatus, Ferocactus acanthodes, Opuntia cholla y Pachycereus pringlei22,24,34. A la rizósfera de estas cactáceas se les reconoce su potencial biotecnológico como fuente de aislados microbianos, los cuales podrían ser empleados en programas de reforestación de zonas áridas o para la conservación de plantas endémicas que se ven amenazadas por actividades antropogénicas o por condiciones ambientales adversas, que afectan su reproducción5.
En la localidad La Cañada (municipio El marqués, estado de Querétaro, México), un análisis florístico realizado por Cabrera y Gómez10 indica que la familia de las cactáceas es la segunda en número de especies y que en ella sobresalen los géneros Coryphantha y Mammillaria, cuyas rizósferas pueden ser fuente de aislados bacterianos con potencial como promotores del crecimiento vegetal.
En el presente trabajo se aislaron y caracterizaron bacterias de la rizósfera de las cactáceas Mammillaria magnimamma Haw. y Coryphantha radians (DC.) Britton & Rose, para evaluar luego su efecto sobre la germinación de semillas de M. magnimamma. El aislado más promisorio fue seleccionado para estudiar su impacto sobre el crecimiento y la floración de plantas de Mammillaria zeilmanniana Boed.
Materiales y métodosAislados bacterianosLas cepas bacterianas empleadas en este trabajo fueron obtenidas de la rizósfera de M. magnimamma y C. radians (figura 1). Ambas cactáceas se encuentran creciendo en la localidad de La Cañada, perteneciente al municipio El Marqués, en el estado de Querétaro. Este sitio se ubica a una altitud promedio de 1820 msnm, entre las coordenadas 20° 36′ a 20° 38′ N y 100° 18′ a 100° 20′ O. El clima predominante es el semiseco templado, con una precipitación media anual de 450 a 800 mm18. La vegetación corresponde al matorral crasicaule, con diferentes grados de conservación39. Para la obtención del suelo, se muestreó 1kg de la zona de la rizósfera, separándola por frotación manual en bolsas estériles. El suelo obtenido fue secado a temperatura ambiente y tamizado por una malla de 2mm. El método empleado para el aislamiento de bacterias del suelo fue la dilución y siembra en placa, seleccionando por pasteurización esporas bacterianas resistentes al calor (80°C, 10min). Esto último se realizó con la finalidad de obtener aislados que demuestren capacidad de sobrevivir a condiciones extremas de desecación y altas temperaturas23. Después, las colonias resultantes fueron sometidas a un segundo escrutinio, sembrándolas en placas con medio NBRIP-BPB25 para seleccionar bacterias solubilizadoras de fosfatos. Se tomaron como positivos los aislados que produjeron un halo de color amarillo alrededor de las colonias debido al cambio de pH en el medio, que contenía azul de bromofenol como indicador. Los aislados así obtenidos fueron nombrados como QAP3, QAP19, QAP22 y QAP24.
Material vegetalPara los ensayos de germinación, se recolectaron frutos de M. magnimamma de la misma zona donde se obtuvo el suelo. Las semillas fueron extraídas, lavadas y secadas a temperatura ambiente. Para los ensayos de crecimiento y floración, se utilizaron 100 plantas de M. zeilmanniana de 1,7 años de edad y un diámetro de 2,72(±0,08)cm, provenientes del vivero Typical Mexican Handmade S. A. de C.V., «Vivero de plantas del desierto» (REG. SEMARNAT-UMA-INT-0043-GTO), ubicado en León, Guanajuato, México. Una vez recibidas, las plantas fueron puestas en macetas cuadradas de 2 pulgadas que contenían una mezcla de arena lavada (42,64%), turba (42,64%), cal (0,77%) y humus (13,95%) como sustrato.
Actividades bioquímicasLas características bacterianas relacionadas con la promoción del crecimiento vegetal fueron determinadas de la siguiente manera. Para detectar la actividad aminociclopropano (ACC) deaminasa, las bacterias fueron sembradas por estriado en el medio mínimo Dowkin y Foster (DF), que contiene ACC como única fuente de nitrógeno. Aquellas que presentaron crecimiento en este medio fueron consideradas como positivas36. La prueba de fijación biológica de nitrógeno (FBN) se realizó sembrando los aislados por picadura en medio semisólido nitrogen fixation biological (NFB), carente de nitrógeno29: el crecimiento bacteriano detectado mediante la formación de una película subsuperficial después de 15 días de incubación a 30°C indica la habilidad de los aislados para fijar nitrógeno en condiciones microaerofílicas.
La prueba de producción de sideróforos fue realizada creciendo las bacterias en medio mínimo líquido MM9 suplementado con ácido succínico, fructosa y triptófano (1,0; 5,0 y 1,0g/l, respectivamente)28 durante 5 días, a 30°C. Después, los sobrenadantes fueron recuperados por centrifugación y filtrados usando una membrana Millipore de 0,22μm de diámetro; la presencia de sideróforos fue detectada mediante el reactivo de cromo azurol-S, se consideró esta prueba como positiva si se registraba cambio de color de azul a anaranjado. Como control positivo se utilizó una solución de mesilato de deferoxamina 1,43mM.
La producción de ácido indol-3-acético (AIA) e indoles relacionados fue determinada creciendo los aislados en caldo nutritivo suplementado con triptófano (1g/l) durante 72h a 30°C. El sobrenadante fue recuperado por centrifugación y sujeto a extracción fraccionada con acetato de etilo, el que después fue evaporado, y el residuo resultante fue resuspendido en metanol. El AIA y los indoles fueron cuantificados por colorimetría con el reactivo de Salkowski27, midiendo a 530nm en un espectrofotómetro (Helios gamma, Spectronic unicam).
Para evaluar la capacidad de solubilizar fosfatos de calcio, los aislados fueron cultivados en el medio NBRIP25 durante 5 días a 30°C con agitación constante. Después, los cultivos fueron centrifugados y el fósforo soluble fue cuantificado en el sobrenadante con el método de azul de molibdeno7.
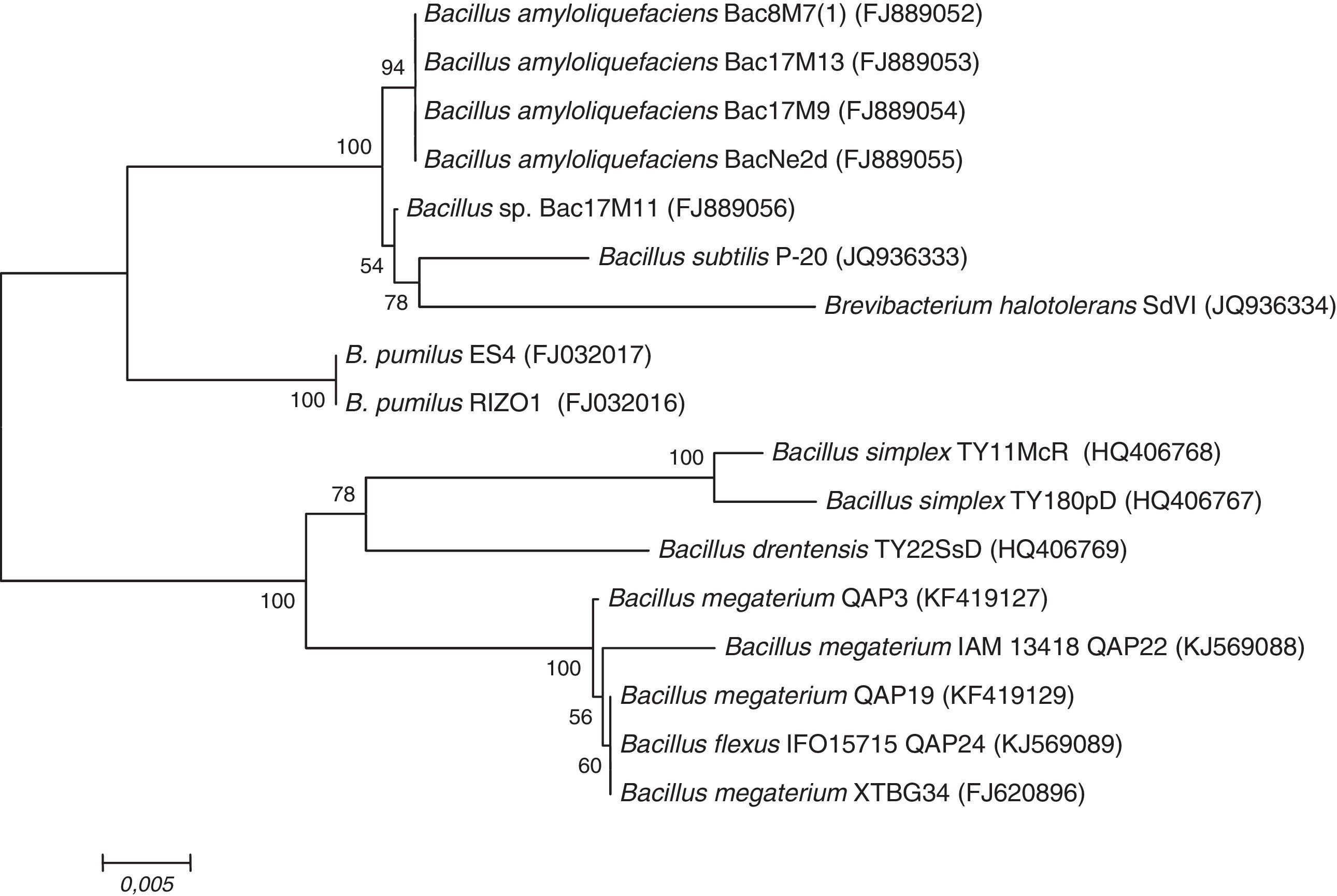
Secuenciación del gen 16S ARNrLa identificación de los aislados fue realizada mediante la amplificación y secuenciación de gen que codifica la subunidad 16S del ARN ribosomal, empleando los oligos fD1 y rD1 y las condiciones propuestas por Weisburg et al.41. El producto resultante de ∼1500 pb fue enviado para secuenciación al Centro de Biotecnología de la UNAM. Las secuencias obtenidas fueron comparadas con otras de Bacillus reportadas como promotoras del crecimiento vegetal en la base de datos del National Center for Biotechnology Information (NCBI), utilizando el programa Blast (http://www.ncbi.nlm.nih.gov/BLAST/). El árbol filogenético fue construido mediante el programa MEGA versión 6.0 usando el método de Neighbor Joining y el modelo de Jukes-Cantor con un bootstrap de 1000 réplicas38.
Preparación de los inóculosPara realizar los ensayos de promoción de la germinación y el crecimiento vegetal, se prepararon inóculos creciendo los aislados en 100ml de caldo nutritivo durante 24h a 30°C, con agitación constante a 180rpm. Después, los cultivos se centrifugaron a 1459×g 15min. La pastilla celular resultante fue lavada con solución salina (NaCl 0,8%) y resuspendida en 5ml para realizar el recuento en la cámara de Neubauer, la densidad celular final fue ajustada a 107 células/ml para los ensayos de inoculación.
Inoculación de semillas de M. magnimammaEn el ensayo de promoción de la germinación, 6 lotes de 50 semillas de M. magnimamma fueron inoculados por inmersión en 5ml de suspensión bacteriana (107 células/ml) con agitación constante durante una hora. Las semillas luego fueron sembradas en charolas con papel de filtro húmedo como sustrato e incubadas en una cámara de crecimiento a 23±5°C. La germinación fue registrada diariamente durante 14 días, considerando germinadas las semillas cuando presentaron emergencia de la radícula.
La viabilidad de las semillas fue determinada por el método bioquímico del tetrazolio: se sumergieron 3 lotes de 50 semillas en agua estéril durante 48h. Después, estas fueron recuperadas y cortadas con un bisturí y sumergidas de nuevo en una solución de tetrazolio al 1% durante 2h. Las semillas consideradas como viables presentaron una coloración rosada-rojiza, producto de la reducción del tetrazolio a formazán por la actividad de las enzimas deshidrogenasas involucradas en la respiración celular30.
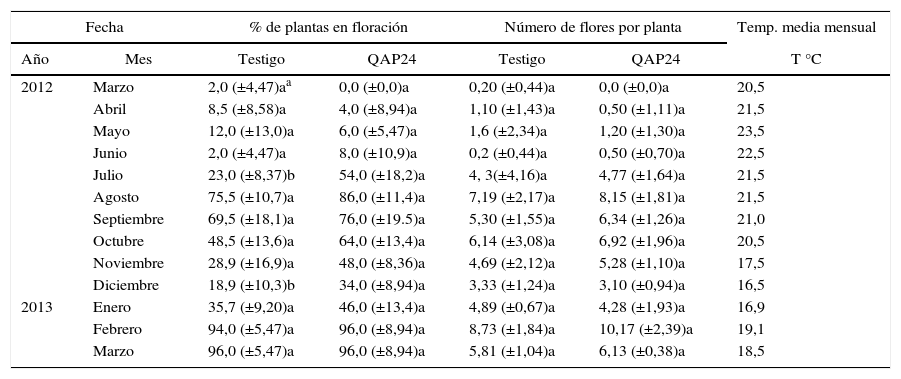
Inoculación de M. zeilmannianaEl ensayo de promoción del crecimiento de plantas de M. zeilmanniana en condiciones de vivero se inició el 16 de marzo del 2012, inoculando la raíz de 50 plantas con 5ml de una suspensión bacteriana de la cepa QAP24, que contenía 107 células/ml. Se efectuaron posteriores inoculaciones a los 75, 135, 150 y 235 días, conservando 50 plantas sin inocular como testigo. La humedad fue mantenida mediante riegos manuales a capacidad de campo, semanalmente en época de calor y espaciándolos en época de frío; la temperatura media mensual fluctuó entre los 16,5 y los 23,5°C, como se muestra en la tabla 1. El diámetro de cada planta fue registrado al inicio y al final del experimento, que duró un año, contabilizando además, semanalmente, el número de plantas en floración y el número de flores por planta.
Efecto de la inoculación de QAP24 sobre la floración de M. zeilmanniana
| Fecha | % de plantas en floración | Número de flores por planta | Temp. media mensual | |||
|---|---|---|---|---|---|---|
| Año | Mes | Testigo | QAP24 | Testigo | QAP24 | T °C |
| 2012 | Marzo | 2,0 (±4,47)aa | 0,0 (±0,0)a | 0,20 (±0,44)a | 0,0 (±0,0)a | 20,5 |
| Abril | 8,5 (±8,58)a | 4,0 (±8,94)a | 1,10 (±1,43)a | 0,50 (±1,11)a | 21,5 | |
| Mayo | 12,0 (±13,0)a | 6,0 (±5,47)a | 1,6 (±2,34)a | 1,20 (±1,30)a | 23,5 | |
| Junio | 2,0 (±4,47)a | 8,0 (±10,9)a | 0,2 (±0,44)a | 0,50 (±0,70)a | 22,5 | |
| Julio | 23,0 (±8,37)b | 54,0 (±18,2)a | 4, 3(±4,16)a | 4,77 (±1,64)a | 21,5 | |
| Agosto | 75,5 (±10,7)a | 86,0 (±11,4)a | 7,19 (±2,17)a | 8,15 (±1,81)a | 21,5 | |
| Septiembre | 69,5 (±18,1)a | 76,0 (±19.5)a | 5,30 (±1,55)a | 6,34 (±1,26)a | 21,0 | |
| Octubre | 48,5 (±13,6)a | 64,0 (±13,4)a | 6,14 (±3,08)a | 6,92 (±1,96)a | 20,5 | |
| Noviembre | 28,9 (±16,9)a | 48,0 (±8,36)a | 4,69 (±2,12)a | 5,28 (±1,10)a | 17,5 | |
| Diciembre | 18,9 (±10,3)b | 34,0 (±8,94)a | 3,33 (±1,24)a | 3,10 (±0,94)a | 16,5 | |
| 2013 | Enero | 35,7 (±9,20)a | 46,0 (±13,4)a | 4,89 (±0,67)a | 4,28 (±1,93)a | 16,9 |
| Febrero | 94,0 (±5,47)a | 96,0 (±8,94)a | 8,73 (±1,84)a | 10,17 (±2,39)a | 19,1 | |
| Marzo | 96,0 (±5,47)a | 96,0 (±8,94)a | 5,81 (±1,04)a | 6,13 (±0,38)a | 18,5 | |
Los porcentajes fueron transformados a grados angulares para el análisis estadístico.
Los ensayos de germinación y promoción del crecimiento fueron realizados con un diseño experimental completamente aleatorizado, donde cada tratamiento consistió en la inoculación de cada cepa y el testigo sin inocular. La unidad experimental estuvo constituida por 50 semillas y 10 plantas, con 6 y 5 repeticiones, respectivamente. Los ensayos bioquímicos fueron realizados por triplicado y los datos obtenidos fueron sujetos a análisis de varianza y prueba de medias (p<0,05)11.
Números de accesoLas secuencias de los genes 16S ARN ribosomales de los aislados bacterianos fueron depositadas en el banco de datos del NCBI con los siguientes números de acceso: KF419127 (QAP3), KF419129 (QAP19), KJ569088 (QAP22) y KJ569089 (QAP24).
ResultadosObtención e identificación de aislados rizosféricosEn el aislamiento y el escrutinio de bacterias de la rizósfera de M. magnimamma y C. radians se obtuvieron 4 aislados bacilares gram positivos, con morfología colonial característica del género Bacillus, los cuales fueron nombrados como QAP3 (el proveniente de M. magnimamma) y como QAP19, QAP22 y QAP24 (los provenientes de C. radians).
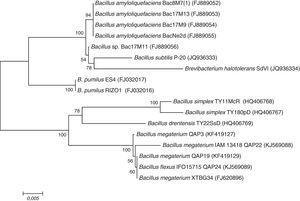
La identificación genética por secuenciación del gen 16S ARNr confirmó que los aislados pertenecían al género Bacillus y que estaban estrechamente relacionados con las especies Bacillus megaterium y Bacillus flexus, con una similitud del 96 al 99%. En el dendrograma (figura 2) se observa que los aislados QAP3, QAP19 y QAP22 muestran alta similitud con B. megaterium; sin embargo, QAP3 se encuentra ligeramente separado en otro clado filogenético, probablemente porque fue aislado de la rizósfera de M. magnimamma, dicho aislado se correlaciona con QAP24, que muestra similitud con B. flexus y se encuentra agrupado con los aislados provenientes de C. radians.
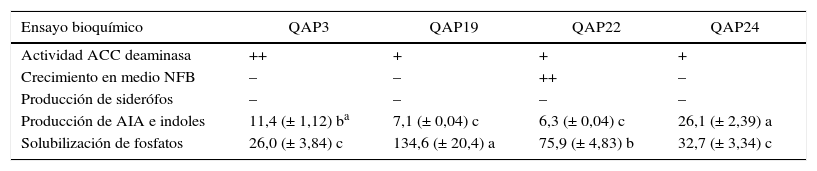
Actividades promotoras del crecimiento vegetalLos resultados de los ensayos bioquímicos muestran que los aislados poseen potencial para la promoción del crecimiento de plantas (tabla 2). El crecimiento de todos los aislados en medio DF indica que poseen actividad enzimática ACC deaminasa, la cual se encuentra relacionada con la disminución en la concentración del etileno, hormona que es producida por las plantas como respuesta a condiciones de estrés biótico y abiótico, y que en altas concentraciones inhibe el crecimiento y el desarrollo16.
Propiedades bioquímicas de los aislados bacterianos relacionadas con la promoción del crecimiento vegetal
| Ensayo bioquímico | QAP3 | QAP19 | QAP22 | QAP24 |
|---|---|---|---|---|
| Actividad ACC deaminasa | ++ | + | + | + |
| Crecimiento en medio NFB | – | – | ++ | – |
| Producción de siderófos | – | – | – | – |
| Producción de AIA e indoles | 11,4 (± 1,12) ba | 7,1 (± 0,04) c | 6,3 (± 0,04) c | 26,1 (± 2,39) a |
| Solubilización de fosfatos | 26,0 (± 3,84) c | 134,6 (± 20,4) a | 75,9 (± 4,83) b | 32,7 (± 3,34) c |
Los valores son el promedio de 3 repeticiones independientes, en mg/l. Se indica entre paréntesis el error estándar de cada valor.
El ensayo de crecimiento en medio carente de nitrógeno solo fue positivo para el aislado QAP22, los microorganismos que crecen en este medio son presuntamente fijadores el nitrógeno (diazótrofos). Esta actividad es llevada a cabo por la enzima nitrogenasa, la cual puede ser confirmada por el ensayo de reducción del acetileno. La producción de AIA e indoles fue registrada en todos los aislados, en un rango de 6,3 a 26,1mg/l, el aislado QAP24 fue el que mostró la mayor producción.
Finalmente, la actividad de solubilización de fosfatos, que fue empleada para el escrutinio de las cepas, dio valores de 26,0 a 134,6mg/l de fósforo soluble en el medio. Esta actividad, dependiente de la producción microbiana de ácidos orgánicos, disminuye el pH haciendo soluble el fosfato tricálcico [Ca3(PO4)2]. El fosfato de aluminio (AlPO4) y el férrico (FePO4) también han sido empleados como fuente de fósforo para el aislamiento de bacterias solubilizadoras, inclusive han permitido seleccionar aislados con mayor actividad, por lo que se sugiere el uso de más de una fuente de fosfatos para el aislamiento y la caracterización de bacterias con esta actividad6.
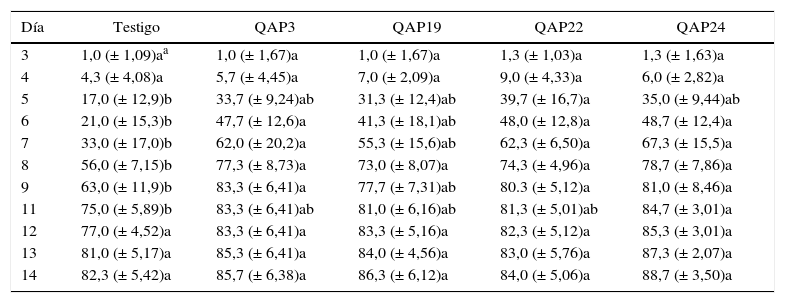
Efecto sobre la germinación de semillas de M. magnimammaPara determinar el efecto de las cepas de Bacillus sobre la germinación de semillas de cactáceas, fue seleccionada M. magnimamma como planta modelo. Se encontró que la inoculación de semillas promovió la germinación, como se puede ver en la tabla 3. En el 5.° día, el aislado QAP22 incrementó el porcentaje de germinación en un 22,7% con respecto al testigo, mientras que los aislados QAP3 y QAP24 mostraron efecto a partir del 6° día, con aumentos de la germinación en un 26,7 y un 27,7%, respectivamente. En general, el aislado QAP24 fue el que demostró el mayor efecto entre el día 6 y el 11, con porcentajes de incremento de hasta el 34,3% con respecto al testigo, seguido por los aislamientos QAP22, QAP3 y QAP19, con incrementos del 29,3, el 29,0 y el 22,3%, respectivamente. La viabilidad de las semillas de acuerdo con el ensayo bioquímico del tetrazolio fue del 84,7 ± 4,2%; este porcentaje de germinación fue alcanzado en el día 11 con la inoculación de QAP24, 3 días antes que en el testigo sin inocular (tabla 3).
Porcentaje de germinación acumulado de semillas de M. magnimamma inoculadas con cepas de Bacillus
| Día | Testigo | QAP3 | QAP19 | QAP22 | QAP24 |
|---|---|---|---|---|---|
| 3 | 1,0 (± 1,09)aa | 1,0 (± 1,67)a | 1,0 (± 1,67)a | 1,3 (± 1,03)a | 1,3 (± 1,63)a |
| 4 | 4,3 (± 4,08)a | 5,7 (± 4,45)a | 7,0 (± 2,09)a | 9,0 (± 4,33)a | 6,0 (± 2,82)a |
| 5 | 17,0 (± 12,9)b | 33,7 (± 9,24)ab | 31,3 (± 12,4)ab | 39,7 (± 16,7)a | 35,0 (± 9,44)ab |
| 6 | 21,0 (± 15,3)b | 47,7 (± 12,6)a | 41,3 (± 18,1)ab | 48,0 (± 12,8)a | 48,7 (± 12,4)a |
| 7 | 33,0 (± 17,0)b | 62,0 (± 20,2)a | 55,3 (± 15,6)ab | 62,3 (± 6,50)a | 67,3 (± 15,5)a |
| 8 | 56,0 (± 7,15)b | 77,3 (± 8,73)a | 73,0 (± 8,07)a | 74,3 (± 4,96)a | 78,7 (± 7,86)a |
| 9 | 63,0 (± 11,9)b | 83,3 (± 6,41)a | 77,7 (± 7,31)ab | 80.3 (± 5,12)a | 81,0 (± 8,46)a |
| 11 | 75,0 (± 5,89)b | 83,3 (± 6,41)ab | 81,0 (± 6,16)ab | 81,3 (± 5,01)ab | 84,7 (± 3,01)a |
| 12 | 77,0 (± 4,52)a | 83,3 (± 6,41)a | 83,3 (± 5,16)a | 82,3 (± 5,12)a | 85,3 (± 3,01)a |
| 13 | 81,0 (± 5,17)a | 85,3 (± 6,41)a | 84,0 (± 4,56)a | 83,0 (± 5,76)a | 87,3 (± 2,07)a |
| 14 | 82,3 (± 5,42)a | 85,7 (± 6,38)a | 86,3 (± 6,12)a | 84,0 (± 5,06)a | 88,7 (± 3,50)a |
Los valores son el promedio del porcentaje de germinación, los que fueron transformados a grados angulares para el análisis estadístico. Se indica entre paréntesis el error estándar de cada valor.
Cabe resaltar que aunque las cepas QAP19, QAP22 y QAP24 fueron aisladas de C. radians, también tuvieron efectos beneficiosos sobre la germinación de semillas de M. magnimamma, estos fueron similares a los observados tras la inoculación con QAP3, el cual forma parte del microbioma de la rizósfera de dicha especie vegetal; esto da cuenta de la versatilidad de estos aislados para ejercer efecto promotor del crecimiento en plantas distintas a su hospedero.
Efecto sobre la floración de M. zeilmannianaPara evaluar el efecto promotor del crecimiento en cactáceas, plantas de M. zeilmanniana fueron inoculadas con la cepa QAP24, que es la que mostró el mayor efecto en el ensayo de germinación. Se detectó un efecto positivo sobre la floración, con un incremento en el porcentaje de plantas con flor con respecto al testigo durante los meses de julio y diciembre del 31,0 y el 15,1%, respectivamente (tabla 1). Esto ocurrió a pesar de que las plantas testigo iniciaron la floración 2 semanas después de haber establecido el ensayo, mientras que las plantas inoculadas con el aislado QAP24 la iniciaron 4 semanas después.
Durante el ensayo, que duró un año, se registraron 2 máximos de floración en M. zeilmanniana: uno en agosto del 2012 y otro en marzo del 2013, y aunque el aislado QAP24 incrementó el porcentaje de plantas en floración, el número de flores en antesis por planta se mantuvo sin diferencias entre el tratamiento y el testigo (tabla 1). Tampoco se observaron diferencias en el crecimiento radial por la inoculación, ambos grupos presentaron un incremento promedio del 52% ± 2,02.
DiscusiónLa microbiota del suelo es esencial para el mantenimiento de los ecosistemas desérticos, donde los microorganismos establecen relaciones beneficiosas con las plantas a través de la rizósfera, contribuyendo a la sobrevivencia, la nutrición y el crecimiento de las especies vegetales en estos ambientes adversos21,35.
Se ha descrito que la composición de los exudados que producen las raíces varía en cada especie; junto con el tipo de suelo, estos factores determinan la composición de las comunidades microbianas de la rizósfera. Dentro de aquellas, las poblaciones bacterianas de Bacillus aparecen como ubicuas.
Bashan y de-Bashan5 reportan los géneros bacterianos Bacillus y Pseudomonas como dominantes de la rizósfera en 4 especies de cactáceas (P. pringlei, Stenocereus thurberi, M. fraileana y O. cholla), en 2 árboles (Ficus palmeri y Pachycormus discolor Benth. Coville) y como endófitos en plántulas del cardón gigante P. pringlei (S. Watson) Britton & Rose. Posteriormente, Aguirre et al.1 analizaron la diversidad microbiana de la rizósfera de Mammillaria carnea Zucc. ex Pfeiff., Opuntia pilifera F.A.C. Weber y S. stellatus (Pfeiff.) Riccob., empleando herramientas moleculares basadas en la amplificación del gen 16S del ARNr y la separación por electroforesis en geles desnaturalizantes. De esa manera, encontraron que la composición de las comunidades bacterianas es diferente entre estas cactáceas, pero comparten el género Bacillus. En nuestro estudio, el aislamiento de cepas de Bacillus provenientes de M. magnimamma y C. radians refuerza el concepto de que este género bacteriano integra la comunidad microbiana de la rizósfera de las cactáceas que crecen en zonas áridas.
La reproducción de cactáceas se lleva a cabo de forma vegetativa y por semilla, esta última es de suma importancia para el mantenimiento de la diversidad genética26. La germinación de las semillas depende de condiciones específicas de humedad, luz y temperatura para romper la latencia. Tal es el caso de M. magnimamma, cuyas semillas son fotoblásticas, ya que responden positivamente a fotoperíodos de 12:12 (horas luz:horas oscuridad) y germinan en un amplio rango de temperaturas (de 15 a 25°C), manteniendo altos porcentajes de viabilidad (83%) hasta después de un año37.
En el presente estudio se encontró que la inoculación de semillas de M. magnimamma con aislados de Bacillus rizosféricos de cactáceas incrementó la germinación hasta un 34,3% en algún momento del ensayo. El aislamiento de Bacillus QAP24 fue el que presentó la mayor inducción y permitió lograr en menor tiempo la mayor tasa de germinación, con un porcentaje de viabilidad similar al reportado por Ruedas et al.37.
En años recientes se ha incrementado el número de reportes sobre aislados rizosféricos que son empleados para inducir la germinación de semillas y mejorar la producción de cereales y hortalizas13,15, pero la información al respecto en cactáceas es mínima.
Puente y Bashan33 utilizaron Azospirillum brasilense Sp 245 proveniente de la rizósfera de trigo para inducir la germinación de semillas de cardón gigante (P. pringlei) y obtuvieron incrementos de hasta el 25%. Este efecto es atribuido a la producción microbiana de AIA más que a la fijación biológica de nitrógeno. El AIA es una fitohormona que pertenece el grupo de las auxinas, su efecto promotor sobre la germinación in vitro de diferentes semillas de especies de cactáceas ha sido documentado2,26. En el ensayo de producción in vitro de AIA e indoles, se detectó en el sobrenadante del aislado QAP24 la mayor cantidad de estos metabolitos con respecto a los demás aislados; esta propiedad bioquímica podría estar relacionada con la inducción de la germinación de semillas de M. magnimamma.
Después de la germinación, toda plántula comienza el desarrollo vegetativo hasta la floración, etapa considerada como crucial para el inicio de la reproducción sexual. Aunque la floración depende de la interacción de factores intrínsecos como el estado de desarrollo de la planta y del estatus nutricional, así como de factores ambientales (fotoperíodo, temperatura, humedad), cada factor puede incidir cambiando el umbral de otro; algunas plantas pueden usar esto a su favor cuando un factor es crítico en su ambiente8. Bowers9 registró durante 2 años la fenología de Mammillaria grahamii Engelm en el desierto de Sonora y encontró hasta 4 períodos de floración cada año, los cuales estuvieron altamente correlacionados (r=0,94; p<0,05) con la presencia de lluvias una semana antes.
Pimienta et al.32 reportan que el agua disponible después de la precipitación promueve el crecimiento de los pelos radicales y la colonización microbiana de la rizósfera de Stenocereus queretaroensis (F.A.C. Weber) Buxb. Así se incrementa la absorción de nutrientes por la planta, lo que resulta en un mayor desarrollo vegetativo, en un incremento en el peso del fruto y en una mayor germinación de las semillas obtenidas de estos frutos. En el ensayo de inoculación en M. zeilmanniana, las plantas presentaron floración durante casi todo el año y, aunque el número de flores por planta no se incrementó con la inoculación de Bacillus QAP24, en los meses julio y diciembre se registró un aumento del 31,0% y el 15,1%, respectivamente, en el número de plantas en floración. Esta inducción pudo deberse a la producción microbiana de AIA. Se ha informado un incremento en la concentración de esta hormona medida por inmunodetección en las etapas iniciales de floración en Opuntia stenopetala Engelm31.
El potencial biotecnológico de bacterias en la producción de flor de corte ha sido documentado por Arriaga et al.3, quienes, después de inocular bulbos de Lilium sp. con Bacillus subtilis Beb-13, redujeron el tiempo hasta el inicio de la floración. Estos autores atribuyeron este efecto a la producción de AIA y a la actividad ACC deaminasa, propiedades bioquímicas también detectadas en Bacillus QAP24 en el presente estudio.
Los resultados expuestos confirman que la rizósfera de cactáceas contiene grupos microbianos que pueden ser empleados en programas de reproducción de cactáceas. Esto se suma a lo observado en reportes previos, que también describen el aislamiento de microorganismos con efecto promotor del crecimiento de cultivos agronómicos como frijol14 y maíz20, y de agentes de control de fitopatógenos4.
ConclusionesLa rizósfera de las cactáceas M. magnimamma y C. radians poseen poblaciones microbianas del género Bacillus con actividades bioquímicas promotoras del crecimiento vegetal, que pueden incrementar la germinación de semillas de cactáceas como M. magnimamma y la floración en M. zeilmanniana. Estos aislados podrían emplearse como herramientas biotecnológicas para programas de reproducción de especies de cactáceas con fines ornamentales o de aquellas cuya extinción se desea evitar.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónLos autores agradecen al Programa de Desarrollo Profesional Docente (PRODEP) de la Secretaría de Educación Pública (SEP) por el financiamiento de esta investigación.
Conflicto de interesesLos autores del presente artículo manifiestan no tener ningún conflicto de intereses.