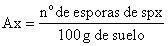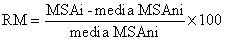Se evaluó la capacidad micotrófica y de esporulación de consorcios microbianos con hongos micorrícicos arbusculares (HMA) nativos de suelos de la provincia de Buenos Aires (Argentina), y se determinó si las características edáficas y los parámetros micorrícicos podrían permitir seleccionar inóculos potencialmente benéficos. Se seleccionaron muestras de suelo provenientes de 7 localidades, cada una bajo manejo agrícola (A) y prístino (P). Se instalaron plantas trampa y a las 10 semanas de crecimiento se evidenció colonización micorrícica en la raíces. El número de esporas del suelo de campo fue bajo, mientras que en el sustrato donde crecieron las plantas trampa varió entre 80–1175 esporas/100g. El análisis de componentes principales indicó que los contenidos de P y Fe en el suelo fueron los principales moduladores de la capacidad micotrófica y de esporulación. Se determinó el potencial micorrícico (PM) de muestras provenientes de tres localidades: Lobería, Junín y Trenque Lauquen. Se verificó un PM elevado en las muestras provenientes de Lobería con suelo prístino y en las de Trenque Lauquen bajo manejo agrícola, mientras que fue bajo en las de Junín. Finalmente, se evaluó la eficiencia en condiciones controladas de suelos-inóculo de Lobería bajo manejo agrícola o prístino en plantas de maíz y de tomate. Si bien los incrementos en la materia seca asociados a la inoculación fueron no significativos (p>0,05), la respuesta micorrícica fue superior al 40 % en tomate y al 25 % en maíz, particularmente con el inóculo proveniente del sitio agrícola. Los bajos incrementos de crecimiento estarían asociados con la incipiente micorrización en ambas especies. Se plantea la necesidad de profundizar los estudios a efectos de determinar los factores involucrados que permitirían seleccionar inóculos eficientes.
We characterized the infective and sporulation capacities of microbial consortia of arbuscular mycorrhizal fungi (AMF) native of Buenos Aires province (Argentina) and determined if some soil characteristics and mycorrhizal parameters could allow to select potentially beneficial inocula. Soil samples were selected from seven locations in Buenos Aires province all under agricultural (A) and pristine (P) conditions. The AMF were multiplied and mycorrhizal root colonization of trap plants was observed at 10 weeks of growth. Spore number in field was low; however, after multiplication spore density accounted for 80-1175 spores per 100g of soil. The principal component analysis showed that the P and Fe soil contents are the main modulators of infectivity and sporulation capacity. The mycorrhizal potential was determined in three locations, being high in Pristine Lobería and Agricultural Trenque Lauquen and low in Junín. Agricultural Lobería (AL) and Pristine Lobería (PL) inocula were selected and their efficiency was evaluated under controlled conditions. Even though shoot dry matter increases after inoculation was not significant (p>0.05) mycorrhizal response was greater than 40% for tomato and 25% for corn, particularly after inoculation with inocula from the agricultural management. These results could be associated to the incipient development of mycorrhizae in both species. Additional research should be conducted to further develop our findings in order to determine the factors involved in the selection of efficient inocula.
La explotación intensiva del suelo de la provincia de Buenos Aires producida por la agricultura convencional de las últimas décadas, con permanente extracción de nutrientes, aceleró su degradación y afectó su fertilidad natural, lo que puso en peligro su productividad30. Sin embargo, las políticas agrícolas a nivel mundial están tendiendo hacia sistemas agrícolas sostenibles, destinados a la producción de cultivos con un mantenimiento del óptimo equilibrio físico, químico y biológico en el suelo. En este sentido, la utilización de microorganismos del suelo con potencialidad para mejorar la nutrición mineral (Rhizobium, Azospirillum, Pseudomonas, hongos formadores de micorrizas, entre otros) se está generalizando y permite disminuir el empleo de fertilizantes. De este modo, se reducen los costos de instalación de los cultivos23 y se mantiene la sostenibilidad de los agroecosistemas.
Las tendencias actuales hacia una agricultura sustentable involucran cambios en las prácticas de manejo, así como la utilización de microorganismos promotores del crecimiento vegetal.
Los hongos formadores de micorrizas arbusculares (HMA) constituyen un grupo de microorganismos cosmopolitas19. Son habitantes del suelo pertenecientes al Phylum Glomeromycota35, que forman asociaciones simbióticas con las raíces de las plantas. Presentan destacada importancia, particularmente por su papel como agentes de transporte de nutrientes de baja movilidad, como P y Zn, hacia la planta36, por lo que son utilizados como biofertilizantes luego de una correcta selección de los HMA más eficientes22.
La mayoría de los cultivos de importancia agrícola forman micorrizas arbusculares y, en muchos casos, evidencian incrementos de la nutrición mineral y el crecimiento36. Aunque algunos estudios han comunicado efectos beneficiosos de la formación de micorrizas sobre el crecimiento de cultivos agrícolas, es difícil evaluar la contribución de los HMA en condiciones de campo18.
En la Argentina, varios autores han comunicado la presencia de HMA nativos. Diehl y Fontenla15 comunicaron la asociación simbiótica de HMA con Araucaria araucana (Molina), una conífera ampliamente distribuida en los bosques andino-patagónicos del sur de Argentina y Chile. En ensayos de larga duración en la zona de La Plata33,34, se determinó elevada biodiversidad natural de HMA asociados a cultivos de trigo. En el sudeste bonaerense, se describió la colonización micorrícica espontánea en trigo12, en pasturas de gramíneas y leguminosas11 y en gramíneas forrajeras tales como agropiro y festuca14.
Las propiedades del suelo y su historia de uso podrían modular la infectividad de los HMA16. Algunas investigaciones indican que las prácticas agrícolas reducen la abundancia y diversidad de los HMA, otras han documentado que niveles elevados de P en el suelo afectan negativamente a los HMA36.
En la provincia de Buenos Aires (Argentina), Covacevich et al.13,14 determinaron que, para una misma área agroecológica, diferentes manejos pueden afectar el potencial micorrícico y la capacidad micotrófica por HMA. Schalamuk y Cabello31,32 comunicaron cambios en la densidad y diversidad de HMA asociados al manejo y al estado fenológico de los cultivos. Djuuna et al.16 utilizaron datos provenientes de 291 muestras de suelo de Australia para evaluar el grado de asociación entre la infectividad de los HMA y las propiedades del suelo, empleando dos modelos estadísticos. Para nuestras condiciones, aún no se cuenta con información suficiente para generar modelos de simulación. Nuestra hipótesis de trabajo es que las características edáficas podrían contribuir a seleccionar HMA nativos de Argentina infectivos y potencialmente benéficos.
Los objetivos del trabajo fueron los siguientes: a) caracterizar la capacidad micotrófica y de esporulación de consorcios microbianos con HMA nativos de sitios con aptitud agrícola de la provincia de Buenos Aires bajo manejos contrastantes (agrícolas y prístinos); b) determinar si las características edáficas o de manejo a las que estos estuvieron expuestos y sus capacidades micotróficas podrían permitir la selección de inóculos potencialmente benéficos.
Materiales y métodosRecolección y selección de las muestras de sueloSe seleccionaron muestras de suelos (Proyecto INTA AERN-295561) de sitios con aptitud agrícola de la provincia de Buenos Aires, cada uno bajo manejo contrastante (agrícola y sin actividad -prístino-). Las muestras de suelo fueron georreferenciadas y compuestas por 10 submuestras extraídas a no más de 50m de radio del punto de georreferencia. Estas fueron obtenidas a una profundidad del perfil entre 0 y 20cm, en similar posición de relieve y del área más representativa de cada lote, y fueron mantenidas en oscuridad a 4°C hasta su procesamiento.
Parte del suelo fue secado a 30°C, tamizado y utilizado en el Laboratorio de Suelos de la EEA INTA-Balcarce para la determinación del contenido de materia orgánica (MO)5, del pH (relación suelo:agua de 1:2,5), del P-Bray5 y de los cationes intercambiables. El Ca y el Mg se determinaron mediante absorción atómica5 (Shimadzu AA-6200, EE. UU.) y el Na y el K por fotometría de llama5 (Corning Flame Photometer 410, EE. UU.), previa extracción con CH3COONH4 (1 N, pH 7). La determinación del contenido de Fe, Mn, Cu y Zn disponible se realizó mediante la extracción con ácido dietilentriaminopentaacético (DTPA), con posterior cuantificación por espectrofotometría de absorción atómica20. La determinación del B disponible se realizó en el Laboratorio Suelo-Fértil (Asociación de Cooperativas Argentinas Coop. Ltda., Pergamino) mediante la cuantificación por colorimetría4, previa extracción con agua caliente.
A partir de los resultados de los análisis químicos de los suelos de 120 sitios, se seleccionaron aquellas localidades que presentaron, al menos en uno de los dos manejos evaluados, valores de P-Bray mayores de 28mg/kg de acuerdo al umbral establecido por Covacevich et al.12 y ubicación espacial diferente dentro la provincia de Buenos Aires. En tal sentido fueron seleccionadas las localidades de Benito Juárez (BJ), Carlos Casares (CC), Coronel Dorrego (CD), Junín (J), Lobería (L), Madariaga (M) y Trenque Lauquen (TL), y de cada una se obtuvieron muestras de suelo bajo manejo agrícola (A) y prístino (P), lo que resultó en 14 sitios de colecta (7 localidades × 2 manejos).
Capacidad micotróficaEl suelo de las localidades seleccionadas fue utilizado para montar cultivos trampa, mezclando el suelo nativo de cada sitio con arena de río estéril (suelo/arena 2:1) en macetas de 100ml con 4 repeticiones. Para obtener plantas hospedadoras de los HMA nativos, se sembraron semillas de raigrás (Lolium multiflorum Lam.) previamente desinfectadas con un tratamiento que consistió en enjuague con H2O destilada, etanol 90 % durante 3min, enjuague con H2O destilada, NaClO comercial al 3,5 % durante 3min y enjuague con H2O destilada. Las plantas fueron criadas en cámara de crecimiento (Laboratorio de Microbiología de Suelos-UI FCA-EEA INTA, Balcarce, 12h luz/12h oscuridad; 23°C), regadas diariamente con H2O destilada y con solución Hoagland con P al 50 % cada dos semanas. Luego de 10 semanas, las plantas fueron descalzadas, parte de las raíces fueron lavadas con agua y procesadas para la tinción con azul de tripán usando una modificación de la metodología propuesta por Phillips y Hayman28, en la que se omitió el uso de fenol en los reactivos. Para ello, las raíces fueron clarificadas con KOH 10 % durante 30min a 60°C, lavadas con H2O, acidificadas con HCl 0,1 N, lavadas con H2O y teñidas con azul de tripán (0,05 %) en lactoglicerol (ácido láctico, glicerol, agua destilada en proporción 1:1:1, 15min, 50°C). Se realizó la cuantificación microscópica8 del grado de colonización micorrícica y de arbúsculos en las raíces mediante observación al microscopio óptico (OLYMPUS BH-2, EE.UU.), registrando los segmentos de raíz colonizados con estructuras de HMA (hifas, arbúsculos). A partir de la relación entre las observaciones donde se registraron estructuras de HMA y las observaciones totales, se calculó el porcentaje de arbúsculos (Ar %) y el de infección total (MA %), que comprendió los segmentos con arbúsculos, con hifas y/o con vesículas de HMA. El sustrato y las raíces no utilizados fueron secados en oscuridad a temperatura ambiente, y conservados para posteriores usos y determinaciones.
Capacidad de esporulaciónTanto del suelo colectado a campo como del sustrato de crecimiento de las plantas trampa, se procedió a la extracción de esporas de HMA a partir de muestras de 40g mediante la técnica de tamizado (malla: 450, 124, 53 y 30μm) en húmedo y decantado y centrifugación (Giumelli Z-29, Argentina) en gradiente de sacarosa al 60 % (http://www.dcs.ufla.br/micorriza/fma_metodos_extracao_de_esporos.html).
Por observación en lupa binocular (Zeiss Stemi SV8, Alemania) se cuantificó el número de esporas que evidenciaron núcleos en su interior como un estimador de viabilidad (http://www.biomedcentral.com/1471-2148/11/51).
Se calculó la abundancia de esporas como un indicador de la capacidad de esporulación, expresando el n.° de esporas/ 100g.
Potencial micorrícicoEl suelo de tres localidades representativas del norte, sudeste y oeste de la provincia de Buenos Aires (Junín, Lobería y Trenque Lauquen, respectivamente), cada uno bajo manejo agrícola y prístino, fue utilizado para la determinación del potencial micorrícico. El suelo fue pasado por tamiz de 2mm de malla, separando los restos vegetales. Parte del suelo fue procesado para erradicar los propágulos viables de HMA con el agregado de 10μl de formaldehído/g suelo10. Se instalaron 6 series experimentales (3 localidades × 2 manejos) en macetas de 100ml; cada una consistió en un sistema de diluciones decimales seriadas5 compuestas por mezclas del suelo nativo y suelo desinfectado de HMA empleando 4 repeticiones por dilución.
Se sembraron plantas trampa con la metodología anteriormente indicada, las que fueron mantenidas en cámara de crecimiento. Luego de 10 semanas, las macetas fueron descalzadas y las raíces se procesaron para la observación de presencia-ausencia de colonización por HMA. El potencial micorrícico fue estimado como el número más probable (NMP) de propágulos micorrícicos/100g suelo empleando las tablas de Alexander, para diluciones 10−1 y sucesivas (p=0,05)5.
Eficiencia micorrícicaPara la selección de inóculos destinados a ser sometidos a un ensayo exploratorio de eficiencia, se consideraron las tres localidades donde se habían determinado todos los parámetros micotróficos (Junín, Lobería y Trenque Lauquen). La selección contempló que los suelos de los cuales provenían los inóculos pertenecieran a la misma localidad y exhibieran características edáficas contrastantes, especialmente en lo referido a P-Bray, MO, Fe y Zn. En este sentido, se seleccionaron los inóculos provenientes de Lobería bajo manejo agrícola (LA) y en condición prístina (LP). Para evaluar la eficiencia micorrícica, se montó un ensayo en cámara de crecimiento con macetas de 100ml que fueron llenadas con un sustrato compuesto de suelo procesado con 10μl formaldehído/g (para la erradicación de HMA) mezclado con perlita y vermiculita autoclavada, en proporción 2:1:1, respectivamente. Los tratamientos comprendieron 2 especies vegetales (maíz y tomate) y 3 tratamientos de inoculación, con 4 repeticiones por especie y tratamiento (total: 24 unidades experimentales): maíz inoculado con sueloinóculo de Lobería agrícola o de Lobería prístino y maíz no inoculado; tomate inoculado con suelo-inóculo de Lobería agrícola o de Lobería prístino y tomate no inoculado. Las macetas fueron mantenidas en cámara de crecimiento y rotadas al azar semanalmente; las plantas fueron regadas diariamente con agua destilada.
El inóculo utilizado consistió en un suelo-inóculo proveniente de los cultivos trampa realizados para determinar la capacidad micotrófica. Las raíces fueron cortadas en segmentos pequeños y mezclados con el suelo-inóculo, el que había sido previamente tamizado utilizando malla de 124μm, a los efectos de eliminar las partículas de sustrato cuyo tamaño no se correspondería con propágulos de HMA. Esto fue confirmado bajo lupa binocular. Cada maceta de tratamiento con inoculación recibió 2g del suelo-inóculo correspondiente.
Se sembraron dos semillas previamente desinfectadas por maceta (maíz: híbrido DK 670, tomate: Florensa N.° 143). Una vez germinadas, se realizó un raleo de plantas dejando solo una por maceta. Luego de la emergencia, los tratamientos no inoculados recibieron un filtrado bacteriano destinado a equilibrar la carga con los tratamientos inoculados. Para ello, 8g de cada inóculo (LA y LP) fueron homogeneizados en 50ml de agua destilada estéril mediante agitación durante 5min en agitador magnético (Hanna Instruments HI 300N, EE. UU.). Luego se filtró (Whatman N.° 2) y se colectaron 40ml de filtrado, que fueron distribuidos a razón de 5ml en cada maceta no inoculada29.
Se colectó el material vegetal de las plantas de maíz y de tomate a 15 y 23 días después de la siembra (DDS), respectivamente. En ambos casos, la parte aérea fue separada de la radical y llevada a estufa a 60°C durante 72h. La cuantificación de la materia seca aérea (MSA) se realizó por gravimetría.
Para cada especie y tratamiento de inoculación se calculó la respuesta micorrícica (RM), parámetro considerado indicador de la eficiencia micorrícica, de acuerdo a la relación descrita por Cavagnaro et al.9
Donde MSAi corresponde al parámetro individual del peso seco de las plantas inoculadas con cada uno de los inóculos y la media MSAni corresponde al peso seco promedio de las plantas no inoculadas.
El material radical de cada tratamiento fue teñido con azul de tripán para la cuantificación microscópica del MA % y Ar % con la metodología anteriormente indicada.
Análisis de los resultadosLos resultados fueron analizados por análisis de la varianza (ANOVA). Cuando las diferencias entre tratamientos fueron significativas, las medias fueron separadas utilizando la prueba estadística de diferencias mínimas significativas (DMS) (p<0,05). Se realizó el análisis de correlación lineal de Pearson y de componentes principales (PCA), este último utilizando el programa CANOCO39, relacionando los resultados de los análisis químicos de las muestras de suelo con los parámetros de capacidad micotrófica y abundancia de esporas de HMA.
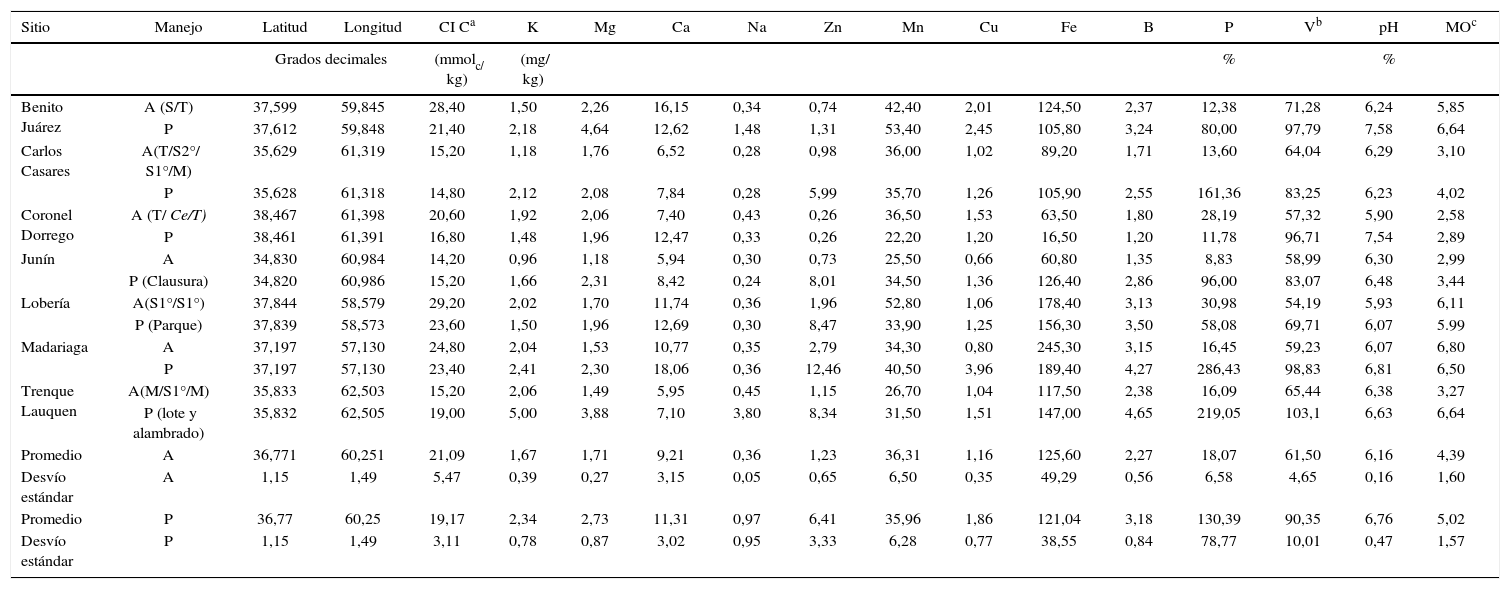
Resultados y discusiónMuestras de sueloLos resultados del análisis fisicoquímico de las muestras de suelo evaluadas se presentan en la tabla 1, donde además, se señalan los valores promedio y desvíos estándar globales calculados para los manejos contrastantes, agrícola (A) y prístino (P). El rango de valores para algunas características fue amplio, como por ejemplo, el contenido de P-Bray, con diferencias de hasta 15 veces entre sitios, y en general, fue mayor para los sitios prístinos que para los agrícolas. Los contenidos de Zn y P-Bray presentaron una elevada variabilidad entre sitios, independientemente del manejo. El pH fue el parámetro que evidenció el menor cambio entre manejos de suelos. En general, los suelos bajo actividad agrícola exhibieron una disminución en la concentración de la mayoría de los nutrientes, a excepción del Mn y del Fe, pero en algunos casos se observaron mayores niveles con el manejo agrícola. Este último efecto podría interpretarse por el menor pH observado bajo agricultura, con un incremento en la disponibilidad en condición de acidez24. De los micronutrientes analizados, el Zn fue el que disminuyó más marcadamente por la agricultura. Por otra parte, también la MO del suelo disminuyó por el uso agrícola, lo que evidenció un balance de carbono negativo.
Ubicación, historia de manejo y características fisicoquímicas de los sitios de colecta de las muestras de suelo.
| Sitio | Manejo | Latitud | Longitud | CI Ca | K | Mg | Ca | Na | Zn | Mn | Cu | Fe | B | P | Vb | pH | MOc |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Grados decimales | (mmolc/ kg) | (mg/ kg) | % | % | |||||||||||||
| Benito Juárez | A (S/T) | 37,599 | 59,845 | 28,40 | 1,50 | 2,26 | 16,15 | 0,34 | 0,74 | 42,40 | 2,01 | 124,50 | 2,37 | 12,38 | 71,28 | 6,24 | 5,85 |
| P | 37,612 | 59,848 | 21,40 | 2,18 | 4,64 | 12,62 | 1,48 | 1,31 | 53,40 | 2,45 | 105,80 | 3,24 | 80,00 | 97,79 | 7,58 | 6,64 | |
| Carlos Casares | A(T/S2°/ S1°/M) | 35,629 | 61,319 | 15,20 | 1,18 | 1,76 | 6,52 | 0,28 | 0,98 | 36,00 | 1,02 | 89,20 | 1,71 | 13,60 | 64,04 | 6,29 | 3,10 |
| P | 35,628 | 61,318 | 14,80 | 2,12 | 2,08 | 7,84 | 0,28 | 5,99 | 35,70 | 1,26 | 105,90 | 2,55 | 161,36 | 83,25 | 6,23 | 4,02 | |
| Coronel Dorrego | A (T/ Ce/T) | 38,467 | 61,398 | 20,60 | 1,92 | 2,06 | 7,40 | 0,43 | 0,26 | 36,50 | 1,53 | 63,50 | 1,80 | 28,19 | 57,32 | 5,90 | 2,58 |
| P | 38,461 | 61,391 | 16,80 | 1,48 | 1,96 | 12,47 | 0,33 | 0,26 | 22,20 | 1,20 | 16,50 | 1,20 | 11,78 | 96,71 | 7,54 | 2,89 | |
| Junín | A | 34,830 | 60,984 | 14,20 | 0,96 | 1,18 | 5,94 | 0,30 | 0,73 | 25,50 | 0,66 | 60,80 | 1,35 | 8,83 | 58,99 | 6,30 | 2,99 |
| P (Clausura) | 34,820 | 60,986 | 15,20 | 1,66 | 2,31 | 8,42 | 0,24 | 8,01 | 34,50 | 1,36 | 126,40 | 2,86 | 96,00 | 83,07 | 6,48 | 3,44 | |
| Lobería | A(S1°/S1°) | 37,844 | 58,579 | 29,20 | 2,02 | 1,70 | 11,74 | 0,36 | 1,96 | 52,80 | 1,06 | 178,40 | 3,13 | 30,98 | 54,19 | 5,93 | 6,11 |
| P (Parque) | 37,839 | 58,573 | 23,60 | 1,50 | 1,96 | 12,69 | 0,30 | 8,47 | 33,90 | 1,25 | 156,30 | 3,50 | 58,08 | 69,71 | 6,07 | 5.99 | |
| Madariaga | A | 37,197 | 57,130 | 24,80 | 2,04 | 1,53 | 10,77 | 0,35 | 2,79 | 34,30 | 0,80 | 245,30 | 3,15 | 16,45 | 59,23 | 6,07 | 6,80 |
| P | 37,197 | 57,130 | 23,40 | 2,41 | 2,30 | 18,06 | 0,36 | 12,46 | 40,50 | 3,96 | 189,40 | 4,27 | 286,43 | 98,83 | 6,81 | 6,50 | |
| Trenque Lauquen | A(M/S1°/M) | 35,833 | 62,503 | 15,20 | 2,06 | 1,49 | 5,95 | 0,45 | 1,15 | 26,70 | 1,04 | 117,50 | 2,38 | 16,09 | 65,44 | 6,38 | 3,27 |
| P (lote y alambrado) | 35,832 | 62,505 | 19,00 | 5,00 | 3,88 | 7,10 | 3,80 | 8,34 | 31,50 | 1,51 | 147,00 | 4,65 | 219,05 | 103,1 | 6,63 | 6,64 | |
| Promedio | A | 36,771 | 60,251 | 21,09 | 1,67 | 1,71 | 9,21 | 0,36 | 1,23 | 36,31 | 1,16 | 125,60 | 2,27 | 18,07 | 61,50 | 6,16 | 4,39 |
| Desvío estándar | A | 1,15 | 1,49 | 5,47 | 0,39 | 0,27 | 3,15 | 0,05 | 0,65 | 6,50 | 0,35 | 49,29 | 0,56 | 6,58 | 4,65 | 0,16 | 1,60 |
| Promedio | P | 36,77 | 60,25 | 19,17 | 2,34 | 2,73 | 11,31 | 0,97 | 6,41 | 35,96 | 1,86 | 121,04 | 3,18 | 130,39 | 90,35 | 6,76 | 5,02 |
| Desvío estándar | P | 1,15 | 1,49 | 3,11 | 0,78 | 0,87 | 3,02 | 0,95 | 3,33 | 6,28 | 0,77 | 38,55 | 0,84 | 78,77 | 10,01 | 0,47 | 1,57 |
A: agrícola; P: prístino. Se indican entre paréntesis los cultivos incluidos en las rotaciones: Ce= cebada; M= maíz; S1 = soja de primera; S2°= soja de segunda; T= trigo.
En las dos últimas filas se muestran los valores promedio y los desvíos estándar globales calculados para los manejos contrastantes, agrícola (A) y prístino (P).
Análisis químicos:
En todas las localidades y bajo las distintas condiciones de manejo se comprobó la colonización micorrícica en la raíces de las planta trampa por observación de estructuras características de HMA en las células corticales de la raíz (figs. 1A, B y C). Al igual que en el trabajo de Nardini et al.26, también en este estudio se registró la presencia de hifas, arbúsculos y vesículas de HMA. El porcentaje de infección varió de 4,8 % a 56,7 % entre localidades. El porcentaje de arbúsculos llegó a un máximo de 35 % en Carlos Casares, mientras que en la localidad de Madariaga bajo manejo prístino no se observó presencia de arbúsculos en las plantas trampa (tabla 2).
Panel superior: Las flechas detallan el reconocimiento de hifa (A), de vesícula (B) y de arbúsculo (C) de HMA en raíz de raigrás (40X) por tinción de Phillips y Hayman modificada, según se describe en Materiales y métodos. Panel inferior: Crecimiento diferencial asociado a la inoculación en plantas de maíz (D) y de tomate (E). NI: no inoculado; ILA: inóculo proveniente de Lobería agrícola; ILP: inóculo proveniente de Lobería prístino.
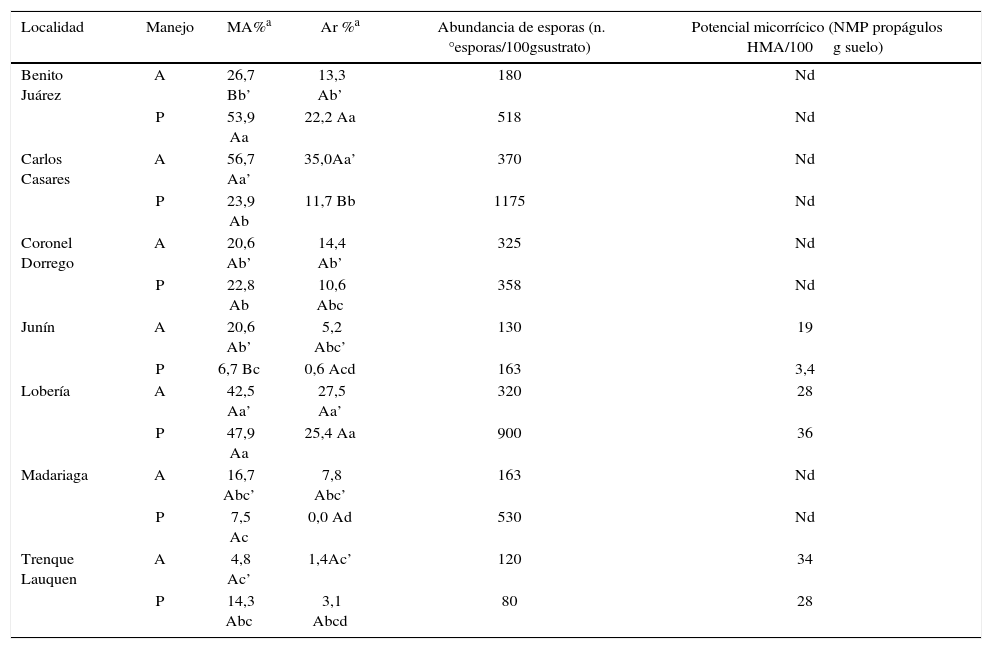
Indicadores de capacidad micotrófica y de esporulación y del potencial micorrícico de los suelos a partir de los resultados obtenidos empleando raigrás como planta hospedadora.
| Localidad | Manejo | MA%a | Ar %a | Abundancia de esporas (n.°esporas/100gsustrato) | Potencial micorrícico (NMP propágulos HMA/100g suelo) |
|---|---|---|---|---|---|
| Benito Juárez | A | 26,7 Bb’ | 13,3 Ab’ | 180 | Nd |
| P | 53,9 Aa | 22,2 Aa | 518 | Nd | |
| Carlos Casares | A | 56,7 Aa’ | 35,0Aa’ | 370 | Nd |
| P | 23,9 Ab | 11,7 Bb | 1175 | Nd | |
| Coronel Dorrego | A | 20,6 Ab’ | 14,4 Ab’ | 325 | Nd |
| P | 22,8 Ab | 10,6 Abc | 358 | Nd | |
| Junín | A | 20,6 Ab’ | 5,2 Abc’ | 130 | 19 |
| P | 6,7 Bc | 0,6 Acd | 163 | 3,4 | |
| Lobería | A | 42,5 Aa’ | 27,5 Aa’ | 320 | 28 |
| P | 47,9 Aa | 25,4 Aa | 900 | 36 | |
| Madariaga | A | 16,7 Abc’ | 7,8 Abc’ | 163 | Nd |
| P | 7,5 Ac | 0,0 Ad | 530 | Nd | |
| Trenque Lauquen | A | 4,8 Ac’ | 1,4Ac’ | 120 | 34 |
| P | 14,3 Abc | 3,1 Abcd | 80 | 28 |
A: agrícola, P: prístino.
MA %: porcentaje de colonización micorrícica (infección total), calculado según se indica en Materiales y métodos.
Ar %: porcentaje de arbúsculos, calculado según se indica en Materiales y métodos.
Nd: no determinado.
Valores seguidos de letras mayúsculas distintas indican diferencias significativas entre manejos contrastantes para la localidad (p<0,05); letras minúsculas distintas indican diferencias significativas entre localidades para cada manejo (p<0,05); letra con apóstrofe: agrícola; letra sin apóstrofe: prístino.
El análisis estadístico evidenció interacciones localidad × manejo para los parámetros de capacidad micotrófica (datos no mostrados). Por esta razón se analizaron las diferencias entre manejos para cada localidad, así como entre localidades para cada uno de los manejos. El MA % varió significativamente entre manejos solo en 2 de las 7 localidades evaluadas: en un caso (Benito Juárez) fue mayor en el prístino y en otro (Junín) fue mayor en el agrícola (tabla 2). Se detectaron diferencias significativas en el porcentaje de arbúsculos (Ar %) solo en la localidad de Carlos Casares, cuyas plantas trampa cultivadas en suelo colectado bajo manejo agrícola presentaron un mayor contenido de arbúsculos en sus raíces. En algunos casos (Carlos Casares y Lobería bajo manejo agrícola), la mayor capacidad micotrófica se correspondió con el menor contenido de P-Bray del sitio agrícola evaluado, comparando los dos manejos. Sin embargo, esto no ocurrió en todas las situaciones. Es probable entonces que las diferencias de colonización se deban, además, a otras características del sustrato no consideradas en este estudio.
Al separar por manejo de suelo, tampoco se obtuvo un patrón uniforme en todas las localidades. Lobería presentó mayor capacidad micotrófica tanto para la situación agrícola como para la prístina, mientras que Benito Juárez y Carlos Casares lo hicieron para la situación agrícola y prístina, respectivamente. Parte de nuestros resultados confirman lo comunicado por Covacevich et al.13 para muestras de otros sitios colectados en las localidades de Benito Juárez (A), Coronel Dorrego (A), Junín (A) y Trenque Lauquen (P).
Nuestros resultados constituyen la primera comunicación de la capacidad micotrófica por HMA nativos en la localidad de Madariaga.
Capacidad de esporulaciónNo se obtuvieron esporas nucleadas a partir de las muestras de suelo colectadas directamente del campo (datos no mostrados). Troeh y Loynachan41 informaron resultados similares, con recuentos bajos (< 1 espora/g suelo) en muestras colectadas en diferentes sitios agrícolas de Iowa, EE. UU. En nuestro trabajo, si bien el número de esporas a campo fue bajo, la capacidad micotrófica de las plantas trampa fue elevada. Es probable, entonces, que los propágulos micorrícicos en las muestras de suelo fueran principalmente segmentos de hifas y raíces colonizadas, más que esporas.
La abundancia de esporas de HMA en el sustrato donde crecieron las plantas trampa se mantuvo en el rango de 80-1175 esporas/100g (tabla 2). Lugo y Cabello21 observaron valores similares (50 a 2000 esporas/100g) en muestras de suelo del sur de Córdoba, Argentina. Sin embargo, estos resultados son menores que los obtenidos por Zangaro et al.42, quienes obtuvieron valores entre 4000 y 8000 esporas/100g suelo. Las diferencias mencionadas podrían atribuirse, en parte, a la disparidad de los biomas en estudio. Mientras que en este trabajo se analizaron suelos con aptitud agrícola, Lugo y Cabello examinaron suelos provenientes de praderas de gramíneas del centro de Argentina, y que Zangaro et al. estudiaron suelos de ambientes de bosque del sur de Brasil. Otra posibilidad es que se requieran más de 10 semanas de multiplicación para la producción de esporas de todos los propágulos viables31.
En 6 de las 7 localidades evaluadas, se registró mayor abundancia de esporas en suelos prístinos que en los agrícolas (tabla 2). Particularmente en Benito Juárez, Carlos Casares, Lobería y Madariaga, la abundancia de esporas en los sitios prístinos triplicó a la registrada en los agrícolas. En Coronel Dorrego, la abundancia de esporas fue similar entre ambas condiciones y en Trenque Lauquen fue levemente superior en el sitio agrícola. En todos los casos, la abundancia de esporas fue el parámetro más elevado de propágulos capaces de formar micorrizas; y se encontraron muestras (Carlos Casares y Madariaga con manejo prístino) en las que, aun habiéndose observado abundancia de esporas, se obtuvieron valores bajos de colonización micorrícica. La correlación entre la abundancia de esporas y la colonización micorrícica fue baja (r=0,37) y sin significancia estadística (p=0,197). Esto coincide con lo comunicado en Argentina por Becerra et al.3, quienes tampoco encontraron correlación entre el número de esporas y la colonización micorrícica. Esto puede deberse a que las hifas se desarrollan más rápido que las esporas, acelerando la infección en mayor grado que si esta proviniera de su germinación. Tommerup40 demostró que la germinación despareja de las esporas podría estar relacionada con la dormición que presentan desde su formación, la que varía entre especies de HMA. Por ejemplo, para Glomus caledonium y Glomus monosporum, el período de dormancia fue de 6 semanas en suelos húmedos y de 5 semanas en suelos secos. Para Gigaspora calospora, fue de 12 y 6 semanas en suelos húmedos y secos, respectivamente; mientras que para Acaulospora laevis, en todas las condiciones de suelo se obtuvieron períodos de dormancia que alcanzaron los 6 meses.
Luego del período de dormición, bajo condiciones adecuadas de humedad y temperatura, las esporas podrían ser capaces de germinar rápidamente y de forma sincronizada. En nuestro caso, es posible entonces que al momento de realizar el recuento, gran parte de las esporas se encontraran en período de dormancia, por lo que no habrían contribuido a la colonización micorrícica a las 10 semanas de instaladas las plantas trampa. La instalación de los cultivos trampa permitió aumentar el número de esporas recolectadas en comparación con el suelo proveniente del campo, donde no se pudieron recolectar esporas nucleadas. Esto coincide con lo comunicado por Troeh y Loynachan41, quienes utilizando cultivos trampa observaron no solo aumentos en la abundancia de esporas, sino también aumentos en la colonización por HMA. Es probable entonces que los propágulos micorrícicos de los suelos utilizados en este estudio consistieran en segmentos de hifas y raíces colonizadas, más que en esporas. Asimismo, es probable también que las esporas generadas en los cultivos trampa hayan provenido de las hifas activas de los HMA que colonizaron las plantas trampa.
La formación de esporas es una de las fases del ciclo de los hongos micorrícicos que daría cuenta de su llegada a la madurez7. En general, la esporulación puede ocurrir entre la 4.ª y la 8.ª semana de iniciada la micorrización bajo la mayoría de las condiciones31, excepto bajo elevados contenidos de P, lo que puede inhibir la formación de micorrizas12,17. En este ensayo las determinaciones se realizaron a la 10.ª semana de crecimiento. Por dicha razón, se considera que el tiempo que permanecieron las raíces de las plantas trampa en contacto con los propágulos nativos fue suficiente para permitir el establecimiento y la estabilización de la colonización micorrícica.
Si bien se realizaron análisis de correlación lineal de Pearson, no se obtuvieron asociaciones significativas entre los parámetros fisicoquímicos y los micorrícicos en los suelos estudiados (datos no mostrados).
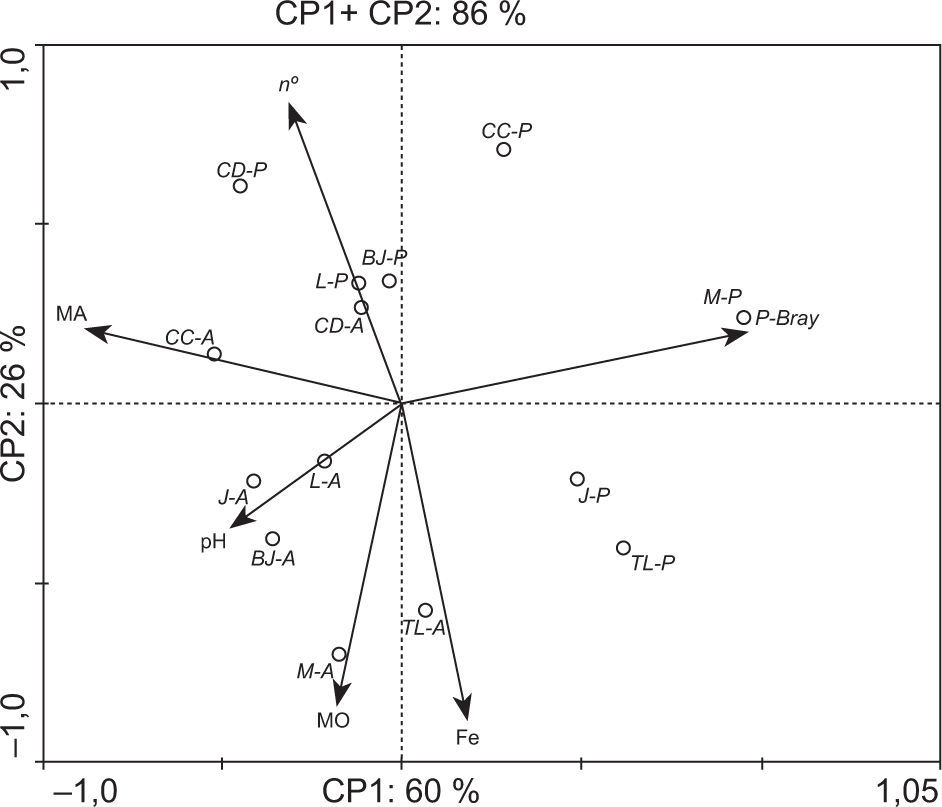
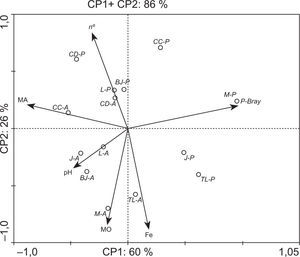
El análisis de componentes principales (PCA) basado en las características químicas de los suelos, la capacidad micotrófica y la abundancia de esporas de las plantas trampa que crecieron en dichos sustratos permitió separar los sitios de estudio según su manejo (fig. 2). El análisis explicó el 86 % de la variabilidad total en los dos primeros componentes, con un 60 % de la varianza explicada por el componente principal 1 (CP1, eje horizontal). Asimismo, el CP1 muestra una asociación positiva (a la derecha) con el contenido de Fe y P-Bray, explicada principalmente por los suelos de los sitios prístinos. En oposición (a la izquierda), se proyectan negativamente el parámetro de micorrización (MA %) junto con el n.° de esporas (n.°). De esta manera, el CP1 sintetizó el manejo del suelo separando casi en su totalidad los sitios bajo agricultura de los prístinos. El CP2 (vertical) explicó aproximadamente el 26 % de la variabilidad y mostró proximidad entre el MA % y el n.° de esporas con el pH del suelo y el contenido de materia orgánica (MO). En general, las relaciones entre la capacidad micotrófica y las propiedades del suelo mostraron que solo algunas propiedades tuvieron influencia sobre la infectividad de los HMA. En este sentido, se evidenció asociación negativa (flechas opuestas) entre MA % y P-Bray, y entre el número de esporas con el contenido de Fe. Estos resultados confirman los obtenidos por Covacevich et al.13 en suelos de sistemas productivos de la provincia de Buenos Aires, donde la capacidad de formar micorrizas de los HMA nativos se asoció principalmente con la disponibilidad de P y Fe, y no con el manejo agrícola de los suelos. De igual manera, estos resultados coinciden con lo publicado por Covacevich et al.12,14 y Siddiqui et al.36, al evidenciar que el P disponible en el suelo se asocia negativamente con la formación de micorrizas. Sin embargo, estos resultados no coinciden con lo comunicado por Djuuna et al.16 para suelos de Australia, quienes no encontraron relación entre la capacidad micotrófica y el contenido de P en el suelo. Según estos autores, solo la elevación de los sitios y el C orgánico (parámetro que en ocasiones presentó resultados contradictorios) parecieron modular el grado de micorrización. En nuestro estudio, todas las muestras fueron colectadas de sitios con similar pendiente, y si bien la MO se asoció con la capacidad infectiva, no se evidenciaron efectos moduladores tan fuertes como los del contenido de P o Fe. En nuestro conocimiento, no hay reportes disponibles sobre la relación entre el contenido de Fe en el suelo y la capacidad de esporulación. En este sentido, cabe destacar que la asociación negativa entre el contenido de Fe en el suelo y la abundancia de esporas de HMA podría considerarse una evidencia de efectos del nutriente sobre los HMA, y constituiría esta la primera comunicación puntualmente referida a suelos de la provincia de Buenos Aires.
Análisis de componentes principales (PCA) basado en las características químicas de los suelos colectados bajo manejo agrícola (A) o prístino (P) en relación con la capacidad micotrófica (MA = colonización micorrícica) y la abundancia de esporas (n.°) determinada en los cultivos trampa. BJ: Benito Juárez; CC: Carlos Casares; CD: Coronel Dorrego; J: Junín; L: Lobería; M: Madariaga; TL: Trenque Lauquen.
Las muestras seleccionadas provinieron del norte, oeste y sudeste de la provincia de Buenos Aires. Los valores más altos de NMP de propágulos capaces de formar micorrizas en los suelos se registraron en Lobería suelo prístino y en Trenque Lauquen manejo agrícola (tabla 2). En contraste, los suelos de Junín, tanto bajo manejo agrícola como prístino, presentaron el menor potencial micorrícico. Estos valores fueron menores que los informados por Covacevich et al.14, en donde estos se mantuvieron en el rango de 700 a 1400 propágulos/100g en suelos de pasturas del sudeste de la provincia de Buenos Aires. Si bien los ambientes no serían comparables, nuestros resultados serían similares a los obtenidos por Silva et al.37 en suelos de Brasil (entre 1,1 y 36 propágulos/100g suelo).
Las correlaciones entre la abundancia de esporas y el potencial micorrícico así como entre este último y la capacidad micotrófica fueron bajas (r=0,44 p=0,378 y r=0,46 p=0,356, respectivamente) y no estadísticamente significativas. Estos resultados no fueron los esperados y contradicen lo que refieren algunas publicaciones. Azcón-Aguilar et al.2 mencionaron que el número de esporas correlacionó positiva y significativamente con el potencial micorrícico de suelos del sudeste de España. En nuestro estudio, las muestras colectadas en Trenque Lauquen, particularmente en situación prístina, aun cuando evidenciaron elevado potencial micorrícico, presentaron una baja capacidad micotrófica y abundancia de esporas en los cultivos trampa (tabla 2). Si bien el elevado contenido del P-Bray en dicho sitio, con más de 200mg/kg en situación prístina, podría haber afectado negativamente la capacidad micotrófica y la esporulación, también se hubiera esperado un efecto similar para el potencial micorrícico. Se desconocen las causas de esta discordancia; deberían dirigirse futuros estudios a dilucidar este aspecto.
La abundancia de esporas cuantificada en los suelos de las plantas trampa fue siempre mayor que el potencial micorrícico. Lo mismo fue comunicado por Silva et al.37, en su estudio de suelos provenientes de Brasil. Esto puede deberse, por un lado, a que las esporas son estructuras más resistentes que otros tipos de propágalos y podrían permanecer por más tiempo en el suelo si se compara con las hifas o los restos vegetales micorrizados. Por otra parte, podría haberse incurrido en una sobreestimación de este parámetro, dado que en ocasiones, esporas con núcleos visibles pueden no germinar (http://www.biomedcentral.com/1471-2148/11/51). Asimismo, tal vez las esporas se encontraban en estado de dormancia, por lo que quizá no pudieron formar micorrizas dentro de las 10 semanas de establecidas las plantas trampa.
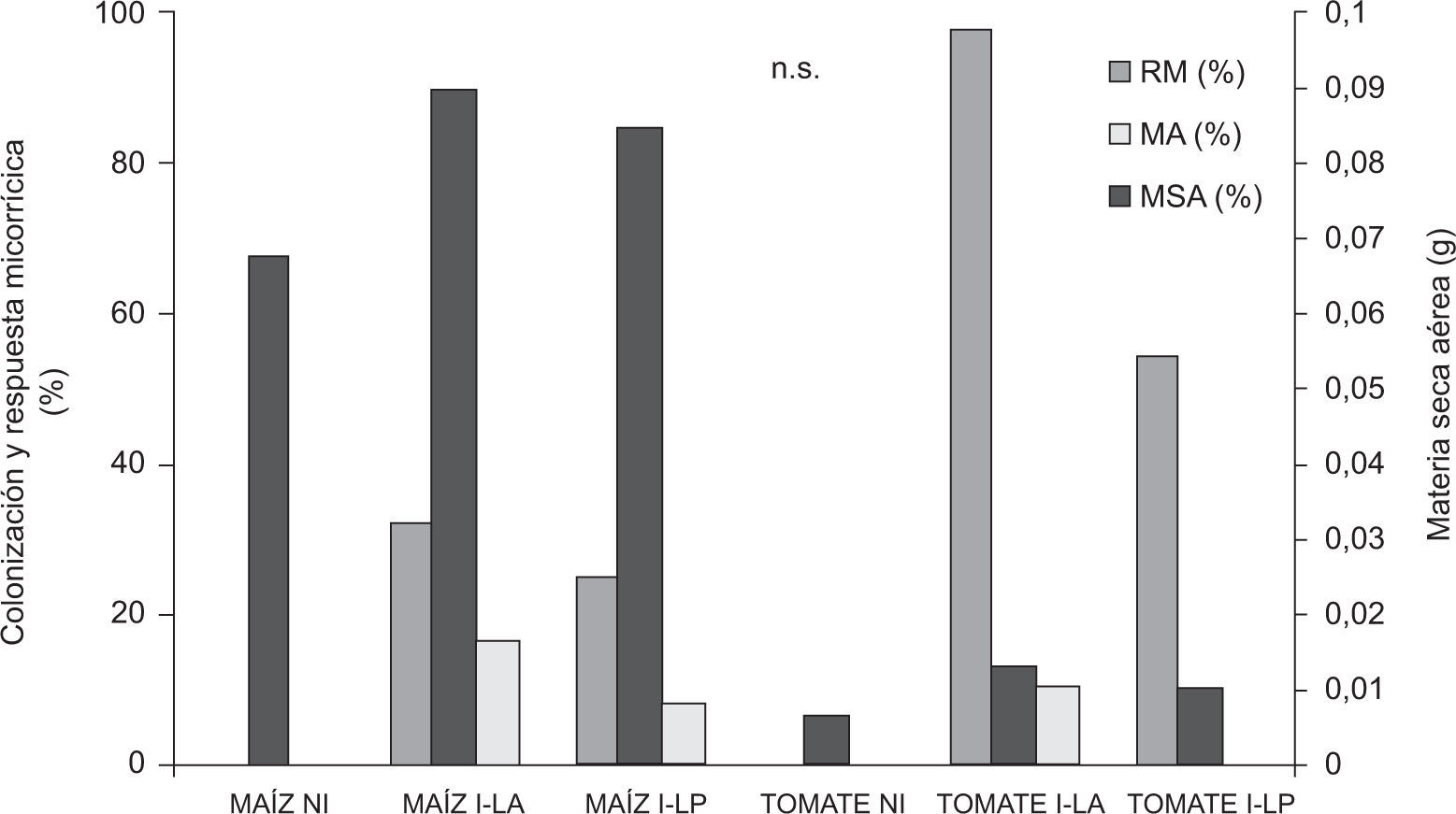
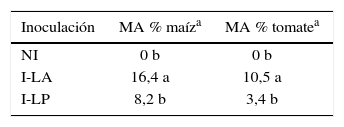
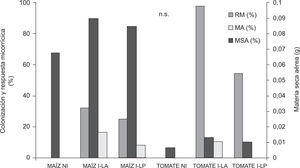
Eficiencia micorrícicaLas muestras provenientes de Lobería registraron alto potencial micorrícico y capacidad micotrófica en las planta trampa, y abundancia intermedia-alta de esporas en comparación con Junín y Trenque Lauquen, donde se observaron menores valores para todos los parámetros mencionados (tabla 2). El suelo-inóculo seleccionado de Lobería permitió un mayor crecimiento de las plantas de maíz, a juzgar visualmente (fig. 1D), y si bien se registraron incrementos de MSA por la inoculación, estos no fueron estadísticamente significativos. La mayor RM se registró en las plantas inoculadas con suelo de LA: 32 %, en comparación con las inoculadas con suelo de LP: 25 % (fig. 3). Como era de esperar, las plantas no inoculadas no evidenciaron colonización micorrícica, mientras que la mayor capacidad micotrófica en plantas de maíz se registró por la inoculación con suelo de LA (tabla 3).
Producción de materia seca aérea (MSA), colonización micorrícica (MA) y respuesta micorrícica (RM) de plantas de maíz y tomate a los 15 y 23 DDS, respectivamente, en función de la inoculación. NI: no inoculado, I-LA: inoculado con inóculo proveniente de Lobería agrícola; I-LP: inoculado con inóculo proveniente de Lobería prístino. n.s.: no significativo (p>0,05).
De manera similar a lo mencionado para maíz, también se observaron diferencias visuales por la inoculación en tomate (fig. 1E). Aun así, las diferencias en producción de MSA fueron estadísticamente no significativas, a pesar de que se registraron algunos incrementos en la producción de MSA, que representaron una RM superior al 90 % y 50 % para las plantas inoculadas con suelo de LA y LP, respectivamente (fig. 3). De manera similar a lo mencionado en el caso del maíz, no se registró evidencia de colonización micorrícica en las plantas no inoculadas, Aun cuando la capacidad micotrófica fue baja para ambos tratamientos inoculados, independientemente del manejo previo, fue mayor en las plantas inoculadas con LA (tabla 3).
Las RM positivas por la inoculación con HMA en maíz serían coincidentes con lo que informa Astiz Imaz1, quien tampoco obtuvo incrementos de crecimiento estadísticamente significativos. En su estudio, Astiz Imaz1 también observó respuestas micorrícicas positivas en plantas de maíz a los 45 DDS por la inoculación con HMA provenientes de dos localidades de la provincia de Buenos Aires: Lobería, con otros inóculos diferentes de los utilizados en este estudio, y Coronel Dorrego.
En algunos trabajos realizados en el extranjero también se hallaron efectos positivos por la inoculación con HMA27,38. Sin embargo, algunas publicaciones son contradictorias. Blanco y Gutiérrez6 encontraron respuesta negativa en maíz a los 48 DDS por la inoculación con HMA provenientes de un ecosistema nativo de Costa Rica (34mg P/kg, 223mg Fe/ kg, 6,10 % MO y textura arcillosa). Los citados autores han atribuido la falta de respuesta a la inoculación tanto a un desbalance entre K, N y P en el sustrato de crecimiento (lo que podría haber provocado una disminución del efecto de las micorrizas) como a la baja efectividad de los HMA nativos utilizados como inoculantes.
Las RM positivas en la producción de biomasa de tomate por la inoculación con HMA obtenidas en este estudio serían similares a las obtenidas por Mujica Pérez y Fuentes Martino25, quienes obtuvieron en esta especie efectos positivos, aunque no significativos, por la inoculación con HMA. Además, Subramanian et al.38 informaron que plantas de tomate inoculadas presentaban mayor altura que las no inoculadas, independientemente de la condición de humedad del suelo; sin embargo, la RM fue mayor en los tratamientos sometidos a sequía grave.
En este trabajo, si bien los incrementos de crecimiento debido a la inoculación fueron no significativos, las dos especies mostraron un valor de RM positivo, alcanzando valores del 95 % de MSA en tomate. Tanto con maíz como con tomate, la mayor RM se obtuvo por la inoculación con los inóculos provenientes de LA. Estos inóculos, provenientes de suelos con elevados contenidos de MO y Fe y con moderados niveles de P-Bray, fueron los que presentaron mayor capacidad micotrófica, intermedio-alto potencial micorrícico y abundancia de esporas. Asimismo, la mayor micorrización en maíz y tomate se registró por la inoculación con el suelo-inóculo proveniente de LA. Si bien la micorrización fue baja (probablemente a consecuencia del corto tiempo de exposición de las plantas a los inóculos –menos de 30 días–), se obtuvieron incrementos de crecimiento no significativos, en correspondencia con la aún incipiente micorrización.
ConclusionesEl manejo de uso del suelo (agrícola y prístino) no afectó a los parámetros de micorrización evaluados (capacidad micotrófica, potencial micorrícico y abundancia de esporas). Asimismo, los elevados contenidos de P y Fe en el suelo se manifestaron como depresores de la capacidad micotrófica y de esporulación en asociación con plantas-trampa de raigrás.
La inoculación con consorcios microbianos (con HMA) nativos de Lobería provenientes de lotes bajo manejo agrícola llevó a una RM positiva en maíz y tomate. Los experimentos fueron exploratorios, pero los resultados sugieren que los bajos incrementos de crecimiento serían consecuencia de una simbiosis micorrícica incipiente. La mayor eficiencia del inóculo proveniente del sitio agrícola es un hallazgo novedoso, en tal sentido deberían encararse futuros estudios orientados a establecer los mecanismos involucrados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
El presente trabajo fue realizado con fondos de los proyectos PIP 1142010010025201, AERN 295582; AGR 400/12 y PICT2011-1413. Thougnon Islas agradece a la Comisión de Investigaciones Científicas de la Provincia de Buenos Aires por la beca BENTR12 otorgada durante el desarrollo del presente trabajo y al Dr. Mondino por su asistencia en el análisis estadístico de componentes principales.