Escherichia coli productor de verotoxina [verotoxin-producing E. coli (VTEC)] es el agente causal del síndrome urémico hemolítico (SUH), enfermedad que afecta principalmente a niños de edades comprendidas entre 6 meses y 5 años. La transmisión se produce por el consumo de alimentos contaminados, por el contacto directo con animales o con el medio ambiente y de persona a persona. En trabajos anteriores hemos determinado que el medio ambiente del tambo es un reservorio no animal de VTEC, por lo cual nos propusimos estudiar la supervivencia de 4 aislamientos VTEC (O20:H19; O91:H21; O157:H7 y O178:H19) en agua estéril de bebederos y en materia fecal de bovinos mediante el recuento de bacterias viables y la detección de genes de virulencia por PCR. Se demostró que la supervivencia de los distintos aislamientos VTEC (O157 y no-O157) varía en función de sus características intrínsecas y de las condiciones del medio ambiente en el que se encuentran. Las principales diferencias entre los aislamientos fueron el tiempo de supervivencia en los microcosmos y los recuentos máximos alcanzados. La capacidad para adaptarse y sobrevivir de estos microorganismos aumenta el riesgo de transmisión a las personas que trabajan en los establecimientos ganaderos o que se encuentran de visita en ellos, así como el riesgo de reinfección de los animales y de contaminación de los alimentos.
Verotoxin-producing Escherichia coli (VTEC) is the etiologic agent of hemolytic-uremic syndrome (HUS), which typically affects children ranging in age from six months to five years old. Transmission is produced by consumption of contaminated food, by direct contact with animals or the environment and from person to person. In previous studies we determined that the environment of a dairy farm is a non-animal reservoir; thus, we proposed to study the survival of 4 VTEC isolates (O20:H19; O91:H21; O157:H7 and O178:H19) in sterile water troughs and bovine feces by viable bacteria count and detection of virulence genes by PCR. It was demonstrated that the survival of different VTEC isolates (O157 and non-O157) varied in terms of their own characteristics as well as of the environmental conditions where they were found. The main differences between isolates were their survival time and the maximal counts reached. The competitive and adaptive characteristics of some isolates increase the infection risk for people that are visiting or working on a farm, as well as the risk for reinfection of the animals and food contamination.
Argentina es el país con mayor incidencia de síndrome urémico hemolítico (SUH) a nivel mundial (17/100 000 niños menores de 5 años)37. El principal agente causal de esta afección es Escherichia coli productor de verotoxina VT1 y VT2 (VTEC)5,22. Estas toxinas producen muerte celular en los tejidos de los órganos afectados: riñón, intestino, hígado, páncreas y sistema nervioso central1. Los genes vt1 y vt2 se encuentran codificados en fagos que se insertan en el cromosoma bacteriano, lo cual facilita la transmisión horizontal de la información a otras bacterias5,20. Otros factores de virulencia importantes de VTEC son la intimina, codificada por el gen eae y necesaria para producir la lesión de adherencia y borrado del enterocito (lesión A/E), y una hemolisina enterohemorrágica (EhxA) codificada en un plásmido32,44. En cepas eae negativas se ha identificado una proteína autoaglutinante de membrana externa (Saa) que le permitiría la adherencia al tejido del intestino. Este hallazgo sugiere que el gen eae no sería esencial para la virulencia de VTEC32. La emergencia de la cepa O104:H4, con características enteroagregativas y enterohemorrágicas y causante de dos brotes de SUH y colitis hemorrágica (CH) en Alemania y Francia (859 casos de SUH y 50 muertos entre mayo y julio de 2011), refuerza la importancia de la transferencia horizontal de los factores de virulencia que están codificados en elementos genéticos móviles de E. coli, como plásmidos, fagos, transposones e islas de patogenicidad9,19,26.
En Argentina, la mayoría de los casos de CH y SUH son producidos por el serotipo O157:H7, aunque serotipos no- O157 son responsables del 40 % de ellos36. La transmisión se produce debido al consumo de alimentos contaminados, como carne mal cocida, vegetales de hoja, leche no pasteurizada, frutas, salames, mayonesas, yogures y aguas contaminadas40. En los últimos 20 años se ha observado un incremento en el número de casos de enfermedad relacionados con el medio ambiente, a través del contacto con agua superfi cial o subterránea y el contacto con el suelo en áreas de cría intensiva de ganado7,17,29,38. Otros casos de infecciones con VTEC en humanos han ocurrido por el consumo de frutas y vegetales cultivados en suelos abonados con efluentes de granjas8,23,34.
Se ha comprobado que la población rural expuesta al contacto directo con materia fecal de bovinos posee una incidencia mayor de casos de SUH (12,7 casos cada 100 000 habitantes) en comparación con la población urbana de la misma zona (7,1 casos cada 100 000 habitantes)39. Estos antecedentes destacan la amenaza que representa para la salud pública la contaminación ambiental con este patógeno35.
La supervivencia de E. coli O157:H7 en suelo, agua y heces de animales frente a condiciones estresantes del medio ambiente ha sido estudiada por muchos investigadores6,18,21,25,43, aunque poco se conoce sobre el efecto del estrés en otros serotipos VTEC28.
Recientemente nuestro grupo de investigación ha informado que en el medio ambiente de un tambo la prevalencia de VTEC fue menor que la observada en los animales del mismo establecimiento (23 % y 27 %, respectivamente) 15,35. Esto podría deberse a las condiciones estresantes del medio ambiente que desencadenarían diferentes respuestas al estrés, lo que permitiría la adaptación y supervivencia de diversas bacterias mediante la adopción de un metabolismo basal durante varias semanas30,39. Las bacterias en estado de metabolismo basal reciben el nombre de bacterias viables pero no cultivables (VNC), pues son capaces de recuperar su culturabilidad bajo condiciones diferentes a las empleadas rutinariamente en los laboratorios24, sin embargo, poco se conoce sobre su capacidad de supervivencia en distintos ambientes27. Por tal motivo, nos propusimos estudiar el crecimiento y la supervivencia de 4 aislamientos VTEC (O20:H19; O91:H21; O157:H7 y O178:H19) en agua estéril de bebederos y en materia fecal de bovinos.
Materiales y métodosCepas utilizadasLas cepas utilizadas en este estudio fueron O20:H19 (ehxA, vt1, vt2, saa, sab) y O157:H7 (ehxA, eae, vt2), aisladas de bovinos de feedlot31; y O91:H21 (ehxA, vt2, saa) y O178:H19 (ehxA, eae, vt2, saa, sab), aisladas de bovinos de tambo14,31. Estas pertenecen al cepario del Laboratorio de Inmunoquímica y Biotecnología CIVETAN – CONICET – CICPBA – FCV - UNICEN. La selección de los serotipos se realizó considerando los datos epidemiológicos de los casos de enfermedad en humanos, la prevalencia en el ganado, la presencia de genes codificantes de factores de virulencia y los antecedentes de resistencia al estrés ácido14,28,31. Para facilitar la recuperación posterior en medios de cultivo, se generaron cepas resistentes a ácido nalidíxico por medio de exposiciones graduales a concentraciones crecientes del antibiótico (0,1; 0,2; 0,4; 0,8; 1,6; 3,2; 6,4; 12,8; 25 y 50μg/ml).
Preparación e inoculación de las muestras de aguaSe recolectaron 15 lde agua de bebederos de un tambo, que se fraccionaron en Erlenmeyers (1 len cada uno) y se autoclavaron3. Se corroboró la ausencia de bacterias portadoras de vt1-vt2 mediante PCR13 y de bacterias resistentes a ácido nalidíxico mediante siembra en placas de agar Mac- Conkey sorbitol con el agregado de ácido nalidíxico (50μg/ ml) (SMAC-NAL).
Las cepas se cultivaron en un caldo nutritivo Luria-Bertani (LB) a 37°C durante 18h y se estimó la concentración bacteriana mediante la determinación de la DO600, para poder inocular el agua de bebederos a razón de 103UFC/ml3. Los Erlenmeyers con agua inoculada se mantuvieron a temperatura ambiente (promedio: 16–20°C), tapados y sin agitación. La recolección de muestras se realizó inmediatamente luego de la inoculación (hora 0), cada 24h durante los primeros 4 días, cada 48h hasta el día 8 y, a partir de entonces, se muestreó una vez por semana hasta que no se recuperaron bacterias por al menos 7 días consecutivos. La toma de muestras se realizó con pipeta de vidrio estéril luego de una agitación suave y en condiciones de esterilidad.
Se realizaron tres experimentos independientes: el primero, desde mayo hasta agosto de 2008; el segundo, desde septiembre hasta diciembre de 2009; y el último, desde agosto hasta noviembre de 2011.
En el ensayo de 2008 se estudió y comparó el crecimiento y la supervivencia de VTEC O157:H7 en el microcosmos del agua y en caldo nutritivo LB, utilizado como control de crecimiento. En cambio, en los ensayos de 2009 y de 2011, solo se utilizó el microcosmos del agua estéril de bebedero y se incorporaron al estudio las restantes cepas VTEC.
Estudio de viabilidadEl estudio de viabilidad de las cepas inoculadas se realizó mediante el recuento de colonias en placas de agar SMACNAL, a partir de diluciones estándares. Para la construcción de las curvas de crecimiento se utilizó el promedio del recuento de colonias obtenidas en dos diluciones decimales consecutivas, por duplicado.
PCRSe tomó 1 ml de agua inoculada y se cultivó en 9ml de caldo LB a 37°C con agitación durante 18h. Luego se tomaron 10μl del cultivo y se diluyeron en 500μl de agua bidestilada y se extrajo el ADN por lisis celular en caliente. Las condiciones de termociclado y las secuencias de los primers para ehxA-eae-vt1-vt2 fueron descritas previamente por Paton y Paton33.
Estudio in vitro de la viabilidad de VTEC O157 y no-O157 en muestras de materia fecal de bovinosSe tomaron muestras de materia fecal y se seleccionaron para el ensayo aquellas que fueron negativas para vt1-vt2 por PCR y con resultado negativo al cultivo en SMAC-NAL.
Estas muestras se inocularon con las cepas O91:H21, O178:H19 y O157:H7 en la misma concentración final (103UFC/g) y con el procedimiento descrito anteriormente. La materia fecal se colocó en una bolsa dentro de contenedores plásticos y se mantuvo a la temperatura ambiente y en contacto con el aire.
En cada ocasión de muestreo, se tomó 1g de materia fecal y se suspendió en 9ml de solución fisiológica estéril. El sobrenadante se utilizó para realizar las mismas determinaciones y siguiendo la misma metodología que en el caso del agua (estudio de viabilidad y PCR).
Los resultados de tiempo de sobrevida y recuentos máximos se analizaron con análisis de varianza de un factor (ANOVA).
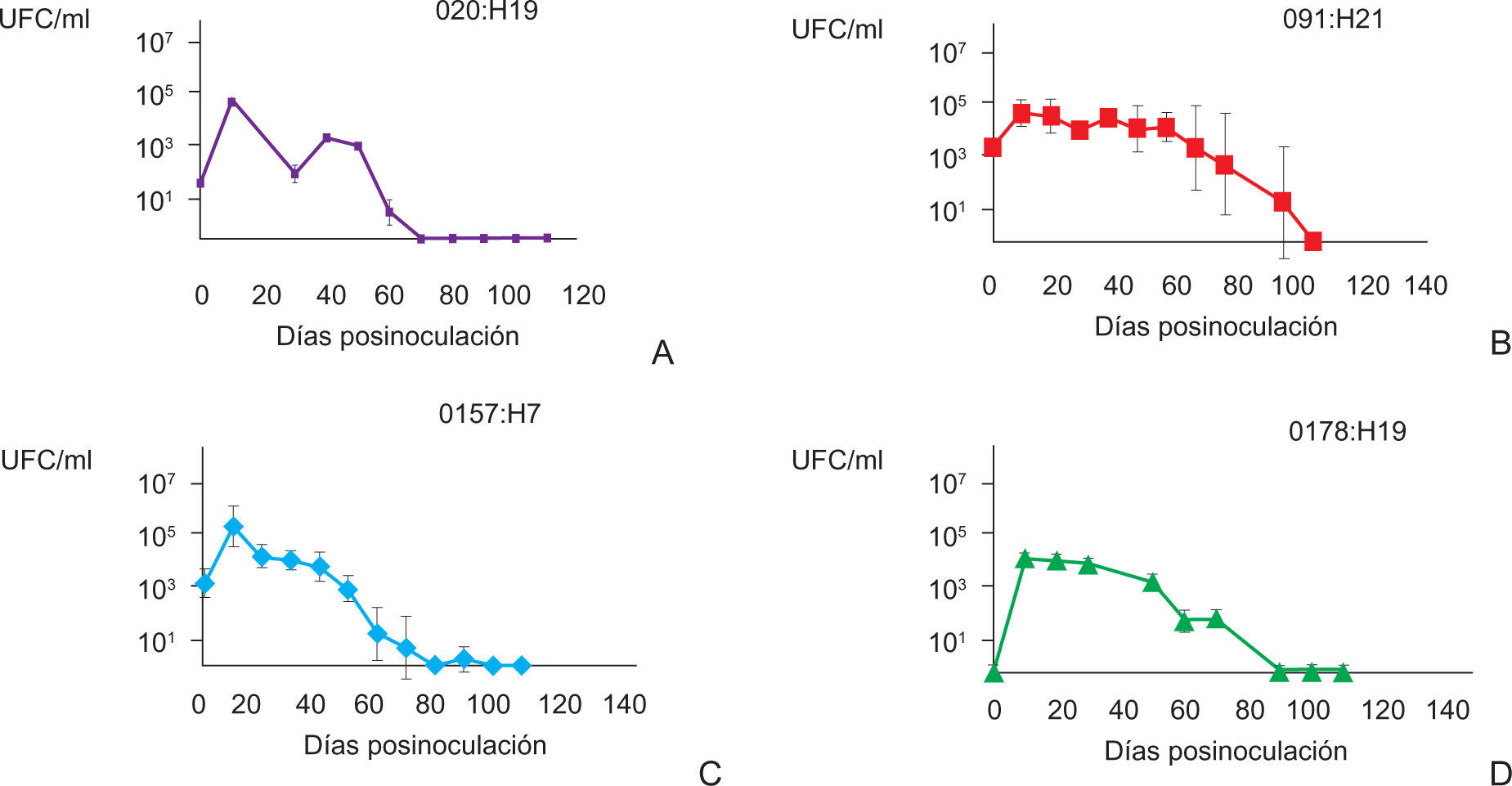
ResultadosViabilidad de VTEC O157 y no-O157 en muestras de agua estéril de bebederosA partir de los datos obtenidos en los ensayos realizados en años independientes, se calculó el promedio para graficar una curva de crecimiento para cada cepa (fig. 1). Se observó que las cepas no mostraron un mismo patrón de crecimiento y tampoco igual tiempo de sobrevida en el microcosmos (p<0,0005). El serotipo O91:H21 sobrevivió más tiempo y alcanzó un recuento máximo de 106UFC/ml, al igual que el O157:H7, mientras que las cepas O20:H19 y O178:H19 no superaron las 104UFC/ml y sobrevivieron menos tiempo en el agua (tabla 1).
Los genes VTEC de todas las cepas estudiadas pudieron detectarse por PCR, aun cuando los recuentos en placas fueron inferiores a 101UFC/ml de agua cuando se cultivaron durante 18h a 37°C con agitación.
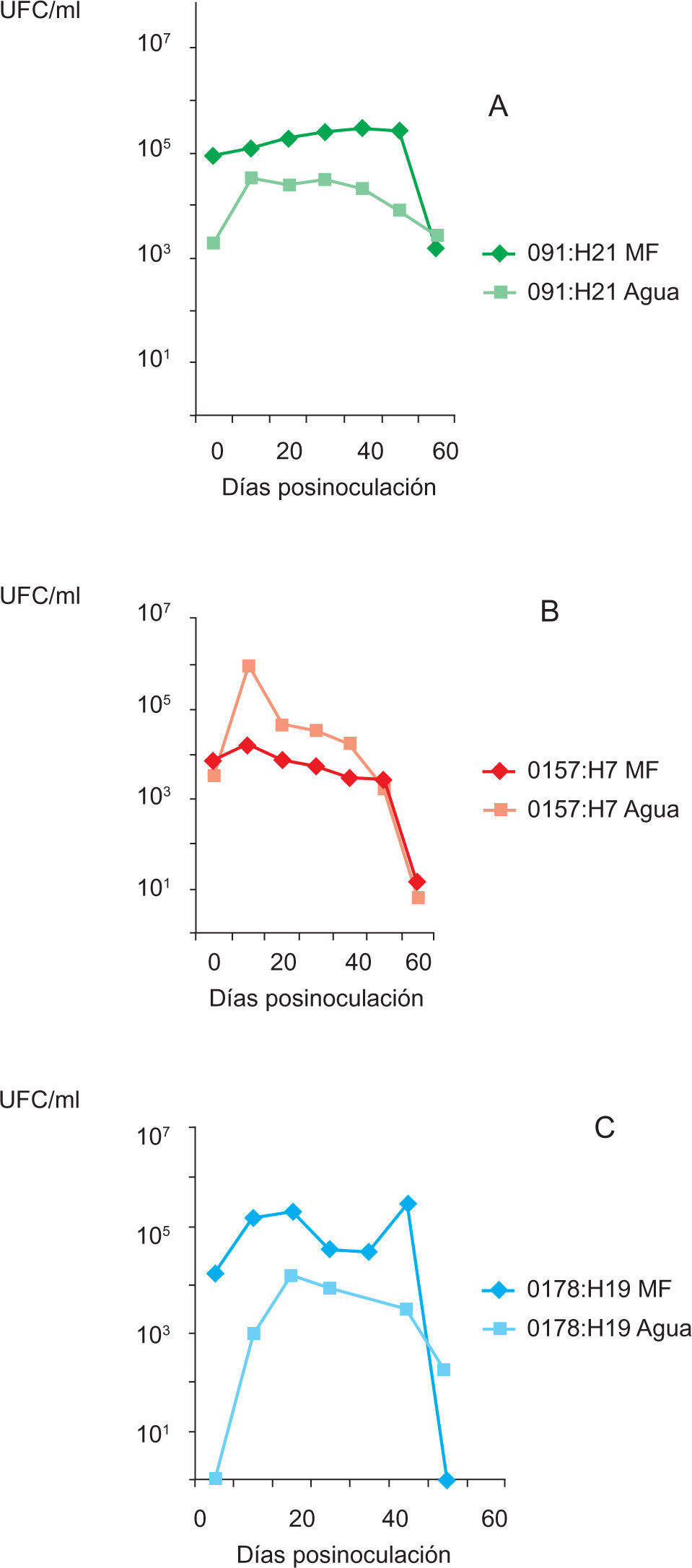
Viabilidad y persistencia de VTEC O157 y no-O157 en muestras de materia fecalTodas las cepas sobrevivieron en la materia fecal aproximadamente 60 días, aunque, al igual que lo sucedid o en el ensayo del agua de bebedero, las cepas se comportaron de forma diferente. Las curvas de crecimiento obtenidas a partir de los resultados de los recuentos de cada cepa en el microcosmos del agua de bebedero y la materia fecal se presentan en la figura 2. Los aislamientos O91:H21 y O178:H19 presentaron recuentos superiores en la materia fecal, en tanto que la cepa O157:H7 mostró un comportamiento inverso, es decir, mayores recuentos en el agua que en la materia fecal.
Durante los primeros 15 días no pudieron obtenerse resultados de PCR a partir de un cultivo overnight (ON) en caldo LB. Entonces, las PCR se realizaron con colonias recuperadas de las placas de SMAC-NAL cultivadas durante 18h a 37°C ON; de esa manera se corroboró la identidad de las cepas inoculadas en cada caso.
DiscusiónEl medio ambiente puede ser una fuente de transmisión y diseminación de VTEC debido a la contaminación fecal repetida producida por los animales infectados. Wang y Doyle43 observar on que O157:H7 fue capaz de sobrevivir 91 días en agua de lago a 15°C. Existe una considerable variabilidad en la persistencia de estos agentes en aguas procedentes de diferentes fuentes y con diferente contenido de nutrientes y grado de competencia por parte de otros microorganismos del ecosistema3,4. La importancia en la salud pública de los serotipos no-O157 nos llevó a analizar, además del O157:H7, la supervivencia de 3 aislamientos VTEC pertenecientes a los serotipos O91:H21, O20:H19 y O178:H19.
En nuestro trabajo, la cepa O157:H7 se recuperó a partir del agua inoculada hasta los días 104, 62 y 69 posinoculación en tres ensayos independientes. Cuando la misma cepa se inoculó en materia fecal sin autoclavar, a los 60 días la presencia de VTEC fue equivalente a la observada en el agua estéril de bebedero (10UFC/g en materia fecal y 10UFC/ml en agua), aunque las dinámicas de crecimiento fueron distintas. En el agua se observó que el crecimiento fue muy rápido durante los primeros 10 días, con un recuento máximo de 106UFC/ml, para luego descender bruscamente, mientras que en la materia fecal el crecimiento fue más lento. Así, a los 10 días apenas se superaron las 104UFC/g, para decrecer luego paulatinamente hasta el día 50. Esta dinámica poblacional puede explicarse por la disponibilidad de nutrientes de fácil acceso en el microcosmos del agua, que VTEC utiliza rápidamente durante los primeros días, pero cuando se reduce su disponibilidad, la población comienza a declinar lentamente. En el caso de la materia fecal, también podría suceder esto, lo que se sumaría a la competencia y antagonismo que podría existir con otros microorganismos del ecosistema41. El comportamiento de aislamientos O157:H7 de distinto origen ha sido distinto ante diferentes condiciones ambientales2,42.
Si bien los trabajos de supervivencia de cepas no-O157 en distintos microcosmos son más escasos, se ha demostrado que el serotipo O26 es más resistente que el O157 y que el O111 en materia fecal a 15°C, y se ha propuesto que dicha capacidad está íntimamente asociada a la temperatura, a la concentración bacteriana del inóculo, al grado de deshidratación de la muestra y a la presencia de antagonistas microbianos, de manera similar a lo que sucede con el serotipo O157:H712,16,18.
Si comparamos los comportamientos de los aislamientos O91:H21 y O178:H19 en los dos microcosmos analizados, luego de 50 días de ensayo observamos en los recuentos diferencias de más de 1 log en la materia fecal con respecto a los obtenidos en el agua estéril, lo que sugiere que podría existir una mejor adaptación a ciertas condiciones de la materia fecal, como la acidez y la competencia microbiana. Los resultados de la cepa O91:H21 concuerdan con lo presentado por Molina et al.28.
Recientemente, Sawant et al.41 han descrito un mecanismo de inhibición dependiente de la interacción íntima entre VTEC y E. coli saprófitas antagonistas presentes en la materia fecal. Este mecanismo es independiente de cualquier elemento soluble, como una bacteriocina o toxina extracelular, y de la presencia de fagos. Aunque aún no se conoce en detalle se ha sugerido que la inhibición dependiente de la proximidad representa una acción de eliminación de la competencia cuando las condiciones son momentáneamente desfavorables, que deja así a la “cepa inhibidora” con una ventaja numérica para cuando las condiciones se restablezcan y pueda, de esta forma, acceder a mayor cantidad de nutrientes.
Desnues et al.10 indicaron que ante la restricción de nutrientes, las células pierden lentamente la capacidad de reproducirse debido al deterioro oxidativo, pero dependiendo del grado de deterioro, esta puede llegar a restablecerse. La pérdida irreversible de los mecanismos de soporte de la vida bacteriana es consecuencia del incremento de la carbonilación de las proteínas durante el estrés. Sin embargo, solo una fracción de la población sufre inmediatamente estas consecuencias, mientras que el resto se adapta lentamente modificando su expresión de genes11. Este proceso aleatorio y progresivo provoca la muerte paulatina de la población a lo largo del tiempo.
En conclusión, todas las cepas VTEC poseen gran capacidad de supervivencia tanto en agua como en materia fecal, circunstancia que aumenta el riesgo de transmisión para las personas que trabajan o que se encuentren de visita en establecimientos ganaderos, así como el de reinfección para los animales.
Estos resultados ponen de manifiesto la necesidad de profundizar los estudios acerca de las relaciones de antagonismo entre las cepas VTEC y otros miembros del ecosistema que abarca los bebederos, la materia fecal animal y el suelo, con el fin de identificar nuevas alternativas para el control de estos patógenos en los ambientes de producción animal y reducir así el riesgo de contaminación de los alimentos derivados de estas producciones y de transmisión al hombre por el contacto directo con el ambiente.
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Los autores agradecen a María R. Ortiz por su asistencia técnica y a la Lic. Silvina Etcheverría por el análisis estadístico. Este trabajo recibió financiamiento por parte de FONCYT PICT 1728/OC-AR Proy 38059, CIC y SECYT–UNCPBA. NL Padola es miembro de la Comisión de Investigaciones Científi cas de la Provincia Buenos Aires (CICPBA), A. I. Etcheverría es miembro de CONICET, y R. Polifroni realizó este trabajo con una beca doctoral interna de CONICET.