Escherichia coli productora de toxina Shiga (STEC) es un patógeno de importancia alimentaria en los humanos, el bovino es su principal reservorio. El objetivo de este estudio fue determinar la portación de STEC en bovinos del Paraguay y analizar el perfil de virulencia y los serotipos de los aislados reunidos. Se estudiaron 197 muestras de hisopado rectal de bovinos y un promedio de 5 a 50 colonias por bovino positivo a genes stx1/stx2. Se amplificaron por PCR los genes stx1, stx2, saa, ehxA y eae. El 84,8% de los bovinos resultaron portadores de STEC. Los perfiles de virulencia predominantes fueron stx2 y stx2/saa/ehxA. La serotipificación se realizó por reacciones de aglutinación en 60 aislamientos seleccionados, se encontró un aislamiento del serogrupo O103, capaz de producir infecciones en humanos. Este trabajo muestra los primeros datos de portación de STEC de ganado bovino paraguayo y señala la necesidad de efectuar otros estudios con mayor cobertura territorial, para lograr una visión completa de este fenómeno.
Shiga toxin-producing Escherichia coli (STEC) is a food-borne pathogen in humans, with cattle being the main reservoir. The objective of this study was to determine the carrying of STEC in Paraguayan bovines and to analyze the virulence profile and serotypes of these isolates. A total of 197 samples of bovine fecal samples and an average of 5 to 50 colonies from stx1/stx2 positive samples were studied. The stx1, stx2, saa, ehxA and eae genes were amplified by PCR. 84.8% of the cattle were carriers of STEC. The predominant virulence profiles were stx2 and stx2/saa/ehxA. The serotyping was performed by agglutination reactions for 60 selected isolates, resulting in isolation of serogroup O103, which could produce infections in humans. This work shows the first data of STEC carriers in Paraguayan cattle, and indicates the need for other studies with greater territorial coverage for a complete vision of this phenomenon.
Escherichia coli productora de toxina Shiga (STEC) se caracteriza por la producción de 2 variantes de potentes citotoxinas llamadas toxinas Shiga 1 y Shiga 2. Las toxinas Shiga pueden producir graves enfermedades, como colitis hemorrágica y síndrome urémico hemolítico (SUH). Asimismo, la presencia de otros factores de virulencia puede aumentar la patogenicidad de las STEC8. Uno de ellos es la intimina, codificada por el gen cromosómico eae e implicada en la adhesión a los enterocitos, lo que provoca lesiones de adhesión y barrido. Otros 2 importantes factores de virulencia son la enterohemolisina, codificada por el gen ehxA e implicada en la lisis de eritrocitos, y la proteína de adhesión autoaglutinante, codificada por el gen saa8.
El ganado bovino es un reservorio natural de STEC; una de las vías de transmisión de este patógeno es el consumo de alimentos contaminados, como la carne mal cocida. La dosis infectiva para el humano es muy baja, lo que redunda en altas tasas de infección y transmisión a las personas7.
La industria cárnica representa uno de los ingresos más importantes del Paraguay; este país se encuentra entre los 10 primeros puestos como exportador de carne bovina a nivel mundial15. Si bien muchas acciones se centran en el aseguramiento de la sanidad animal y la inocuidad de los productos de origen animal, no existen datos sobre la portación de STEC en ganado en pie. El presente trabajo tuvo como objetivo determinar la portación de STEC en bovinos de 2 establecimientos ganaderos de distintas regiones del país y caracterizar el perfil de virulencia de dichos aislamientos, así como el serogrupo de aislamientos representativos.
Este estudio descriptivo de corte transversal contó con la aprobación de los comités científicos y de ética del IICS (código P06/2013). Las muestras fueron colectadas en el año 2013 por hisopado rectal de 197 bovinos de aptitud carnicera de 1 a 4 años, alimentados con pastura natural, pertenecientes a 2 establecimientos ganaderos de explotación extensiva localizados en los departamentos de Presidente Hayes (n=98, raza Brangus) y Paraguarí (n=99, raza Nelore). La selección de los animales fue aleatoria simple, hasta alcanzar aproximadamente el 10% del total de cabezas de ganado de cada establecimiento.
Las muestras fueron cultivadas en medio MacConkey-sorbitol a 37°C durante 24h. De la zona de confluencia del cultivo se realizó la extracción de ADN y la criopreservación a −80°C en medio BHI glicerol al 15%. La extracción de ADN se realizó por el método de ebullición descrito por Ennis et al.6, con una modificación consistente en la incubación en hielo durante 5min después de la fase de hervido.
El ADN obtenido de la zona de confluencia del cultivo del hisopado rectal se sometió a amplificación por PCR de los genes stx1, stx2 y rfbO157. Aquellas muestras que resultaron positivas fueron cultivadas en medio LB agar para el aislamiento de colonias. Se analizaron de 5 a 50 colonias de E. coli por bovino, que fueron identificadas previamente por pruebas bioquímicas. Estas se sometieron a amplificación de los genes stx1, stx2, eae, saa, ehxA y rfbO157. Las condiciones de PCR empleadas fueron las descritas por Padola et al.13. Los productos de PCR fueron visualizados por electroforesis en gel de agarosa al 2% (Thermo Scientific, Waltham, EE. UU.) con tinción de bromuro de etidio (3μg/ml). Los tamaños de los productos se estimaron por comparación con un marcador de peso molecular de 100pb (Bioline, Londres, Reino Unido).
Para la serotipificación se seleccionaron aislamientos STEC con perfiles de virulencia diferentes, representativos de cada bovino portador, lo que originó un total de 60 aislamientos. La determinación de los serotipos se hizo con antisueros adquiridos al laboratorio de referencia de E. coli de Lugo, España. El protocolo empleado para la identificación del antígeno O fue el descrito por Guinée et al.9. Los antisueros a los cuales se enfrentaron los aislamientos corresponden a los designados desde O1 hasta O185, con excepción de los siguientes: O2, O9, O11, O15, O16, O38, O45, O139, O143, O146, O147, O149, O152, O158, O163 y O175.
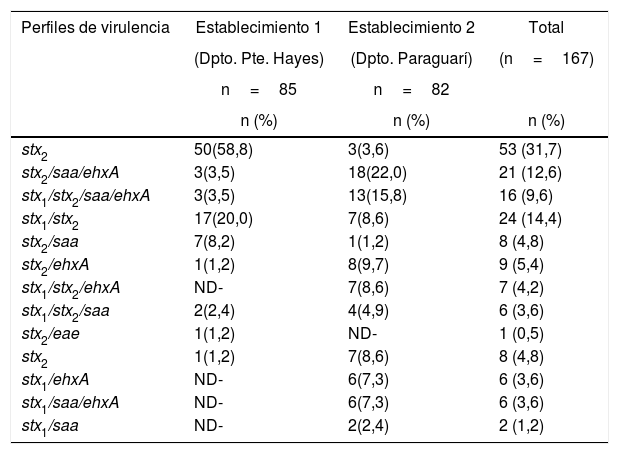
La proporción de STEC en los 197 bovinos en estudio fue del 84,8% (n=167). La portación de los factores de virulencia mostró unas frecuencias para los genes saa, ehxA y eae del 77,7% (153/197), el 84,3% (166/197) y el 13,2% (26/197), respectivamente. El gen rfbO157 no fue detectado en ninguno de los bovinos. El análisis de aislamientos individuales a partir de los bovinos portadores de STEC permitió la caracterización de 13 perfiles de virulencia distintos, de los cuales 9 incluían stx2; fue este el determinante genético más frecuente dentro de los factores de virulencia detectados.
En el establecimiento 1, ubicado en el departamento de Presidente Hayes, el perfil de virulencia mayoritario estuvo constituido por el gen stx2 solo, que fue hallado en el 58,8% (50/85) de los aislamientos, seguido del perfil stx1/stx2, con el 20,0% (17/85). En el establecimiento 2, ubicado en el departamento de Paraguarí, el perfil más frecuente fue stx2/saa/ehxA, detectado en el 22% (18/82) de los aislamientos estudiados, seguido del perfil conformado por los genes stx1/stx2/saa/ehxA, presente en el 15,8% (13/82) de los aislamientos (tabla 1).
Perfiles de virulencia de los aislamientos STEC obtenidos de bovinos de 2 establecimientos ganaderos del Paraguay
| Perfiles de virulencia | Establecimiento 1 | Establecimiento 2 | Total |
|---|---|---|---|
| (Dpto. Pte. Hayes) | (Dpto. Paraguarí) | (n=167) | |
| n=85 | n=82 | ||
| n (%) | n (%) | n (%) | |
| stx2 | 50(58,8) | 3(3,6) | 53 (31,7) |
| stx2/saa/ehxA | 3(3,5) | 18(22,0) | 21 (12,6) |
| stx1/stx2/saa/ehxA | 3(3,5) | 13(15,8) | 16 (9,6) |
| stx1/stx2 | 17(20,0) | 7(8,6) | 24 (14,4) |
| stx2/saa | 7(8,2) | 1(1,2) | 8 (4,8) |
| stx2/ehxA | 1(1,2) | 8(9,7) | 9 (5,4) |
| stx1/stx2/ehxA | ND- | 7(8,6) | 7 (4,2) |
| stx1/stx2/saa | 2(2,4) | 4(4,9) | 6 (3,6) |
| stx2/eae | 1(1,2) | ND- | 1 (0,5) |
| stx2 | 1(1,2) | 7(8,6) | 8 (4,8) |
| stx1/ehxA | ND- | 6(7,3) | 6 (3,6) |
| stx1/saa/ehxA | ND- | 6(7,3) | 6 (3,6) |
| stx1/saa | ND- | 2(2,4) | 2 (1,2) |
ND: no detectado.
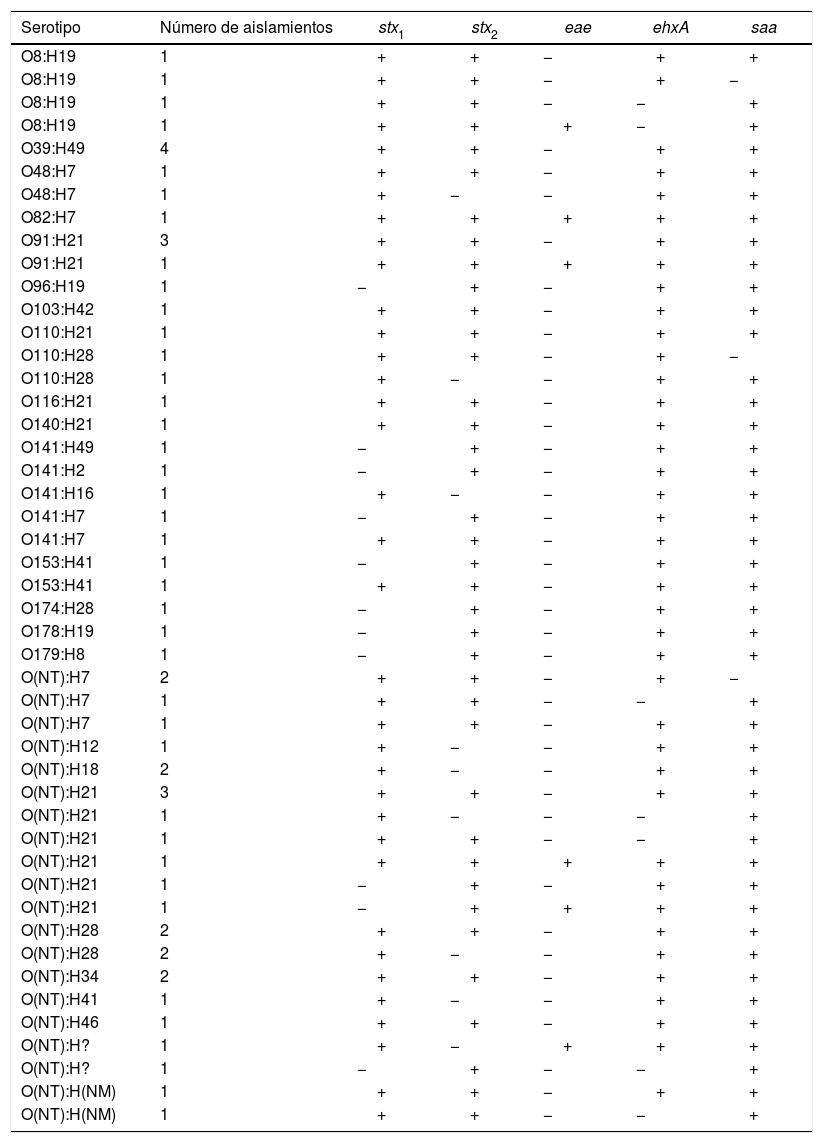
Se observó una gran variabilidad en cuanto a los serotipos detectados en los 60 aislamientos STEC representativos de los bovinos portadores (cuyos perfiles de virulencia también fueron diversos): se encontraron 27 serotipos diferentes, entre ellos el O103, que se encuentra dentro del grupo llamado big six, relacionado con brotes graves (tabla 2).
Serotipos y genes de virulencia de 60 aislamientos de STEC bovino
| Serotipo | Número de aislamientos | stx1 | stx2 | eae | ehxA | saa |
|---|---|---|---|---|---|---|
| O8:H19 | 1 | + | + | − | + | + |
| O8:H19 | 1 | + | + | − | + | − |
| O8:H19 | 1 | + | + | − | − | + |
| O8:H19 | 1 | + | + | + | − | + |
| O39:H49 | 4 | + | + | − | + | + |
| O48:H7 | 1 | + | + | − | + | + |
| O48:H7 | 1 | + | − | − | + | + |
| O82:H7 | 1 | + | + | + | + | + |
| O91:H21 | 3 | + | + | − | + | + |
| O91:H21 | 1 | + | + | + | + | + |
| O96:H19 | 1 | − | + | − | + | + |
| O103:H42 | 1 | + | + | − | + | + |
| O110:H21 | 1 | + | + | − | + | + |
| O110:H28 | 1 | + | + | − | + | − |
| O110:H28 | 1 | + | − | − | + | + |
| O116:H21 | 1 | + | + | − | + | + |
| O140:H21 | 1 | + | + | − | + | + |
| O141:H49 | 1 | − | + | − | + | + |
| O141:H2 | 1 | − | + | − | + | + |
| O141:H16 | 1 | + | − | − | + | + |
| O141:H7 | 1 | − | + | − | + | + |
| O141:H7 | 1 | + | + | − | + | + |
| O153:H41 | 1 | − | + | − | + | + |
| O153:H41 | 1 | + | + | − | + | + |
| O174:H28 | 1 | − | + | − | + | + |
| O178:H19 | 1 | − | + | − | + | + |
| O179:H8 | 1 | − | + | − | + | + |
| O(NT):H7 | 2 | + | + | − | + | − |
| O(NT):H7 | 1 | + | + | − | − | + |
| O(NT):H7 | 1 | + | + | − | + | + |
| O(NT):H12 | 1 | + | − | − | + | + |
| O(NT):H18 | 2 | + | − | − | + | + |
| O(NT):H21 | 3 | + | + | − | + | + |
| O(NT):H21 | 1 | + | − | − | − | + |
| O(NT):H21 | 1 | + | + | − | − | + |
| O(NT):H21 | 1 | + | + | + | + | + |
| O(NT):H21 | 1 | − | + | − | + | + |
| O(NT):H21 | 1 | − | + | + | + | + |
| O(NT):H28 | 2 | + | + | − | + | + |
| O(NT):H28 | 2 | + | − | − | + | + |
| O(NT):H34 | 2 | + | + | − | + | + |
| O(NT):H41 | 1 | + | − | − | + | + |
| O(NT):H46 | 1 | + | + | − | + | + |
| O(NT):H? | 1 | + | − | + | + | + |
| O(NT):H? | 1 | − | + | − | − | + |
| O(NT):H(NM) | 1 | + | + | − | + | + |
| O(NT):H(NM) | 1 | + | + | − | − | + |
H?: no determinado; NM: no móvil; NT: no tipable.
Este trabajo aporta los primeros datos de prevalencia de STEC en ganado bovino de Paraguay, que alcanzó niveles del 84,8%. Esto es ligeramente superior a lo reportado en un estudio realizado en Argentina, en el que se informa una prevalencia del 62,7%13.
La presencia de STEC en bovinos pone de manifiesto un potencial factor de riesgo para la salud, debido a la eventual contaminación durante los procesos de faenado y despiece, o la contaminación de agua o alimentos por contacto con la materia fecal de los bovinos portadores, entre otros10. Por lo tanto, este estudio aporta datos que fortalecen la justificación de buenas prácticas en todas las etapas de la cría y la producción cárnica.
La detección de stx2 como perfil de virulencia más frecuente, seguido por el perfil conformado por los genes stx1/stx2, es un hecho relevante, ya que ciertos estudios señalan que la expresión de stx2 potenciaría en unas 400 veces la patogenicidad con respecto a aquellas cepas que portan únicamente el gen stx1. Los perfiles de virulencia hallados son similares a los reportados en Argentina por Blanco et al.1, quienes informaron que la mayoría de las cepas STEC portaban stx2. Leotta et al.12 demostraron que la portación del gen stx2 reviste mayor importancia que la del gen stx1 en el desarrollo de los cuadros clínicos más graves por infección con STEC.
La frecuencia de portación del gen eae en los aislamientos de E. coli alcanzó el 13,2% de las muestras analizadas y fue inferior con respecto a lo reportado en otros estudios6. Por otro lado, el hecho de haber encontrado solo un aislamiento portador de la combinación stx2/eae podría considerarse positivo para el país y su industria cárnica, ya que la presencia de esta combinación de genes es empleada por entidades como la European Food Safety Authority para categorizar los alimentos en sus 3 niveles de riesgo, así como por el Food Safety and Inspection Service del USDA para clasificar las STEC de acuerdo con la gravedad de las enfermedades que provocan5,11. Esta pequeña proporción podría estar relacionada con la baja prevalencia del SUH que se registra en el país.
No se detectó la presencia de STEC O157 en los aislamientos obtenidos en esta investigación. Si bien no se han empleado técnicas de concentración o inmunomagnéticas, nuestros resultados se diferencian de otros obtenidos con similar metodología en Argentina, en los que se informa la presencia de STEC O157 en el 6,8% de los bovinos en estudio13. Este serogrupo representa uno de los más importantes dentro de los causantes de SUH en el mundo y al cual se le atribuye el mayor número de brotes graves registrados por el CDC desde 2006 hasta la actualidad14.
Aunque la República del Paraguay cuenta con un sistema de vigilancia de enfermedades diarreicas dependientes del Ministerio de Salud, la información publicada sobre la detección de STEC en humanos se restringe a un estudio puntual en niños, donde este patotipo se detectó en el 4%2. Asimismo, existen pocos reportes en los que se informen casos de SUH; uno de ellos, publicado por Chamorro Noceda en 2009, da cuenta de un niño de 2 años infectado por el consumo de un alimento contaminado con el serotipo O157:H74.
La incidencia de cuadros graves desencadenados por cepas no O157 ha aumentado, principalmente a causa de aislamientos del grupo denominado big six, que incluye los serogrupos O26, O45, O103, O111, O121 y O1453. En este trabajo se detectó en una baja frecuencia solo el serogrupo O103. Sin embargo, también se detectaron otros serotipos que han sido aislados de casos de SUH (O8:H19, O91:H21 y O178:H19)8.
La proporción de STEC presente en el ganado bovino estudiado superó el 80%, con predominio de aislamientos no O157 LEE negativos, portadores de stx2. Como perspectiva, en un futuro próximo se propone realizar estudios en un mayor número de establecimientos y extendiendo la cobertura territorial, para ahondar en el análisis de la portación de STEC, así como abordar la búsqueda de otros factores de virulencia asociados a STEC LEE negativos.
FinanciaciónEl presente trabajo contó con financiación del Consejo Nacional de Ciencia y Tecnología (CONACYT), proyecto 14-INV-309, 2014.
Conflicto de interesesLos autores del manuscrito declaran que no existe ningún potencial conflicto de interés relacionado con el artículo.