Los hongos micorrícicos arbusculares (HMA) incrementan la toma de fosfatos solubles, mientras que los hongos solubilizadores de fósforo (S) promueven la solubilización de complejos insolubles de fosfato, en conjunto benefician la nutrición de las plantas. La utilización de estos organismos en combinación con minerales o rocas que aportan nutrientes es otra alternativa para mantener la productividad de los cultivos. El objetivo de este trabajo fue combinar HMA y S con materiales piroclásticos (cenizas y pumicitas) del volcán Puyehue y rocas fosfóricas (RP) del Grupo Río Chico (Chubut) y evaluar el desempeño de estas mezclas como sustratos para la producción en maceta de Lactuca sativa. Para formular los sustratos, se utilizó como base una mezcla de Terrafertil® con cenizas. Penicillium thomii fue el S y esporas del hongo Rhizophagus intraradices (AEGIS® Irriga) sirvieron de fuente del HMA. Se evaluaron diversas combinaciones de microorganismos y la adición o no de RP. Los tratamientos fueron: 1) sustrato; 2) sustrato+HMA; 3) sustrato+S; 4) sustrato+HMA+S; 5) sustrato: RP; 6) sustrato: RP+HMA; 7) sustrato: RP+S, y 8) sustrato: RP+HMA+S. Se efectuaron 3 repeticiones por tratamiento. Los parámetros evaluados fueron el contenido de P total y asimilable en el sustrato, el P en el tejido vegetal y la biomasa seca. Todos ellos fueron significativamente mayores en las plantas que crecieron en el sustrato adicionado con RP e inoculadas con S y HMA. Este trabajo confirma que la combinación S/HMA con cenizas volcánicas del Puyehue y las RP del Grupo Río Chico formuladas con un sustrato comercial promueven el crecimiento de L. sativa. De este modo es posible incrementar el valor agregado de geomateriales de origen nacional.
Arbuscular mycorrhizal fungi (AMF) increase the uptake of soluble phosphates, while phosphorus solubilizing fungi (S) promote solubilization of insoluble phosphates complexes, favoring plant nutrition. Another alternative to maintaining crop productivity is to combine minerals and rocks that provide nutrients and other desirable properties. The aim of this work was to combine AMF and S with pyroclastic materials (ashes and pumices) from Puyehue volcano and phosphate rocks (PR) from Rio Chico Group (Chubut) - to formulate a substrate for the production of potted Lactuca sativa. A mixture of Terrafertil®:ashes was used as substrate. Penicillium thomii was the solubilizing fungus and Rhizophagus intraradices spores (AMF) was the P mobilizer (AEGIS® Irriga). The treatments were: 1) Substrate; 2) Substrate+AMF; 3) Substrate+S; 4) Substrate+AMF+S; 5) Substrate: PR; 6) Substrate: PR+AMF; 7) Substrate: PR+S and 8) Substrate: PR+AMF+S. Three replicates were performed per treatment. All parameters evaluated (total and assimilable P content in substrate, P in plant tissue and plant dry biomass) were significantly higher in plants grown in substrate containing PR and inoculas with S and AMF. This work confirms that the combination of S/AMF with Puyehue volcanic ashes, PR from the Río Chico Group and a commercial substrate promote the growth of L. sativa, thus increasing the added value of national geomaterials.
Los hongos micorrícicos arbusculares (HMA) y los microorganismos solubilizadores de fósforo (P) presentes en la rizósfera cumplen un importante papel en el crecimiento y desarrollo de sus plantas hospedadoras1. Los HMA (phylum Glomeromycota) incrementan la toma de fosfatos solubles en los alrededores de la planta3,29, mientras que los hongos solubilizadores de P (S) promueven la solubilización de complejos insolubles de fosfato1,7,8,13,34. Este proceso se logra a través de la acidificación y la quelación, así como por reacciones de intercambio de iones y producción de ácidos orgánicos de bajo peso molecular, como glucónico, cítrico y oxálico5,31.
Otra alternativa de uso para mantener la productividad de las plantas es la combinación de diferentes materiales minerales en el sustrato de crecimiento, que puedan aportar nutrientes, entre otras propiedades deseables. El P y el nitrógeno (N) son los nutrientes más importantes en el suelo que limitan el crecimiento vegetal. Se estima que 5,7 billones de hectáreas en el mundo no contienen la cantidad suficiente de P disponible para sustentar la productividad de sus cultivos15. Nuestro país no registra depósitos fosfóricos con altos contenidos de P como para elaborar fertilizantes fosfatados, no obstante, cuenta en distintas regiones con amplios depósitos de rocas fosfóricas (RP), con contenidos bajos a medianos de este nutriente, que no permiten la elaboración de fertilizantes solubles (p. ej., superfosfatos) con las tecnologías actuales.
Los sistemas de cultivos sin suelo en Argentina son relativamente recientes. Han adquirido importancia y crecido en forma sostenida, especialmente en la última década. Estos sistemas requieren la utilización de sustratos32. Estos son materiales porosos que, colocados en contenedores, proporcionan anclaje y suficientes niveles de agua y oxígeno para el crecimiento de las plantas. Entre las ventajas que presentan los cultivos sin suelo se destacan la eliminación de patógenos, el ajustado control de la disponibilidad de nutrientes y la uniformidad en la producción. Por ello, este sistema se ha difundido rápidamente en la producción de plantines hortícolas, forestales, frutícolas, florícolas, de tabaco y de plantas ornamentales. Los cultivos sin suelo requieren de insumos tales como turba, perlita o arcillas expandidas, entre otros, en su mayor parte de alto costo. La incorporación de materiales piroclásticos (cenizas, pumicitas y otros materiales volcánicos) en sustratos es frecuente en otros países que disponen de ellos. Dado los amplios recursos de materiales volcánicos existentes en distintas regiones de nuestro país, resulta de interés ampliar las posibilidades de su uso agrícola, especialmente en cultivos intensivos, y reemplazar el uso de productos importados y de alto costo.
La erupción del complejo volcánico Puyehue-Cordón Caulle (junio del 2011) expulsó a la atmósfera grandes cantidades de materiales piroclásticos que cubrieron amplias extensiones de Argentina. En las provincias de Río Negro y Neuquén, las más afectadas, la acumulación de estos materiales cubrió 5.658ha; en el 45% de esta superficie el espesor de cenizas alcanzó de 0,2 a 1,5cm y en el 55% restante la acumulación fue mayor de 1,5 cm10.
Se han probado alternativas para el uso de estos materiales como sustratos de crecimiento de plantas, así también como vehículos o trasportadores (carriers) de microorganismos beneficiosos. Estos materiales piroclásticos han sido probados por Barbaro et al.2, quienes obtuvieron resultados alentadores al combinarlos con turba Sphagnum como sustrato de crecimiento de Salvia splendens. Por otro lado, Schalamuk et al.25,26 evaluaron la potencialidad de estos materiales como carriers del hongo entomopatógeno Beauveria bassiana para su uso como micoinsecticida.
La aplicación directa de RP de baja ley en la agricultura puede ser tecnológicamente viable cuando se la combina con microorganismos beneficiosos, dada su capacidad de promover la solubilización y la movilización del P hacia la planta en algunos suelos27.
Las RP del Grupo Río Chico (Chubut), de origen sedimentario, constituyen un recurso de interés como fuente de fósforo para la agricultura23,28. Si bien estas RP son de bajo contenido de P, una alternativa económica y ecológica podría ser la aplicación directa de RP conjuntamente con microorganismos capaces de solubilizar el P mediante la producción de ácidos orgánicos12. En tal sentido, estas fosforitas han sido probadas a través de la inoculación de sustratos con microorganismos4,33,34. Los estudios biológicos realizados han demostrado que cepas nativas de geohongos como Penicillium thomii y Aspergillus niger solubilizan las RP mencionadas, lo que ha sido corroborado tanto en estudios in vitro en medios de cultivo como en sustratos para el crecimiento vegetal. Por otra parte, se ha encontrado que la aplicación de dichas RP junto con los S mencionados y HMA generó respuestas positivas en el crecimiento de especies hortícolas31.
Teniendo en cuenta estos antecedentes, el objetivo de este trabajo fue combinar HMA y S con materiales geológicos argentinos —cenizas y pumicitas procedentes del volcán Puyehue y RP del Grupo Río Chico— en la elaboración de un sustrato para la producción en maceta de plantas de Lactuca sativa.
Materiales y métodosEl ensayo se llevó a cabo en condiciones controladas en el invernáculo perteneciente al Instituto Spegazzini, Facultad de Ciencias Naturales y Museo, Universidad Nacional de La Plata, Argentina.
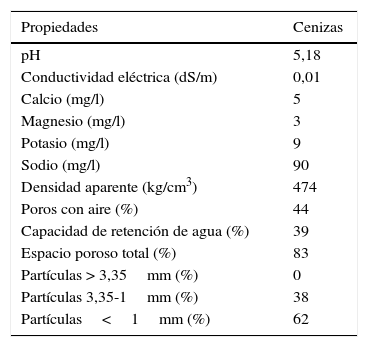
Preparación y características del sustratoPara formular el sustrato se utilizó una mezcla del producto comercial Terrafertil® (Terrafertil Sociedad Anónima Moreno, Provincia de Buenos Aires, Argentina) con cenizas (1:1 v/v). Las cenizas provinieron de Neuquén, Villa La Angostura (40° 45’ 48” S; 71° 38’ 46”O); sus propiedades físicas y químicas se muestran en la tabla 1. Las cenizas fueron tamizadas con una malla de 2mm antes de mezclarlas con el sustrato comercial. El sustrato fue tindalizado antes de disponerlo en macetas de 377cm3 para el ensayo en invernáculo. El pH en pasta de la mezcla Terrafertil®-ceniza, determinado a 23,7°C, fue de 5,7.
Propiedades físicas y químicas de las cenizas utilizadas para mezclar con el producto comercial y emplear como sustrato de crecimiento de plantas de Lactuca sativa
| Propiedades | Cenizas |
|---|---|
| pH | 5,18 |
| Conductividad eléctrica (dS/m) | 0,01 |
| Calcio (mg/l) | 5 |
| Magnesio (mg/l) | 3 |
| Potasio (mg/l) | 9 |
| Sodio (mg/l) | 90 |
| Densidad aparente (kg/cm3) | 474 |
| Poros con aire (%) | 44 |
| Capacidad de retención de agua (%) | 39 |
| Espacio poroso total (%) | 83 |
| Partículas > 3,35mm (%) | 0 |
| Partículas 3,35-1mm (%) | 38 |
| Partículas<1mm (%) | 62 |
A la mitad del sustrato así obtenido se le adicionó como fuente de fósforo RP provenientes del Grupo Río Chico. La cantidad de RP adicionada al sustrato fue calculada para proveer como suplemento nutricional fosforado 22,7mg de RP por planta.
Estudios químicos y mineralógicos de las rocas fosfóricasLas RP fueron analizadas mediante difracción de rayos X (Goniómetro Philips 3020 con controlador PW 3710, radiación Cu-Kα y filtro de Ni). Se efectuaron análisis cuantitativos mediante ICP-AES (ALS Chemex Lab, Canadá) y por fotometría infrarroja (FT-IR). Se calculó la relación molar CO3/PO417. También se determinó la solubilidad de la RP mediante el empleo de diferentes extractantes6.
Inoculación con hongos solubilizadores de fósforo (S) y hongos formadores de micorrizas arbusculares (HMA)Como S se usó una cepa de P. thomii depositada en el Instituto Spegazzini, La Plata (LPS cultivo n.° 743), aislada de un suelo de Tierra del Fuego, Argentina21. Para el aislamiento, la identificación, la determinación de la capacidad solubilizadora de P y el recuento de unidades formadoras de colonias (UFC) se siguió la metodología descripta por Cabello et al.4. Se adicionaron 5g del inóculo de P. thomii con una concentración de 107 células/ml.
Para la inoculación con HMA, se utilizó el fertilizante biológico AEGIS® Irriga (N.° de lote: ASIR311HL, Grupo Giten, Tarragona, España), el cual contenía esporas de HMA. El producto fue analizado en el Instituto Spegazzini mediante la técnica de tamizado y centrifugación en gradiente de sacarosa33. Se determinó que contenía 192 esporas/g de inoculante y el morfotipo de aquellas correspondía a Rhizophagus intraradices (Schenck & Smith) Walker & Schuessler. Este inóculo fue mezclado con el sustrato de crecimiento, siguiendo la dosificación indicada en el marbete, de modo que cada planta recibió 3g de inoculante. Cuando finalizó el ensayo, los sistemas radicales fueron cuidadosamente lavados, clarificados y teñidos de acuerdo a la técnica de Phillips y Hayman22. Se procedió al recuento de segmentos de raíz micorrizados en microscopio, según McGonigle et al.16.
Ensayo con plantasEl ensayo consistió en 8 tratamientos (3 macetas por tratamiento): 1) sustrato (control sin RP); 2) sustrato+HMA; 3) sustrato+S; 4) sustrato+HMA+S; 5) sustrato: RP (control con RP); 6) sustrato: RP+HMA; 7) sustrato: RP+S, y 8) sustrato: RP+HMA+S.
Las semillas de L. sativa fueron desinfectadas superficialmente con una solución de hipoclorito de sodio (10% v/v) durante 10 min, y luego enjuagadas con agua destilada estéril. Las semillas fueron sembradas en un sustrato estéril compuesto de perlita:vermiculita (1:1 v/v), colocadas en bandejas plásticas de 20×15×5cm. Luego de la germinación, a los 15 días, las plántulas fueron seleccionadas por uniformidad de tamaño y trasplantadas según se detalla a continuación.
La unidad experimental fue una maceta (10×12cm, 377 cm3). Cada maceta se llenó con 315g del sustrato correspondiente y se trasplantó una plántula de L. sativa pregerminada, como se mencionó anteriormente. Las macetas se dispusieron en un invernáculo con temperatura controlada (24±1°C día/20±1°C noche) y un fotoperíodo de 16h proporcionado por lámparas blancas-frías e incandescentes. El ensayo finalizó a los 60 días. En ese momento, se midió la masa seca y fresca de la parte aérea y radical.
Análisis del contenido de PEl contenido de P total y asimilable en el sustrato y el contenido de P en el tejido vegetal se determinó según las normas estandarizadas por la Comisión de Normalización y Acreditación —Sociedad Chilena de la Ciencia del Suelo—, métodos de análisis de tejidos vegetales (revisión 2004). Los análisis se realizaron en un laboratorio Habilitado OPDS, Reg. N.° 017 Res. 640/02.
Diseño experimental y análisis estadísticosLos datos obtenidos de P total y asimilable en el sustrato, de P en el tejido vegetal, de peso seco aéreo y radical, de colonización radical por HMA y de UFC de P. thomii fueron evaluados mediante un análisis de la varianza (ANOVA) utilizando un diseño completamente aleatorizado. El porcentaje de colonización fue transformado utilizando arcsen√x y los de UFC aplicando log (x+1), para ajustar los datos a una distribución normal y normalizar los residuos de la varianza. Las medias fueron comparadas mediante la prueba de Tukey. Se consideró p<0,05 como valor de significación estadística. El software utilizado fue el programa InfoStat versión 20099.
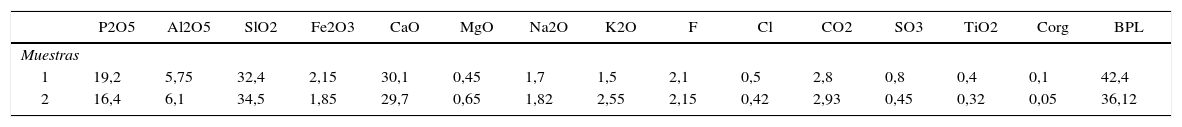
ResultadosEstudios químicos y mineralógicos de la roca fosfóricaLos análisis de la RP mediante difracción de rayos X registraron reflexiones principales de fosfatos pertenecientes a carbonatohidroxilapatita (2,78; 2,68; 1,96Å) y a carbonatofluorapatita (2,69; 2,79; 2,24; 3,05Å); se identificaron además calcita, cuarzo y caolinita. Los análisis cuantitativos mediante ICP-AES revelaron los elementos principales expresados en óxidos (tabla 2). El espectro FT-IR de las fosforitas mostró las bandas de absorción bien definidas del enlace C-O a 1.427 y 1.456/cm. Además, se destacaron las bandas de 603 y 578/cm, correspondientes al enlace P-O, las cuales son características de las carbonato-apatitas. La relación molar CO3/PO4 permitió establecer que el componente fosfórico posee un elevado reemplazo isomórfico de PO4−3 por CO3−2, con valores del 18%.
Análisis cuantitativos (ICP-AES) de las rocas fosfórica de Río Chico en porcentaje de óxidos y valores de BPL (Bone Phosphate of Lime)
| P2O5 | Al2O5 | SlO2 | Fe2O3 | CaO | MgO | Na2O | K2O | F | Cl | CO2 | SO3 | TiO2 | Corg | BPL | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Muestras | |||||||||||||||
| 1 | 19,2 | 5,75 | 32,4 | 2,15 | 30,1 | 0,45 | 1,7 | 1,5 | 2,1 | 0,5 | 2,8 | 0,8 | 0,4 | 0,1 | 42,4 |
| 2 | 16,4 | 6,1 | 34,5 | 1,85 | 29,7 | 0,65 | 1,82 | 2,55 | 2,15 | 0,42 | 2,93 | 0,45 | 0,32 | 0,05 | 36,12 |
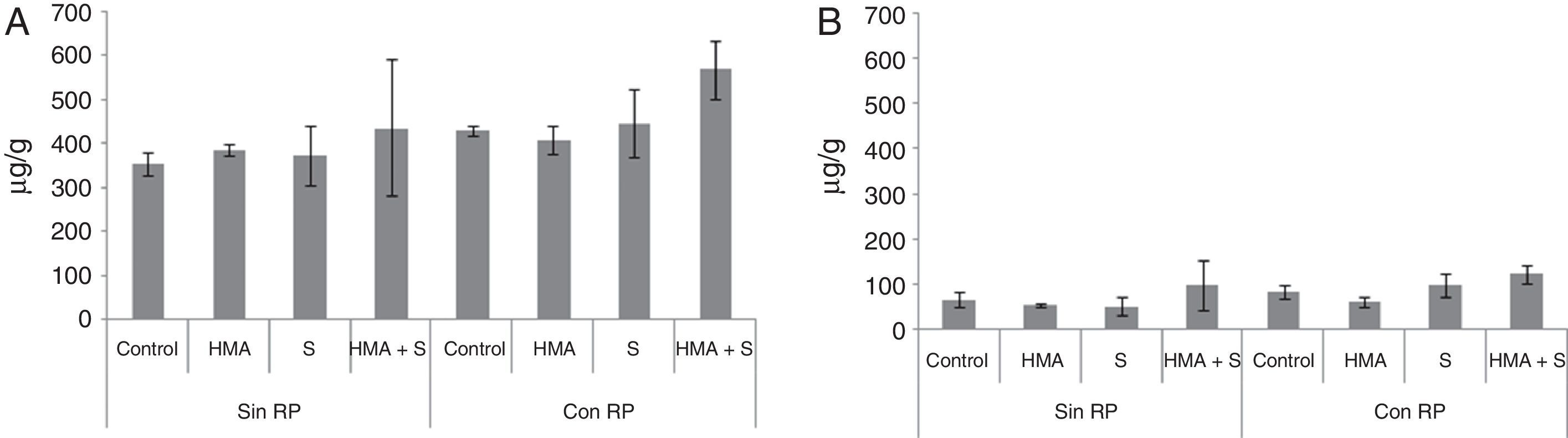
En la figura 1 se observan los contenidos de P total y P asimilable en el sustrato de crecimiento de plantas de L. sativa.
Concentración de fósforo en 2 sustratos de crecimiento de plantas de Lactuca sativa, constituidos por una mezcla de Terrafertil® con cenizas del volcán Puyehue, sin roca fosfórica (sin RP) o adicionada con roca fosfórica (con RP). A) Fósforo total. B) Fósforo asimilable. Los datos son promedio de 3 macetas. Las líneas sobre las barras indican desviación estándar del promedio.
HMA: hongo micorrícico arbuscular; S: hongo solubilizador de fósforo.
Los contenidos de P total en el sustrato (fig. 1A) no mostraron diferencias significativas en los tratamientos inoculados con HMA, con S o con HMA+S (F = 3,15; gl = 3; p = 0,0542). Cuando se analizó el efecto de la adición de RP, se observaron diferencias significativas (F = 6,75; gl = 1; p<0,05), con valores más altos en los tratamientos con RP con respecto a aquellos en los que no se adicionó RP (464,15μg/g y 388,03μg/g de P total, respectivamente). La interacción microorganismos×RP presentó diferencias significativas (F = 7; gl = 0,59; p<0,05). El tratamiento con RP+S+HMA fue el que mostró el mayor contenido de P total en el sustrato (569,5μg/g), mientras que el control sin RP mostró el menor contenido (355μg/g).
En la figura 1B se observan los contenidos de P asimilable en el sustrato. Los tratamientos inoculados con microorganismos y en los que se adicionó RP presentaron diferencias significativas (F = 4,63; gl = 3; p<0,05 y F = 5,27; gl = 1; p<0,05, respectivamente). Con la inoculación con HMA+S se obtuvieron los valores más altos de P asimilable (110,86μg/g), mientras que los valores más bajos (57,46μg/g) se registraron en el tratamiento con HMA. Sin embargo, no se observaron diferencias significativas (F = 0,7; gl = 7; p = 0,0675) en la interacción microorganismo×RP.
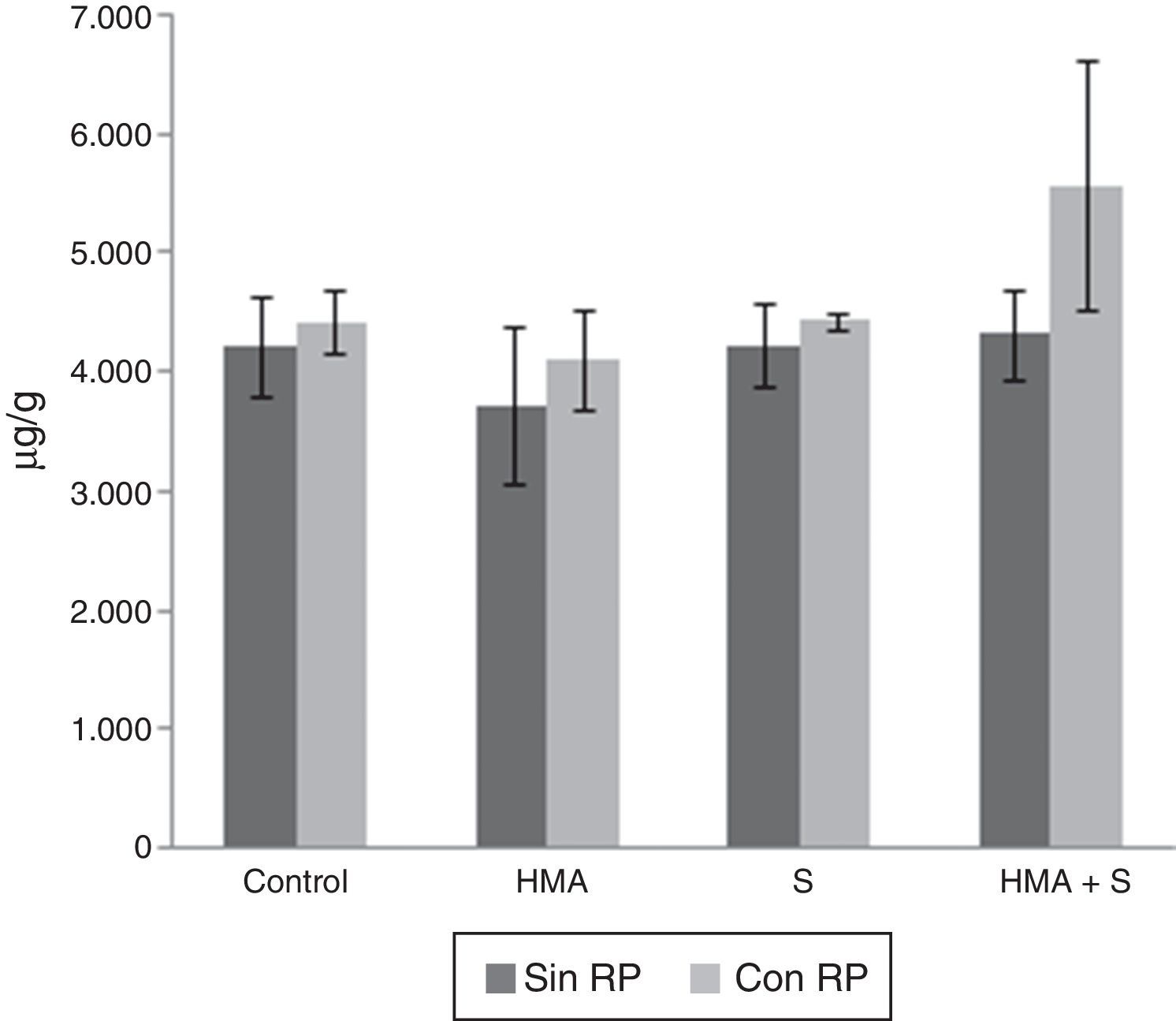
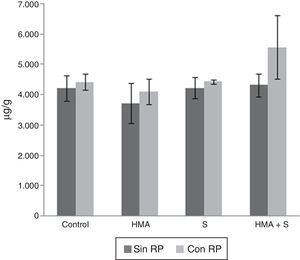
Fósforo en el tejido vegetalEl contenido de P en el tejido vegetal se observa en la figura 2. La presencia de microorganismos llevó a diferencias significativas en este nutriente (F = 3,98; gl = 3; p<0,05), el mayor contenido se registró en el tratamiento con HMA+S (4.952,83μg/g), mientras que el menor en el tratamiento con HMA (3.913,83μg/g). La adición de RP en el sustrato llevó a diferencias significativas (F=5,71; gl=1; p<0,05): el mayor contenido se verificó en el tratamiento con RP (4.639,58μg/g) y el menor en el que no se adicionó esta fuente (4.126,67μg/g). La interacción microorganismos×RP fue significativamente diferente (F=1,33; gl = 7; p<0,05), observándose los mayores contenidos de P en el tratamiento HMA+S×RP y el menor en el tratamiento solo con HMA (5.575,33μg/g y 3.720,62μg/g, respectivamente).
Fósforo en el tejido de plantas de Lactuca sativa cultivadas durante 60 días en 2 sustratos de crecimiento, constituidos por una mezcla de Terrafertil® con cenizas del volcán Puyehue, sin roca fosfórica (Sin RP, serie gris oscuro) o adicionada con roca fosfórica (Con RP, serie gris claro). Líneas sobre las barras indican una desviación estándar de los promedios de 3 repeticiones. HMA: hongo micorrícico arbuscular; S: hongo solubilizador de fósforo.
El contenido de P en el tejido vegetal fue significativamente mayor en las plantas que crecieron en el sustrato con RP en comparación con las que crecieron sin adición de RP. El contenido de P en las plantas que se desarrollaron en sustrato combinado con RP fue significativamente mayor en el tratamiento en el que se incorporaron HMA y S (5.575μg/g) y un valor significativamente menor se registró en el tratamiento asociado a HMA (4.107μg/g). La misma tendencia se observó en las plantas que crecieron en el sustrato, al cual no se le adicionó RP: el mayor contenido de P se observó en aquellas en las que estuvieron consociados HMA y S (4.225μg/g) y valores significativamente menores (3.720μg/g) se registraron en las que solo se inocularon con HMA.
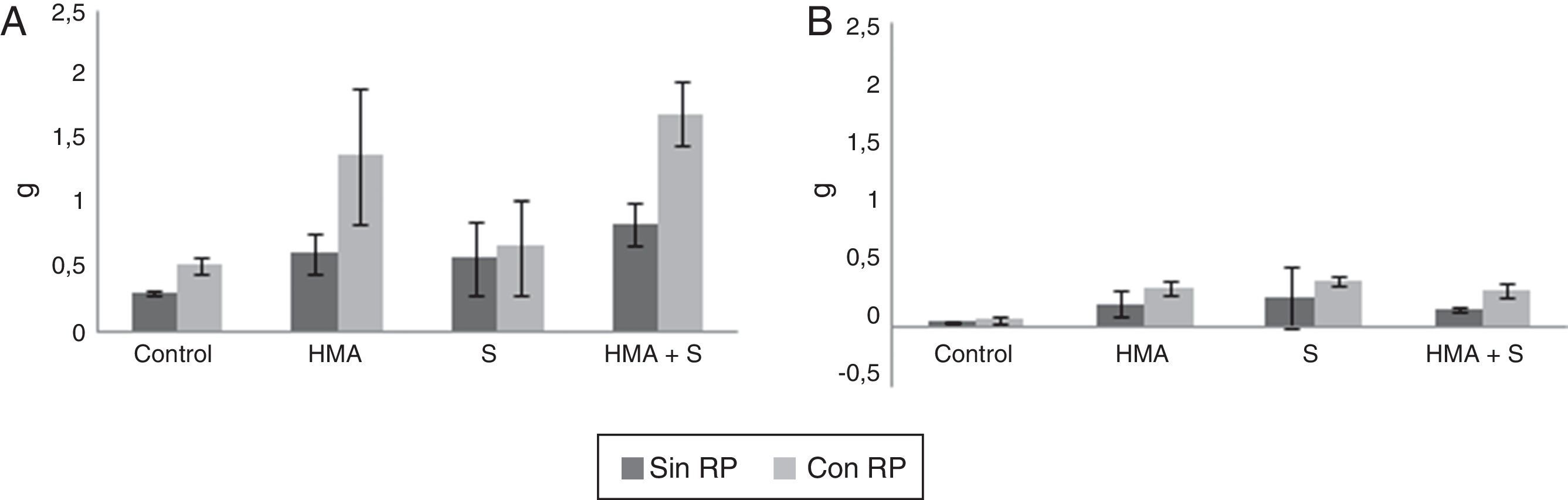
Evaluación de los parámetros de crecimiento de las plantas de L. sativaLa figura 3 muestra los resultados obtenidos de biomasa seca aérea y radical de las plantas de L. sativa.
Peso seco aéreo (A) y radical (B) de plantas de Lactuca sativa cultivadas durante 60 días en 2 sustratos de crecimiento, constituidos por una mezcla de Terrafertil® con cenizas del volcán Puyehue, sin roca fosfórica (Sin RP, serie gris oscuro) o adicionada con roca fosfórica (Con RP, serie gris claro). Las líneas sobre las barras indican una desviación estándar del promedio de 3 repeticiones. (HMA) Hongo micorrícico arbuscular; (S) Hongo solubilizador de fósforo.
La biomasa seca aérea (fig. 3A) mostró diferencias significativas cuando se analiza el efecto simple de la presencia de microorganismos (F = 11,61; gl = 3; p<0,05). El mayor valor se registró en el tratamiento HMA+S (1,27g), mientras que el menor fue en el tratamiento control (0,41g). Al analizar el efecto de la RP, fueron registrados valores significativamente mayores (F = 18,1; gl = 1; p<0,05) en los tratamientos con RP y menores en los cuales no se adicionó RP (1,06g y 0,58g, respectivamente). Para la interacción microorganismos×RP las diferencias fueron significativas (F = 2,86; gl = 7; p<0,05); la mayor biomasa aérea se registró en el tratamiento HMA+S×RP y la menor en el control sin RP (1,69g y 0,3g, respectivamente).
La biomasa seca radical (fig. 3B) solo mostró diferencias significativas (F = 3,92; gl = 3; p<0,05) al analizar el efecto simple de los tratamientos con microorganismos; el mayor valor se observó cuando se inoculó con HMA y el menor en el tratamiento control (0,25g y 0,05g, respectivamente). La presencia de RP (F = 0,58; gl = 1; p = 0,45) y la interacción microorganismos×RP (F = 2,74; gl = 7 y p = 0,07) no mostraron diferencias significativas.
Colonización radical por hongos formadores de micorrizas arbuscularesLas estructuras observadas fueron micelio externo, micelio interno, puntos de entrada y arbúsculos (tabla 3). Se comprobó la presencia de estructuras pertenecientes a HMA solo en los tratamientos inoculados con micorrizas arbusculares. La cantidad de arbúsculos fue el único parámetro micorrícico que presentó diferencias significativas entre el tratamiento inoculado solo con HMA y aquellos en los que se encontraban HMA+S. El mayor porcentaje de colonización con arbúsculos (26%) fue observado en el tratamiento con RP y ambos microorganismos (HMA+S), mientras que un valor significativamente menor se observó en el tratamiento sin RP y micorrizas (4%).
Resultados del ANOVA de 2 vías (valores de F y P) para el efecto de la adición de roca fosfórica, la presencia de microorganismos y la interacción entre ambos factores sobre las variables de colonización por hongos formadores de micorrizas arbusculares y las unidades formadoras de colonias de hongos solubilizadores de fósforo
| Micelio externo | Micelio interno | Punto de entrada | Arbúsculos | Unidades formadoras de colonias | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| F | P | F | P | F | P | F | P | F | P | |
| Roca fosfórica | 0,04 | 0,84 | 0,11 | 0,75 | 4,21 | 0,07 | 0,19 | 0,67 | 74,09 | < 0,01 |
| Presencia de microorganismos | 2,92 | 0,12 | 2,62 | 0,14 | 0,77 | 0,41 | 5,90 | <0,05 | 13,15 | < 0,01 |
| Roca fosfórica×microorganismos | 0,41 | 0,54 | 1,02 | 0,34 | 0,15 | 0,71 | 0,11 | 0,75 | 1,69 | 0,22 |
Nivel de significancia p<0,05.
Los porcentajes de colonización con la presencia de micelio tanto externo como interno presentaron la misma tendencia: los mayores porcentajes fueron encontrados en el tratamiento sin RP y con la presencia de ambos microorganismos (50% con micelio externo y 52% con micelio interno), y los valores más bajos se encontraron en el tratamiento sin RP y con HMA (21% y 20% con micelio externo e interno, respectivamente). Con respecto al porcentaje de puntos de entrada, el mayor valor se obtuvo en aquellos tratamientos en los que se adicionó RP+HMA (31%) y el menor valor se reportó en el tratamiento sin RP y con los 2 tipos de microorganismos consociados (7,3%).
Unidades formadoras de colonia de hongos solubilizadores de PSe encontraron diferencias significativas para el recuento de UFC de P. thomii al analizar el efecto simple de la adición de RP y la presencia de microorganismos. La interacción microorganismo×RP no mostró diferencias significativas (tabla 3). El recuento más alto de estos microorganismos se obtuvo en el tratamiento HMA+S (1,43UFC/g de sustrato) y el más bajo en el que estaban solo presentes los solubilizadores (1,31UFC/g de sustrato). Considerando la adición de RP, en el tratamiento sin RP se obtuvo un mayor recuento que en el que recibió RP (1,51UFC/g de sustrato y 1,23UFC/g de sustrato, respectivamente).
DiscusiónLas cenizas volcánicas provenientes del volcán Puyehue presentaron propiedades físico-químicas favorables para su uso como sustrato en cultivos en maceta. No obstante, se plantea la necesidad de combinarlas con otros materiales para optimizar sus propiedades. Barbaro et al.2 destacaron que estos materiales piroclásticos en combinación con sustrato como turba Sphagnum aumentan la capacidad de retención de agua, al mejorar la relación de poros con aire y agua.
Los contenidos de P total y asimilable en el sustrato aumentaron en aquellos tratamientos en los que se adicionó RP y se los combinó con P. thomii y R. intraradices. Esto evidencia las posibilidades que presentan las RP del Grupo Río Chico para ser utilizadas en aplicación directa en contenedores. Si bien las RP utilizadas en este ensayo presentan bajos contenidos de P, constituyen una alternativa económica y ecológica en combinación con microorganismos capaces de solubilizar fosfato, como P. thomii, y con movilizadores de este elemento, como en el caso del hongo arbuscular R. intraradices. Las interacciones que ocurren entre estos microorganismos son esenciales para entender la dinámica de procesos que acontecen en la rizósfera30. De este modo, un gran número de microorganismos rizosféricos desarrollan actividades que alteran la disponibilidad de nutrientes y actúan sinérgicamente con HMA para incrementar el crecimiento de las plantas1,7,8,18,19.
Asimismo, el mayor contenido de P en el tejido vegetal se registró en aquellas plantas en las que se combinaron las cenizas del volcán Puyehue, la RP y el consorcio S/HMA. Goenadi et al.11 reportaron una mejor absorción tanto del P nativo como del P contenido en las RP cuando las plantas son coinoculadas con ambos microorganismos. La capacidad solubilizadora de P. thomii y el sinergismo positivo de este hongo con Funneliformis mosseae, un HMA, en el crecimiento de plantas de Mentha piperita fueron comprobados por Cabello et al.4.
Los parámetros de crecimiento de la planta, medidos como biomasa aérea seca, fueron mayores en aquellas plantas con la adición de RP sumada a la inoculación de P. thomii y R. intraradices. Estos resultados coinciden con los incrementos de P detectados en el tejido vegetal de estas plantas. El aumento de biomasa aérea puede atribuirse tanto a una mejor nutrición fosforada como al efecto de la coinoculación con microorganismos. El efecto positivo con el tratamiento coinoculado abarcó, además, al tratamiento sin RP y con P. thomii/R. intraradices, que presentó el mayor peso seco aéreo. Este resultado evidencia que el sinergismo entre estos microorganismos resultó beneficioso para la producción de biomasa de L. sativa, aun bajo esta condición. Velázquez et al.31 también reportaron un incremento en la biomasa de plantas de tomate cuando fueron coinoculadas con A. niger/F. mosseae, tanto en sustratos que recibieron aportes de una fuente fosforada como aquellos sustratos que no los recibieron.
En cuanto a la producción de biomasa seca radical, no se encontraron diferencias significativas entre los tratamientos con agregado de RP o sin él. Sin embargo, las plantas asociadas con HMA presentaron el mayor valor de biomasa radical en ambas condiciones (con RP y sin RP), mientras que el menor peso seco se encontró en los tratamientos control. El incremento de la biomasa radical por efecto de la inoculación con R. intraradices ha sido previamente reportado por Salgado-Barreiro et al.24. El aumento en la producción de la biomasa radical, así como de la biomasa aérea, es parte de la respuesta positiva que la planta hospedadora obtiene de la simbiosis micorrícica. En nuestro trabajo, este aumento de biomasa radical es un efecto positivo de la colonización por hongos arbusculares y fue independiente de la adición de una fuente fosforada.
Todas las plantas que recibieron inóculo a base de HMA evidenciaron en sus raíces estructuras características de esta asociación: micelio externo e interno, puntos de entrada y arbúsculos. Sin embargo, el número de arbúsculos mostró diferencias significativas entre los tratamientos: se observó la mayor cantidad de arbúsculos en los tratamientos con RP y con los microorganismos consociados. En nuestro trabajo se observa que la cantidad de P, tanto total como asimilable en el sustrato, se relaciona de manera positiva con un aumento en la colonización arbuscular. Estas observaciones contrastan con los hallazgos de otros autores, que señalan una correlación negativa entre disponibilidad de P y la colonización micorrícica28. Velázquez et al.31 encontraron que los porcentajes de colonización radical disminuían en los tratamientos coinoculados y con la adición de RP.
Los resultados aportados en este ensayo confirman la capacidad solubilizadora de P. thomii frente a una fuente de P insoluble, dato reportado previamente por Cabello et al.4. Kucey et al.15 y Kapoor14 describieron que la excreción de ácidos orgánicos y sustancias quelantes son las vías por las cuales los microorganismos solubilizadores disuelven estas formas no disponibles de P. Los valores de UFC de P. thomii obtenidos en los recuentos estuvieron influenciados por la adición de RP y por los microorganismos. Los tratamientos en los cuales se adicionó RP evidenciaron los menores recuentos, en relación con los tratamientos sin RP. La liberación de ácidos orgánicos producidos durante el proceso de solubilización disminuye el pH del sustrato20. Posiblemente, este incremento en la acidez afecte a la germinación de las esporas de P. thomii. De este modo, el tratamiento con RP y el consorcio P. thomii y R. intraradices presentó los valores más elevados de P soluble. En relación con la presencia de microorganismos, los tratamientos coinoculados, adicionados o no con RP, presentaron los mayores recuentos, lo que resalta el sinergismo positivo entre ambos microorganismos. Estos efectos sinérgicos han sido reportados en trabajos previos3,4.
Este trabajo confirma que las cenizas volcánicas del volcán Puyehue y las rocas fosfóricas del grupo Río Chico, formuladas con un sustrato comercial (Terrafertil®) y con la combinación de microorganismos solubilizadores/movilizadores de P, representan una alternativa favorable para el reemplazo parcial de los materiales convencionales (perlita, turba, arcillas expandidas, entre otros) usados en el cultivo de plantas de L. sativa en maceta. De este modo, se incrementa también el valor agregado de materiales geológicos de origen nacional.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo fue parcialmente financiado por el Consejo Nacional de Investigaciones Científicas y Tecnológicas (CONICET), Comisión de Investigaciones Científicas de la Provincia de Buenos Aires (CICPBA).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Se agradece la colaboración del Instituto de Recursos Minerales (INREMI-UNLP-CIC).