La necesidad de separar a las bacterias del sedimento para lograr un conteo adecuado ha llevado a probar la eficiencia de distintas técnicas. En este trabajo se comparan técnicas tradicionales: agitación manual, homogenización, ultrasonicación y adición de surfactante. Además, se propone la posibilidad de usar un conjunto de enzimas (pancreatina) y un antibiótico (ampicilina) para la extracción de coliformes del sedimento. Las muestras se obtuvieron del lago de Xochimilco, Ciudad de México. Después de aplicar cada técnica de separación de bacterias se determinó el número más probable de coliformes. La mayoría de las técnicas probadas generaron números similares a la técnica tomada como control (agitación manual). Únicamente se observó una mayor concentración de coliformes totales con el uso de la ampicilina (Mann-Whitney, z=2,09; p=0,03). Es posible proponer el uso de la ampicilina como técnica para la extracción de coliformes totales, sin embargo, es necesario considerar la sensibilidad de las bacterias al antibiótico.
The need to separate bacteria from sediment in order to appropriately count them has led to test the efficacy of different techniques. In this research, traditional techniques such as manual shaking, homogenization, ultrasonication, and surfactant are compared. Moreover, the possibility of using a set of enzymes (pancreatine) and an antibiotic (ampicillin) for sediment coliform extraction is proposed. Samples were obtained from Xochimilco Lake in Mexico City. The most probable number of coliform bacteria was determined after applying the appropriate separation procedure. Most of the techniques tested led to numbers similar to those of the control (manual shaking). Only with the use of ampicillin, a greater total coliform concentration was observed (Mann-Whitney, z=2.09; p=0.03). It is possible to propose the use of ampicillin as a technique for total coliform extraction; however, it is necessary to consider sensitivity of bacteria to the antibiotic.
La contaminación microbiológica en los ambientes acuáticos proviene de descargas de agua residual y fuentes dispersas, provenientes de desechos fecales de animales y humanos. El grupo coliforme está formado por bacterias que producen gas durante la fermentación de la lactosa y pueden crecer en medios con sales biliares. Este grupo se ha usado como indicador de contaminación microbiológica debido a que incluye especies que se encuentran en el tracto gastrointestinal de animales de sangre caliente. Algunas bacterias que pertenecen a los coliformes totales (CT) pueden tener un origen no fecal, sin embargo, se han utilizado en la determinación de la calidad sanitaria por ser más resistentes que los coliformes fecales (CF) a ambientes no favorables1. Generalmente se registra un mayor número de bacterias en sedimento que en agua, y las acciones que remueven el sedimento pueden resuspenderlas e incrementar su concentración en agua8. Esto constituye un riesgo para la salud humana y la vida acuática, por lo que es importante evaluar también los niveles de bacterias fecales en sedimento5.
Las bacterias se adhieren a las partículas del sedimento por m edio de una secreción extracelular compuesta de polisacáridos y proteínas denominada glicocálix6,10, esto provoca subestimaciones en el conteo y torna necesario el uso de métodos que permitan desprenderlas5. Los tratamientos para extraer bacterias pueden ser agresivos y causar destrucción celular durante la separación, por lo que es preciso encontrar el mecanismo adecuado, así como el tiempo de acción y la concentración que garanticen la mayor separación de bacterias con daño celular mínimo3.
El modo de acción de cada técnica determinará una eficiencia distinta en los diferentes tipos de sedimento. Si el tratamiento es capaz de separar las bacterias de superficies dará mejores resultados en un sedimento arenoso, en cambio, si puede romper agregados será más eficiente al actuar en partículas finas.
Se han probado y comparado diferentes técnicas para separar bacterias del sedimento, como la agitación manual, la homogenización y la ultrasonicación2,3,5,7,10, pero existen discrepancias respecto del tiempo de procesamiento adecuado y la eficiencia de estas metodologías.
Debido a que las técnicas probadas no han dado resultados que aseguren una extracción completa de bacterias, es de interés probar otras estrategias para su separación del sedimento, como puede ser el uso de enzimas y de antibióticos. Existen antecedentes del uso de enzimas proteolíticas para separar bacterias acuáticas previamente adheridas a superficies13, y también existen estudios que demuestran que algunos antibióticos son capaces de eliminar el glicocálix12, sin embargo, hasta ahora no se ha probado el uso de enzimas y antibióticos en la separación de bacterias del sedimento. Por lo anterior, el objetivo de este trabajo fue probar y comparar diferentes técnicas para la extracción de bacterias coliformes del sedimento.
Las muestras se colectaron en el lago de Xochimilco, actualmente constituido por un sistema de canales de agua, ubicado en la zona sur de la Ciudad de México9; se trata de un importante lugar turístico. Se realizaron cinco colectas semanales durante abril-mayo y cinco en agosto-septiembre de 2008, en un solo punto ubicado en los 19°15′10″ de latitud norte y 99°05′31″ de longitud oeste, cerca del embarcadero Nativitas. Las muestras de agua se tomaron en superficie con un frasco estéril de 100ml. Las muestras de sedimento se sacaron con una draga tipo van Veen a una profundidad de 1,5 m, y posteriormente se extrajeron 20g con jeringas despuntadas estériles de 20ml de la parte subsuperfi cial, a 0,3cm. Las muestras se colocaron en hielo y se procesaron antes de que se cumplieran 15h.
Los CT y CF se determinaron con el método de tubos múltiples de fermentación utilizando tres tubos por dilución para obtener el número más probable (NMP)1. La calidad sanitaria del agua se estableció con base en la legislación mexicana4,15. Las muestras de agua se diluyeron hasta 10−5 y de cada dilución se sembró 1ml en tubos con 9ml de caldo Lactosado (BD Bioxon, México), incubados a 37±0,5°C por 48h. Los tubos positivos (turbios y con producción de gas) se resembraron en los medios confirmativos: caldo Verde Brillante Bilis al 2 % (BD Bioxon, México) incubado a 37±0,5°C durante 48h para CT y caldo EC (BD Difco, EE.UU.) incubado a 44,5±0,5°C por espacio de 48h para CF. El NMP se determinó por el valor en tablas de McCrady con los tubos positivos de los medios confirmativos1. Las muestras fueron procesadas por triplicado para obtener un total de 30 datos de cada grupo de coliformes en agua.
Para separar las bacterias coliformes del sedimento se utilizaron seis técnicas, tres de acción mecánica y tres de acción química. En cada muestra se llevó a cabo una primera dilución colocando 2g de sedimento en tubos con 18ml de agua estéril. Se aplicó una técnica diferente por cada tubo. En el caso de la homogenización fue necesario colocar 10g de muestra y 90ml de agua estéril en un vaso licuadora de 250ml. Las técnicas aplicadas fueron las siguientes:
- 1)
Agitación manual. Es el método más simple y común para procesar sedimento y se utilizó como control2,5. Consistió en una agitación vigorosa del tubo con la muestra en un arco de 15cm durante 1min.
- 2)
Homogenización. Esta se realizó con una licuadora (430rev/min) durante 5min3,7,10.
- 3)
Ultrasonicación. Realizada con un baño de sonicación (Bransonic®, modelo 1510R-MTH; 70W poder de salida, 42 kHz), por 4min, más 1min de agitación manual3,5,7,10.
- 4)
Surfactante. Las muestras fueron tratadas con 1μg/ml de Lauril Sulfato de Sodio (SIGMA, EE.UU.) durante 5min, más 1min de agitación manual2,7.
- 5)
Enzimas. Se utilizó pancreatina de 150mg (Italmex S.A., México) compuesta por lipasa 10 000U, amilasa 33 200U (enzima que podría actuar sobre el glicocálix) y proteasa 37 500U (enzima proteolítica)13, con una concentración de 500μg/ml, que se incubó a 28°C durante 25min, más 1min de agitación manual.
- 6)
Ampicilina. Solución inyectable de 500mg (Laboratorio Química Son's S.A. de C.V., México). Este antibiótico es capaz de atacar el glicocálix12, se aplicaron 100μg/ml durante 25min, más 1min de agitación manual.
Después de cada tratamiento se realizaron diluciones hasta 10−7. De cada dilución, se sembró 1ml en tubos con 9ml de caldo Lactosado. Los tubos positivos se resembraron en caldo Verde Brillante Bilis al 2 % y en caldo EC para determinar los NMP de CT y CF1, respectivamente. Las muestras se procesaron por triplicado para generar un total de 180 datos para cada grupo de coliformes (30 para cada técnica).
Se realizó el análisis granulométrico del sedimento de los 10 muestreos, por el método del pipeteo11, esto con el fin de relacionar la extracción de bacterias de cada técnica con el tamaño de partícula del sedimento.
El análisis estadístico se llevó a cabo con los programas NCSS 2000 y STATISTICA (StatSoft Ser 1997). Los datos fueron transformados a log10(×) y se realizaron pruebas para probar la normalidad de los datos. En algunos casos se rechazó la normalidad de los datos, por lo que se utilizó estadística no-paramétrica. La prueba de U de Mann-Whitney (z; p<0,05) se usó para establecer si existían diferencias entre las concentraciones de bacterias obtenidas por los diferentes métodos. También se buscó si había alguna relación entre el tamaño de las partículas del sedimento y las concentraciones de bacterias obtenidas con cada técnica por medio de la correlación de Spearman (rs; p<0,05). Se calculó la media geométrica de las bacterias extraídas con cada técnica y se calculó el coeficiente de variación a partir del error estándar.
Los resultados indicaron una mayor concentración de CT respecto de los CF (z>2,71; p<0,01). El 100 % de las muestras de agua rebasó el límite máximo permisible de 240 NMP de CF/100ml, para servicios al público con contacto directo en lagos artificiales recreativos15, y el 90 % de las muestras rebasó el límite máximo permisible de 1000 NMP de CF/100ml para la protección de la vida acuática4 y servicios con contacto indirecto u ocasional en lagos artificiales no recreativos15.
El número de bacterias extraídas desde el sedimento generó valores dos órdenes de magnitud superiores a los del agua (tabla 1), con diferencias significativas tanto en CT (z>6,56; p<0,01) como en CF (z>6,60; p<0,01), esto confirma la protección que proporciona el sedimento al favorecer la supervivencia de los coliformes y representa un riesgo, porque durante los paseos en las trajineras se remueve el sedimento y esto puede incrementar la concentración de bacterias en el agua8.
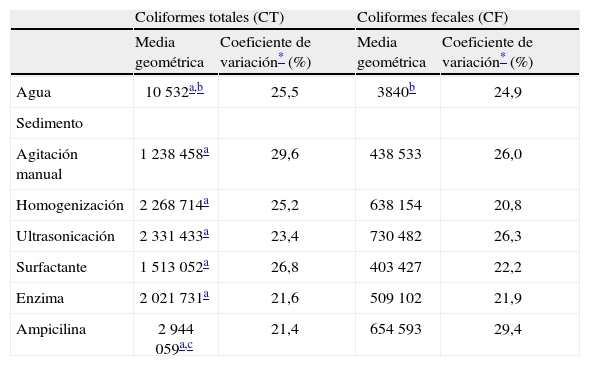
Efecto de distintas técnicas de extracción en la cuantificación de bacterias coliformes del sedimento (NMP/g) y concentración de coliformes en agua (NMP/100ml) del lago de Xochimilco, México
| Coliformes totales (CT) | Coliformes fecales (CF) | |||
| Media geométrica | Coeficiente de variación* (%) | Media geométrica | Coeficiente de variación* (%) | |
| Agua | 10 532a,b | 25,5 | 3840b | 24,9 |
| Sedimento | ||||
| Agitación manual | 1 238 458a | 29,6 | 438 533 | 26,0 |
| Homogenización | 2 268 714a | 25,2 | 638 154 | 20,8 |
| Ultrasonicación | 2 331 433a | 23,4 | 730 482 | 26,3 |
| Surfactante | 1 513 052a | 26,8 | 403 427 | 22,2 |
| Enzima | 2 021 731a | 21,6 | 509 102 | 21,9 |
| Ampicilina | 2 944 059a,c | 21,4 | 654 593 | 29,4 |
La mayor cantidad de CT en sedimento se obtuvo con la ampicilina, con una media geométrica cercana a los 3 000 000 NMP/100g, esta mostró diferencias significativas (z=2,09; p=0,03) con respecto a la concentración obtenida con agitación manual (tabla 1). Asimismo, en la extracción de CF no se detectó ninguna diferencia significativa entre las técnicas aplicadas (tabla 1).
Los resultados del análisis granulométrico indicaron que la fracción fina fue predominante en el sedimento analizado, el limo tuvo una media de 49,9±8,8 % y la arcilla 21,9±6,1 %, mientras que la fracción gruesa compuesta por arena y restos de materia vegetal fue de 28,2±9,2 %. Se encontró una correlación positiva entre la presencia de limo y el número de coliformes obtenido con la homogenización (rs>0,41; p<0,03), lo que sugiere que esta técnica es adecuada para romper los agregados en sedimentos finos.
La homogenización y la ultrasonicación tienen una acción mecánica durante la separación. La vibración en la sonicación y la intensa agitación en la homogenización separan a las bacterias por el movimiento individual de las partículas y por la fricción entre ellas a través de un efecto abrasivo y la ruptura de agregados3,10. Sin embargo, las características de los equipos determinan la intensidad y fuerza que son aplicadas a la muestra, lo que ha generado contradicciones en diversos estudios, en cuanto al tiempo óptimo para lograr la mayor separación de bacterias3,7,10.
En contraste, la correlación entre la presencia de limo y la concentración de coliformes al utilizar el surfactante y la enzima fue negativa (rs<−0,38; p<0,04); probablemente estas técnicas no son capaces de romper los agregados. Se ha recomendado el uso de surfactantes porque reducen la dispersión de los resultados que se obtienen tras aplicar estrategias dirigidas a la separación de bacterias2,7. En este estudio, el uso del Lauril Sulfato de Sodio no generó una menor variabilidad de los NMP (tabla 1). En la selección del surfactante y su concentración, se debe considerar que este también puede causar alteraciones en la superficie de la bacteria y destrucción celular. Las enzimas tienen la posibilidad de actuar sobre la estructura del glicocálix para lograr la separación. Sin embargo, los resultados obtenidos con las enzimas no mostraron mayor efectividad en la extracción de bacterias respecto del control, por lo que es necesario realizar pruebas con otras enzimas que ataquen los enlaces de la secreción extracelular de polímeros.
Es posible que la ampicilina actúe sobre el glicocálix12 y permita la separación de las bacterias del sedimento, pero también el antibiótico puede matar a las bacterias y provocar subestimaciones. Resulta indispensable considerar la sensibilidad de las bacterias y la concentración adecuada del antibiótico para proponer su uso como una técnica de extracción de bacterias. En el grupo de coliformes, Klebsiella y Enterobacter, presentan alta resistencia a la ampicilina, sin embargo, una proporción de las cepas de Escherichia coli son sensibles a este antibiótico14. La sensibilidad a la ampicilina podría explicar por qué la concentración de CF no mostró diferencias significativas respecto del control. Se ha comunicado que en los canales de Xochimilco, las bacterias coliformes mostraron una resistencia variable a la ampicilina en cepas de diferentes zonas, en un rango que va de 34,5 a 87 %9. Resulta necesario generar más información sobre el mecanismo que permite a algunos antibióticos erradicar el glicocálix, para tener mayor claridad respecto del uso de sustancias que permitan la separación de las bacterias del sedimento.
La mayor extracción de CT con el uso de ampicilina sugiere que es posible aplicar este método en la extracción de CF, por lo que se debería profundizar en el tema y efectuar estudios en los que se analicen diferentes dosis y tipos de antibióticos. Este estudio es una primera aproximación que propone el uso de enzimas y antibióticos como nuevas posibilidades para separar a las bacterias de muestras ambientales a través de un mecanismo selectivo, orientado a la eliminación del glicocálix por medios químicos. Estas estrategias pueden representar una alternativa a las técnicas tradicionales basadas en la separación física.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Esta investigación se realizó con el apoyo de la Universidad Autónoma Metropolitana. Se agradece la valiosa asesoría del Ing. Geol. Alberto Pérez Rojas en el análisis granulométrico, así como el acceso a material y equipo para llevarlo a cabo.