En este estudio se determinó el perfil de distribución de grupos filogéneticos y la detección genética de factores de virulencia en cepas de Escherichia coli uropatógena (ECUP) productoras de β-lactamasa CTX-M-15. Veintiocho cepas fueron aisladas de pacientes con infección del tracto urinario (ITU) que asistieron al Laboratorio de Salud Pública del estado Mérida, Venezuela, durante el lapso comprendido entre enero 2009 y julio 2011. La determinación de los grupos filogenéticos y la detección de seis genes de virulencia, fimH, fyuA, kpsMTII, usp, PAI y papAH, se realizó mediante amplificación por PCR. Quince cepas de 28 se ubicaron principalmente en el filogrupo A, seguidos por el B2 (12/28) y D (1/28). No se observó una relación directa entre la recurrencia o gravedad de la ITU y la distribución de los filogrupos. Todos los factores de virulencia estudiados se encontraron con la frecuencia más alta en el grupo B2. El perfil de virulencia prevalente estuvo conformado por la asociación de tres genes principales: fimH, fyuA y kpsMTII y en menor frecuencia, por la presencia de otros determinantes como usp, PAI y/o papAH. Estos resultados indican que la mayoría de ECUP estuvieron dotadas de tres propiedades virulentas importantes: adhesión, captación de hierro y evasión de la fagocitosis, las cuales favorecieron la producción de ITU recurrentes. Este es el primer trabajo que describe la asociación de grupos filogenéticos con el potencial de virulencia de cepas de ECUP productoras de β-lactamasa CTX-M-15 en Venezuela.
In this study, the distribution of phylogenetic groups and the genetic detection of virulence factors in CTX-M-15 β-lactamase-producing uropathogenic Escherichia coli (UPEC) strains were analyzed. Twenty eight strains were isolated between January 2009 and July 2011 from patients with urinary tract infection (UTI) who attended the Public Health Laboratory at Mérida, Venezuela. Determination of phylogenetic groups and detection of six virulence genes, fimH, fyuA, kpsMTII, usp, PAI and papAH, were performed by PCR amplification. Fifteen of the 28 isolates were mainly located in the phylogenetic group A, followed by B2 (12/28) and D (1/28). No direct relationship between the severity or recurrence of UTI and the distribution of phylogroups was observed. All studied virulence factors were found in group B2 strains with the highest frequency. The prevalent virulence profile included the combination of three main genes: fimH, kpsMTII and fyuA and, to a lesser extent, the presence of other determinants such as usp, PAI and/or papAH. These results indicate that virulent UPEC incorporated three important properties: adhesion, iron uptake and evasion of phagocytosis, which favored the production of recurrent UTI. This is the first report describing the association of phylogenetic groups with the potential virulence of CTX-M-15 β-lactamase producing UPEC strains in Venezuela.
Escherichia coli es uno de los más importantes agentes causales de infección extraintestinal31. Esta especie bacteriana puede ser agrupada en cepas comensales, patotipos intestinales y patógenos extraintestinales. En este último grupo se encuentran las cepas de E. coli uropatógena (ECUP), las productoras de sepsis y meningitis26.
ECUP es el agente etiológico más comúnmente involucrado en las infecciones del tracto urinario (ITU). Se estima que entre un 70% a 95% de las ITU de inicio comunitario y aproximadamente un 50% de las de origen nosocomial son producidas por ECUP26,31. Las cepas de E. coli son genéticamente diversas, de manera que las diferencias entre aislados patógenos y comensales se fundamentan en sus antecedentes filogenéticos. Las cepas comensales pertenecientes a los grupos A y B1 son consideradas de bajo poder virulento, mientras que las patógenas extraintestinales, además de albergar genes que codifican factores de virulencia responsables de promover las etapas de colonización, adherencia, invasión y la evasión de los mecanismos de defensa del hospedero humano, derivan principalmente de los filogrupos B2 y D5,26,31. Las cepas de ECUP del grupo B2 producen el 69% de las cistitis, 67% de las pielonefritis y el 72% de las sepsis con punto de partida en el tracto urinario5,12,26,28,31.
La prevalencia y frecuencia de aislamiento de ECUP en ITU en pacientes de la comunidad se ha relacionado con el incremento de la resistencia antimicrobiana, especialmente a los antibióticos β-lactámicos, por la producción de β-lactamasas de espectro extenso (BLEE), principalmente las del tipo CTX-M17,26. La β-lactamasa CTX-M-15, una de las variantes del grupo CTX-M-1, es la BLEE de más amplia diseminación mundial6,11,25,30.
Es controversial la asociación de genes que median la resistencia antimicrobiana, grupos filogenéticos y la presencia de determinantes de virulencia como indicadores de patogenicidad5,13,21,22,28. Sin embargo, Lee et al.18 encontraron una estrecha relación entre los genes involucrados en el transporte del hierro y la supervivencia en el suero (genes iutA y traT, respectivamente) y la presencia de CTX-M-1 y CTX-M-9 en cepas de ECUP del grupo B2. En este contexto, recientemente reportamos por primera vez en Latinoamérica la presencia de ECUP productora de CTX-M-32, filogrupo B2 que portaba cuatro genes asociados a virulencia (fimH, kpsMTII, fyuA y usp)2.
En Venezuela son escasas las publicaciones que describen las bases genéticas que sustentan el potencial patogénico de los grupos filogenéticos de ECUP productoras de BLEE que circulan en la comunidad2,20. Por tal motivo, en este estudio se determinó por primera vez la distribución de los filogrupos y la presencia genética de factores de virulencia en cepas de ECUP productoras de β-lactamasa CTX-M-15 aisladas de pacientes con ITU provenientes de la comunidad de Mérida, Venezuela.
Materiales y métodosCepas bacterianasSe estudió una colección de 28 cepas de E. coli productoras de CTX-M-15 aisladas de muestras de orina provenientes de pacientes que asistieron al Laboratorio de Salud Pública del estado Mérida, Venezuela, con diagnóstico de infección urinaria durante el período enero 2009 a julio 2011. Estas cepas fueron caracterizadas fenotípica y genéticamente para genes blaBLEEs en un estudio previo11. Dentro de las características clínico-epidemiológicas de los pacientes que asistieron a este centro de salud, resalta que la edad promedio fue 49,8 años (rango de 8 a 86 años), 24 pacientes pertenecieron al género femenino y 4 al masculino. Veinticuatro casos tenían diagnóstico de infección urinaria recurrente y la mitad de estos (12) presentó otra patología o condición clínica asociada, tales como: litiasis renal, vejiga neurogénica, atrofia renal, prolapso genital o vesical, diabetes mellitus y embarazo.
Preparación del ADN genómicoLa extracción del ADN total se realizó mezclando varias colonias provenientes de cultivos frescos en 200μl de agua destilada estéril. Estas suspensiones se congelaron a −20°C durante 30 min y luego se sometieron a ebullición durante 15min. Los residuos celulares se separaron por centrifugación (13 000g durante 5min a temperatura ambiente) y el ADN disuelto en el sobrenadante se recuperó en un tubo eppendorf estéril, el cual se almacenó a −20°C hasta el momento de su uso.
Detección de los grupos filogenéticosLas cepas fueron clasificadas dentro de los biotipos filogenéticos (A, B1, B2 y D) de acuerdo a la presencia de los genes chuA, yjaA y el fragmento génico TspE4.C2, mediante una PCR múltiple utilizando los iniciadores (tabla 1) y condiciones previamente establecidas8. La mezcla de amplificación se realizó en un volumen final de 25μl y estuvo compuesta por: 2,5μl del buffer de reacción (10X; Bioneer, Daejeon, Korea), 1,5μl de MgCl2 (50mM; Bioneer), 1,5μl de dNTPs (10 mM; Bioneer), 2,5μl de cada iniciador (10pmol/μl), 0,3μl de la Taq polimerasa (5U/μl; Bioneer), 2,2μl de agua bidestilada ultrapura y 2μl del ADN extraído. Los resultados fueron interpretados con base en el esquema de Clermont et al.8 mediante la ausencia (−) o presencia (+) de los elementos antes descritos: grupo A: chuA − y TspE4.C2 −; B1: chuA − y TspE4.C2 +; B2: chuA + y yjaA + y el filogrupo D: chuA + y yjaA −. Para estos ensayos se utilizaron como cepas control: E. coli LMM36-ULA (chuA + y yjaA +) y E. coli LMM32-ULA (TspE4.C2 +).
Iniciadores utilizados en este estudio
| Gen o fragmento de ADN | Nombre del iniciador | Secuencia del oligonucleótido | Tamaño del amplicón (pb)a | Referencia |
| 5´→ 3´ | ||||
| chuA | chuA 1 | GACGAACCAACGGTCAGGAT | 279 | 8 |
| chuA 2 | TGCCGCCAGTACCAAAGACA | |||
| yjaA | yjaA 1 | TGAAGTGTCAGGAGACGCTG | 211 | 8 |
| yjaA 2 | ATGGAGAATGCGTTCCTCAAC | |||
| TspE4.C2 | TspE4C21 | GAGTAATGTCGGGGCATTCA | 152 | 8 |
| TspE4C22 | CGCGCCAACAAAGTATTACG | |||
| kpsMTII | KpsMTIIF | GCGCATTTGCTGATACTGTTG | 272 | 16 |
| KpsMTIIR | CATCCAGACGATAAGCATGAGCA | |||
| fimH | fimHF | TGCAGAACGGATAAGCCGTGG | 508 | 16 |
| fimHR | GCAGTCACCTGCCCTCCGGTA | |||
| PAIb | PAIF | GGACATCCTGTTACAGCGCGCA | 930 | 16 |
| PAIR | TCGCCACCAATCACAGCCGAAC | |||
| papAH | papAHF | ATGGCAGTGGTGTCTTTTGGTG | 720 | 16 |
| papAHR | CGTCCCACCATACGTGCTCTTC | |||
| fyuA | fyuAF | TGATTAACCCCGCGACGGGAA | 880 | 16 |
| fyuAR | CGCAGTAGGCACGATGTTGTA | |||
| usp | uspF | ATGCTACTGTTTCCGGGTAGTGTGT | 1000 | 23 |
| uspR | CATCATGTAGTCGGGGCGTAACAAT |
Se estudiaron 6 genes de virulencia, los cuales incluyeron: cápsula polisacárida específica del grupo II (kpsMTII), adhesina de la fimbria tipo 1 (fimH), fimbria P (papAH), marcador de isla de patogenicidad (PAI), yersiniabactina (sideróforo fyuA) y proteína específica uropatógena (usp). Los genes kpsMTII, fimH y PAI fueron detectados mediante una PCR múltiple y el resto (papAH, fyuA y usp) por PCR simple, utilizando los iniciadores señalados en la tabla 1 y las condiciones de amplificación previamente establecidas16. La mezcla de reacción para las PCR múltiple estuvo compuesta por 2,5μl de agua bidestilada ultrapura, 2,0μl de buffer (10X; Bioneer), 2,0μl de dNTPs (10mM; Bioneer), 1,5μl de MgCl2 (50mM; Bioneer), 0,3μl de Taq polimerasa (5 U/μl; Bioneer), 2,5μl de cada iniciador (10pmol/μl) excepto para el fimH que se utilizó 2μl y de ADN 2μl para un volumen final de 25μl. Para las PCR simples se utilizaron 12,3μl de agua bidestilada ultrapura, 2,5μl de buffer (10X; Bioneer), 1,5μl de dNTPs (10mM; Bioneer), 1,5μl de MgCl2 (50mM; Bioneer), 0,2μl de Taq polimerasa (5U/μl; Bioneer), 2,5μl de cada iniciador (10pmol/μl) y 2μl de ADN para un volumen final de 25μl. Las cepas control utilizadas en estos ensayos fueron E. coli LMM/E02-ULA (fimH +, fyuA +, kpsMTII + y PAI +) y E. coli LMM/Sc03-ULA (papAH +) y E. coli LMM/E02-ULA (usp +).
En todos los ensayos, los productos amplificados se separaron en un gel de agarosa (Sigma-Aldrich Co. St. Louis, MO, USA) al 1%, teñido con bromuro de etidio (0,5μg/mL; Sigma-Aldrich) y fotografiados con el UVP Biodoc-It System. Se utilizó el marcador de peso molecular de 100 pb (Bioneer) para identificar el tamaño de los productos amplificados.
Las cepas de control utilizadas en este estudio pertenecen a la colección de referencia del Laboratorio de Microbiología Molecular (LMM) de la Facultad de Farmacia y Bioanálisis, Universidad de Los Andes (ULA), Mérida, Venezuela, las cuales fueron caracterizadas genéticamente en estudios anteriores2,11,20.
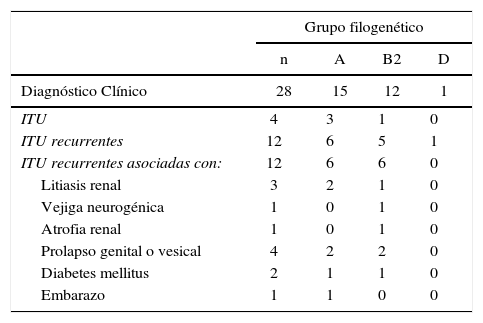
ResultadosLa distribución de los grupos filogenéticos en las 28 cepas de ECUP productoras de CTX-M-15 y su relación con el diagnóstico clínico se muestran en la tabla 2. Quince de los 28 aislados se concentraron principalmente en el filogrupo A. El filogrupo B2 estuvo representado por 12 cepas, mientras que la muestra restante se ubicó en el filogrupo D (1/28). En esta colección de ECUPs no se encontraron cepas pertenecientes al grupo B1. La relación de esta característica y el tipo de diagnóstico clínico, demostró que las cepas aisladas en pacientes con ITU sin complicación, o no recurrentes, se ubicaron mayoritariamente en el filogrupo A (3/4). En el caso de las ITU recurrentes sin asociación a otra patología o condición, las cepas se distribuyeron casi equitativamente entre el grupo A (6/12) y B2 (5/12) y fue en este grupo de pacientes donde se encontró la única cepa de ECUP del filogrupo D (1/12). Las cepas aisladas de ITU recurrentes asociadas con otras patologías o embarazo se ubicaron con igual número (6/12) en los filogrupos A y B2.
Distribución de los filogrupos de ECUP productoras de CTX-M-15 de acuerdo al diagnóstico clínico
| Grupo filogenético | ||||
|---|---|---|---|---|
| n | A | B2 | D | |
| Diagnóstico Clínico | 28 | 15 | 12 | 1 |
| ITU | 4 | 3 | 1 | 0 |
| ITU recurrentes | 12 | 6 | 5 | 1 |
| ITU recurrentes asociadas con: | 12 | 6 | 6 | 0 |
| Litiasis renal | 3 | 2 | 1 | 0 |
| Vejiga neurogénica | 1 | 0 | 1 | 0 |
| Atrofia renal | 1 | 0 | 1 | 0 |
| Prolapso genital o vesical | 4 | 2 | 2 | 0 |
| Diabetes mellitus | 2 | 1 | 1 | 0 |
| Embarazo | 1 | 1 | 0 | 0 |
a ITU: Infección del tracto urinario.
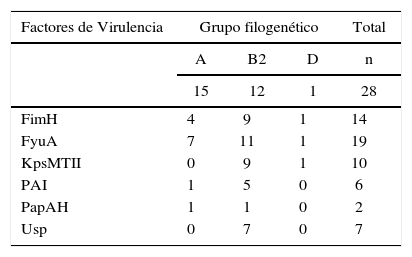
En la tabla 3 se muestran los factores de virulencia detectados en las cepas de ECUP y su frecuencia en los filogrupos A, B2 y D. Todos los factores de virulencia estudiados se encontraron con una frecuencia mayor en el grupo B2. El gen fyuA fue el más frecuente (19/28), seguidos de fimH (14/28) y kpsMTII (10/28). El gen usp fue detectado exclusivamente en las cepas pertenecientes al filogrupo B2 (7/28) y representó el tercero más frecuente en este grupo (7/15) luego de los genes fyuA (11/15), fimH y kpsMTII (9/15). En el grupo A no se encontró kpsMTII ni usp, mientras que solo 3 genes de virulencia (fyuA, fimH y kpsMTII) de los 6 estudiados, fueron detectados en la única cepa del grupo D.
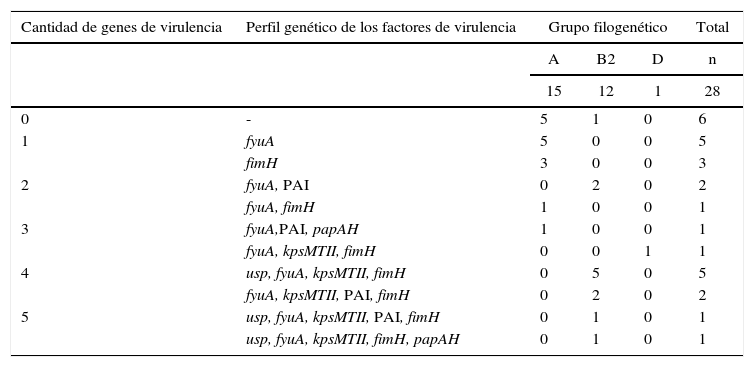
La presencia y las diferentes asociaciones de factores de urovirulencia, así como la ausencia de estos en las cepas estudiadas, permitió identificar varios perfiles (tabla 4). El mayor número de cepas con ausencia de factores de virulencia fue observado en el filogrupo A (5/15), mientras que el grupo B2 concentró el mayor número de ECUP con la más alta frecuencia de asociaciones de genes de virulencia, en la que se incluyeron cepas con 4 (7/12) y 5 combinaciones diferentes (2/12).
Perfil de genes de virulencia en cepas de ECUP productoras de CTX-M-15 y su distribución de acuerdo a grupos filogenéticos
| Cantidad de genes de virulencia | Perfil genético de los factores de virulencia | Grupo filogenético | Total | ||
|---|---|---|---|---|---|
| A | B2 | D | n | ||
| 15 | 12 | 1 | 28 | ||
| 0 | - | 5 | 1 | 0 | 6 |
| 1 | fyuA | 5 | 0 | 0 | 5 |
| fimH | 3 | 0 | 0 | 3 | |
| 2 | fyuA, PAI | 0 | 2 | 0 | 2 |
| fyuA, fimH | 1 | 0 | 0 | 1 | |
| 3 | fyuA,PAI, papAH | 1 | 0 | 0 | 1 |
| fyuA, kpsMTII, fimH | 0 | 0 | 1 | 1 | |
| 4 | usp, fyuA, kpsMTII, fimH | 0 | 5 | 0 | 5 |
| fyuA, kpsMTII, PAI, fimH | 0 | 2 | 0 | 2 | |
| 5 | usp, fyuA, kpsMTII, PAI, fimH | 0 | 1 | 0 | 1 |
| usp, fyuA, kpsMTII, fimH, papAH | 0 | 1 | 0 | 1 | |
La ITU es una de las afecciones clínicas más frecuentes en el ámbito de la asistencia primaria en salud, especialmente en el género femenino. Se estima que el 10% de las mujeres padece, por lo menos, una ITU al año y hasta un 60% sufre un episodio en algún momento de su vida5,21. En este estudio, la mayoría de las cepas de E. coli fueron aisladas en pacientes femeninas (24/28) que cursaron con ITU recurrente y la mitad de estas se asociaron a otra patología o condición clínica (tabla 2). Johnson et al.15 señalaron que las cepas de E. coli que causan ITU recurrentes, además de ser favorecidas por condiciones subyacentes del hospedero humano, poseen factores genéticos que facilitan su persistencia en el tracto urinario.
Durante los últimos años se ha incrementado el aislamiento de cepas de E. coli productoras de CTX-M-15 como un patógeno prevalente en infecciones de inicio comunitario, especialmente las relacionadas con el tracto urinario6,11,13,17,25. Varios estudios reportan que independientemente de la diversidad genética de las cepas de E. coli, las β-lactamasas tipo CTX-M se encuentran extensamente distribuidas en este género bacteriano gracias a una plataforma genética eficiente que le permite a esta enzima diseminarse y movilizarse entre microorganismos diferentes6,19,25. En este estudio, las cepas de ECUP productoras de CTX-M-15 se distribuyeron en tres (A, B2 y D) de los cuatro principales grupos filogenéticos, siendo el grupo A el dominante (tabla 2). Aunque los grupos B2 y D son considerados como los más frecuentemente implicados en ITU por su capacidad patogénica16,18,28, en este trabajo no se observó una relación directa entre la severidad o complicación de la ITU y la distribución de los filogrupos. Por el contrario, cepas de E. coli del grupo A, indistintamente produjeron ITU no complicada, recurrente y asociada a otra patología o condición clínica. Al respecto, reportes previos han señalado que no existe una distribución particular de los grupos filogenéticos de E. coli y el síndrome urinario14,22. Sin embargo, la procedencia geográfica de las cepas, como también las características de la población estudiada, son elementos a considerar cuando se establecen patrones particulares de distribución filogenética en cepas de E. coli3.
Las cepas de ECUP poseen una variedad de determinantes de patogenicidad que hacen posible la colonización e invasión del tracto urinario. Estos determinantes median la presencia de fimbrias, adhesinas, sideróforos, toxinas, formación de cápsula, entre otros5,28. En este estudio 22 de las 28 cepas de E. coli presentó por lo menos un factor de urovirulencia de los 6 analizados (tabla 3). Además, independientemente del grupo filogenético, se pudo observar que los genes fyuA y fimH fueron los más frecuentes (19/28 y 14/28, respectivamente).
El gen fyuA codifica la proteína yersiniabactina férrica (FyuA), la cual actúa como receptora para el sideróforo Fe-Ybt en los sistemas de captación de hierro5. El sistema FyuA/yersiniabactina participa en el crecimiento, colonización y formación de biopelículas de E. coli en el tracto urinario10,29. Recientemente se ha considerado al gen fyuA como uno de los mejores marcadores de cepas de ECUP y junto con el gen fimH que codifica para una adhesina o fimbria tipo 1, constituyen los indicadores claves de virulencia en cepas de ECUP16,28,29. En este estudio se demostró que en la mayoría de las cepas los genes fyuA y fimH fueron encontrados en asociación y formando parte de diferentes patrones de virulencia (tabla 4). De hecho, el gen kpsMTII que media la producción de proteínas de la cápsula, fue detectada en forma conjunta con los determinantes fyuA y fimH. Por otra parte, también destaca la estrecha relación observada entre la presencia del gen fyuA y el marcador de isla de patogenicidad (PAI, del inglés pathogenicity island). Al respecto, varios investigadores han confirmado la localización del locus que codifica el sideróforo Fe-YbtA/yersiniabactina en PAI II o en islas de alta patogenicidad (HPI, del inglés high-pathogenicity island)10,16,29. Otro gen que se encuentra localizado en PAI es el que codifica la proteína específica uropatogénica (Usp)23. Este factor, con funciones de bacteriocina, fue encontrado en el 25% de las cepas y exclusivamente en las del filogrupo B2. Es probable que su presencia incremente las propiedades virulentas de las cepas que conforman este grupo.
La expresión de otras adhesinas, como las fimbrias P, con afinidad a receptores específicos distintos a las de tipo 1, puede conferir ventajas a las cepas de ECUP, especialmente aquellas que tienen importancia en el ascenso y patogénesis de la ITU superior como la pielonefritis5. Sin embargo, papHA (fimbrias P) fue el gen urovirulento que se encontró con menor frecuencia, detectándose solamente en 2 cepas una del grupo filogenético A y la otra en el filogrupo B2. En ambos casos estas cepas fueron causantes de ITU recurrentes asociadas a litiasis renal.
De acuerdo a los resultados obtenidos, la mayoría de las cepas de ECUP estuvieron dotadas de tres propiedades virulentas importantes: adhesión, captación de hierro y evasión de la fagocitosis, las cuales coadyuvaron a la producción de ITU recurrentes. Un perfil similar al descrito ha sido comunicado previamente en cepas de ECUP aisladas de pacientes con ITU24, urosepsis1,16, cistitis recurrentes15 y en pacientes con ITU asociados con diabetes mellitus9.
Por otra parte, 6 de las 28 cepas no mostraron ninguno de los factores de virulencia analizados en este trabajo, pero es probable que otros genes de virulencia, diferentes a los estudiados, pudieran estar presentes en estas cepas. En este sentido, trabajos previos describen que en una fracción apreciable de las cepas ECUP analizadas (10% al 51%), no se encontraron genes de virulencia tales como traT, PAI, pap, sfa, aer, cnf1 y hly24,27. Estos resultados reflejan la heterogeneidad en la distribución de los factores de virulencia y la condición multifactorial y compleja que tiene el potencial patogénico de las cepas de ECUP. Es importante destacar que estas cepas fueron aisladas como patógenos únicos en pacientes que, en su mayoría, se caracterizaron por la recurrencia de la infección y la presencia de condiciones predisponentes. Asimismo, al igual que en el resto de la colección de cepas de ECUP estudiadas, los 6 aislados que resultaron negativos para la detección de genes de virulencia, fueron portadores del gen blaCTX-M-15 y, particularmente, estos también presentaron resistencia a ciprofloxacina y tobramicina11.
Diversos investigadores señalan que las β-lactamasas y los genes de virulencia pueden coexistir en cepas de E. coli como resultado de un proceso coevolutivo gradual, pero aún no está claro si la expresión de las BLEE afecta la virulencia y/o la eficacia biológica (fitness) de estas bacterias4,26,31. Si bien establecer la relación del perfil de resistencia y el patrón de virulencia con el fitness de ECUP no fue un objetivo de este estudio, es razonable suponer que ambas características proporcionaron a las cepas estudiadas ventajas para mejorar los mecanismos adaptativos, los cuales potenciaron su desarrollo, colonización e infección del tracto urinario de manera recurrente. Al respecto, Van der Bij et al.30 y Chen et al.7 comunicaron que la diversidad genómica, la presencia de factores de virulencia y la producción de BLEE, no afectaron el fitness de ECUP y que, por el contrario, estas características genéticas favorecieron la diseminación de algunos clones de importancia epidemiológica.
En conclusión, a pesar de que el tamaño de la muestra estudiada fue pequeño, los hallazgos obtenidos sustentan la hipótesis que los procesos fisiopatológicos que se activan en la instalación de una infección urinaria están mediados, además del estado inmunológico del paciente, por un conjunto de factores urovirulentos cuya combinación es particular para cada cepa. En este sentido, el perfil prevalente de las cepas de ECUP analizadas estuvo conformado por la asociación de tres genes principales: fimH, fyuA y kpsMTII y, en menor grado, por la presencia de otros determinantes genéticos como usp, PAI y/o papAH. Este perfil de virulencia de las cepas ECUP fue independiente del grupo filogenético y de la propiedad de producir la β-lactamasa CTX-M-15. Por consiguiente, los factores de virulencia expresados en las cepas de ECUP, y con una significación clínica importante, pueden constituir la clave para el desarrollo de vacunas como una estrategia para el control y prevención de las infecciones del tracto urinario.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo fue financiado por el Consejo de Desarrollo Científico, Humanístico, Tecnológico y de las Artes de la Universidad de Los Andes (CDCHTA-ULA), código: ADG FA-02-97-07 y FA-523-12-03-EM y por el Fondo Nacional de Ciencia, Tecnología e Innovación (FONACIT), Venezuela (Proyecto N° 2012002321. Contrato N° 201201213).