La inclusión de cultivos de cobertura invernales (CCI) en un sistema de siembra directa (SD) en reemplazo del barbecho constituye una alternativa promisoria para mejorar la salud del suelo y contribuir a la sustentabilidad ambiental de los sistemas agrícolas. Esta revisión ofrece un panorama integral de los efectos sobre el microbioma del suelo que tiene la introducción de CCI en rotación con cultivos de verano en sistemas de SD vs. el barbecho desnudo. Se realizó una búsqueda sistemática de la literatura que reporta los efectos de los CCI sobre los parámetros de abundancia, actividad y diversidad microbiana del suelo. Combinando 7 criterios de búsqueda se seleccionaron y analizaron 22 trabajos. El conjunto de resultados de esos trabajos muestra que la actividad enzimática del suelo se ve favorecida con la inclusión de CCI en la rotación, principalmente si estos se componen de leguminosas y mezclas de especies. Más de la mitad de esos trabajos reportan una mayor biomasa microbiana con CCI que con barbecho. Además, se advierte que los efectos de los CCI sobre los parámetros microbianos son independientes de la duración de los ensayos. Sin embargo, aún se necesitan más investigaciones básicas que permitan reducir la heterogeneidad entre estudios y comprender las complejas interacciones que ocurren entre los CCI y el microbioma del suelo.
The inclusion of winter cover crops (WCC) in no-till (NT) systems in replacement of bare fallow is a promising alternative to improve soil health and consequently, contribute to environmental sustainability of agricultural systems. This review provides a comprehensive evaluation of the effects of the use of WCC in rotation with summer cash crops under NT systems on the soil microbiome versus bare fallows. A systematic literature search was conducted to evaluate the impact of WCC on microbial parameters indicative of abundance, activity and diversity. Twenty-two papers were selected based on seven combined criteria. The results of this review show that enzyme activities in soil are enhanced with the inclusion of WCC in the rotation, particularly those that include legumes and mix of species. In general, more than half of the analyzed papers report higher microbial biomass in soils with WCC than in bare fallow. Interestingly, the effects of WCC on microbial parameters are independent of the duration of the experiments. However, more basic research is necessary to reduce the heterogeneity of the studies and to better understand the complexity of the interactions between WCC and the soil microbiome.
La agricultura de conservación, en particular, el uso de la labranza cero o siembra directa (SD), surgió como respuesta a los problemas de degradación de los suelos ocasionados por la expansión e intensificación agrícola32. La SD combinada con la rotación de cultivos se presenta como un sistema de manejo agrícola muy promisorio y sustentable49. Los cultivos de cobertura invernales (CCI) son recomendados para complementar los efectos de la SD durante la época de barbecho, entre dos cultivos comerciales (usualmente cultivos de verano). En el sistema de SD, el crecimiento vegetativo de los CCI se suprime con herbicidas, con labores mecánicas (por ejemplo, corte o rolado) o con una combinación de los dos métodos (por ejemplo, glifosato+rolado) antes de la siembra del cultivo comercial; los CCI no son pastoreados, cosechados, ni incorporados al suelo por labranza3,4,54,56.
Los beneficios de los CCI se relacionan estrechamente con las especies utilizadas. Por ejemplo, las leguminosas aportan N extra al suelo por fijación biológica, favorecen el control de malezas y mejoran la estructura del suelo14,31,51,55, en tanto que las gramíneas producen una gran cantidad de biomasa, absorben nitratos residuales y los devuelven al suelo en forma de N orgánico; asimismo, reducen la erosión del suelo y compiten con las malezas invernales6,38,39,53,77. Las crucíferas son también muy utilizadas por su potencial para reducir la compactación de los suelos18 y controlar patógenos y malezas30,34. A menudo, una mezcla de CCI se compone de especies de distintas familias (generalmente, leguminosas, gramíneas y crucíferas), con características funcionales diferentes. Los CCI multiespecie pueden aportar más beneficios que los CCI monoespecíficos10. Por ejemplo, las mezclas de especies aumentan la producción de compuestos con efecto fungicida19 y la supresión de malezas59, y pueden producir más o igual cantidad de biomasa y acumular más N que un cultivo monoespecífico60.
Dada la importancia de los CCI como práctica de manejo sustentable, tanto para la conservación y mejora de la calidad del suelo como para la retención de nutrientes, es importante dilucidar los efectos de estos sobre la salud del suelo. La «calidad» del suelo ha sido definida como la «capacidad del suelo de funcionar en forma continuada como un sistema vital viviente de acuerdo con los límites de los ecosistemas y de manejo de la tierra, de sustentar la productividad biológica, promover la calidad del aire y del agua, y mantener la salud animal, humana y de las plantas»23. Más recientemente, se ha introducido también el concepto de suelo saludable como parte del concepto de calidad del suelo, definido como un sistema estable con altos niveles de diversidad biológica, actividad, ciclado de nutrientes y resiliencia ante distintos disturbios63.
La calidad del suelo puede ser estimada y cuantificada a través de la evaluación de parámetros físicos, químicos, bioquímicos y biológicos12. Entre los parámetros biológicos, los microorganismos del suelo y sus funciones han sido reconocidos como componentes integrales de la calidad del suelo, dado que están involucrados en procesos claves que permiten mantener las funciones del suelo, como la formación de la estructura, la descomposición de la materia orgánica, el ciclado de nutrientes y la degradación de contaminantes7,20,40,68,72. Además, son capaces de responder rápidamente a perturbaciones externas ya que, por su alta relación superficie:volumen, establecen una íntima relación con el entorno8,57,73. Por lo tanto, los indicadores microbianos se utilizan para monitorear la calidad del suelo por ser sensibles a factores ambientales, prácticas de manejo, tipo de suelo y especies vegetales2,22,27,28,43.
Los indicadores microbiológicos pueden ser clasificados en tres grupos, de acuerdo a la información que ellos proveen: 1) abundancia microbiana, definida como el componente vivo de la materia orgánica del suelo: incluye medidas de carbono (C) y N de la biomasa microbiana (BM), unidades formadoras de colonias (UFC), ácidos grasos fosfolipídicos (PLFA), abundancia de grupos filogenéticos específicos (PCR cuantitativa); 2) actividad microbiana: indicadores de respiración microbiana, actividad enzimática, nitrificación potencial; 3) diversidad y composición microbiana, definida como el número de diferentes taxones (riqueza) y la abundancia relativa de los diferentes grupos (equitatividad o evenness)36: análisis de perfiles fisiológicos a nivel de comunidad (CLPP) para estudiar la diversidad funcional microbiana, índices de diversidad α [índices de heterogeneidad de Shannon-Weaver (H’) y el recíproco del índice de Simpson (1/λ), número de OTUs observadas e índice de Chao-1] y diversidad β de hongos y bacterias
Numerosos estudios han analizado los efectos de los CCI sobre el microbioma del suelo, y reportaron aumentos en la biomasa microbiana5, la actividad enzimática33 y la diversidad fisiológica16. En tanto, un reciente metaanálisis publicado por Alvarez et al.3 reporta interesantes resultados para la región pampeana en cuanto a la introducción de CCI en rotación con soja o maíz. Tanto las propiedades físicas como las químicas de los suelos mejoraron en general, mientras que el rinde de maíz también aumentó significativamente con el uso de CCI de leguminosas. Sin embargo, dicho estudio no analizó los efectos de los CCI sobre las propiedades microbianas del suelo, por lo cual resulta necesaria una revisión sobre este tema.
Hay varios metaanálisis sobre temas similares, pero algunos no son específicos de CCI; además, varios se limitan a un grupo taxonómico en particular o evalúan solo algunos parámetros microbianos11,21,29,45,65. En el metaanálisis realizado por Bowles et al.11 se informaron efectos positivos de los cultivos de cobertura (CC) sobre la colonización microbiana de las raíces de cultivos de verano, pero solo se estudiaron los hongos micorrícicos arbusculares (HMA). En otro metaanálisis, el de McDaniel et al.45, se analizó el efecto de la rotación de cultivos y el manejo sobre la dinámica de la materia orgánica del suelo y se encontró que la rotación de cultivos asociada a la inclusión de CC mantuvo la calidad y productividad del suelo, con aumento del C y el N total y de la biomasa microbiana (CBM y NBM). Otro metaanálisis reportó que la diversidad de cultivos en rotación aumentó la riqueza y diversidad microbiana del suelo65. Sin embargo, ninguno de estos dos trabajos investigó específicamente sobre los CC.
El reciente metaanálisis realizado por Kim et al.37 fue el primero en estudiar el impacto de los CC sobre el microbioma edáfico. Dichos autores reportaron que los CC tienen efectos significativos en comparación con los barbechos desnudos, con incrementos en los parámetros de abundancia, actividad y diversidad microbiana37. Sin embargo, este metaanálisis incluyó trabajos sobre abonos verdes (es decir, cultivos que se incorporan al suelo por labranza), los que no son considerados como CCI en la presente revisión. Nuestra hipótesis de investigación es que la introducción de CCI en la rotación con cultivos de verano incrementa la actividad, abundancia y diversidad microbiana del suelo en comparación con un manejo donde el suelo permanece sin cobertura (barbecho desnudo) entre cultivos de cosecha estivales. Esta revisión sistemática se planteó con el objetivo de dar respuesta a dicha hipótesis, en particular, para sistemas de SD.
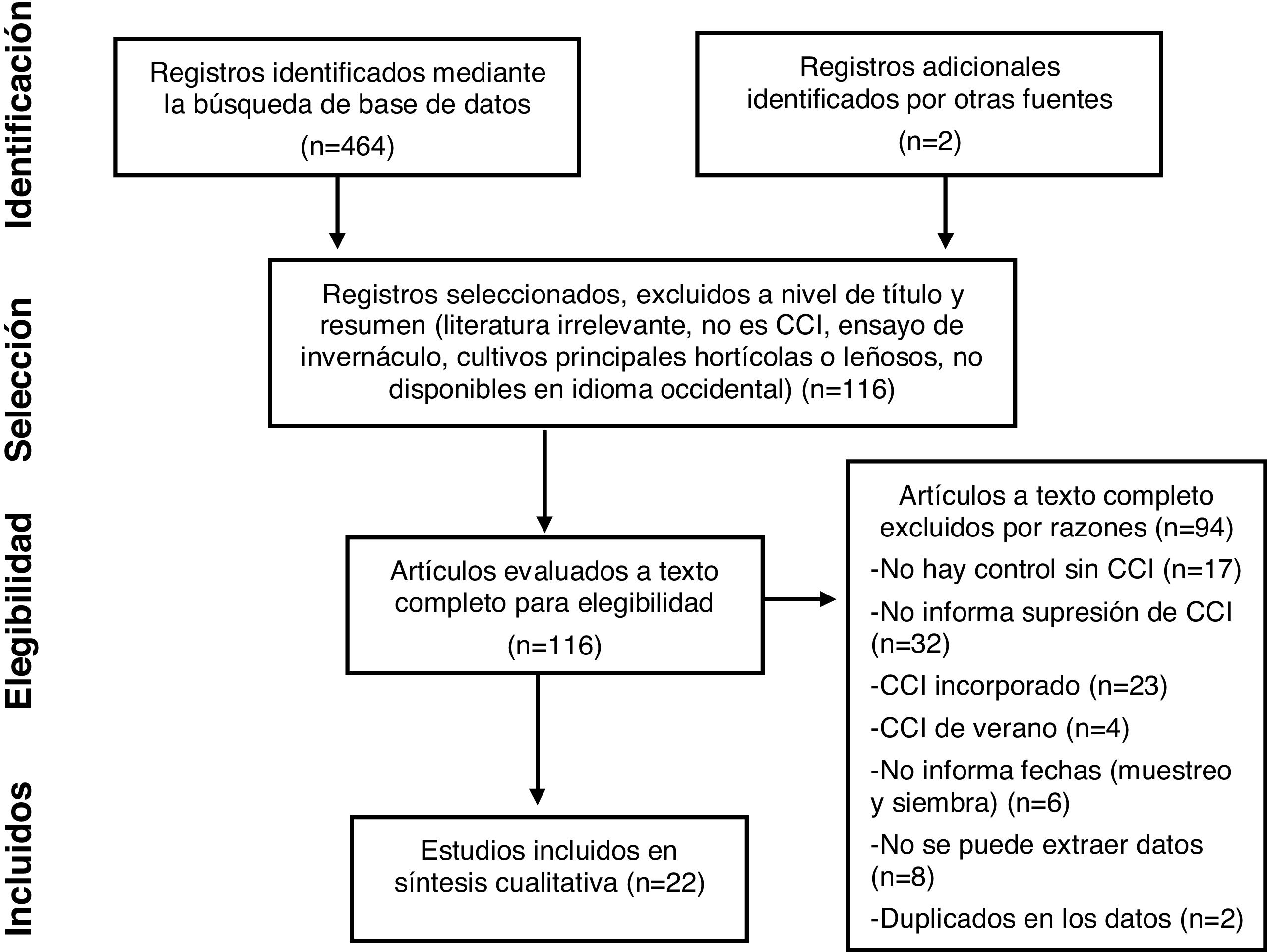
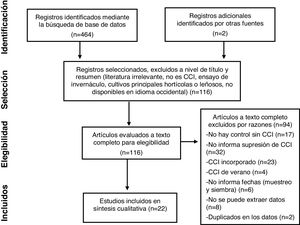
MétodosCriterios de selecciónEn marzo de 2020, se realizó una revisión sistemática de literatura en las bases de datos disponibles en línea. Las palabras clave que se utilizaron para la búsqueda de artículos fueron una combinación de «cover crop*» y «microbial» o «microb*». La búsqueda inicial se llevó a cabo en SCOPUS y arrojó un total de 464 artículos, que fueron seleccionados por título y resumen. También se examinó la literatura citada en los estudios que cumplieron con nuestros criterios, y se expandió la búsqueda aún más con Google Scholar, ScienceDirect, AGRICOLA y Wiley Online Library. Los criterios que se adoptaron para incluir un artículo en esta revisión fueron los siguientes: 1) ensayo de campo bajo SD, 2) inclusión de tratamiento control (barbecho desnudo) y de al menos un tratamiento identificado como CCI, 3) nombre científico de las especies empleadas, 4) CCI no cosechados, tampoco incorporados o pastoreados, 5) diseño experimental claramente descripto, 6) fecha de muestreo del suelo, 7) cultivo anual de verano como sucesor del CCI. Además, no se extrajeron datos de trabajos sin el dato explícito de supresión de los CCI; tampoco de los que incluyeron parcelas inoculadas con patógenos, plagas o malezas ni de los que describían comparaciones en las que se agregó una enmienda orgánica a las parcelas con CCI pero no a las que permanecían en barbecho, o viceversa.
En los trabajos que compararon CCI con labranza convencional y SD, solo se consideró la comparación con SD. A su vez, en los trabajos en los que compararon un tratamiento control sin CCI con varios CCI (multiespecie o monoespecífico), se analizó cada tratamiento CCI por separado versus el control.
Después de aplicar estos criterios, quedaron seleccionados 22 trabajos (tabla 1), que reportaron 36 parámetros microbianos de interés (tabla 2). Este proceso de búsqueda se describe en la figura 1 mediante el diagrama PRISMA46.
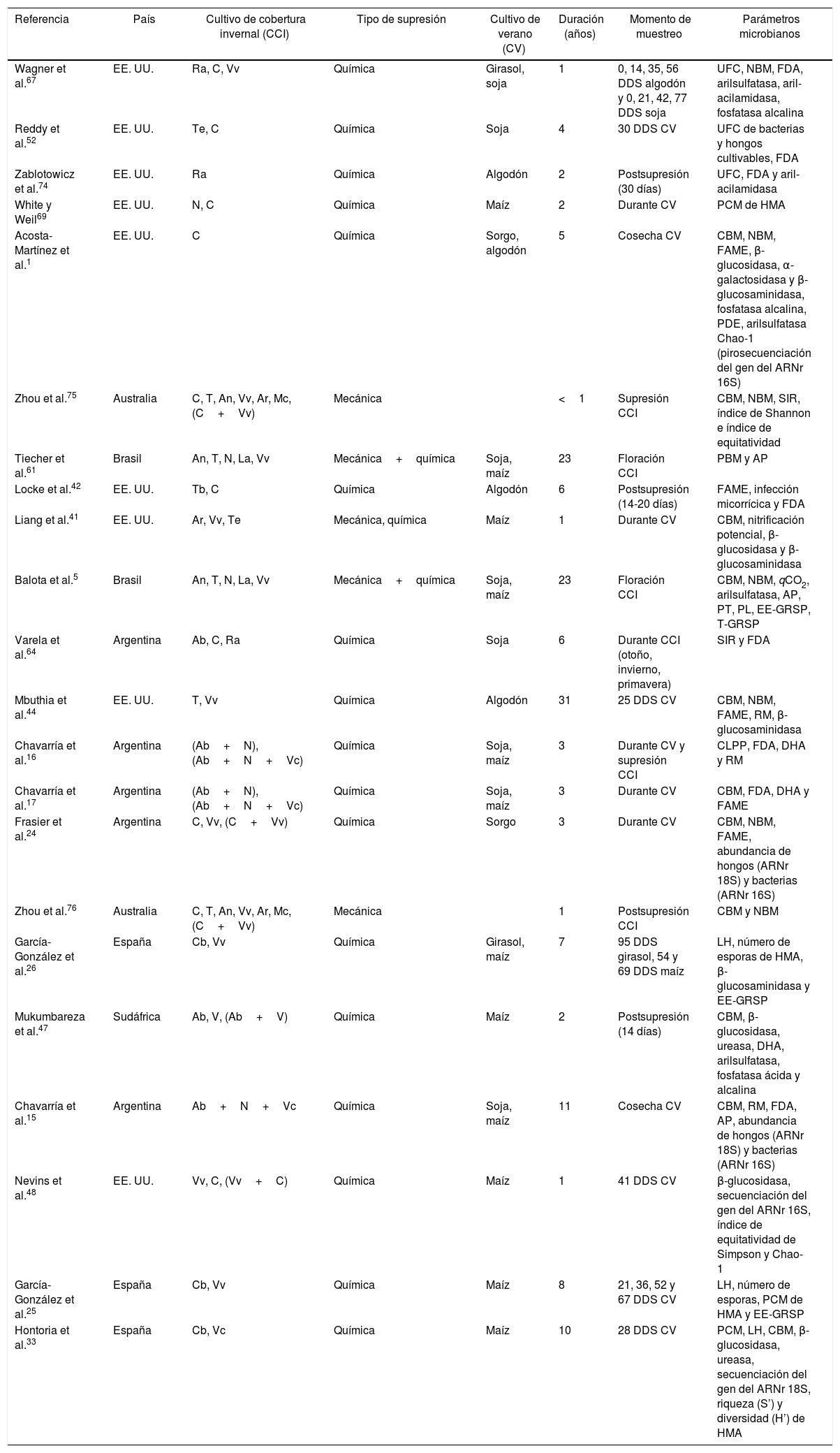
Características principales de los ensayos seleccionados para esta revisión
| Referencia | País | Cultivo de cobertura invernal (CCI) | Tipo de supresión | Cultivo de verano (CV) | Duración (años) | Momento de muestreo | Parámetros microbianos |
|---|---|---|---|---|---|---|---|
| Wagner et al.67 | EE. UU. | Ra, C, Vv | Química | Girasol, soja | 1 | 0, 14, 35, 56 DDS algodón y 0, 21, 42, 77 DDS soja | UFC, NBM, FDA, arilsulfatasa, aril-acilamidasa, fosfatasa alcalina |
| Reddy et al.52 | EE. UU. | Te, C | Química | Soja | 4 | 30 DDS CV | UFC de bacterias y hongos cultivables, FDA |
| Zablotowicz et al.74 | EE. UU. | Ra | Química | Algodón | 2 | Postsupresión (30 días) | UFC, FDA y aril-acilamidasa |
| White y Weil69 | EE. UU. | N, C | Química | Maíz | 2 | Durante CV | PCM de HMA |
| Acosta-Martínez et al.1 | EE. UU. | C | Química | Sorgo, algodón | 5 | Cosecha CV | CBM, NBM, FAME, β-glucosidasa, α-galactosidasa y β-glucosaminidasa, fosfatasa alcalina, PDE, arilsulfatasa Chao-1 (pirosecuenciación del gen del ARNr 16S) |
| Zhou et al.75 | Australia | C, T, An, Vv, Ar, Mc, (C+Vv) | Mecánica | <1 | Supresión CCI | CBM, NBM, SIR, índice de Shannon e índice de equitatividad | |
| Tiecher et al.61 | Brasil | An, T, N, La, Vv | Mecánica+química | Soja, maíz | 23 | Floración CCI | PBM y AP |
| Locke et al.42 | EE. UU. | Tb, C | Química | Algodón | 6 | Postsupresión (14-20 días) | FAME, infección micorrícica y FDA |
| Liang et al.41 | EE. UU. | Ar, Vv, Te | Mecánica, química | Maíz | 1 | Durante CV | CBM, nitrificación potencial, β-glucosidasa y β-glucosaminidasa |
| Balota et al.5 | Brasil | An, T, N, La, Vv | Mecánica+química | Soja, maíz | 23 | Floración CCI | CBM, NBM, qCO2, arilsulfatasa, AP, PT, PL, EE-GRSP, T-GRSP |
| Varela et al.64 | Argentina | Ab, C, Ra | Química | Soja | 6 | Durante CCI (otoño, invierno, primavera) | SIR y FDA |
| Mbuthia et al.44 | EE. UU. | T, Vv | Química | Algodón | 31 | 25 DDS CV | CBM, NBM, FAME, RM, β-glucosaminidasa |
| Chavarría et al.16 | Argentina | (Ab+N), (Ab+N+Vc) | Química | Soja, maíz | 3 | Durante CV y supresión CCI | CLPP, FDA, DHA y RM |
| Chavarría et al.17 | Argentina | (Ab+N), (Ab+N+Vc) | Química | Soja, maíz | 3 | Durante CV | CBM, FDA, DHA y FAME |
| Frasier et al.24 | Argentina | C, Vv, (C+Vv) | Química | Sorgo | 3 | Durante CV | CBM, NBM, FAME, abundancia de hongos (ARNr 18S) y bacterias (ARNr 16S) |
| Zhou et al.76 | Australia | C, T, An, Vv, Ar, Mc, (C+Vv) | Mecánica | 1 | Postsupresión CCI | CBM y NBM | |
| García-González et al.26 | España | Cb, Vv | Química | Girasol, maíz | 7 | 95 DDS girasol, 54 y 69 DDS maíz | LH, número de esporas de HMA, β-glucosaminidasa y EE-GRSP |
| Mukumbareza et al.47 | Sudáfrica | Ab, V, (Ab+V) | Química | Maíz | 2 | Postsupresión (14 días) | CBM, β-glucosidasa, ureasa, DHA, arilsulfatasa, fosfatasa ácida y alcalina |
| Chavarría et al.15 | Argentina | Ab+N+Vc | Química | Soja, maíz | 11 | Cosecha CV | CBM, RM, FDA, AP, abundancia de hongos (ARNr 18S) y bacterias (ARNr 16S) |
| Nevins et al.48 | EE. UU. | Vv, C, (Vv+C) | Química | Maíz | 1 | 41 DDS CV | β-glucosidasa, secuenciación del gen del ARNr 16S, índice de equitatividad de Simpson y Chao-1 |
| García-González et al.25 | España | Cb, Vv | Química | Maíz | 8 | 21, 36, 52 y 67 DDS CV | LH, número de esporas, PCM de HMA y EE-GRSP |
| Hontoria et al.33 | España | Cb, Vc | Química | Maíz | 10 | 28 DDS CV | PCM, LH, CBM, β-glucosidasa, ureasa, secuenciación del gen del ARNr 18S, riqueza (S’) y diversidad (H’) de HMA |
Cultivos de cobertura invernales: Avena blanca (Ab), Centeno (C), Cebada (Cb), Trigo (T), Avena negra (An), Raigrás anual (Ra), Trébol encarnado (Te), Vicia común (Vc), Vicia villosa (Vv), Vicia (V), Lupino azul (La), Arveja (Ar), Trébol balansa (Tb), Nabo (N), Mostaza castaña (Mc).
Parámetros microbianos: carbono de la biomasa microbiana (CBM), nitrógeno de la biomasa microbiana (NBM), fósforo de la biomasa microbiana (PBM), metil ésteres de ácidos grasos fosfolipídicos (FAME), unidades formadoras de colonias (UFC), porcentaje de colonización micorrícica (PCM), longitud de hifas (LH), número de esporas de hongos micorrícicos arbusculares (HMA), fracción fácilmente extraíble-proteína del suelo relacionada con glomalina (EE-GRSP), proteínas del suelo relacionadas con glomalina total (T-GRSP), polisacáridos lábiles (PL), polisacáridos totales (PT), deshidrogenasa (DHA), diacetato de fluoresceína (FDA), actividad fosfatasa ácida (AP), actividad de la fosfodiesterasa (PDE), respiración microbiana (RM), cociente metabólico (qCO2), actividad potencial nitrificante (APN), respiración inducida por el sustrato (SIR), perfiles fisiológicos a nivel de comunidad (CLPP), riqueza [número de OTUs observadas (S’)], índice de diversidad de Shannon-Weaver (H’), riqueza de especies (Chao-1).
DDS: días después de la siembra.
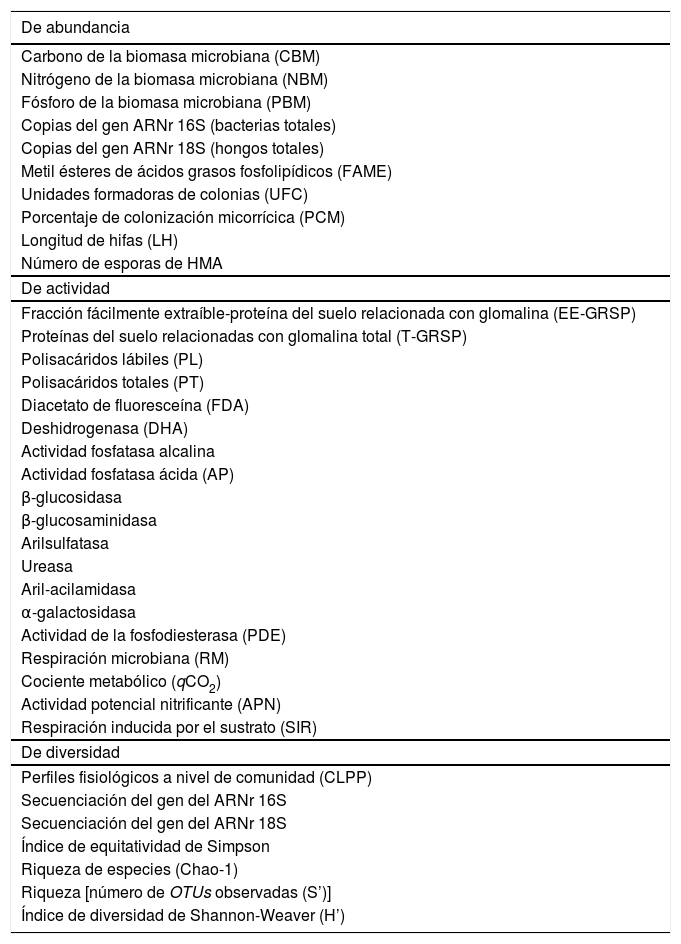
Parámetros microbianos medidos en los trabajos revisados
| De abundancia |
|---|
| Carbono de la biomasa microbiana (CBM) |
| Nitrógeno de la biomasa microbiana (NBM) |
| Fósforo de la biomasa microbiana (PBM) |
| Copias del gen ARNr 16S (bacterias totales) |
| Copias del gen ARNr 18S (hongos totales) |
| Metil ésteres de ácidos grasos fosfolipídicos (FAME) |
| Unidades formadoras de colonias (UFC) |
| Porcentaje de colonización micorrícica (PCM) |
| Longitud de hifas (LH) |
| Número de esporas de HMA |
| De actividad |
| Fracción fácilmente extraíble-proteína del suelo relacionada con glomalina (EE-GRSP) |
| Proteínas del suelo relacionadas con glomalina total (T-GRSP) |
| Polisacáridos lábiles (PL) |
| Polisacáridos totales (PT) |
| Diacetato de fluoresceína (FDA) |
| Deshidrogenasa (DHA) |
| Actividad fosfatasa alcalina |
| Actividad fosfatasa ácida (AP) |
| β-glucosidasa |
| β-glucosaminidasa |
| Arilsulfatasa |
| Ureasa |
| Aril-acilamidasa |
| α-galactosidasa |
| Actividad de la fosfodiesterasa (PDE) |
| Respiración microbiana (RM) |
| Cociente metabólico (qCO2) |
| Actividad potencial nitrificante (APN) |
| Respiración inducida por el sustrato (SIR) |
| De diversidad |
| Perfiles fisiológicos a nivel de comunidad (CLPP) |
| Secuenciación del gen del ARNr 16S |
| Secuenciación del gen del ARNr 18S |
| Índice de equitatividad de Simpson |
| Riqueza de especies (Chao-1) |
| Riqueza [número de OTUs observadas (S’)] |
| Índice de diversidad de Shannon-Weaver (H’) |
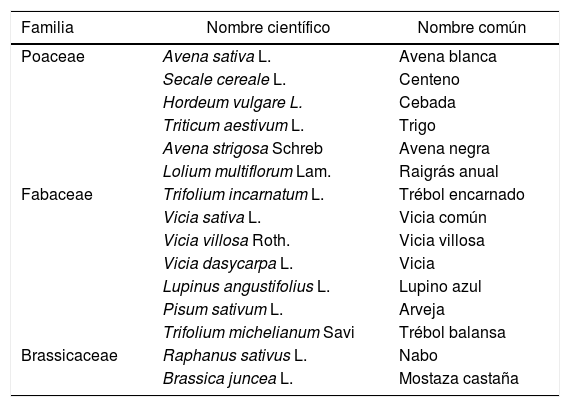
En la tabla 3 se muestran las especies de CCI que se utilizaron en los distintos trabajos. Entre los cultivos comerciales sucesores de los CCI se incluyeron la soja (Glycine max L. Merr), el maíz (Zea mays L.), el sorgo forrajero (Sorghum bicolor L.), el girasol (Helianthus annuus L.) y el algodón (Gossypium hirsutum L.).
Especies utilizadas como cultivos de cobertura invernales en los trabajos revisados
| Familia | Nombre científico | Nombre común |
|---|---|---|
| Poaceae | Avena sativa L. | Avena blanca |
| Secale cereale L. | Centeno | |
| Hordeum vulgare L. | Cebada | |
| Triticum aestivum L. | Trigo | |
| Avena strigosa Schreb | Avena negra | |
| Lolium multiflorum Lam. | Raigrás anual | |
| Fabaceae | Trifolium incarnatum L. | Trébol encarnado |
| Vicia sativa L. | Vicia común | |
| Vicia villosa Roth. | Vicia villosa | |
| Vicia dasycarpa L. | Vicia | |
| Lupinus angustifolius L. | Lupino azul | |
| Pisum sativum L. | Arveja | |
| Trifolium michelianum Savi | Trébol balansa | |
| Brassicaceae | Raphanus sativus L. | Nabo |
| Brassica juncea L. | Mostaza castaña |
Las mezclas de gramíneas y leguminosas fueron las más utilizadas y estudiadas, tanto por su importancia ecológica como por razones prácticas. Para el productor agropecuario, una mayor diversidad de CCI implica un aumento en los costos de las semillas y la dificultad para establecer y manejar mezclas complejas, particularmente si las especies de cultivo tienen tamaños de semilla, tasas de crecimiento y requerimientos de terminación muy diferentes58,70.
En un ensayo de corto plazo, Chavarría et al.16 analizaron las funciones de las comunidades microbianas del suelo en dos momentos diferentes (a cosecha de los cultivos comerciales y desecación de los CCI) en relación con la introducción de cultivos de cobertura en mezclas (CC1: avena blanca, vicia común y nabo; CC2: avena común y nabo), en rotación con soja/maíz o soja (monocultivo). En ese ensayo se observaron diferencias significativas en la respiración de sustratos carbonados específicos, lo que indicó un mejoramiento de la diversidad catabólica en tratamientos con CCI (CC1 y CC2) en comparación con el tratamiento sin CCI. Este efecto estuvo asociado a un aumento de la actividad microbiana (FDA, DHA y RM) en los dos momentos de muestreo. Asimismo, se observaron incrementos en la biomasa microbiana (CBM) y en la abundancia de bacterias (particularmente, FAME de bacterias gram positivas) en las muestras tomadas a la cosecha del cultivo sucesor17. Sin embargo, un estudio posterior realizado con las mismas especies de CCI en la rotación con soja/maíz no encontró diferencias significativas en la abundancia de hongos ni de bacterias totales (copias de genes ribosomales ARNr 18S y ARNr 16S, respectivamente), tampoco en el CBM, y solo la actividad enzimática (FDA y AP) se incrementó con la inclusión de CCI con respecto al control15.
Por otro lado, numerosos estudios analizaron el efecto de diferentes especies de CCI (leguminosas y gramíneas) sembradas en mezclas sobre los microorganismos del suelo24,47,48,75,76. La mezcla de vicia villosa y centeno como CCI antecesores de sorgo forrajero (cultivo principal) produjo un aumento en algunos parámetros indicativos de biomasa microbiana (CBM, NBM y abundancia de bacterias totales), pero una menor abundancia de hongos (copias del gen ARNr 18S) con respecto al control sin CCI en el primer año de la rotación, en un experimento de 3 años de duración24. Al término del ensayo, después de 3 años de rotación, se encontró un aumento en la abundancia de bacterias (específicamente, FAME de bacterias gram positivas) en muestras de suelo tomadas durante el crecimiento del cultivo principal24. Esta misma mezcla de CCI en rotación con maíz produjo un aumento en la actividad de la enzima β-glucosidasa en comparación con el control, en muestras de suelos tomadas durante el crecimiento del cultivo sucesor48. La secuenciación profunda del gen del ARNr 16S en esas muestras mostró resultados disímiles en los índices de diversidad alfa: el índice de equitatividad de Simpson resultó mayor en vicia villosa+centeno con respecto al control, lo que reflejaría una distribución más uniforme entre taxones bacterianos, mientras que la riqueza de especies (Chao-1) no fue afectada48.
En un ensayo de similar composición florística, se evaluaron distintos porcentajes de mezcla de avena blanca y vicia como CCI en rotación con maíz47. A pesar de la proximidad temporal entre el disturbio propio de la supresión del CCI y el muestreo, realizado 2 semanas después, se detectó un aumento en el CBM y una mayor actividad enzimática (β-glucosidasa, ureasa, DHA, arilsulfatasa, fosfatasa ácida y alcalina) en las distintas mezclas de CCI (90%/10%, 70%/30%, 50%/50% de avena/vicia, respectivamente) comparado con el control sin CCI47. Asimismo, Zhou et al.75 evaluaron la mezcla de vicia villosa y centeno en un estudio de corto plazo, en el cual el CCI fue finalizado por labores mecánicas y las muestras se tomaron cuando se suprimió el CCI. Se reporta en ese trabajo que la actividad (SIR medida en sistema MicroResp®) y la diversidad catabólica (índice de diversidad metabólica de Shannon, H’ e índice de equitatividad) fueron mayores con la mezcla de CCI con respecto al control, mientras que no se observaron diferencias en la biomasa microbiana (CBM y NBM). En contraste, el mismo grupo informa en una publicación posterior que después de 8 meses de descomposición de los residuos de los CCI, se detectó mayor biomasa microbiana (CBM y NBM) con vicia villosa+centeno con respecto al control sin CCI76.
Cultivos de cobertura de invierno monoespecíficosEn la mayor parte de los trabajos revisados se seleccionó una sola especie de CCI para ser incluida en la rotación con cultivos de verano. En un ensayo de larga duración (7 años), la cebada como CCI antecesor de girasol incrementó en un 80% la longitud de las hifas de los HMA y la actividad microbiana (β-glucosaminidasa y EE-GRSP), y en un 30% el número de esporas, con respecto al suelo desnudo, en muestras de raíces y suelo tomadas 95 días después de la siembra (DDS) de girasol. En rotación con maíz, la longitud de las hifas y el número de esporas se incrementaron en un 60-70% y la actividad enzimática un 100% con respecto al control en muestras tomadas 54 y 69 DDS de maíz26. En contraste, al utilizar la vicia villosa como CCI antecesor de girasol o maíz, no observaron mejoras en la mayoría de los parámetros micorrícicos, pero sí una mayor actividad enzimática con respecto al control sin CCI26.
Después de 8 años de rotación, la cebada como CCI antecesor de maíz mantuvo el efecto positivo sobre los indicadores de abundancia (LH, número de esporas y PCM) y actividad microbiana (EE-GRSP) con respecto al barbecho, mientras que el tratamiento con vicia villosa como CCI no incidió positivamente sobre los parámetros relacionados con HMA y tendieron a ser similares al tratamiento control25. Recientemente, Hontoria et al.33 obtuvieron efectos promotores similares con la cebada como CCI sobre la población de HMA en maíz (PCM y LH) y la biomasa microbiana (CBM) en muestras de raíces y suelo tomadas 28 DDS de maíz. Asimismo, estos autores reportaron que tanto la cebada como la vicia común como CCI estimularon la actividad microbiana del suelo (β-glucosidasa, ureasa) con respecto al control sin CCI. Llamativamente, los CCI no afectaron la riqueza [número de OTUs observadas (S’)] ni la diversidad [índice de Shannon-Weaver (H’)] de los HMA en el cultivo de maíz, aún después de 10 años de rotación con CCI33.
Por otra parte, Mbuthia et al.44 reportaron incrementos con respecto al control en parámetros indicadores de abundancia (NBM, FAME de bacterias gram positivas y concentración de FAME total) y de actividad microbiana (RM y β-glucosaminidasa) en un ensayo de 31 años de rotación de algodón en el que se empleó vicia villosa como CCI, mientras que el trigo como CCI no tuvo efectos significativos, en muestras de suelo tomadas durante la senescencia de los CCI (25 DDS de algodón). Sin embargo, los FAME marcadores de hongos micorrícicos (FAME 16:1ω5c) fueron negativamente afectados por la inclusión de vicia villosa como CCI44.
En un ensayo de 2 años de rotación de maíz y CCI, White y Weil69 demostraron que el uso de centeno como CCI aumentó la colonización de las raíces de maíz por HMA con respecto al control, mientras que el nabo como CCI no mostró efectos significativos. Por otro lado, Frasier et al.24 demostraron que el centeno como CCI antecesor de sorgo forrajero incrementó el contenido de FAME de bacterias gram positivas y la abundancia de hongos en el suelo, pero redujo la de bacterias totales (copias de los genes de ARNr 18S y ARNr 16S, respectivamente) luego de 3 años de rotación. En ese mismo ensayo se observó que el CCI a base de vicia villosa produjo efectos opuestos a los del centeno sobre la abundancia de los genes ribosomales con respecto al control. Además, se registró un incremento significativo en los parámetros indicativos de biomasa microbiana (NBM y CBM) en suelos con ambos CCI con respecto al control24.
En un ensayo de un año de duración, Nevins et al.48 encontraron que el centeno en rotación con maíz también estimuló la actividad microbiana (β-glucosidasa) con respecto al control, mientras que la diversidad bacteriana (índice de equitatividad de Simpson y Chao-1) no fue significativamente afectada por la inclusión de vicia villosa o centeno en muestras de suelo tomadas durante la senescencia de los CCI (41 DDS de maíz)48. Reddy et al.52 reportaron, asimismo, que la inclusión de centeno y trébol encarnado como CCI en rotación con soja estimuló los parámetros indicativos de biomasa (UFC de bacterias y hongos cultivables) y actividad microbiana (FDA) respecto del control en muestras de suelo obtenidas 30 DDS de soja.
En dos ensayos simultáneos realizados en el mismo suelo con rotaciones de raigrás anual/algodón y vicia villosa o centeno/soja, Wagner et al.67 observaron aumentos significativos en los parámetros de biomasa (UFC de bacterias y hongos cultivables, bacterias gram negativas y NBM) y actividad microbiana (FDA, arilsulfatasa, aril-acilamidasa, fosfatasa alcalina) con respecto al control, atribuibles al efecto de los CCI, luego de un mes desde su desecación. Zablotowicz et al.74 reportaron resultados similares para los indicadores de biomasa microbiana (UFC de bacterias y bacterias gram negativas) y actividad enzimática (FDA y aril-acilamidasa) en muestras de suelo tomadas 30 días postsupresión de raigrás anual, tras 2 años de rotación con algodón.
La inclusión del centeno como CCI en rotación con sorgo forrajero/algodón en el estudio de Acosta-Martínez et al.1 no tuvo los efectos positivos frecuentemente observados en otros estudios después de 5 años de rotación en una región semiárida, pese a que se evaluaron varios parámetros indicativos de biomasa (CBM y NBM) y abundancia de distintos grupos microbianos (FAME de bacterias gram positivas y gram negativas, actinomicetos y hongos), así como diversidad por pirosecuenciación de amplicones del gen del ARNr 16S (ACE y Chao-1) y actividad de enzimas del ciclo del C (β-glucosidasa, α-galactosidasa y β-glucosaminidasa). Sin embargo, las enzimas involucradas en el ciclo del P y del S (fosfatasa alcalina, fosfodiesterasa y arilsulfatasa) aumentaron con centeno como CCI con respecto al control en muestras de suelo tomadas después de la cosecha de los cultivos de verano1.
En un ensayo de largo plazo (23 años) de rotación de distintos CCI (avena negra, trigo, nabo, lupino azul y vicia villosa) con soja o maíz, Tiecher et al.61 reportaron mayor actividad enzimática (AP) con el uso de vicia villosa, lupino azul y trigo con respecto al barbecho, mientras que la biomasa microbiana (PBM) solo resultó mayor con el empleo de lupino azul, en comparación con el control, en muestras de suelo obtenidas en el estadio de floración de los CCI61.
Asimismo, en un trabajo publicado años más tarde por Balota et al.5, se informan efectos positivos de los CCI sobre la biomasa microbiana (mayor CBM con todos los CCI y mayor NBM solo con vicia villosa comparado con el control). Con respecto a los parámetros indicativos de actividad microbiana, se informan incrementos significativos en la actividad arilsulfatasa y una disminución en el cociente metabólico (qCO2) en los CCI con respecto al control. El qCO2 disminuye en sistemas más estables, lo que indica un uso más eficiente del C por parte de la comunidad microbiana del suelo. Otros parámetros evaluados, indicativos de actividad microbiana (PT, PL, EE-GRSP, T-GRSP), también mostraron mayores valores en los suelos bajo CCI, aunque los efectos fueron diferentes según la especie empleada como CCI5.
En otro ensayo de rotación de CCI (avena blanca, centeno y raigrás) con soja, Varela et al.64 mostraron que la biomasa determinada por SIR y la actividad microbiana (FDA) fueron mayores en los CCI con respecto al control en tres momentos de muestreo a lo largo del crecimiento de los CCI (otoño, invierno y primavera)64. Locke et al.42 informaron resultados similares en un estudio de 6 años de rotación de CCI (centeno o trébol balansa) con algodón, en el que tanto la actividad microbiana (FDA) como la biomasa estimada de micorrizas a partir de su marcador de ácidos grasos (FAME 16:1 ω5c) resultaron mayores en el suelo con CCI postsupresión (luego de 14 días) que en el control. Los efectos positivos de la rotación con CCI se extendieron hasta inicios de la floración del algodón, momento en que la infección micorrícica fue un 40% mayor en parcelas que tuvieron centeno o trébol balansa como CCI antecesor que en aquellas dejadas en barbecho42. Asimismo, Mukumbareza et al.47 mostraron que la rotación de CCI (avena blanca o vicia) con maíz también promovió un aumento del CBM y una mayor actividad enzimática (β-glucosidasa, ureasa, DHA, arilsulfatasa, fosfatasa ácida y alcalina) postsupresión (14 días) con respecto al control, en un ensayo de 2 años47. Otras leguminosas (arveja, vicia villosa y trébol encarnado) también tuvieron efectos positivos sobre la actividad microbiana (nitrificación potencial, β-glucosidasa y β-glucosaminidasa), pero no modificaron la biomasa (CBM) con respecto al control, en un ensayo de rotación de maíz con CCI de corto plazo, en muestras de suelo tomadas durante el crecimiento del cultivo sucesor41. Por el contrario, en un estudio de corto plazo en una región árida en el que se evaluaron los efectos de centeno, avena negra, trigo, vicia villosa, arveja y mostaza castaña como CCI sobre la comunidad microbiana en muestras tomadas al suprimir los CCI mecánicamente, Zhou et al.75 hallaron menor actividad microbiana (SIR), sin cambios en la abundancia (CBM, NBM), aunque hubo un aumento en los indicadores de diversidad catabólica (índice de Shannon e índice de equitatividad, basados en CLPP) bajo CCI en comparación con el control75. Sin embargo, después de 8 meses de descomposición de los residuos de los CCI, los parámetros de biomasa microbiana (CBM, NBM) resultaron mayores en suelos con CCI respecto del suelo sin CCI76.
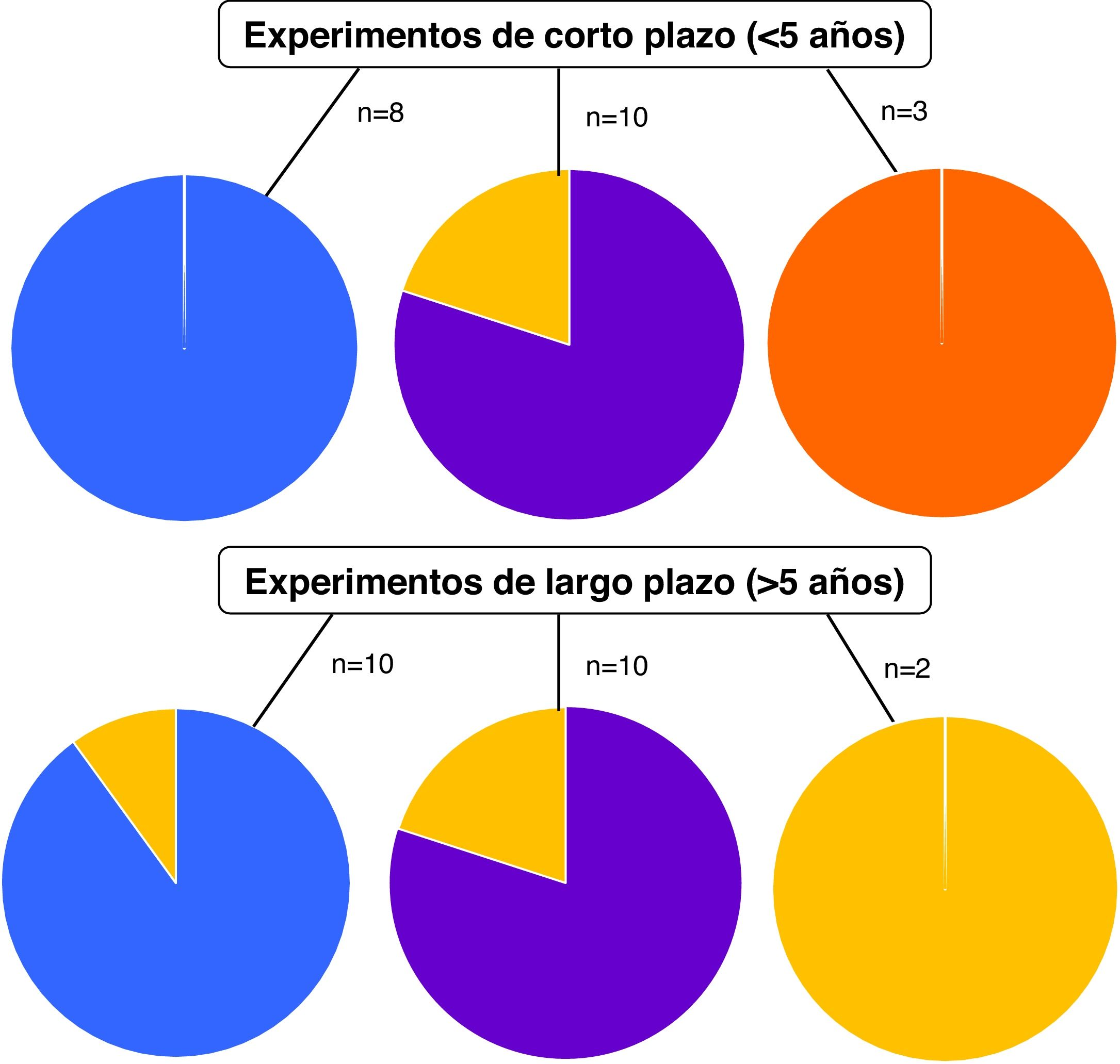
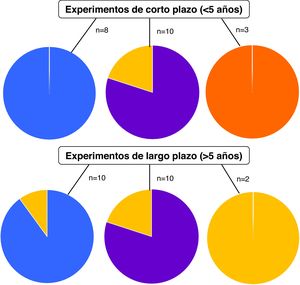
DiscusiónLos trabajos científicos incluidos en esta revisión sistemática evaluaron el efecto de los CCI sobre los indicadores de actividad, abundancia y diversidad microbiana en experimentos de corto (<5años) y largo (>5años) plazo (figura 2). En el 90-100% de los trabajos relevados, los CCI aumentaron la actividad biológica en ensayos de corto y largo plazo, y en el 80% de ellos se consignó aumento de la biomasa microbiana. Estos resultados indican que los efectos de los CCI sobre los microorganismos del suelo son independientes de la duración de los ensayos.
Si bien 3 trabajos reportaron aumento de la diversidad microbiana como resultado de la inclusión de CCI en el corto plazo, esta tendencia no se observó en los trabajos de largo plazo (n=2, donde n indica la cantidad de trabajos en los cuales se reportaron resultados para el indicador). Esta aparente discrepancia bien podría atribuirse a la escasa cantidad de trabajos analizados en cada categoría, que, al mismo tiempo, reportan parámetros disímiles para la evaluación de la diversidad.
La especie vegetal, la etapa de desarrollo y la diversidad de plantas pueden influir en la composición y actividad de la comunidad microbiana edáfica9,50, probablemente por los exudados radicales que alteran las propiedades químicas del suelo y son usados como fuente de nutrientes por los microorganismos71. Entre los múltiples CCI que se han estudiado en los trabajos analizados, los cultivos predominantes fueron centeno y vicia villosa. El efecto del centeno y la vicia villosa como CCI sobre el microbioma del suelo se analizó en el 53% y 58% de los trabajos revisados, respectivamente. El 100% (n=5) de los estudios revisados coincidieron en que la actividad microbiana aumentó con la introducción de CCI multiespecie con respecto al suelo desnudo15,16,47,48,75 (tabla 4). A su vez, el 100% (n=10) de los trabajos que analizaron el efecto de los CCI de leguminosas reportaron una mayor actividad microbiana con respecto al control sin CCI5,26,33,41,42,44,47,52,61,67 (tabla 4). Además, se observó en el 81% (n=16) de los estudios que las gramíneas como CCI aumentaron la actividad microbiana en comparación con el barbecho desnudo5,25,26,33,42,47,48,52,61,64,67,74,75 (tabla 4).
Proporción de trabajos científicos analizados que reportan cambios en indicadores de actividad, abundancia o diversidad microbiana
| IndicadoresFamilia botánica | Actividada | Abundancia o biomasa | Diversidad fisiológica o taxonómica |
|---|---|---|---|
| Leguminosas | ↑100% | ↑57% | ↑33% |
| (n=10) | ↓14% | (n=3) | |
| (n=14) | |||
| Gramíneas | ↑81% | ↑76% | ↑25% |
| ↓6% | (n=17) | (n=4) | |
| (n=16) | |||
| Crucíferas | ↑40% | ↑40% | -- |
| (n=5) | (n=5) | (n=0) | |
| Mezcla CCI | ↑100% | ↑67% | ↑100% |
| (n=5) | (n=6) | (n=3) |
CCI: cultivo de cobertura invernal.
Sin embargo, en un trabajo se reportó una disminución en la actividad microbiana (SIR) con gramíneas como CCI75, posiblemente por la duración del ensayo (5 meses) y el ambiente árido donde se realizó el estudio. Calderón et al.13 sugieren que en una región semiárida son necesarios períodos de tiempo mayores que un año para ver los efectos de los CC sobre la comunidad microbiana del suelo.
Las crucíferas como CCI han sido poco estudiadas y el 40% (n=5) de los estudios encontraron una mayor actividad microbiana con respecto al control5,75 (tabla 4). En particular, se observó un aumento en la actividad microbiana en el 71% (n=7) y 78% (n=9) de los trabajos que introdujeron centeno y vicia villosa, respectivamente, comparada con la hallada en suelos en barbecho. Estos resultados demuestran que la inclusión de CCI en la rotación aumenta la actividad microbiana edáfica. Resultados similares fueron observados en un metaanálisis realizado por Kim et al.37 sobre el impacto de CC sobre el microbioma edáfico, en el cual se reportó que la actividad microbiana (β-glucosidasa, actividad fosfatasa y RM) aumentó un 22% con CC en comparación con el barbecho desnudo. Otro metaanálisis reciente también encontró que la actividad fosfatasa extracelular aumentó un 20% con CC con respecto al control29.
El 67% (n=6) de los trabajos analizados en esta revisión reportaron un aumento en los indicadores de biomasa microbiana con la utilización de CCI multiespecie17,24,47,76 (tabla 4). Además, el 57% (n=14) de los estudios reportaron una mayor abundancia microbiana con CCI de leguminosas con respecto al control5,24,44,47,52,61,67,76 (tabla 4). En dos de esos trabajos se informa que la vicia villosa como CCI afectó la abundancia de hongos24,44.
Ciertas prácticas de manejo, como las rotaciones de cultivo y la aplicación de pesticidas o fertilizantes, pueden afectar negativamente a la comunidad de hongos del suelo. Sin embargo, estos efectos son dependientes de las condiciones ambientales donde se llevan a cabo los ensayos (tipo de suelo, disponibilidad de nutrientes, clima, comunidad microbiana, etc.)35. En el estudio de Frasier et al.24, la menor abundancia de hongos fue temporal o transitoria, dado que se observó solo en el primer año de la rotación en un ensayo de 3 años de duración. Respecto de los resultados reportados por Mbuthia et al.44, una posible explicación es que las plantas tienden a derivar menos C a los HMA cuando aumenta el nivel de N disponible en el suelo como resultado de la descomposición de los residuos de las leguminosas, con baja relación C/N62. Sin embargo, es necesario contar con más trabajos que evalúen la abundancia fúngica bajo condiciones ambientales similares para concluir acerca de un posible efecto negativo de las leguminosas sobre este grupo microbiano.
De los 17 trabajos que evaluaron los efectos de los CCI de gramíneas sobre la biomasa microbiana, el 76% reportó incrementos con respecto al control sin CCI5,24–26,33,42,47,52,64,67,69,74,76 (tabla 4). Además, en el 40% (n=5) de los estudios se encontró que las crucíferas como CCI aumentaron la biomasa microbiana5,76 (tabla 4). En particular, se reportó una mayor biomasa microbiana en el 78% (n=9) y el 50% (n=10) de los estudios que incluyeron centeno y vicia villosa como CCI, respectivamente, en relación con el control. En general, se observó que los CCI aumentaron los parámetros de abundancia microbiana. Estos resultados coinciden con los de un metaanálisis realizado por Daryanto et al.21, en el que se reportó un incremento en indicadores de abundancia microbiana (CBM, NBM, PBM y colonización HMA) con CC en comparación con el suelo desnudo. Además, otro metaanálisis reportó que los CC tuvieron efectos significativos en comparación con los barbechos desnudos, con incrementos en los parámetros de abundancia (CFU, CBM, NBM y PLFA), si bien los efectos variaron en relación con los moderadores considerados (labranza, manejo del CC, clima, entre otros). Los efectos de los CC fueron menores en climas continentales, en manejos con supresión química y bajo labranzas conservacionistas37.
En el 66% (n=3) y 75% (n=4) de los trabajos que introdujeron CCI de leguminosas y gramíneas, respectivamente, no se detectaron diferencias en la diversidad microbiana en suelo bajo CCI con respecto al control (tabla 4). Solo uno de 4 estudios reportó una mayor diversidad con gramíneas y solo uno de 3 la informó con leguminosas como CCI75. En contraste, el 100% (n=3) de los trabajos incluidos en esta revisión reportaron que la diversidad catabólica o taxonómica se vio favorecida con la inclusión de mezclas de CCI con respecto al control16,48,75 (tabla 4). En una revisión sobre el tema, Vukicevich et al.66 también informaron que el incremento en la diversidad de especies vegetales de los CC aumentaba la diversidad microbiana, especialmente de grupos beneficiosos para las plantas.
Los efectos del centeno y la vicia villosa sobre los indicadores de diversidad microbiana han sido menos estudiados que los que ejerce sobre parámetros de actividad y abundancia, en consonancia con el menor número de estudios del efecto de CCI sobre la diversidad microbiana. Debido a que son muy pocos los trabajos que analizaron el efecto de los CCI sobre los parámetros de diversidad microbiana, no es posible llegar a una conclusión definitiva y resultan necesarias más investigaciones sobre el tema. En este mismo sentido, Kim et al.37, en el primer metaanálisis que analizó los efectos de los CC sobre los parámetros de diversidad microbiana, encontraron un incremento del 2,5% con CC en comparación con el control.
ConclusionesEsta revisión sistemática de la literatura permite concluir que la inclusión de CCI (principalmente leguminosas y gramíneas y/o sus mezclas) en rotación con cultivos de verano en sistemas bajo SD promueve la actividad biológica y la biomasa microbiana edáfica en comparación con los barbechos desnudos, y que estos efectos son independientes de la duración de los ensayos. Asimismo, muestra que los CCI monoespecíficos más utilizados son centeno y vicia villosa, y que la mezcla de ambos es el CCI multiespecie más estudiado.
Es notoria la escasez de estudios en los que se evaluaron parámetros de diversidad microbiana del suelo en presencia de CCI, por lo que se destaca la necesidad de realizar más investigaciones primarias sobre el tema. Por último, resulta llamativo que solo un artículo de 22 seleccionados reporte resultados sobre el efecto de diferentes métodos de supresión de los CC sobre la actividad biológica y la biomasa microbiana del suelo. Sería importante que futuros estudios abordaran este aspecto del manejo de los CCI, ya que, sin duda, merece mayor atención por la influencia directa e indirecta que podría tener sobre el microbioma del suelo y la rizosfera.
FinanciaciónLos autores agradecen a la Comisión Nacional de Investigaciones Científicas y Técnicas (CONICET) la financiación de las becas de posgrado otorgadas a M.E. Morales y G.A. Iocoli. El presente trabajo ha sido financiado por la Agencia Nacional de Promoción Científica y Tecnológica (ANPCYT) mediante el subsidio PICT 2015-1556 y por la Universidad Nacional del Sur a través del subsidio PGI 24/A250.
Conflicto de interesesLos autores declaran no tener conflictos de interés.