Mycobacterium bovis es el agente etiológico de la tuberculosis bovina. La confirmación diagnóstica en el laboratorio se realiza a través del aislamiento bacteriológico. Los ensayos interlaboratorio permiten evaluar el desempeño de cada laboratorio participante comparándolo con otros de capacidades similares. El objetivo del presente estudio fue determinar la eficiencia en el aislamiento de M. bovis. Este estudio contó con la participación de 4 laboratorios, los cuales procesaron a ciego 25 muestras de tejidos con lesiones, seleccionadas previamente por aislamiento. El laboratorio A obtuvo la mayor proporción de aislamientos (68%), seguido del C (60%) y luego del B y D (ambos con el 52%). Las mayores concordancias se observaron entre los pares de laboratorios B-C y B-D (68%). Las diferencias pudieron deberse a factores propios de los procedimientos en cada laboratorio.
Este tipo de análisis interlaboratorio permite evidenciar posibles errores en los procedimientos bacteriológicos e identificar puntos críticos del proceso para detectar M. bovis de manera eficiente.
Mycobacterium bovis is the causative agent of bovine tuberculosis. The diagnostic laboratory confirmation is made through bacterial isolation. The aim of interlaboratory tests is to assess the performance of each participant in comparison with other of similar capacities. The test objective was to determine the efficiency of isolation of M. bovis. Four laboratories were part of the test and processed 25 blind tissue samples from granulomatous lesions and with previous M. bovis isolation. The laboratory that had the highest proportion of isolates was A (68%), followed by C (60%) and then B and D (both with 52%). The greatest concordance was observed between B-D and B-C laboratories (68%). The differences could be due to specific factors in each laboratory procedures.
This type of interlaboratory tests highlights errors in the bacteriology and identifies critical points in the process to detect M. bovis accurately.
La tuberculosis bovina (TBB), cuyo agente etiológico es Mycobacterium bovis, es una enfermedad infecciosa de carácter zoonótico, que ocasiona serios problemas en la salud pública7.
El control y la erradicación de la TBB en Argentina se basan en el diagnóstico y la eliminación de los animales reactores a la intradermorreacción. Asimismo, se establecen la monitorización y la vigilancia epidemiológica en los frigoríficos, donde los animales son inspeccionados con el fin de detectar lesiones compatibles con la enfermedad. De acuerdo a cifras oficiales, durante el año 2014 fueron decomisados 32.110 bovinos sospechados de TBB sobre una faena total de 9.984.170, es decir, un 0,3% del total de animales sacrificados en establecimientos fiscalizados por SENASA13.
A través de la resolución 128/2012, se encuentra vigente el Programa Nacional de Control y Erradicación de la Tuberculosis Bovina, que incluye a la prueba intradérmica ano-caudal (PAC) como el principal método diagnóstico. Dicha prueba es de referencia a nivel mundial y se utiliza ampliamente como prueba tamiz para el diagnóstico in vivo de la enfermedad. Esta prueba depende enteramente de una apropiada respuesta inmune celular del hospedador durante las diversas fases que abarcan la patogénesis de la enfermedad. La utilización de ensayos diagnósticos confirmatorios, como la bacteriología y la histopatología post mortem, permiten arribar a un diagnóstico definitivo de los casos5.
Diversos estudios demostraron la importancia diagnóstica de estas técnicas a partir de muestras de tejidos15, y la bacteriología se considera la técnica de referencia en el diagnóstico de TBB. En este sentido, el Programa Nacional de Tuberculosis Bovina de Argentina contempla el seguimiento a faena y el posterior análisis de esta muestra clínica para aquellos casos con resultados inciertos en la PAC.
En frigorífico son caracterizadas todas las lesiones granulomatosas como lesión compatible con TBB (LCT). La confirmación de la infección por M. bovis se lleva a cabo mediante un procedimiento bacteriológico8, procesando muestras de tejidos con LCT. Existen diversas variantes durante dichos procedimientos, como por ejemplo en lo referido al método de macerado de tejidos utilizado y a la descontaminación. Por ello, el objetivo de este trabajo fue comparar entre diferentes laboratorios la eficacia en la detección y el aislamiento de M. bovis a través de sus procedimientos de bacteriología habituales, utilizando un grupo de muestras de tejidos bovinos con lesiones granulomatosas que contaban ya con resultados bacteriológicos positivos.
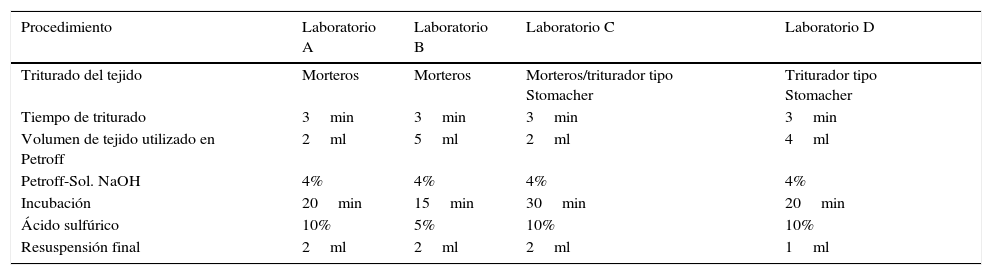
Participaron del ensayo 4 unidades de distintas partes del país (Entre Ríos, Córdoba, Capital Federal y Buenos Aires), con capacidad de procesamiento bacteriológico para el cultivo de M. bovis. Los laboratorios, que fueron nomenclados como A, B, C y D, recolectaron y seleccionaron muestras de tejidos provenientes de bovinos PAC positivos, según las normativas vigentes12, que presentaron a la inspección post mortem LCT de acuerdo a lo descripto por Neill et al.11 y que contaban con el aislamiento previo de M. bovis. Dichos tejidos fueron linfonódulos retrofaríngeos, mediastínicos y mesentéricos, pulmón e hígado.
Cada laboratorio aportó al trabajo entre 4 y 7 muestras de tejidos, hasta totalizar 25 muestras. Uno de los laboratorios ofició a la vez de organizador, teniendo a su cargo la recolección de todo el material aportado. Las 25 muestras fueron divididas (utilizando bisturí) en 4 partes iguales de aproximadamente 4 cm2 y remitidas de manera refrigerada a cada laboratorio participante, incluyendo el propio laboratorio organizador, en los cuales se procesó el material recibido cumpliendo el procedimiento general abajo descripto y aplicando las variaciones adoptadas por cada uno de ellos, según se resume en la tabla 1. En el laboratorio organizador posteriormente se recibieron los resultados de cada laboratorio, y se analizó la correlación entre todos los laboratorios participantes a través del programa Statistix 8.0 utilizando el test Spearman rank correlations.
Resumen de algunas variaciones en el protocolo de descontaminación utilizado por cada laboratorio
| Procedimiento | Laboratorio A | Laboratorio B | Laboratorio C | Laboratorio D |
|---|---|---|---|---|
| Triturado del tejido | Morteros | Morteros | Morteros/triturador tipo Stomacher | Triturador tipo Stomacher |
| Tiempo de triturado | 3min | 3min | 3min | 3min |
| Volumen de tejido utilizado en Petroff | 2ml | 5ml | 2ml | 4ml |
| Petroff-Sol. NaOH | 4% | 4% | 4% | 4% |
| Incubación | 20min | 15min | 30min | 20min |
| Ácido sulfúrico | 10% | 5% | 10% | 10% |
| Resuspensión final | 2ml | 2ml | 2ml | 1ml |
Las muestras recepcionadas por cada laboratorio fueron trituradas y homogeneizadas, ya sea de manera manual utilizando morteros, o bien mecánicamente a través de un triturador de tipo Stomacher (Masticator Basic IUL Instruments modelo 470). Posteriormente se procedió a la descontaminación por el método de Petroff8 de la siguiente manera: al material triturado se le agregó entre 5 y 20ml de agua bidestilada estéril (dependiendo de cada laboratorio), mezclando cuidadosamente hasta la formación de un homogenato. Este material fue colocado en tubo tipo falcón, agregando una solución de NaOH al 4% y rojo de fenol (como indicador de pH), en una proporción 1:2 (tejido: NaOH). La mezcla fue incubada entre 15 y 30min a 37°C, de acuerdo al protocolo de trabajo de cada laboratorio, agitando vigorosamente cada 5min. Luego se centrifugó eliminando el sobrenadante y neutralizando con una solución de ácido sulfúrico hasta viraje del indicador. Nuevamente se centrifugó durante 20min a 3.000rpm (salvo en el laboratorio B, en donde se centrifugó durante 5min). Se eliminó el sobrenadante resuspendiendo el pellet en agua estéril, mezclando vigorosamente y sembrando este producto en los medios de cultivo.
La siembra se realizó por duplicado en los medios Stonebrink y Löwenstein Jensen (2 de cada uno por muestra) y los tubos se incubaron inclinados a 37°C/25°C durante 2 meses. Se verificó semanalmente el posible desarrollo de bacilos ácido-alcohol resistentes (BAAR). En este sentido, todos los crecimientos de colonias blancas amarillentas fueron observados en el microscopio (baciloscopia) tras efectuar la tinción específica de Ziehl Neelsen (ZN), para informar luego los resultados al laboratorio organizador como positivo o sin desarrollo.
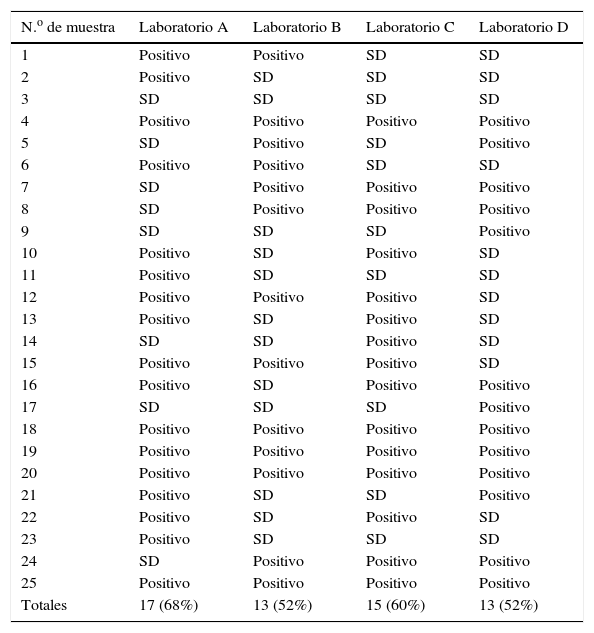
De las 25 muestras procesadas, 6 arrojaron resultados coincidentes entre los 4 laboratorios participantes: 5 de ellas fueron positivas y una negativa. De esta manera, la proporción de coincidencia sobre el total procesado arrojó un 24% (tabla 2). Por otro lado, en la suma de todos los resultados se pudieron obtener 24 aislamientos de las 25 muestras procesadas. Una muestra resultó negativa en todos los laboratorios, aunque contaba con resultado positivo previo en uno de ellos, y por eso formó parte de la selección.
Resumen de los resultados interlaboratorios
| N.o de muestra | Laboratorio A | Laboratorio B | Laboratorio C | Laboratorio D |
|---|---|---|---|---|
| 1 | Positivo | Positivo | SD | SD |
| 2 | Positivo | SD | SD | SD |
| 3 | SD | SD | SD | SD |
| 4 | Positivo | Positivo | Positivo | Positivo |
| 5 | SD | Positivo | SD | Positivo |
| 6 | Positivo | Positivo | SD | SD |
| 7 | SD | Positivo | Positivo | Positivo |
| 8 | SD | Positivo | Positivo | Positivo |
| 9 | SD | SD | SD | Positivo |
| 10 | Positivo | SD | Positivo | SD |
| 11 | Positivo | SD | SD | SD |
| 12 | Positivo | Positivo | Positivo | SD |
| 13 | Positivo | SD | Positivo | SD |
| 14 | SD | SD | Positivo | SD |
| 15 | Positivo | Positivo | Positivo | SD |
| 16 | Positivo | SD | Positivo | Positivo |
| 17 | SD | SD | SD | Positivo |
| 18 | Positivo | Positivo | Positivo | Positivo |
| 19 | Positivo | Positivo | Positivo | Positivo |
| 20 | Positivo | Positivo | Positivo | Positivo |
| 21 | Positivo | SD | SD | Positivo |
| 22 | Positivo | SD | Positivo | SD |
| 23 | Positivo | SD | SD | SD |
| 24 | SD | Positivo | Positivo | Positivo |
| 25 | Positivo | Positivo | Positivo | Positivo |
| Totales | 17 (68%) | 13 (52%) | 15 (60%) | 13 (52%) |
SD: sin desarrollo.
El laboratorio A fue el que obtuvo mayor número de aislamientos, 68% (17/25), seguido por el laboratorio C con el 60% (15/25) y luego por los laboratorios B y D con un 52% (13/25) cada uno. Así, el promedio de porcentaje de aislamiento positivo fue del 58%.
De acuerdo a lo detallado en la tabla 2, se pueden comparar los resultados obtenidos entre los laboratorios, donde las mayores concordancias correspondieron a los pares B-D y B-C, con el 68% en ambos casos (17/25). Utilizando el test de Spearman, se observó también una mayor correlación entre los pares de laboratorios B-C y B-D, con una p=0,077 y p=0,078, respectivamente.
A fin de analizar las concordancias entre los laboratorios participantes, se puede observar en la misma tabla que la mayor concordancia comparativa, tomados los laboratorios de a 3, se observó en B-C-D, quienes compartieron el 48% de sus resultados (12/25).
Como se indicó, los laboratorios B-C y B-D fueron los que mayor concordancia presentaron. No obstante, el laboratorio A fue el que demostró mayor capacidad de detección y aislamiento de M. bovis. El análisis conjunto arrojó una concordancia completa en los resultados obtenidos por los 4 laboratorios del 24% (6/25). Las diferencias pudieron deberse a diversas causas, entre ellas la uniformidad de la muestra, ya que al recibir cada laboratorio una porción del tejido, es posible que la distribución y la carga de micobacterias contenidas en cada una de esas muestras clínicas no hayan sido lo suficientemente uniformes. Esto podría subsanarse en un futuro ensayo inoculando cantidades conocidas de M. bovis en cada porción de tejido. Si bien esto permitiría ajustar esta variante, la misma no reflejaría lo que sucede durante una infección natural, donde el microorganismo establece en el hospedador una forma de vida intracelular, y es esta la forma en la que se encuentra en los tejidos blancos.
Asimismo es importante tener en cuenta el límite de detección propio del ensayo bacteriológico, el cual requeriría valores superiores a 10 o 100 microorganismos viables para lograr un resultado positivo. Esta cantidad de microorganismos se asocia generalmente a una etapa avanzada de la enfermedad, por lo que en estadios tempranos, no serían detectables1,2. En este sentido, Stewart et al.14 describieron la posible baja carga de M. bovis en tejidos con lesiones compatibles con TBB. Algunas de las muestras procesadas podrían haber contado con una baja carga micobacteriana que, asociada al límite de detección bacteriológico, podría originar disparidad en los resultados obtenidos.
Por otro lado, de acuerdo a lo descripto por Neill et al.11, el método de descontaminación Petroff es agresivo para los microorganismos que acompañan la muestra, como así también para las micobacterias, de modo que es este un paso crítico para la sobrevida del microorganismo2,3,6,15. Por esto, las variaciones existentes en cada protocolo podrían ser el motivo de las diferencias encontradas entre los laboratorios. De hecho, ningún protocolo de descontaminación fue igual entre los laboratorios. Por un lado, el procedimiento de triturado del tejido no fue el mismo. El mortero es un elemento de triturado artesanal, en el cual el material macerado es diluido en un volumen de agua estéril inferior (entre 5 y 10ml) al utilizado con un homogeneizador de tipo Stomacher (entre 10 y 20ml, aproximadamente). Por otro lado, si bien las soluciones utilizadas fueron similares —salvo la concentración de ácido sulfúrico del laboratorio B, que fue 5%—, la calidad analítica de las drogas utilizadas al producir los reactivos (hidróxido de sodio y ácido sulfúrico) es una variable no ajustada en este trabajo, que pudo haber motivado diferencias en los resultados. En este sentido, cabe señalar que los laboratorios B-C-D fueron los de mayor coincidencia, aunque el laboratorio B lleva adelante el protocolo utilizando mortero y una solución más concentrada de ácido para la neutralización del proceso. Asimismo, se encontraron las mayores coincidencias entre los laboratorios B-C y B-D.
El promedio de eficacia de aislamiento, medido como porcentaje de aislamiento positivo, fue de 58% considerando los 4 laboratorios participantes. Este valor se encuentra levemente por encima de valores reportados previamente por Cardoso et al.4 (51,5%) y Liébana et al.9 (50%). Por otro lado, la eficacia de aislamiento fue claramente superior a la informada por Müller et al.10 (35%) y Biffa et al.3 (31,2%).
Si bien cada muestra incluida en el estudio presentó LCT y contaba con aislamiento previo, cabe resaltar que provinieron de los distintos laboratorios participantes. Al ser analizada por otros participantes, no siempre se reprodujeron los resultados originales.
En síntesis, los resultados obtenidos demuestran la importancia que presentan estos tipos de ensayos interlaboratorio, ya que permiten evidenciar posibles errores y aspectos susceptibles de ser mejorados, como la unificación de los protocolos de los laboratorios, la calidad analítica de los reactivos utilizados, las condiciones y el tiempo de almacenamiento y la homogeneidad de la muestra, con el objetivo de brindar una efectiva detección y aislamiento de M. bovis a partir de muestras de tejidos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEl trabajo fue financiado a través del PICT 2006 1114.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
SB y AC son investigadores del CONICET.