El género Fusarium es ampliamente conocido por su capacidad fitopatógena, típicamente asociada al marchitamiento vascular. Sin embargo, se ha reportado como un patógeno oportunista en pacientes inmunocompetentes e inmunocomprometidos, por lo que puede ser considerado como un microorganismo de interés en estudios de patogenicidad en diferentes hospederos. Este trabajo evaluó la capacidad patogénica de aislamientos de Fusarium spp. de diferentes orígenes en hospederos vegetales y en un hospedero animal (modelo murino). Doce aislamientos de Fusarium spp. de origen vegetal, animal superficial, humano superficial y humano sistémico fueron inoculados en plantas de tomate, gulupa y clavel, y en ratones BALB/c, inmunocompetentes e inmunosuprimidos. Las pruebas de patogenicidad en plantas no mostraron todos los síntomas asociados al marchitamiento vascular en los tres modelos vegetales, pero la colonización y la necrosis de los haces vasculares observada en todos los casos, independientemente de la especie de Fusarium y el origen del aislamiento, demostró el potencial infeccioso de Fusarium spp. en las diferentes especies de plantas. Por otro lado, las pruebas de patogenicidad en el modelo murino evidenciaron alteraciones del comportamiento. Asimismo, se observó en el modelo murino que todos los aislamientos infectaron y colonizaron diferentes órganos, independientemente de su origen, de la especie o del estado inmunitario del hospedero, pero solamente cinco (de diferente origen y correspondientes a diferentes especies) generaron mortalidad. En contraste, la prueba de inoculación superficial no evidenció lesiones ni colonización. Los resultados observados indican el potencial papel patogénico de los aislamientos de Fusarium spp. en los diferentes tipos de hospederos. Sin embargo, es necesario profundizar en estudios de factores de patogenicidad que expliquen la capacidad de este género para colonizar múltiples hospederos.
The genus Fusarium is widely recognized for its phytopathogenic capacity. However, it has been reported as an opportunistic pathogen in immunocompetent and immunocompromised patients. Thus, it can be considered a microorganism of interest in pathogenicity studies on different hosts. Therefore, this work evaluated the pathogenicity of Fusarium spp. isolates from different origins in plants and animals (murine hosts). Twelve isolates of Fusarium spp. from plants, animal superficial mycoses, and human superficial and systemic mycoses were inoculated in tomato, passion fruit and carnation plants, and in immunocompetent and immunosuppressed BALB/c mice. Pathogenicity tests in plants did not show all the symptoms associated with vascular wilt in the three plant models; however, colonization and necrosis of the vascular bundles, regardless of the species and origin of the isolates, showed the infective potential of Fusarium spp. in different plant species. Moreover, the pathogenicity tests in the murine model revealed behavioral changes. It was noteworthy that only five isolates (different origin and species) caused mortality. Additionally, it was observed that all isolates infected and colonized different organs, regardless of the species and origin of the isolates or host immune status. In contrast, the superficial inoculation test showed no evidence of epidermal injury or colonization. The observed results in plant and murine models suggest the pathogenic potential of Fusarium spp. isolates in different types of hosts. However, further studies on pathogenicity are needed to confirm the multihost capacity of this genus.
Fusarium es un hongo saprófito de distribución cosmopolita, habitante natural del suelo y de material orgánico en descomposición20. Este género es conocido por su capacidad fitopatógena que afecta a una gran variedad de cultivos. Fusarium oxysporum es la especie causal del marchitamiento vascular, enfermedad que genera importantes pérdidas económicas a nivel productivo en diferentes países1,16.
Adicionalmente, Fusarium es considerado un patógeno oportunista capaz de generar enfermedad en humanos y otros animales13. En pacientes inmunocompetentes causa infecciones superficiales o localizadas y en pacientes inmunocomprometidos, infecciones diseminadas. Fusarium solani y F. oxysporum son las principales especies asociadas a altas tasas de morbimortalidad19. Trabajos realizados por varios investigadores demostraron que diferentes especies de Fusarium, de múltiples orígenes, pueden causar infección diseminada, tanto en ratones inmunocompetentes como en inmunosuprimidos. Esta habilidad de causar enfermedad tanto en plantas como en animales sugiere la capacidad de este patógeno para colonizar diferentes hospederos5,12,15. En este sentido, el presente estudio propuso evaluar la capacidad patogénica de aislamientos de Fusarium spp. de diferentes orígenes en tres especies vegetales y en un modelo animal murino.
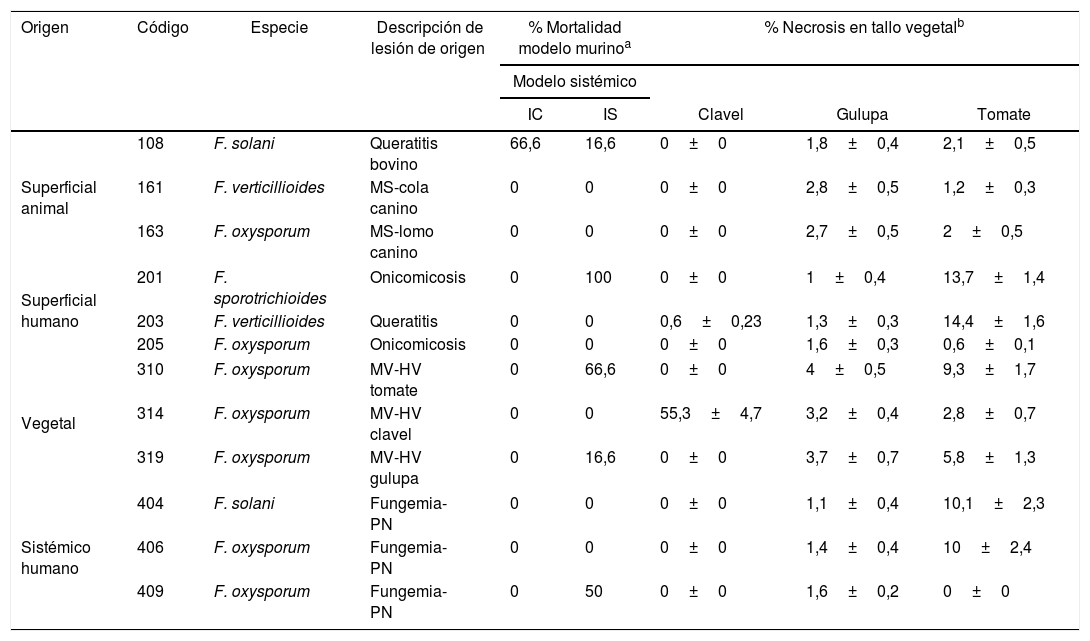
Materiales y métodosAislamientosSe evaluaron 12 aislamientos previamente caracterizados morfológica y molecularmente como hongos del género Fusarium, obtenidos de diferentes orígenes: lesiones superficiales en animales (serie 100) y en humanos (serie 200), marchitamiento vascular en plantas (serie 300) e infecciones sistémicas en humanos (serie 400). Los aislamientos pertenecen a la Unidad de Investigaciones Agropecuarias y al Grupo de Enfermedades Infecciosas de la Pontificia Universidad Javeriana. Los aislamientos de la serie 400 fueron donados por el Instituto Nacional de Cancerología (Bogotá) y el aislamiento 319 fue donado por la Clínica de Plantas (Facultad de Ciencias Agrarias) de la Universidad Nacional de Colombia (tabla 1).
Descripción de los aislamientos de Fusarium spp. empleados en el estudio y porcentaje general de afectación según modelo de experimentación
| Origen | Código | Especie | Descripción de lesión de origen | % Mortalidad modelo murinoa | % Necrosis en tallo vegetalb | |||
|---|---|---|---|---|---|---|---|---|
| Modelo sistémico | ||||||||
| IC | IS | Clavel | Gulupa | Tomate | ||||
| Superficial animal | 108 | F. solani | Queratitis bovino | 66,6 | 16,6 | 0±0 | 1,8±0,4 | 2,1±0,5 |
| 161 | F. verticillioides | MS-cola canino | 0 | 0 | 0±0 | 2,8±0,5 | 1,2±0,3 | |
| 163 | F. oxysporum | MS-lomo canino | 0 | 0 | 0±0 | 2,7±0,5 | 2±0,5 | |
| Superficial humano | 201 | F. sporotrichioides | Onicomicosis | 0 | 100 | 0±0 | 1±0,4 | 13,7±1,4 |
| 203 | F. verticillioides | Queratitis | 0 | 0 | 0,6±0,23 | 1,3±0,3 | 14,4±1,6 | |
| 205 | F. oxysporum | Onicomicosis | 0 | 0 | 0±0 | 1,6±0,3 | 0,6±0,1 | |
| Vegetal | 310 | F. oxysporum | MV-HV tomate | 0 | 66,6 | 0±0 | 4±0,5 | 9,3±1,7 |
| 314 | F. oxysporum | MV-HV clavel | 0 | 0 | 55,3±4,7 | 3,2±0,4 | 2,8±0,7 | |
| 319 | F. oxysporum | MV-HV gulupa | 0 | 16,6 | 0±0 | 3,7±0,7 | 5,8±1,3 | |
| Sistémico humano | 404 | F. solani | Fungemia-PN | 0 | 0 | 0±0 | 1,1±0,4 | 10,1±2,3 |
| 406 | F. oxysporum | Fungemia-PN | 0 | 0 | 0±0 | 1,4±0,4 | 10±2,4 | |
| 409 | F. oxysporum | Fungemia-PN | 0 | 50 | 0±0 | 1,6±0,2 | 0±0 | |
MS: micosis superficial; PN: paciente neutropénico; HV: haces vasculares; MV: marchitamiento vascular; IC: inmunocompetente; IS: inmunosuprimido.
Modelos vegetales. Las pruebas de patogenicidad en plantas se llevaron a cabo en los siguientes modelos vegetales: tomate (Lycopersicum esculentum) variedad Santa Clara, de un mes de desarrollo (3 trifolios verdaderos); gulupa (Passiflora edulis Sims), de 2 meses de desarrollo (5 hojas verdaderas); y clavel (Dianthus caryophyllus L.) variedad Nelson, esquejes enraizados con 8-10 hojas verdaderas.
Diseño experimental. Comprendió 14 tratamientos para cada especie vegetal (12 aislamientos de Fusarium, un control absoluto y un control abiótico). Cada tratamiento contó con tres réplicas de 10 plantas.
Pruebas de patogenicidad. Se preparó un inóculo por cada uno de los 12 aislamientos de Fusarium spp. en 150ml de medio para la producción de conidios (azúcar pulverizada, 10g/l; levadura panaria, 5g/l). Se incubó a 30°C con agitación constante (120rpm) durante 72 h y se ajustó la concentración a 1×107 conidios/ml. Se realizaron heridas en los ápices de las raíces (cortes de 5mm) y se infectaron mediante inmersión en 20ml del inóculo durante 5 min. Para el control abiótico se sumergieron plantas con heridas en las raíces en solución salina estéril (0,85%), y el control absoluto consistió en plantas sin lesiones. Todas las plantas fueron luego trasplantadas a una mezcla de suelo:arena 3:1, con aplicación foliar de un fertilizante del complejo NPK cada 15 días (NUTRIFOLIAR® [Colinagro S.A., Colombia], 3ml/l).
Las plantas fueron mantenidas bajo condiciones de invernadero durante 2 meses, con evaluación cada 8 días para determinar la eventual aparición de síntomas típicos de marchitamiento vascular (clorosis, pérdida de turgencia, epinastia y defoliación) y establecer la severidad de la enfermedad4,11. Adicionalmente, se evaluaron el avance del patógeno y la longitud de la necrosis en los haces vasculares. El primer parámetro se determinó realizando cortes transversales de 5mm desde la base de la raíz principal hacia el tallo. Para reaislar el patógeno, estos materiales fueron sembrados en medio agar papa dextrosa suplementado con cloranfenicol (0,2g/l) y diclorán (16mg/l) e incubados a 30°C. La observación se realizó a los 5 días de incubación, evaluando características macro y microscópicas. Para la evaluación de la longitud de la necrosis en los haces vasculares, se realizaron cortes longitudinales desde la base de la raíz principal hacia el tallo y se midió la extensión de las zonas necrosadas.
Pruebas de patogenicidad en modelo murinoAnimales y área de experimentación. Para las pruebas de patogenicidad sistémica y superficial, se utilizaron ratones machos y hembras del linaje BALB/c con un peso promedio entre 20-25g. Dichos ratones se alojaron en jaulas de microaislamiento con filtración HEPA (Super Mouse 750TM, Lab Products Inc., USA), bajo condiciones controladas de temperatura (20 a 24°C), humedad relativa (30 a 60%), ventilación (10 a 15 recambios por hora), ruido controlado y fotoperíodo (12h luz/12h oscuridad).
Como control de calidad se realizaron cultivos microbiológicos ambientales en la sala de experimentación y en las celdas donde se alojaron los animales.
Diseño experimental. Por cada aislamiento de Fusarium se establecieron grupos experimentales de 12 animales distribuidos en grupos de 3, teniendo en cuenta el sexo y el estado inmunitario (inmunocompetentes [IC]; inmunosuprimidos [IS]), se incluyeron también grupos control.
Condiciones de experimentación para la inoculación sistémica. Estas condiciones fueron determinadas mediante una prueba piloto en la que se les realizó un control de calidad microbiológica a los animales y se determinaron el medicamento y la dosis apropiada para lograr la inmunosupresión, así como la concentración del inóculo y las vías de inoculación (datos no mostrados)15,17,18.
La inmunosupresión fue realizada con una dosis única de 200mg/kg de ciclofosfamida por vía intraperitoneal, 48 h preinoculación. Los inóculos fueron ajustados a una concentración de 1×108 conidios/ml mediante recuento en cámara de Neubauer, y se confirmó su viabilidad por recuento microbiológico (UFC/ml). Se inocularon 0,1ml de la suspensión de conidios de cada aislamiento en la vena lateral de la cola.
Las condiciones fisiológicas y comportamentales, y la presencia de signos y síntomas asociados a la infección, fueron monitoreadas durante 7 días. A los animales que fallecieron durante el experimento y a los que fueron sacrificados a los 7 días postinoculación (eutanasia mediante cámara de inhalación con mezcla de aire y CO2) se les extrajo una muestra de sangre por punción cardíaca y también órganos para su evaluación (hígado, bazo y pulmón).
A partir de las muestras de sangre se realizaron hemocultivos en caldo infusión cerebro corazón y de los órganos extraídos se realizó aislamiento microbiológico e histopatología con coloración de hematoxilina-eosina (H&E) y Groccot.
Condiciones de experimentación para la inoculación superficial. Las condiciones de inmunosupresión, la concentración del inóculo y el seguimiento clínico fueron los mismos que los descritos anteriormente. Antes de la inoculación superficial, los animales fueron sedados con ketamina (75mg/kg) y xilazina (5mg/kg) por vía intraperitoneal8 para facilitar el rasurado y el raspado de la zona de piel en la parte antero-superior del lomo, donde fueron inoculados 0,1ml de la suspensión de conidios mediante la fijación de un apósito estéril durante 24h. El área de exposición fue monitorizada diariamente durante 7 días para evaluar alteraciones del estrato córneo. Los animales fueron sacrificados a los 7 días postinoculación y se les extrajo muestra de pelo, raspado de piel y tejido cutáneo. A partir del pelo y del raspado de piel se realizaron un tricograma y un análisis microbiológico del tejido cutáneo en agar Sabouraud suplementado con 50mg/l de cloranfenicol; también se realizó histopatología con H&E y Groccot.
Aspectos éticosEl número de animales y las condiciones de mantenimiento se determinaron de acuerdo con el principio de las 3 Rs (reemplazo, reducción y refinamiento) y cumpliendo con los estándares de bienestar animal, dentro de los cuales se destacan el enriquecimiento ambiental con material estéril en cada uno de los habitáculos, la densidad de alojamiento y la calidad del alimento y del agua7. El reconocimiento y la valoración de los signos adversos de dolor y angustia se realizó con una escala desarrollada de acuerdo con Gebhart et al.9, para el establecimiento de los criterios de punto final.
Los animales que no murieron en el proceso de experimentación fueron sometidos a eutanasia, como se describió anteriormente.
ResultadosModelos vegetales. Las pruebas de patogenicidad en los modelos vegetales no mostraron todos los síntomas típicos del marchitamiento vascular durante el tiempo de evaluación. Por lo tanto, no se pudo establecer una escala de severidad de la enfermedad, excepto para las plantas de clavel inoculadas con el aislamiento 314 (F. oxysporum, marchitamiento vascular en clavel), en las que la totalidad de su follaje evidenció clorosis, epinastia y pérdida de turgencia, sin defoliación. En las plantas de tomate solamente se observó amarillamiento en las hojas bajeras. En las plantas de gulupa se evidenció clorosis progresiva y ascendente de las hojas, con diferentes grados de amarillamiento y posterior defoliación, además de puntos y áreas necróticas en la base del tallo con todos los aislamientos, independientemente de su origen.
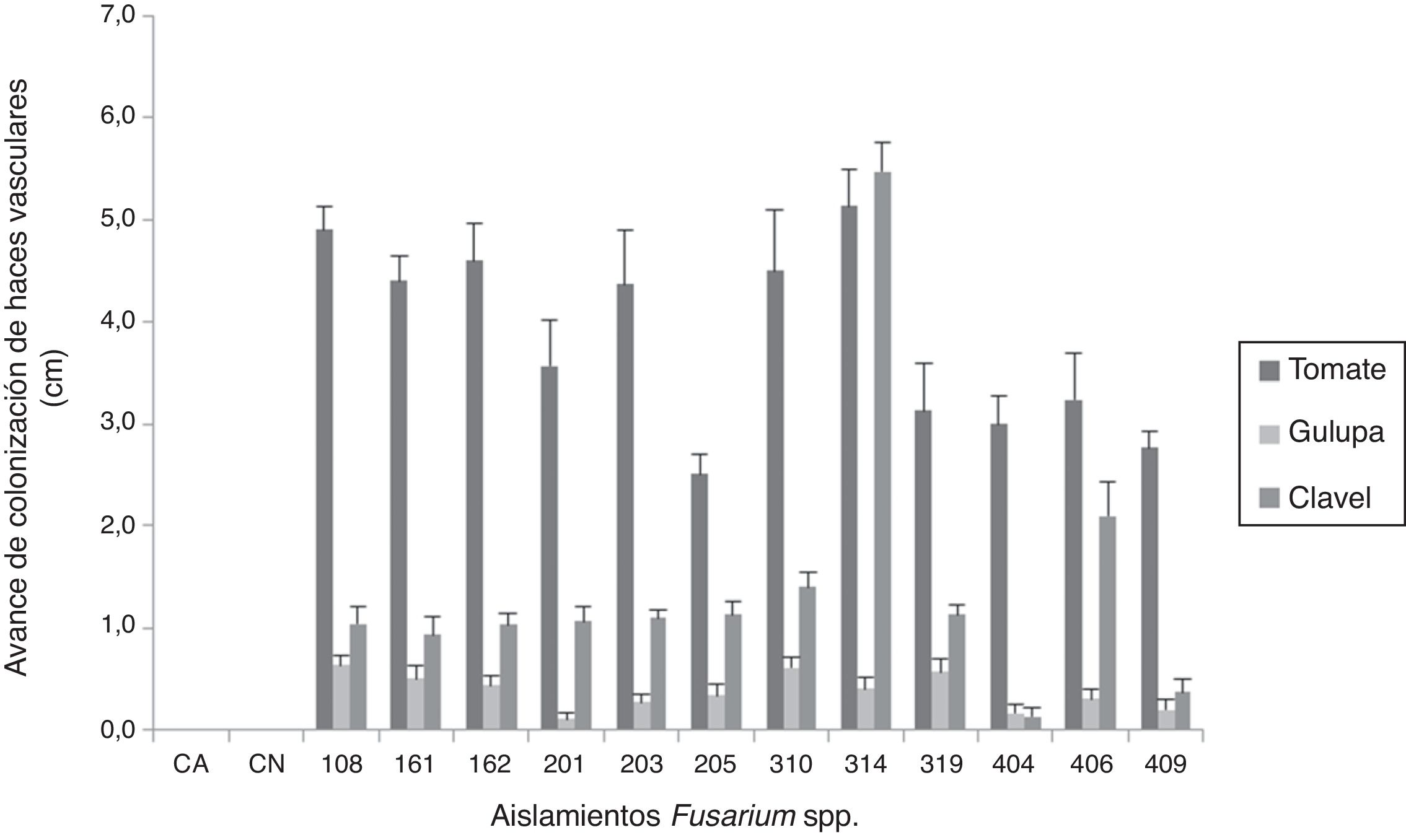
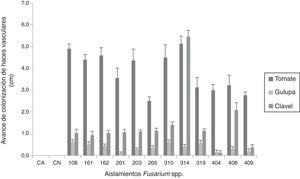
El grado de afectación de cada modelo vegetal se evaluó teniendo en cuenta el porcentaje promedio de necrosis de haces vasculares en el tallo (tabla 1). Se evidenciaron diferencias en los porcentajes de necrosis al comparar los tres hospederos elegidos, pero cada modelo vegetal mostró una diferente relación con el origen de los aislamientos.
El avance de la colonización del patógeno en el tallo se evidenció en los tres modelos vegetales y con todos los aislamientos de Fusarium spp. en estudio (fig. 1).
Modelo murino sistémico. En general, la evaluación clínica de los individuos inoculados con todos los aislamientos de Fusarium evidenció alteraciones del comportamiento asociadas con dolor y conducta de agrupamiento, con baja respuesta exploratoria en el 70% de los animales IS, mientras que en los IC las alteraciones fueron menos evidentes y se presentaron solo en el 17,36% de los casos. Adicionalmente, se presentó piloerección, tanto en los animales IC como en los IS, taquipnea, pérdida de peso, secreción rojiza compatible con porfirinas oculares y disminución del diámetro ocular en el 70% de los animales IS y en menos del 20% de los IC.
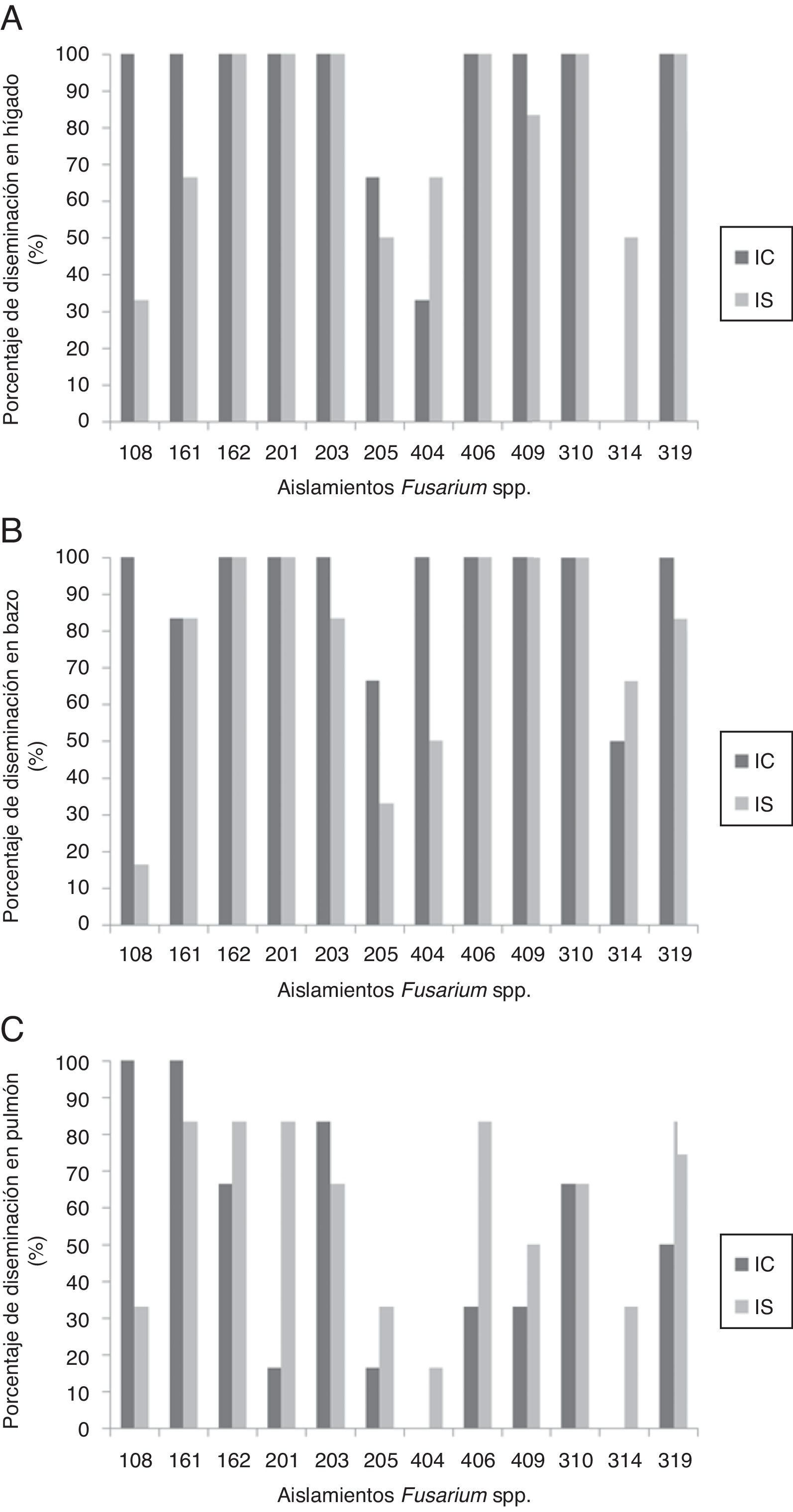
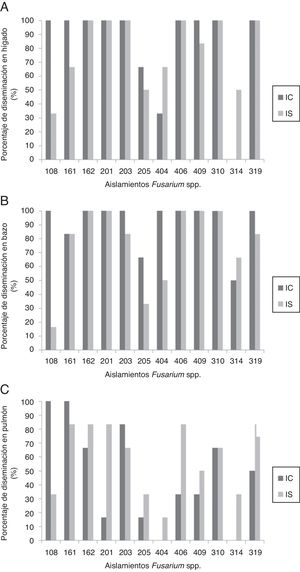
En animales IS se observó mortalidad con algunos aislamientos, mientras que en IC se evidenció mortalidad solamente con el aislamiento 108 (especie: F. solani; origen: superficial animal) (tabla 1). Adicionalmente, todos los aislamientos evaluados tuvieron la capacidad de diseminarse a órganos de ratones IC e IS, independientemente de su origen (fig. 2), lo que se confirmó por su reaislamiento a partir de al menos uno de los órganos analizados y de los hemocultivos, que fueron positivos en el 7,63% de los animales (n=11, 9 IS y 2 IC).
La evaluación histopatológica demostró que el órgano más afectado fue el hígado, independientemente del origen del aislamiento, la especie de Fusarium o el estado inmunitario del hospedero; en los demás órganos la escala de las lesiones fue de leve a moderada.
Modelo murino superficial. En este modelo no se detectaron alteraciones del comportamiento ni lesiones macro o microscópicas. La evaluación microbiológica mediante el tricograma y el cultivo de piel presentó resultados negativos en el 100% de los casos.
DiscusiónEl establecimiento del proceso infeccioso de Fusarium en las plantas de tomate, gulupa y clavel en relación con el avance de la colonización en el tallo y la necrosis de los haces vasculares, independientemente del origen de los aislamientos y de la especie implicada, demuestra el potencial de este género como patógeno de diferentes especies vegetales, aunque no se observaran todos los síntomas asociados al marchitamiento vascular en los tres modelos vegetales.
La ausencia de algunos de estos síntomas pudo deberse a diferentes factores, entre los cuales se incluyen la capacidad fitopatógena de los aislamientos evaluados, la susceptibilidad del hospedero y las condiciones ambientales. La variedad de tomate evaluada en este estudio, chonto Santa Clara, es conocida por su sensibilidad a Fusarium. Sin embargo, Jaramillo et al.10 indican que algunas variedades de tomate chonto son resistentes a las razas 1 y 2 de F. oxysporum f. sp. lycopersici, lo cual podría explicar los resultados obtenidos. En el caso de las plantas de gulupa, se observaron puntos y áreas necróticas en la base del tallo, que pueden ser el inicio de la pudrición del cuello, uno de los síntomas generados por Fusarium en este modelo de estudio. Cabe resaltar que este síntoma solamente ha sido reportado para F. solani en este mismo hospedero14. Por otro lado, la sintomatología observada exclusivamente en las plantas de clavel inoculadas con el aislamiento 314 se puede asociar a la especificidad del hospedero, razón por la cual se ha definido una formae specialis para clavel (F. oxysporum f. sp. dianthi), lo que contrasta con la capacidad multihospedero sugerida para F. oxysporum5.
La necrosis del interior de los haces vasculares observada en las tres especies vegetales evidencia la colonización intracelular de los aislamientos evaluados, una característica típica de patógenos necrótrofos como Fusarium spp.6. Aunque los porcentajes de necrosis del tallo no superaron el 1% (1mm) en algunos casos, es importante mencionar que especies como Fusarium verticillioides y Fusarium sporotrichioides, que no son reportadas como agentes causales del marchitamiento vascular en tomate, gulupa y clavel, tuvieron la capacidad de inducir este síntoma.
El hecho de que se recuperaran los diferentes aislamientos a partir del tallo en los tres modelos vegetales, independientemente de que no se hayan observado los síntomas de la enfermedad, indica su capacidad para colonizar los haces vasculares. En las plantas de tomate y gulupa no se observó una relación entre la capacidad de colonizar los haces vasculares y el origen de los aislamientos, a diferencia de lo que se observó en las plantas de clavel, que mostraron el mayor avance de colonización con el aislamiento 314 (F. oxysporum, marchitamiento vascular en clavel), lo que se puede atribuir a la especificidad de ese aislamiento por este hospedero.
En lo que hace referencia al modelo murino, la signología clínica (dolor, piloerección, taquipnea, pérdida de peso, disminución del diámetro ocular, secreción de porfirinas, aspecto de las heces y respuesta a estímulos) evidenciada en los animales inmunocompetentes e inmunosuprimidos inoculados por vía intravenosa podría indicar un posible proceso de colonización sistémica por parte del patógeno, como lo indican Bernal-Martínez et al.3, quienes establecieron signos de distrés, movilidad reducida y síntomas respiratorios, entre otros, como criterios de punto final tras haber inoculado animales por vía intranasal.
F. solani ha sido reconocida como la especie más patógena para humanos2,3,12, lo que concuerda con los hallazgos del presente estudio, específicamente para el aislamiento 108 (F. solani de origen animal), con el que se observó un considerable porcentaje de mortalidad (66,6%). Sin embargo, este resultado corresponde a ratones inmunocompetentes, lo que concuerda con lo reportado por Mayayo et al.12, quienes determinaron que los aislamientos de esta especie fueron los más virulentos en animales sin inmunosupresión. Por otro lado, este aislamiento junto con el 404 (F. solani) evidenciaron su capacidad de diseminarse y colonizar pulmón en animales inmunosuprimidos, en coincidencia con lo informado por Ahmad et al.2. Bernal-Martínez et al.3 recuperaron F. solani a partir de pulmón de ratones inmunosuprimidos en un porcentaje mayor (86,8%) que en este estudio (el 33,3 y el 16,6% con los aislamientos 108 y 404, respectivamente), lo que podría atribuirse a la diferencia en el esquema de inmunosupresión utilizado, que fue en ese caso de 7 medicaciones de ciclofosfamida y 2 de cortisona3, mientras que en este estudio se utilizó una única dosis de ciclofosfamida.
Por otro lado, aunque F. oxysporum también ha sido reportado como patógeno en humanos13, en el modelo animal aquí utilizado solamente tres de los siete aislamientos de esa especie ocasionaron mortalidad en ratones inmunosuprimidos (tabla 1), mientras que los ratones inmunocompetentes fueron refractarios a la infección. Estos hallazgos son similares a los reportados por Ortoneda et al.15. Por su parte, Bernal-Martínez et al.3 aislaron esta misma especie a partir de pulmón en el 79,5% de animales inmunosuprimidos, lo que confirma su capacidad como patógeno oportunista. Adicionalmente, se han comunicado tasas de mortalidad de hasta un 40%12.
Otras especies que han sido halladas como patógenos oportunistas son F. verticilloides y F. sporotrichiodes; la primera fue reportada como causante de bajas tasas de mortalidad en individuos inmunocompetentes12. En este estudio no se registró mortalidad asociada a dicha especie en ninguno de los grupos evaluados. Asimismo, mientras que no se han efectuado estudios de patogenicidad con F. sporotrichiodes en modelo murino, en el presente estudio esta especie ocasionó un 100% de mortalidad en animales inmunosuprimidos.
Las observaciones histopatológicas demostraron diferentes grados de lesión en los órganos evaluados y fue el hígado el órgano con la mayor afectación, a diferencia de lo que señalan otros trabajos, en los que los órganos más afectados fueron el riñón y el corazón12. Esto podría estar asociado con la inmunosupresión realizada en el presente estudio. Sin embargo, los reportes indican la capacidad del modelo animal utilizado para controlar el proceso infeccioso a los 16 días postinoculación2.
Respecto del modelo de inoculación superficial, no se evidenció capacidad de los diferentes aislamientos para colonizar el tejido cutáneo. La ausencia de reportes que den cuenta de este tipo de ensayos en la literatura científica se podría deber a que Fusarium spp. es reconocido más como un patógeno sistémico, como lo corroboran los resultados de esta investigación.
Teniendo en cuenta los hallazgos de este estudio preliminar descriptivo de patogenicidad cruzada en modelos murino y vegetales, se podría sugerir la capacidad patogénica de los aislamientos de Fusarium spp. en los diferentes tipos de hospederos. Sin embargo, se recomienda realizar más investigaciones que expliquen la capacidad del género en estudio para colonizar múltiples hospederos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que la propuesta de investigación fue avalada por el Comité de Ética de la Facultad de Ciencias de la Pontificia Universidad Javeriana (Acta No. 19, 19/10/2010) y los procedimientos de experimentación con animales siguieron el Formato General de Aplicación de Uso de Animales (FUA) avalado por el Comité Institucional de Cuidado y Uso de Animales de Laboratorio (CICUAL) documento N.° C-003-14. Los autores también declaran que no se realizaron experimentos en seres humanos.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.
Los autores expresan sus agradecimientos a COLCIENCIAS por la financiación del proyecto, Convocatoria: 521-2010, ID Proyecto: 120352128600; Instituto Nacional de Cancerología (Bogotá), Dra. Pilar Rivas por la donación de los aislamientos de origen humano sistémico; Clínica de Plantas (Facultad de Ciencias Agrarias) de la Universidad Nacional de Colombia, Dra. Liliana Hoyos por la donación del aislamiento de gulupa; y a Suata Plants S.A. (municipio El Rosal, Cundinamarca) por la donación de los esquejes de clavel.