Los procesos microbianos como la mineralización, la nitrificación y la desnitrificación regulan la dinámica del nitrógeno en el suelo. Estos 2 últimos son los principales responsables de la emisión de óxido nitroso (N2O). En este trabajo se determinaron los flujos de N2O en momentos clave del ciclo de cultivo del arroz en 2 sitios que diferían principalmente en el contenido de materia orgánica del suelo (MO), en las localidades de Salto (mayor MO) y de Treinta y Tres. Dichos momentos clave fueron a la siembra, en macollaje, en primordio floral y a la madurez. También se determinó el potencial de mineralización neta de N y las actividades y los números más probables (NMP) de oxidantes de NH4+ y de desnitrificantes. El potencial de mineralización de N, así como la actividad y el NMP de oxidantes de NH4+, no variaron con el tipo de suelo. Sin embargo, la actividad y el NMP de desnitrificantes fueron mayores en el suelo con mayor contenido de MO, independiente de la etapa del cultivo. A su vez, en las etapas finales del ciclo del cultivo, el NMP de desnitrificantes aumentó coincidiendo con el mayor potencial de mineralización y el mayor contenido de N mineral del suelo. Solo se observó un incremento en el flujo de N2O en el suelo de Salto a la madurez del arroz y cuando el suelo ya había sido drenado (44,2g N-N2O/ha d, frente a 20,8g N-N2O/ha d en Treinta y Tres). Esta investigación señala la importancia de estudiar las emisiones en distintos tipos de suelos y de continuar la medición luego del drenaje del cultivo de arroz para la elaboración de los inventarios de gases de efecto invernadero.
Microbial processes such as mineralization, nitrification and denitrification regulate nitrogen dynamics in the soil. The last two processes may produce nitrous oxide (N2O). In this work N2O fluxes were quantified at four moments of the rice cycle, sowing, tillering, panicle initiation and maturity, in two sites that differed mainly in their soil organic matter (OM) content, Salto (higher OM) and Treinta y Tres. Potential net N mineralization, ammonium oxidation and denitrification as well as the most probable numbers (MPN) of ammonia oxidizers and denitrifiers were determined. Potential N mineralization did not vary with the soil type and increased at rice maturity. Neither ammonia oxidation potential nor MPN were different among the soils. However, the soil with higher OM exhibited higher activity and MPN of denitrifiers, irrespective of the rice stage. In turn, at the latest phases of the crop, the MPN of denitrifiers increased coinciding with the highest mineralization potential and mineral N content of the soil. Significant differences in N2O flux were observed in Salto, where the highest emissions were detected at rice maturity, after the soil was drained (44.2 vs 20.8g N-N2O/ha d in Treinta y Tres). This work shows the importance of considering the soil type and end-of-season drainage of the rice field to elaborate GHGs (greenhouse gases) inventories.
Los procesos microbianos como la mineralización, la nitrificación y la desnitrificación regulan la dinámica del nitrógeno (N) en el suelo. La nitrificación, a través de la oxidación de amonio (NH4+), produce nitrato (NO3–), una forma móvil de N, que es la principal vía de pérdida de N por lixiviación y desnitrificación35.
La oxidación de NH4+ y la desnitrificación en el suelo generan emisiones de óxido nitroso (N2O), un potente gas de efecto invernadero (GEI). La oxidación de NH4+ es un proceso aerobio, pero cuando la provisión de oxígeno (O2) es limitada se genera N2O como subproducto, mientras que la desnitrificación se activa una vez que el O2 ha sido consumido y se han generado microambientes anóxicos dentro del perfil del suelo33.
El cultivo de arroz irrigado, que ocupa aproximadamente 160.000ha en Uruguay1, es considerado una fuente importante de metano, fundamentalmente, y de N2O18. Los arrozales proveen un ambiente especialmente propicio para la producción de N2O debido a las variaciones frecuentes que experimentan los suelos a lo largo del ciclo del cultivo en términos de pH, presencia de compuestos orgánicos lábiles, contenido de humedad, disponibilidad de nutrientes y actividad microbiana47. Asimismo, la existencia de interfases óxicas-anóxicas en los suelos cultivados con arroz favorece el acoplamiento entre los procesos de nitrificación y desnitrificación.
Dos de las principales áreas del cultivo de arroz en Uruguay se distribuyen en la zona este y norte1. Los suelos de estas zonas poseen distintas propiedades fisicoquímicas y capacidad de anegamiento13, que podrían influir en la dinámica de las poblaciones y la actividad potencial de nitrificantes y desnitrificantes, así como en las formas minerales del N presentes en el suelo. Trabajos sobre las emisiones de GEI en un arrozal del este uruguayo comprobaron que la máxima emisión de N2O se produce luego de la aplicación de urea e inundación del cultivo al inicio del macollaje, y no se observaron emisiones de N2O luego de 2 semanas de inundado el cultivo17,36. Hasta el momento, no se cuenta con trabajos que hayan evaluado las emisiones de N2O en la zona arrocera norte, ni con estudios sistemáticos de las actividades de mineralización, nitrificación y desnitrificación en estos suelos.
El objetivo de este trabajo fue comparar la emisión de N2O y la actividad nitrificante y desnitrificante, así como el número de microorganismos responsables de dichos procesos y la mineralización neta de N, en momentos clave del ciclo del cultivo del arroz sembrado en 2 suelos con diferente contenido de materia orgánica (MO). La hipótesis planteada fue que el tipo de suelo y las prácticas de fertilización, inundación y drenado del cultivo incidirían en la emisión de N2O, al afectar la actividad y el número de nitrificantes y desnitrificantes, y la disponibilidad de N mineral.
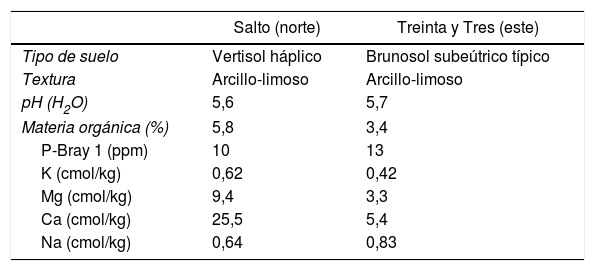
Materiales y métodosSitios de experimentación y manejo del cultivoLos experimentos se realizaron en 2 arrozales durante la zafra de arroz 2013-2014, en los departamentos de Treinta y Tres (zona este de Uruguay) y de Salto (zona norte), en la Unidad Experimental Paso de la Laguna del INIA Treinta y Tres (33°15′ S, 54°10′ O), perteneciente a la unidad de suelo La Charqueada3, y en un predio comercial perteneciente a la unidad de suelo Itapebí-Tres Árboles (31°22′ S, 57°27′ O), respectivamente. Las propiedades fisicoquímicas de los suelos se resumen en la tabla 1.
Propiedades fisicoquímicas de los suelos de Salto y Treinta y Tres a la siembra
| Salto (norte) | Treinta y Tres (este) | |
|---|---|---|
| Tipo de suelo | Vertisol háplico | Brunosol subeútrico típico |
| Textura | Arcillo-limoso | Arcillo-limoso |
| pH (H2O) | 5,6 | 5,7 |
| Materia orgánica (%) | 5,8 | 3,4 |
| P-Bray 1 (ppm) | 10 | 13 |
| K (cmol/kg) | 0,62 | 0,42 |
| Mg (cmol/kg) | 9,4 | 3,3 |
| Ca (cmol/kg) | 25,5 | 5,4 |
| Na (cmol/kg) | 0,64 | 0,83 |
El cultivo de arroz (cv. El Paso L144), precedido por 3 años de pradera, se instaló con siembra directa a una densidad de 150kg/ha. Se inundó en la etapa de macollaje y se realizó una fertilización nitrogenada fraccionada: a la siembra se agregó fosfato de amonio (18-46) 25kgN/ha; las otras 2 fertilizaciones fueron con urea (23kgN/ha).
La temperatura promedio durante el ciclo del cultivo fue 21,3 y 23,4°C para Treinta y Tres y Salto, respectivamente. La precipitación acumulada durante el ciclo del cultivo para Treinta y Tres fue de 762mm, 222mm cayeron antes de la inundación. En Salto la precipitación fue de 882mm y antes de la inundación se registraron 376mm.
Muestreo de suelosSe seleccionaron 4 parcelas completamente al azar y se tomaron 6 submuestras de suelo a 15cm de profundidad para realizar una muestra compuesta. Los muestreos se realizaron en 4 oportunidades: a la siembra, en macollaje, en primordio floral y a la madurez del cultivo. Los 3 primeros se efectuaron al día siguiente de las fertilizaciones nitrogenadas programadas (solo en el estadio de primordio floral la fertilización se realizó en agua); el último muestreo fue anterior a la cosecha y posterior al drenado del suelo. Las muestras se mantuvieron a 5°C para su posterior análisis. Con esas muestras se cuantificaron la actividad potencial y el NMP de microorganismos desnitrificantes y oxidantes de NH4+, el potencial de mineralización de N (PMN) y el contenido de NH4+ y NO3−.
Emisión de N2OLos flujos de N2O emitidos en las fechas de los muestreos se monitorizaron con la técnica de cámaras cerradas estáticas para arroz, descritas por Lindau et al.25. Las cámaras consistieron en bases de acero inoxidable de 40cm de diámetro y 20cm de altura parcialmente insertas en el suelo (a 5cm), que permanecieron instaladas durante todo el ciclo de cultivo. En correspondencia con cada fecha de muestreo del suelo se colocaron cilindros de acrílico de 60cm de altura sobre las bases, con un sello de agua para evitar el escape de gases17. Las muestras de gases del interior de las cámaras se tomaron con jeringas plásticas de 25ml a tiempo 0 y a los 20 y a los 40min, y se almacenaron en tubos con vacío (10ml) hasta su análisis. Se registraron la temperatura de las cámaras, la profundidad del agua de inundación y la altura del espacio de aire en cada cámara para calcular los flujos de gases.
El análisis de N2O se realizó con un cromatógrafo de gases Shimadzu 14B modificado con detector ECD (de captura electrónica) descrito por Perdomo et al.29. La tasa de emisión del gas se calculó según Watanabe et al.41 y las medidas de 4 repeticiones de cada tratamiento fueron promediadas para determinar el valor final de emisión por tratamiento y fecha.
Actividades microbianas potencialesEl PMN se evaluó en anaerobiosis según Kandeler21. Tubos herméticos con 15g de suelo fresco y 15ml de agua destilada se incubaron una semana a 40°C. Se agregó 15ml de KCl 2M y se filtró con papel Whatman n.o 41. El contenido de NH4+ se determinó colorimétricamente según el método de Berthelot y se expresó como mg NH4+-N/d kg de suelo seco (ss)30.
La actividad potencial oxidante de NH4+ se determinó según Kandeler20, con algunas modificaciones: se utilizaron 10ml de (NH4)2 SO4 1,33mM, 0,05ml de clorato de sodio 1,5M y 2,5ml de agua destilada estéril6. La suspensión se incubó a 28°C en agitación a 200rpm en un agitador orbital (Wiseshake SHO-2D, Witeg, Alemania) durante 24h y como controles se mantuvieron suspensiones de suelo a −20°C. Luego de la incubación, se agregó KCl 2M (15ml), se centrifugó a 9.000g y 0,5ml del sobrenadante fueron resuspendidos en 0,5ml de NH4Cl 0,19M. Se estimó el contenido de nitritos (NO2−) mediante la reacción colorimétrica con los reactivos de Griess-Ilosvay, por espectrofotometría a 540nm. La actividad se expresó como μg NO2-N/d g ss.
La actividad potencial desnitrificante se determinó creando condiciones anaerobias y permitiendo la acumulación de N2O por inhibición de la N2O reductasa con acetileno12. Se incubaron 4g de suelo húmedo con 2ml de glucosa 1mM y 2ml de KNO3 1mM en viales herméticos. En cada vial se reemplazó la atmósfera por una mezcla de N2 y C2H2. Se tomaron 3 muestras de gas durante el tiempo de incubación (2h a 25°C) para medir la producción de N2O por cromatografía gaseosa. La actividad desnitrificante se expresó como μg N2O/h g ss.
Recuento de microorganismosSe realizaron recuentos de bacterias cultivables oxidantes de NH4+ y desnitrificantes por la técnica de NMP para cada muestreo de suelo. Se suspendieron 10g de suelo fresco en 90ml de buffer fosfato y se realizaron diluciones seriadas de 1 en 10.
Para el recuento de microorganismos oxidantes de NH4+ se utilizaron tubos con 4ml de medio mineral con 5g/l de (NH4)2 SO431. Los tubos se incubaron durante un mes en agitación a 28°C. La presencia de NO2– revelada con los reactivos de Griess-Ilosvay permitió identificar los tubos de reacción positiva.
El recuento de microorganismos desnitrificantes se realizó utilizando tubos anaeróbicos con 5ml de medio con extracto de carne 1,5g/l, peptona 2,5g/l y KNO3 0,25g/l con buffer HEPES 1,25g/l. La atmósfera se reemplazó con 90% de N2 y 10% con C2H2, y los tubos se incubaron durante 2 semanas en oscuridad a 28°C. Mediante cromatografía gaseosa se identificaron los tubos positivos, con presencia de N2O37. Tanto para el recuento de desnitrificantes como de oxidantes de NH4+, los resultados se refirieron a tablas de probabilidad43.
Amonio y nitratoAl suelo húmedo (5g) se le agregó 15ml de KCl 2M para su extracción, se agitó durante 30min y posteriormente se filtró la suspensión con papel Whatman n.o 41. El contenido de NO3− se cuantificó tras la reducción a NO2− por una columna de cadmio y posterior determinación colorimétrica (reacción de Griess-Ilosvay)28. El contenido de NH4+ se cuantificó según Rhine et al.30. El N mineral se calculó como la suma de NH4+-N y NO3–-N.
Análisis estadísticoSe realizó un análisis de varianza (ANOVA) para evaluar la relación entre estadio del cultivo y el tipo de suelo con las actividades potenciales, el NMP de microorganismos oxidantes de NH4+ y desnitrificantes y el contenido de NH4+ y NO3. Los datos de NMP fueron transformados a logaritmo en base 10 para su análisis. También se analizó la interacción entre los factores suelo×estadio del cultivo. Para detectar la presencia de diferencias significativas se realizaron un ANOVA con el test de Tukey (p<0,05) y un análisis de correlación de Pearson; se utilizó el software estadístico Infostat15. Para todas las variables se presentan las medias de 4 repeticiones±los errores estándar.
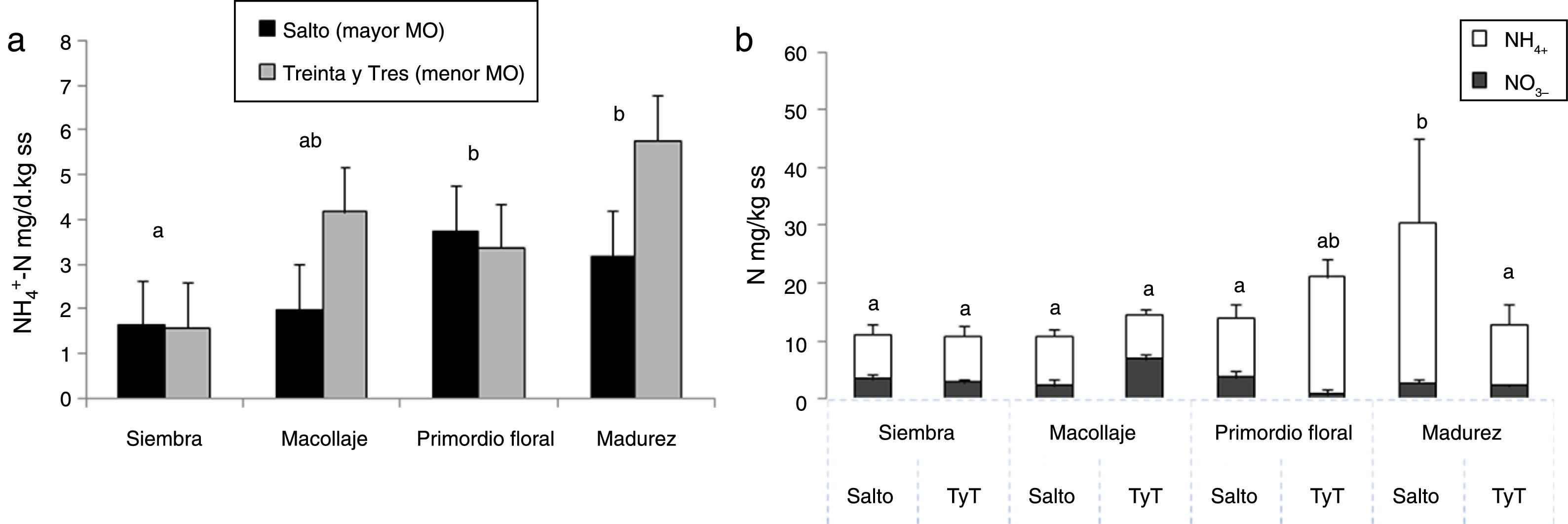
Resultados y discusiónMineralización netaLa mineralización del N del suelo es un proceso clave para la provisión de este nutriente a la planta de arroz, ya que la mayor parte de aquel es absorbido a partir de este proceso, aun en suelos fertilizados16. El PMN no presentó diferencias entre los suelos con distinto porcentaje de MO (fig. 1a), pero sí entre estadios diferentes del ciclo del cultivo de arroz. La mayor actividad potencial de mineralización se presentó en la etapa de primordio floral y de madurez del arroz (en promedio, 4,5g NH4+-N/d kg ss), y se diferenció significativamente del PMN a la siembra (en promedio, 1,6g NH4+-N/d kg ss).
a) Actividad potencial de mineralización (mg NH4+-N/d kg de suelo seco) en suelos de Salto y Treinta y Tres (TyT). b) Nitrógeno mineral (N-NH4++N-NO3−mg/kg de suelo seco) en 4 momentos del cultivo de arroz. Las barras representan la media+el error estándar (n=4). Letras diferentes indican diferencias significativas (p<0,05). El análisis en a se realizó por momento del cultivo de arroz, ya que no hubo efecto del tipo de suelo. En b hubo interacción entre el tipo de suelo y el momento del cultivo.
La mineralización del N depende de múltiples factores y la cantidad de MO del suelo no parece ser el factor principal que afecta dicho proceso, según lo demuestran este ensayo y otros45. A lo largo del ciclo del cultivo el contenido de raíces va en aumento y varían los exudados radicales y los restos celulares fácilmente degradables, hechos que podrían explicar el aumento de la mineralización hacia el final del ciclo de cultivo9.
La medición del PMN considera la mineralización neta, o sea, el aumento en el nitrógeno inorgánico en el suelo producto de la diferencia entre la mineralización bruta y la inmovilización. En el caso del suelo inundado, si bien se espera una menor mineralización bruta (transformación de N orgánico a inorgánico), también la inmovilización de N por microorganismos sería menor. También en otros estudios se encontró mayor mineralización en suelos inundados que en condiciones aeróbicas y se atribuyó a un menor requerimiento de N por la microflora debido a una mayor proporción de bacterias respecto de hongos y actinobacterias en los suelos inundados38. El establecimiento de la inundación, por otro lado, pudo haber favorecido la muerte de algunos microorganismos, que constituirían un pool de N fácilmente mineralizable, y la reducción de Fe3+ que, a su vez, promueve la liberación de parte de la MO del suelo protegida por minerales y del NH4+ fijado19.
En el suelo de mayor tenor de MO, el contenido de N mineral también fue significativamente mayor a la madurez del cultivo (30mg/kg ss) y difirió entre suelos solamente en esa etapa (fig. 1b). Como era de esperar, la mayor parte del N mineral se encontró bajo la forma de NH4+ en estos suelos, inundados después del macollaje (fig. 1b). La mineralización determina el N potencialmente disponible para la planta y, en caso de no ser usado por esta, ese N puede perderse del suelo por volatilización o por desnitrificación, luego de la nitrificación.
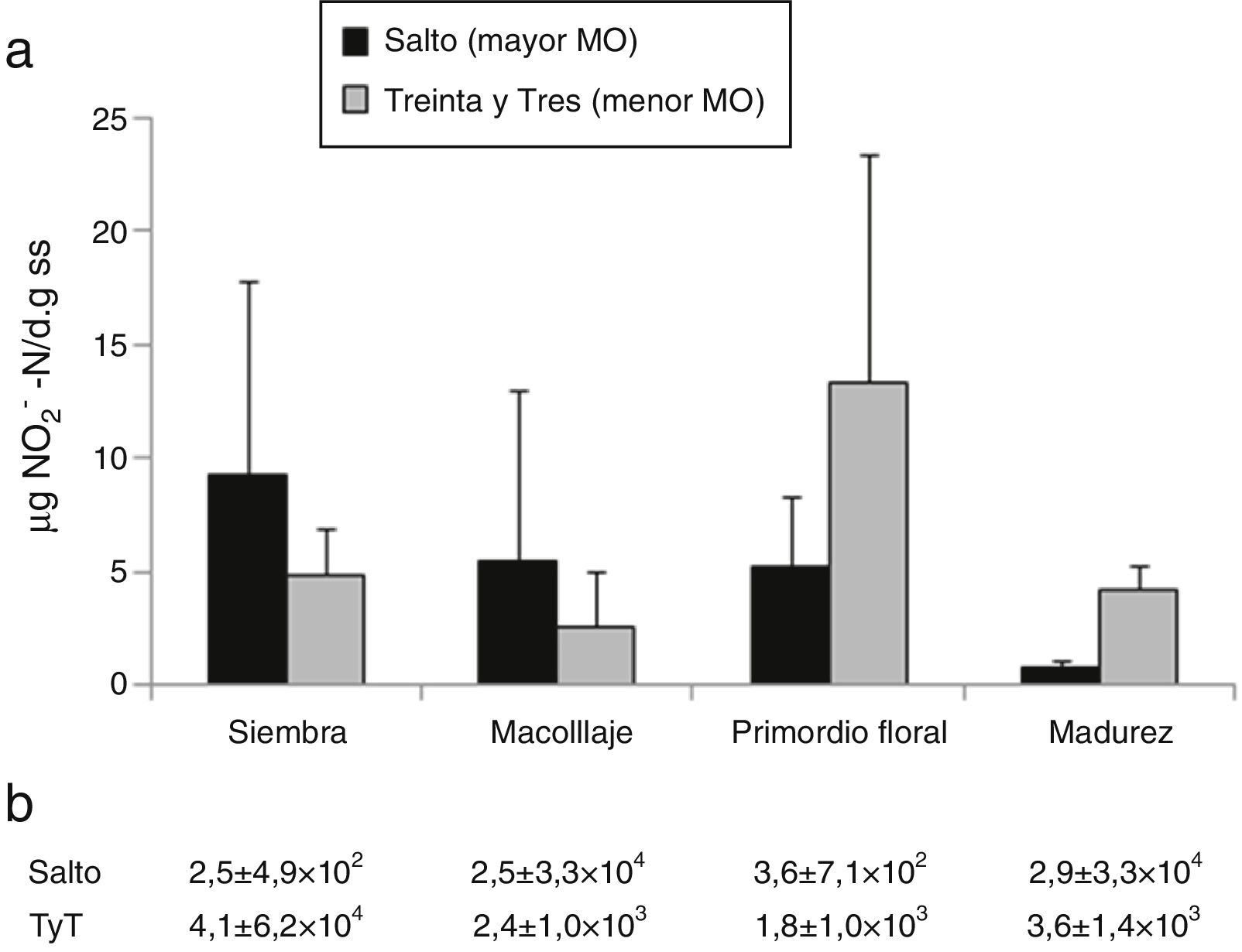
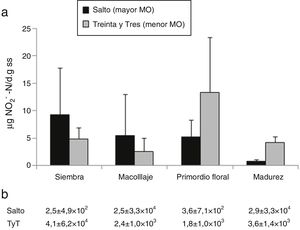
Oxidación de amonioLa oxidación de NH4+ a NO2− es el primer paso de la nitrificación. No hubo efecto del suelo (p=0,6) ni del momento del ciclo del cultivo (p=0,10) sobre la actividad potencial y el NMP de oxidantes de NH4+ en condiciones de campo (fig. 2).
a) Actividad potencial de oxidación de NH4+ (μg NO2-N/d g de suelo seco). b) Número más probable de oxidantes de NH4+/g de suelo seco en: suelo de Salto y suelo de Treinta y Tres (TyT), en 4 momentos del cultivo de arroz. Las barras representan la medias+el error estándar (n=4). Las diferencias entre suelos y momentos del cultivo de arroz no fueron significativas.
El NMP de oxidantes de NH4+ estuvo en el orden de entre 102 a 104/g ss (fig. 2b). Números similares fueron encontrados en arrozales tropicales y con diferentes manejos8. Los oxidantes de NH4+ son microorganismos de crecimiento lento22 y solo una pequeña proporción de estos son cultivables34, de modo que emplear la técnica del NMP para estimar estas poblaciones representa una limitación metodológica. En un estudio con los mismos suelos analizados en este trabajo, pero con técnicas independientes del cultivo, como la amplificación por qPCR del gen de la amonio monoxigenasa, se estimó una población del orden de 105 a 107 bacterias oxidantes de NH4+4.
Hay comunicaciones que indican que la actividad potencial se relacionaría con la abundancia de bacterias oxidantes de NH4+40, pero otras documentan la ausencia de tal relación7. Muchos trabajos muestran que la actividad o el número de oxidantes de NH4+ es relativamente estable y resiliente frente a cambios en las condiciones ambientales32,42.
Yang et al44. sostienen que tanto la mineralización como la nitrificación en suelos inundables serían insensibles a cambios en la concentración de O2 disponible. Glaser et al.10. indican que, debido a su crecimiento lento, un aumento en el número de oxidantes de NH4+ solo se percibiría unos 21 días después del aumento en la concentración de NH4+. Y dado que en este estudio la concentración de NH4+ aumentó recién en la cosecha (fig. 1b), es probable que de haberse producido un aumento en la cantidad de oxidantes, este no hubiese sido detectado en los muestreos anteriores a dicho estadio.
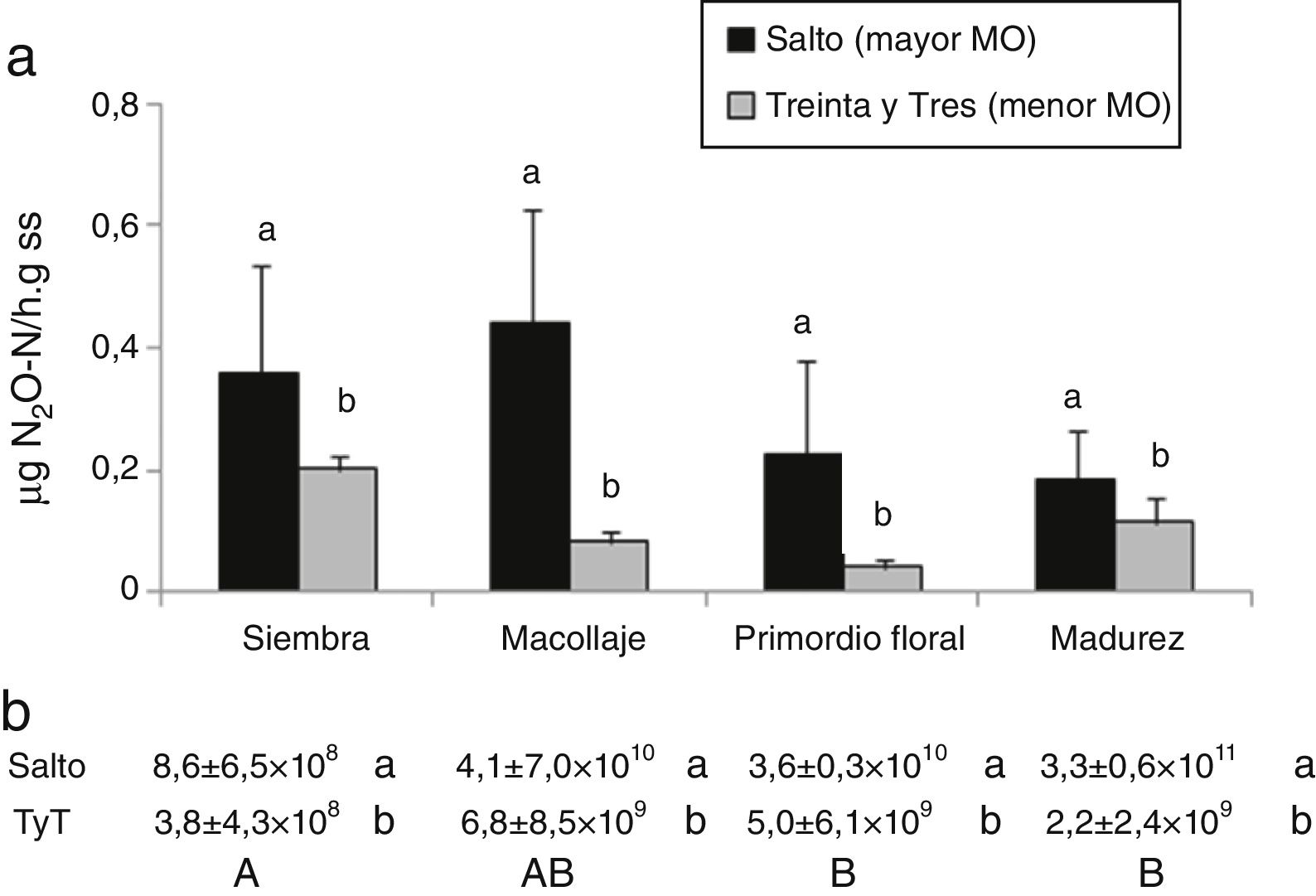
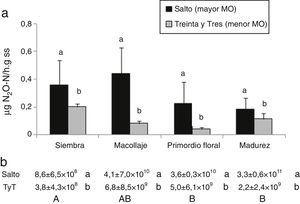
DesnitrificaciónLa abundancia y la actividad de los microorganismos desnitrificantes ha sido ampliamente estudiada en arrozales, donde las condiciones del cultivo favorecen este proceso24. En este estudio, el suelo de Salto (con mayor contenido de MO) presentó mayor actividad potencial y NMP de desnitrificantes, independientemente del estadio del ciclo del cultivo del arroz (fig. 3). Las poblaciones responsables de este proceso en el suelo de Salto se ubicaron en el orden de 1011 y en el de Treinta y Tres en el orden de 109, considerando el promedio de todas las etapas del cultivo. Estos microorganismos fueron significativamente más abundantes en ambos suelos en el estadio de primordio floral y madurez del cultivo con el suelo inundado, respecto del momento de la siembra en secano (fig. 3b). Kravchenko y Yu encontraron valores de NMP del orden de 106 para suelos arroceros de Arkansas23, donde la forma de cultivo es parecida a la de Uruguay, mientras que los NMP fueron más bajos en arrozales tropicales de India8.
a) Actividad de la enzima desnitrificante (μgN2O-N/hg de suelo seco). b) Número más probable de desnitrificantes/g de suelo seco en: suelo de Salto y suelo de Treinta y Tres (TyT), en 4 momentos del cultivo de arroz. Las barras representan la medias+el error estándar (n=4). Letras minúsculas diferentes indican diferencias significativas entre suelos (p<0,05). Letras mayúsculas diferentes indican diferencias significativas por momento del cultivo para ambos suelos (p<0,05).
La desnitrificación heterótrofa es afectada por la disponibilidad de fuentes de C, la concentración de NO3−, la disponibilidad de O2, el pH y la temperatura11. En este estudio se usó glucosa como fuente de C para la estimación de la actividad potencial. Algunos autores cuestionan el empleo de glucosa y sostienen que la relación N2/N2O es menor cuando se usan ácidos dicarboxílicos, compuestos que secretan las raíces27.
Los desnitrificantes son microorganismos que reducen NO3− a compuestos gaseosos (NO, N2O y N2) y la técnica del NMP utilizada en este trabajo no puede distinguir entre los que realizan la reducción completa a N2 o solo hasta N2O.
El suelo de Salto presentó mayor potencial desnitrificante que el de Treinta y Tres (0,3 contra 0,1μg/g ss, p=0,0004) (fig. 3a); su mayor contenido de MO podría sustentar una alta actividad desnitrificante heterótrofa. La desnitrificación no solo se ve favorecida con altos contenidos de MO, sino también por la fertilización nitrogenada y las condiciones limitantes de O25.
En este trabajo no hubo correlación entre el NMP de desnitrificantes, el potencial de desnitrificación y el contenido de NO3− en ninguno de los suelos analizados (datos no mostrados), aunque dada la versatilidad metabólica de los desnitrificantes y las limitaciones de la técnica de NMP, no siempre se detecta coincidencia entre abundancia y actividad de estos microorganismos46.
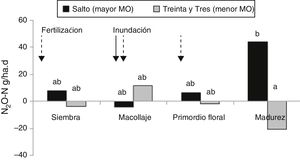
Emisión de N2OLa emisión de N2O se observa en la figura 4. No se constataron diferencias significativas en los flujos de N2O al comparar los 2 sitios experimentales, salvo en el último muestreo, cuando el arrozal de Salto emitió más N2O que el de Treinta y Tres: 44,2 N-N2O/ha d y −20,8g N-N2O/ha d, respectivamente (fig. 4). En la madurez del cultivo, ambos suelos se encontraban drenados, pero el de Salto presentaba mayor pendiente (1,4%, comparado con el 0,8% del suelo de Treinta y Tres) y, probablemente, un drenado más rápido explicaría el pico de emisión de N2O. Este aumento en la emisión de N2O luego de drenado el cultivo también ha sido reportado por otros autores2,17. Irisarri et al. atribuyen este evento a la liberación del N2O atrapado en el suelo y a las condiciones rédox óptimas para la producción de N2O17. Por otro lado, el aumento en la emisión de N2O a la madurez del cultivo podría deberse al aumento en la mineralización del N39, que coincide con el mayor contenido de N mineral (fig. 1) en el suelo de Salto. La mayor disponibilidad de N mineral en el suelo podría estimular los procesos de nitrificación y desnitrificación implicados en la producción de N2O.
Si bien se observaron flujos promedios negativos en algunos de los muestreos, la alta variabilidad de las emisiones no permitió detectar diferencias entre las distintas fechas. Majumdar revisó la capacidad de los suelos de arrozales de actuar como sumideros de N2O y encontró mayor capacidad de consumo de N2O en suelos inundados26. En contraste con los resultados obtenidos en este trabajo, ensayos previos realizados en la localidad de Treinta y Tres evidenciaron picos de N2O en la etapa vegetativa del arroz17,36. Si bien en este estudio se consideraron los posibles momentos con máxima emisión, no pudieron observarse esos picos en los momentos de muestreo. Tampoco se encontró correlación entre la emisión de N2O y las actividades potenciales ni la abundancia de oxidantes de NH4+ o desnitrificantes en ninguno de los suelos (datos no mostrados). Hou et al. no encontraron correlación entre la emisión de N2O y el NMP de desnitrificantes14, mientras que Das y Adhya encontraron una correlación positiva entre el N2O emitido y la actividad y el número de nitrificantes y desnitrificantes8.
Como conclusión, el suelo de Salto, con mayor contenido de MO, presentó un mayor potencial de desnitrificación, un mayor NMP de desnitrificantes y emitió más N2O a la madurez del cultivo que el suelo de Treinta y Tres. En ese momento del ciclo del cultivo, el suelo con mayor proporción de MO también presentó un mayor contenido de N mineral.
Los estudios de emisiones de GEI se han concentrado en Uruguay en la zona de Treinta y Tres, tradicional para el cultivo de arroz. En este trabajo se comprobó que el suelo de Salto presentó un comportamiento diferente, lo que estimula a estudiar otros tipos de suelos y a continuar las mediciones luego del drenaje del cultivo del arroz. Investigaciones de ese tipo contribuirían a la elaboración del inventario nacional de GEI y al cálculo de la huella de C del arroz uruguayo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo fue financiado por CSIC U. de la R. (proyecto I+D, responsable P.I.) y por una beca de Maestría (ANII) a G.I.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a J. Terra (INIA Treinta y Tres) y a B. Bocking por los ensayos de campo y a G. Pérez, G. Gordillo y P. Gutiérrez por su colaboración con los ensayos de laboratorio. También agradecemos a S. Tarlera y L. Frioni por sus comentarios sobre el trabajo.