El objetivo de este trabajo fue evaluar los resultados de sensibilidad a los antifúngicos de diversas especies de Candida utilizando el sistema semiautomatizado Vitek 2 (tarjetas AST-YSO1; bioMérieux), y compararlos con los obtenidos por el método de referencia del Clinical and Laboratory Standards Institute (CLSI), la microdilución en caldo (Documento M27-A3, 2008). La concordancia esencial fue > 90 %, excepto en el caso de Candida glabrata frente al voriconazol (VCZ) y de Candida krusei frente al fluconazol (FCZ). La concordancia global por categoría (variación no mayor que 2 diluciones, sin discriminar por especie) fue > 90 % cuando se evaluó el FCZ, y 89,5 % a las 24h y 80,7 % a las 48h con el VCZ. El tiempo promedio para obtener los resultados fue de 15,5h. Los errores menores (sensible o resistente por un método y dosis dependiente por el otro) para FCZ fueron de 7,8 % a las 24h y 6,1 % a las 48h; para VCZ, 10,5 % a las 24h y 19,3 % a las 48h. Solo se detectó 1 error muy mayor (resistente por el método de referencia y sensible por Vitek 2) con Candida parapsilosis frente a FCZ a las 48h. No se observaron errores mayores (sensibles por el método de referencia y resistentes por Vitek 2). Con respecto a la anfotericina B, solo 3 cepas presentaron una CIM ≥ 2μg/ml. El sistema Vitek 2 detectó correctamente el valor de CIM para diversas especies de Candida y presentó una excelente concordancia con el método de referencia propuesto por el CLSI.
The aim of this investigation was to evaluate the results of antifungal susceptibility for various Candida species using the Vitek 2 semi-automated system (AST-YSO1 cards, bioMérieux), and to compare them with those obtained by the CLSI (Clinical and Laboratory Standards Institute) broth microdilution reference method (Document M27-A3,2008). The essential agreement (EA) was > 90%, except for Candida glabrata against voriconazole (VCZ); and for Candida krusei against fluconazole (FCZ). The overall categorical agreement (CA) was > 90% when FCZ was evaluated and 89.5% at 24h and 80.7% at 48h for VCZ. The average time for obtaining results was 15.5h. Minor errors were 7.8% at 24h and 6.1% at 48h for FCZ, and 10.5% at 24h and 19.3% at 48h for VCZ. There was only one very major error for FCZ against Candida parapsilosis and no major errors were observed. For amphotericin B, only three isolates showed MICs ≥ 2μg/ml. The Vitek 2 system detected the MIC value for various Candida species and showed excellent agreement with the reference method proposed by the CLSI.
Las infecciones por levaduras del género Candida constituyen un grave problema hospitalario. Los datos del National Nosocomial Infections Surveillance System (NNISS) indican que el 9 % de las infecciones nosocomiales en EE.UU. son producidas por hongos9. En un estudio realizado por la Red de Micología de la Ciudad de Buenos Aires, se analizaron 190 820 hemocultivos procesados entre 2005 y 2008; en 1020 se recuperaron diversos hongos, de los cuales un 68 % correspondieron a candidemias, con una incidencia global de 1,15/1000 ingresos y valores variables entre centros, que fueron desde 0,35 a 2,65/1000 ingresos14.
Desde hace varios años, se ha observado una disminución en el número de patologías causadas por Candida albicans y un marcado aumento de las ocasionadas por otras especies de Candida6. Por otra parte, se han identificado diferentes hongos como agentes etiológicos, lo que ha tenido impacto no solo en la epidemiología, sino también en el éxito del tratamiento antifúngico. En los hemocultivos analizados en la Ciudad de Buenos Aires, se encontraron 683 episodios de fungemia por Candida, 214 por Cryptococcus, 105 por Histoplasma capsulatum, 7 por Rhodotorula, 5 por Trichosporon, 2 por Pichia, 2 por Acremonium, uno por Saccharomyces y otro por Fusarium14.
En la última década se ha observado un incremento en el uso de antimicóticos del 12 % anual. Su uso masivo ha originado la aparición de resistencias secundarias y el desplazamiento de hongos sensibles por otros más resistentes8. Ante esta realidad, es importante conocer el perfil de sensibilidad de las especies fúngicas que se aíslan con mayor frecuencia en cada institución, para establecer la terapéutica más adecuada.
Como alternativas rápidas y más fáciles de implementar que los métodos de referencia vigentes (los propuestos por el CLSI4,5 y el EUCAST11,12), surgieron en el mercado diversos equipos comerciales. Uno de ellos es el sistema semiautomatizado Vitek 2® (bioMérieux, Marcy l'Etoile, Francia), que permite determinar por espectrofotometría el crecimiento de las levaduras, realizar su identificación y establecer la concentración inhibitoria mínima (CIM) correspondiente. La identificación del aislamiento en estudio se efectúa a través de 47 pruebas bioquímicas con marcadores fluorescentes, que incluyen asimilación de carbohidratos y ácidos orgánicos y detección de oxidasas y arilamidasas.
Diversos trabajos mostraron una concordancia > 90 % entre el sistema Vitek 2 y el método de referencia del CLSI de anfotericina B (AMB), 5-fluocitosina, fluconazol (FCZ) y voriconazol (VCZ)2,3,20,23,24,27.
El objetivo del presente estudio fue comparar los valores de CIM de FCZ, AMB y VCZ obtenidos con el sistema Vitek 2 con los del método de referencia de microdilución en caldo (Documento M27-A3, 2008, del CLSI)4.
Materiales y métodosMicroorganismosSe estudiaron 167 aislamientos de Candida spp., provenientes de diversas muestras clínicas procesadas en los hospitales de la Red de Micología de la Ciudad Autónoma de Buenos Aires entre el 1 de septiembre de 2009 y el 31 de mayo de 2010.
Se incluyeron, además, 5 cepas de Candida spp., de identidad y sensibilidad conocidas, pertenecientes a la colección de cultivos del Hospital de Infecciosas Dr. Francisco J. Muñiz y del Hospital General de Agudos Dr. Juan A. Fernández.
Los aislamientos clínicos correspondieron a hemocultivos (42), catéteres (10), retrocultivos (4), líquidos de punción (10), hisopados de fauces (19), esputos (8), uñas (12), flujos vaginales (10), urocultivos (41), biopsias (7) y otros sitios (4).
Se utilizaron como control de calidad las cepas Candida parapsilosis ATCC 22019, Candida krusei ATCC 6258, y las cepas de referencia Candida glabrata ATCC 90030 y Candida albicans ATCC 64548.
Identificación de las levadurasTodas las levaduras fueron identificadas con una probabilidad ≥ 90 % por medio del equipo API 20C Aux o API ID32C (bioMérieux, Marcy l'Etoile, Francia) en el hospital de origen y se remitieron en un criovial con agua destilada estéril, donde se mantuvieron hasta ser utilizadas en el presente estudio.
Se analizaron en total 176 cepas: 32 C. parapsilosis, 29 Candida tropicalis, 28 C. glabrata, 27 C. krusei, 26 C. albicans, 24 Candida guilliermondii y 10 Candida dubliniensis.
Con el objetivo de confirmar la identidad y pureza del material recibido, todas las cepas se sembraron en agar cromogénico para levaduras CHROMagar Candida (CHROMagar Company Ltd., Francia) y se estudió la micromorfología de cada una de ellas en agar harina de maíz con Tween 80 (corn-meal agar, Oxoid, Reino Unido)13.
Se utilizaron como pruebas presuntivas adicionales para diferenciar entre C. albicans y C. dubliniensis crecimiento a 42°C, desarrollo en medio con NaCl 11 %, agar opacidad, agar tabaco y asimilación de D-xilosa26. Para confirmar los resultados de estos ensayos se realizó la identificación molecular de ambas especies por medio de PCR convencional, en la que se amplificó la región codificante completa del gen hwp1, que codifica una adhesina de superficie. Se utilizaron las siguientes secuencias de primers: Fwd 5′-GCTACCACTTCAGAATCATCATC-3′ y Rv 5′-GCACCTTCAGTCGTAGAGACG-3′. La detección de los productos amplificados se realizó mediante electroforesis en gel de agarosa al 2 %. El tamaño de los fragmentos esperados era 941 pb (C. albicans) y 569 pb (C. dubliniensis)29.
Pruebas de sensibilidad in vitro- 1)
Método de microdilución en caldo
Se realizó el método de microdilución en caldo, según lo establecido en el documento M27-A35. Se utilizaron placas de microtitulación de 96 pocillos, fondo en U, estériles (Cellstar, Greiner Bio-One, Alemania). Los antifúngicos probados fueron AMB (Sigma, EE.UU.), FCZ (Pfizer, Reino Unido) y VCZ (Pfizer, Reino Unido); las soluciones madre de estas drogas fueron preparadas según lo indicado en el documento. No se incluyó en este estudio a la 5-fluorocitosina por ser una droga que no se comercializa en nuestro país. Como medio de cultivo se utilizó RPMI 1640 (Gibco, EE.UU.) con glutamina y sin bicarbonato de sodio, tamponado a pH 7 con ácido morfolino propano sulfónico (MOPS) (Sigma, Argentina). El inóculo se preparó según se indica luego. Las placas se incubaron a 35°C y se leyeron visualmente a las 24 y 48h de incubación.
- 2)
Vitek 2
- a.
Paneles de microdilución. Las tarjetas del sistema Vitek 2 AST YSO1 contienen una serie de diluciones seriadas de AMB (0,25 a 16μg/ml), VCZ (0,125 a 8μg/ml) y FCZ (1 a 64μg/ml), provistas por el fabricante. Estas se conservaron a 2-8°C hasta el momento de ser utilizadas.
- b.
Inóculo para microdilución y Vitek 2. Cada aislamiento se subcultivó en agar Sabouraud glucosado y se incubó durante 48h a 35°C, para asegurar su pureza y viabilidad. Se realizó luego un segundo repique en el mismo medio de cultivo, que fue incubado 24h a 35°C.
El inóculo para realizar el método de microdilución (CLSI) se preparó a partir de una suspensión de colonias de levaduras crecidas durante 24h en agar Sabouraud glucosado en 5ml de solución fisiológica estéril. La suspensión se ajustó a una turbidez equivalente a 0,5 de la escala de McFarland, y se realizó una dilución posterior 1/1000 en RPMI para obtener una concentración 1–5 × 103 UFC/ml (doble de la concentración final).
El inóculo para el sistema Vitek 2 fue preparado a partir de una suspensión de levaduras en 3ml de solución fisiológica-agua destilada (1:1), hasta una turbidez equivalente a 1,8-2,2 de McFarland, utilizando el instrumento DensiCheck® (bioMérieux). Cada suspensión fue diluida apropiadamente, transfiriendo 280μl a un tubo con 3ml de solución fisiológica-agua destilada (1:1).
- c.
Siembra de las tarjetas AST YSO1. El inóculo preparado se dispensó en la tarjeta AST YSO1 a través de un tubo de poliestireno estéril. Los cassettes fueron colocados en el instrumento Vitek 2; las tarjetas se llenaron e incubaron en el equipo y luego se leyeron por espectrofotometría. El tiempo de incubación varió de 11,7 a 26,5h (promedio 15,5h), en función de la tasa de crecimiento en el pocillo libre de droga. Los resultados de CIM se expresaron en μg/ml, de acuerdo a lo procesado por el software del aparato.
- a.
Los resultados de CIM obtenidos por Vitek 2 se compararon con los obtenidos por el método de referencia leídos a las 24h y a las 48h de incubación.
Se consideró que hubo concordancia esencial (essential agreement, EA) cuando el resultado de la CIM obtenido por el sistema Vitek 2 no varió en más de dos diluciones (2 pocillos) respecto del obtenido mediante el método de referencia23,24.
Se utilizaron los puntos de corte propuestos por el CLSI para C. albicans, C. parapsilosis, C. glabrata, C. tropicalis y C. krusei (M27-S4)4 a fin de obtener los porcentajes de concordancia por categoría (categorical agreement, CA)23,24. El CLSI no ha establecido puntos de corte para AMB, ni para evaluar la sensibilidad de C. guilliermondii ni de C. dubliniensis, por lo que en estos casos solo se determinó el EA.
Las discrepancias entre los resultados fueron categorizadas como errores muy mayores cuando el método de referencia lo clasificaba como resistente y la CIM obtenida por el Vitek 2 como sensible; como errores mayores cuando el aislamiento era clasificado como resistente por el Vitek 2 y sensible por el método de referencia, y como errores menores cuando el resultado de uno de los métodos era sensible o resistente y el otro era sensible dosis dependiente (SDD).
Los resultados de cada ensayo se validaron en función de los datos correspondientes a las cepas control. Se observó una alta reproducibilidad con los dos métodos analizados.
ResultadosIdentificación de los microorganismosSe corroboró la identificación original de las 176 cepas utilizadas en este estudio. En todos los casos, el color y el aspecto de las colonias en agar cromogénico y la micromorfología observada en el agar harina de maíz fue el esperado para cada especie. Todos los aislamientos de C. albicans y C. dubliniensis fueron confirmados mediante las pruebas fisiológicas, morfológicas y moleculares.
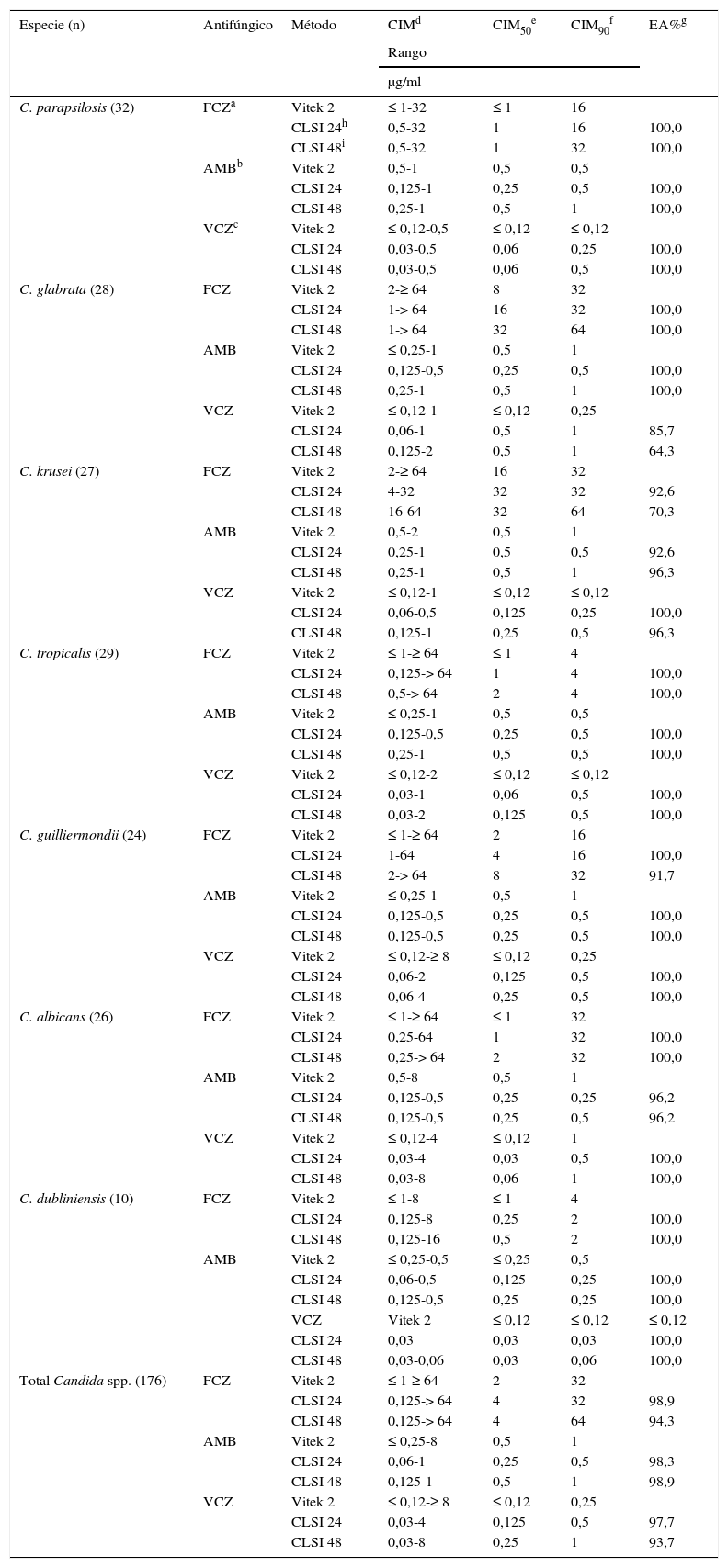
Pruebas de sensibilidadEn la tabla 1 se detallan los resultados de CIM de FCZ, AMB y VCZ para las 176 cepas analizadas, ordenadas por especie, determinados con el sistema Vitek 2 y con el método de referencia leído a las 24h y a las 48h, y también los porcentajes de EA.
Perfil de sensibilidad de las especies de Candida a los antifúngicos probados y concordancia entre los métodos utilizados.
| Especie (n) | Antifúngico | Método | CIMd | CIM50e | CIM90f | EA%g |
|---|---|---|---|---|---|---|
| Rango | ||||||
| μg/ml | ||||||
| C. parapsilosis (32) | FCZa | Vitek 2 | ≤ 1-32 | ≤ 1 | 16 | |
| CLSI 24h | 0,5-32 | 1 | 16 | 100,0 | ||
| CLSI 48i | 0,5-32 | 1 | 32 | 100,0 | ||
| AMBb | Vitek 2 | 0,5-1 | 0,5 | 0,5 | ||
| CLSI 24 | 0,125-1 | 0,25 | 0,5 | 100,0 | ||
| CLSI 48 | 0,25-1 | 0,5 | 1 | 100,0 | ||
| VCZc | Vitek 2 | ≤ 0,12-0,5 | ≤ 0,12 | ≤ 0,12 | ||
| CLSI 24 | 0,03-0,5 | 0,06 | 0,25 | 100,0 | ||
| CLSI 48 | 0,03-0,5 | 0,06 | 0,5 | 100,0 | ||
| C. glabrata (28) | FCZ | Vitek 2 | 2-≥ 64 | 8 | 32 | |
| CLSI 24 | 1-> 64 | 16 | 32 | 100,0 | ||
| CLSI 48 | 1-> 64 | 32 | 64 | 100,0 | ||
| AMB | Vitek 2 | ≤ 0,25-1 | 0,5 | 1 | ||
| CLSI 24 | 0,125-0,5 | 0,25 | 0,5 | 100,0 | ||
| CLSI 48 | 0,25-1 | 0,5 | 1 | 100,0 | ||
| VCZ | Vitek 2 | ≤ 0,12-1 | ≤ 0,12 | 0,25 | ||
| CLSI 24 | 0,06-1 | 0,5 | 1 | 85,7 | ||
| CLSI 48 | 0,125-2 | 0,5 | 1 | 64,3 | ||
| C. krusei (27) | FCZ | Vitek 2 | 2-≥ 64 | 16 | 32 | |
| CLSI 24 | 4-32 | 32 | 32 | 92,6 | ||
| CLSI 48 | 16-64 | 32 | 64 | 70,3 | ||
| AMB | Vitek 2 | 0,5-2 | 0,5 | 1 | ||
| CLSI 24 | 0,25-1 | 0,5 | 0,5 | 92,6 | ||
| CLSI 48 | 0,25-1 | 0,5 | 1 | 96,3 | ||
| VCZ | Vitek 2 | ≤ 0,12-1 | ≤ 0,12 | ≤ 0,12 | ||
| CLSI 24 | 0,06-0,5 | 0,125 | 0,25 | 100,0 | ||
| CLSI 48 | 0,125-1 | 0,25 | 0,5 | 96,3 | ||
| C. tropicalis (29) | FCZ | Vitek 2 | ≤ 1-≥ 64 | ≤ 1 | 4 | |
| CLSI 24 | 0,125-> 64 | 1 | 4 | 100,0 | ||
| CLSI 48 | 0,5-> 64 | 2 | 4 | 100,0 | ||
| AMB | Vitek 2 | ≤ 0,25-1 | 0,5 | 0,5 | ||
| CLSI 24 | 0,125-0,5 | 0,25 | 0,5 | 100,0 | ||
| CLSI 48 | 0,25-1 | 0,5 | 0,5 | 100,0 | ||
| VCZ | Vitek 2 | ≤ 0,12-2 | ≤ 0,12 | ≤ 0,12 | ||
| CLSI 24 | 0,03-1 | 0,06 | 0,5 | 100,0 | ||
| CLSI 48 | 0,03-2 | 0,125 | 0,5 | 100,0 | ||
| C. guilliermondii (24) | FCZ | Vitek 2 | ≤ 1-≥ 64 | 2 | 16 | |
| CLSI 24 | 1-64 | 4 | 16 | 100,0 | ||
| CLSI 48 | 2-> 64 | 8 | 32 | 91,7 | ||
| AMB | Vitek 2 | ≤ 0,25-1 | 0,5 | 1 | ||
| CLSI 24 | 0,125-0,5 | 0,25 | 0,5 | 100,0 | ||
| CLSI 48 | 0,125-0,5 | 0,25 | 0,5 | 100,0 | ||
| VCZ | Vitek 2 | ≤ 0,12-≥ 8 | ≤ 0,12 | 0,25 | ||
| CLSI 24 | 0,06-2 | 0,125 | 0,5 | 100,0 | ||
| CLSI 48 | 0,06-4 | 0,25 | 0,5 | 100,0 | ||
| C. albicans (26) | FCZ | Vitek 2 | ≤ 1-≥ 64 | ≤ 1 | 32 | |
| CLSI 24 | 0,25-64 | 1 | 32 | 100,0 | ||
| CLSI 48 | 0,25-> 64 | 2 | 32 | 100,0 | ||
| AMB | Vitek 2 | 0,5-8 | 0,5 | 1 | ||
| CLSI 24 | 0,125-0,5 | 0,25 | 0,25 | 96,2 | ||
| CLSI 48 | 0,125-0,5 | 0,25 | 0,5 | 96,2 | ||
| VCZ | Vitek 2 | ≤ 0,12-4 | ≤ 0,12 | 1 | ||
| CLSI 24 | 0,03-4 | 0,03 | 0,5 | 100,0 | ||
| CLSI 48 | 0,03-8 | 0,06 | 1 | 100,0 | ||
| C. dubliniensis (10) | FCZ | Vitek 2 | ≤ 1-8 | ≤ 1 | 4 | |
| CLSI 24 | 0,125-8 | 0,25 | 2 | 100,0 | ||
| CLSI 48 | 0,125-16 | 0,5 | 2 | 100,0 | ||
| AMB | Vitek 2 | ≤ 0,25-0,5 | ≤ 0,25 | 0,5 | ||
| CLSI 24 | 0,06-0,5 | 0,125 | 0,25 | 100,0 | ||
| CLSI 48 | 0,125-0,5 | 0,25 | 0,25 | 100,0 | ||
| VCZ | Vitek 2 | ≤ 0,12 | ≤ 0,12 | ≤ 0,12 | ||
| CLSI 24 | 0,03 | 0,03 | 0,03 | 100,0 | ||
| CLSI 48 | 0,03-0,06 | 0,03 | 0,06 | 100,0 | ||
| Total Candida spp. (176) | FCZ | Vitek 2 | ≤ 1-≥ 64 | 2 | 32 | |
| CLSI 24 | 0,125-> 64 | 4 | 32 | 98,9 | ||
| CLSI 48 | 0,125-> 64 | 4 | 64 | 94,3 | ||
| AMB | Vitek 2 | ≤ 0,25-8 | 0,5 | 1 | ||
| CLSI 24 | 0,06-1 | 0,25 | 0,5 | 98,3 | ||
| CLSI 48 | 0,125-1 | 0,5 | 1 | 98,9 | ||
| VCZ | Vitek 2 | ≤ 0,12-≥ 8 | ≤ 0,12 | 0,25 | ||
| CLSI 24 | 0,03-4 | 0,125 | 0,5 | 97,7 | ||
| CLSI 48 | 0,03-8 | 0,25 | 1 | 93,7 |
Se registró un EA entre el sistema Vitek 2 y la microdilución a las 24h y a las 48h > 90 % para todas las combinaciones de Candida y antifúngico analizadas, con la excepción de C. glabrata y VCZ (85,7 % y 64,3 % a las 24 y 48h, respectivamente) y C. krusei y FCZ a las 48h (70,3 %), aunque se debe mencionar que este dato carecería de relevancia clínica puesto que C. krusei es una especie con resistencia intrínseca a esta droga.
Los resultados globales de EA a las 24h fueron de 98,9 % en el caso del FCZ, del 98,3 % al evaluar la AMB y del 97,7 % para el VCZ; a las 48h los valores fueron, en el mismo orden, 94,3 %, 98,9 % y 93,7 %
La especie que presentó menor EA fue C. krusei, aunque superó el 90 % con AMB y VCZ. Frente al FCZ presentó también una concordancia > 90 % a las 24h, pero a las 48h alcanzó solo el 70,3 %.
Se compararon las CIM50 y CIM90 (concentraciones que inhiben al 50 % y al 90 % de los aislados, respectivamente) obtenidas por cada método con cada combinación especie-antifúngico, y se observó que estas se encontraban en un rango de ± 2 diluciones en todos los casos, lo que indica que los métodos analizados fueron comparables.
El tiempo promedio para obtener los resultados con Vitek 2 fue 15,5h (rango: 11,7-26,5h). Solo un aislamiento clínico de C. parapsilosis no creció lo suficiente en el sistema Vitek 2, por lo que fue eliminado del estudio.
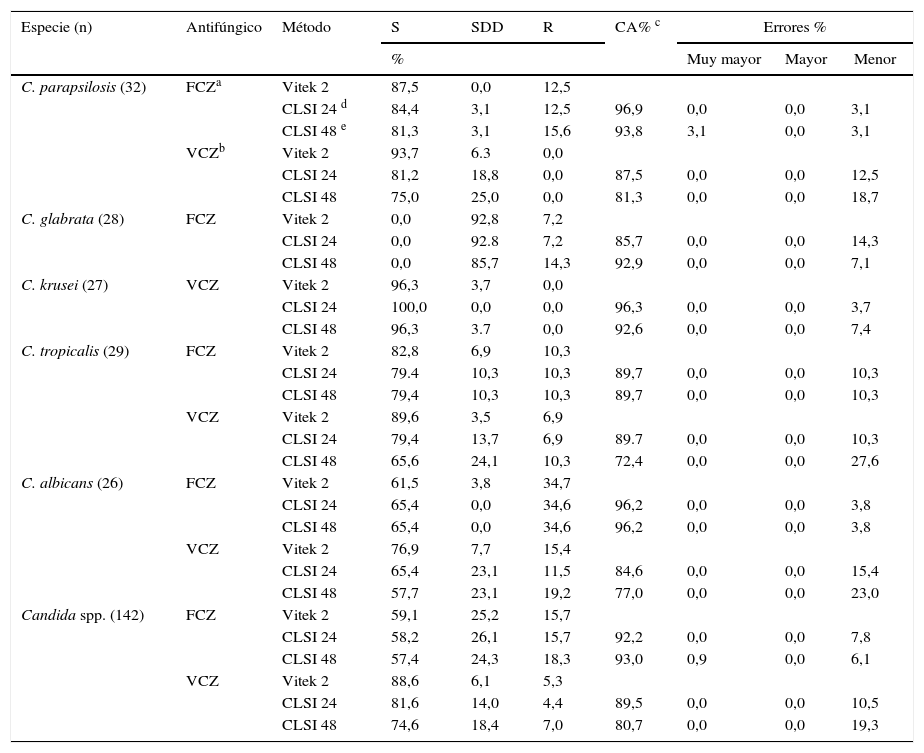
En la tabla 2 se observan los resultados de CIM de FCZ y VCZ según los criterios del CLSI-M27-S4 para C. albicans, C. parapsilosis, C. tropicalis, C. glabrata y C. krusei. Se indica también el CA y los porcentajes de errores muy mayores, mayores y menores encontrados.
Actividad de fluconazol y voriconazol frente a las especies de Candida. Concordancia por categoría y errores.
| Especie (n) | Antifúngico | Método | S | SDD | R | CA% c | Errores % | ||
|---|---|---|---|---|---|---|---|---|---|
| % | Muy mayor | Mayor | Menor | ||||||
| C. parapsilosis (32) | FCZa | Vitek 2 | 87,5 | 0,0 | 12,5 | ||||
| CLSI 24 d | 84,4 | 3,1 | 12,5 | 96,9 | 0,0 | 0,0 | 3,1 | ||
| CLSI 48 e | 81,3 | 3,1 | 15,6 | 93,8 | 3,1 | 0,0 | 3,1 | ||
| VCZb | Vitek 2 | 93,7 | 6.3 | 0,0 | |||||
| CLSI 24 | 81,2 | 18,8 | 0,0 | 87,5 | 0,0 | 0,0 | 12,5 | ||
| CLSI 48 | 75,0 | 25,0 | 0,0 | 81,3 | 0,0 | 0,0 | 18,7 | ||
| C. glabrata (28) | FCZ | Vitek 2 | 0,0 | 92,8 | 7,2 | ||||
| CLSI 24 | 0,0 | 92.8 | 7,2 | 85,7 | 0,0 | 0,0 | 14,3 | ||
| CLSI 48 | 0,0 | 85,7 | 14,3 | 92,9 | 0,0 | 0,0 | 7,1 | ||
| C. krusei (27) | VCZ | Vitek 2 | 96,3 | 3,7 | 0,0 | ||||
| CLSI 24 | 100,0 | 0,0 | 0,0 | 96,3 | 0,0 | 0,0 | 3,7 | ||
| CLSI 48 | 96,3 | 3.7 | 0,0 | 92,6 | 0,0 | 0,0 | 7,4 | ||
| C. tropicalis (29) | FCZ | Vitek 2 | 82,8 | 6,9 | 10,3 | ||||
| CLSI 24 | 79.4 | 10,3 | 10,3 | 89,7 | 0,0 | 0,0 | 10,3 | ||
| CLSI 48 | 79,4 | 10,3 | 10,3 | 89,7 | 0,0 | 0,0 | 10,3 | ||
| VCZ | Vitek 2 | 89,6 | 3,5 | 6,9 | |||||
| CLSI 24 | 79,4 | 13,7 | 6,9 | 89.7 | 0,0 | 0,0 | 10,3 | ||
| CLSI 48 | 65,6 | 24,1 | 10,3 | 72,4 | 0,0 | 0,0 | 27,6 | ||
| C. albicans (26) | FCZ | Vitek 2 | 61,5 | 3,8 | 34,7 | ||||
| CLSI 24 | 65,4 | 0,0 | 34,6 | 96,2 | 0,0 | 0,0 | 3,8 | ||
| CLSI 48 | 65,4 | 0,0 | 34,6 | 96,2 | 0,0 | 0,0 | 3,8 | ||
| VCZ | Vitek 2 | 76,9 | 7,7 | 15,4 | |||||
| CLSI 24 | 65,4 | 23,1 | 11,5 | 84,6 | 0,0 | 0,0 | 15,4 | ||
| CLSI 48 | 57,7 | 23,1 | 19,2 | 77,0 | 0,0 | 0,0 | 23,0 | ||
| Candida spp. (142) | FCZ | Vitek 2 | 59,1 | 25,2 | 15,7 | ||||
| CLSI 24 | 58,2 | 26,1 | 15,7 | 92,2 | 0,0 | 0,0 | 7,8 | ||
| CLSI 48 | 57,4 | 24,3 | 18,3 | 93,0 | 0,9 | 0,0 | 6,1 | ||
| VCZ | Vitek 2 | 88,6 | 6,1 | 5,3 | |||||
| CLSI 24 | 81,6 | 14,0 | 4,4 | 89,5 | 0,0 | 0,0 | 10,5 | ||
| CLSI 48 | 74,6 | 18,4 | 7,0 | 80,7 | 0,0 | 0,0 | 19,3 | ||
Al analizar todos los aislamientos en conjunto en relación con cada antifúngico, el CA fue de 92,2 % con FCZ y de 89,5 % con VCZ a las 24h, en tanto que a las 48h se registraron CA de 93,0 % y 80,7%, respectivamente.
El CA observado entre el sistema Vitek 2 y la microdilución a las 48h fue ligeramente menor que a las 24h, dato que coincide con lo informado en otros trabajos.
Se encontró solo 1 error muy mayor con C. parapsilosis (3,1 %) al analizar los resultados de FCZ a las 24h. No se observaron errores mayores en ninguna de las cepas analizadas en la evaluación del FCZ y el VCZ. Con el primero de los citados antifúngicos se detectaron 7,8 % de errores menores a las 24h y 6,1% de errores menores y 0,9% de errores muy mayores a las 48h; con el segundo, se registraron 10,5 % y 19,3 % de errores menores a las 24h y a las 48h, respectivamente.
Con respecto a C. guilliermondii, solo una de las 24 cepas analizadas presentó una diferencia mayor de 2 diluciones con FCZ a las 24 y a las 48h, y en otra cepa se registró una diferencia de 3 diluciones al comparar la CIM del Vitek 2 y la lectura realizada a las 48h. Con VCZ, todas las cepas presentaron valores de CIM dentro del rango esperado.
En C. dubliniensis se observaron valores de CIM en un rango de +/− 2 diluciones al evaluar FCZ y VCZ.
En el ensayo de la AMB, de las 176 cepas analizadas solo tres presentaron una CIM elevada con el sistema Vitek 2: dos de C. krusei (CIM = 2μg/ml) y una C. albicans (CIM = 8μg/ml). En todos los casos, por el método de referencia se obtuvieron CIM ≤ 1μg/ml a las 24h y 48h.
Con respecto al FCZ, se encontró 12,5 % de resistencia en C. parapsilosis; 7,2 % en C. glabrata; 10,3 % en C. tropicalis y 34,6 % en C. albicans. Para el VCZ, los niveles de resistencia fueron 6,9 % en C. tropicalis y 11,5 % en C. albicans. No se observó resistencia a esta droga en C. parapsilosis ni en C. krusei.
DiscusiónLas especies de Candida causan el 10 % de las sepsis nosocomiales y la candidemia prolonga en tres semanas la estancia hospitalaria, lo que duplica el riesgo de muerte de los enfermos8. Varios trabajos señalan que el tratamiento inadecuado es un factor independiente de mortalidad y está afectado por el momento en que se comienza con la terapia antifúngica específica17-19,22. Si bien estudios realizados hasta la fecha indican que las tasas de resistencia a los azoles son bajas, existen diferencias regionales en la sensibilidad a estos agentes cuando se analizan por especie25.
En el estudio de vigilancia ARTEMIS (1997 a 2007) se observó que 13 de 31 especies de Candida presentaban sensibilidad disminuida a FCZ (< 75 % de sensibilidad). En diez años y medio, no se observaron variaciones importantes en el perfil de sensibilidad (S) a FCZ en C. albicans, C. glabrata, C. tropicalis, C. krusei, C. inconspicua, C. norvegensis y C. valida. Otras especies mostraron leves aumentos en la resistencia a FCZ en el período analizado: C. parapsilosis (2,5 a 3,6 %), C. guilliermondii (9,9 a 14,2 %), Candida lusitaniae (2,9 a 6,0 %). Durante el período 2001-2007, el FCZ fue la droga más activa (90,0 %) frente a las especies más frecuentes: C. albicans (98,0 %), C. tropicalis (91,0 %), C. parapsilosis (93,2 %), C. dubliniensis (96,1 %), y se observó una disminución en la sensibilidad en C. glabrata (68,7 %), C. krusei (8,6 %) y C. guilliermondii (73,5 %). Dentro de los aislamientos resistentes a FCZ, menos del 30 % permanecieron sensibles a VCZ: C. albicans (28,1 %), C. glabrata (19,1 %), C. tropicalis (17,0 %)25.
En un estudio multicéntrico sobre fungemias realizado en Argentina, se detectó entre las especies del género Candida un 5,4 % de cepas resistentes a FCZ y un 1,6 % a VCZ, con notables diferencias según las especies6. Con respecto a FCZ, se ha informado un 20 % de resistencia en C. glabrata; 4,2 % en C. tropicalis; 2,5 % en C. parapsilosis; 28,5 % en C. guilliermondii y 42,8 % en C. pelliculosa. En nuestro estudio, que incluye diferentes tipos de muestras, el 7,2% de los aislamientos de C. glabrata fueron resistentes a FCZ, y en otras especies los porcentajes fueron aun más elevados (10,3 % en C. tropicalis; 12,5% en C. parapsilosis y 34,6 % en C. albicans), con un 15,7% de resistencia global, en tanto que la resistencia a VCZ fue de 4,4 %. Por otra parte, ningún aislamiento presentó una sensibilidad disminuida a la AMB.
Según la técnica del CLSI, se requieren 48h de incubación para poder determinar la CIM. Con la mayoría de los aislamientos, las diferencias entre las lecturas a las 24h y a las 48h fueron mínimas y no provocaron un cambio en la interpretación por categoría. Varios autores han propuesto 48h de incubación para determinar la CIM de VCZ, mientras que la de FCZ podría ser leída visualmente a las 24 o a las 48h, dependiendo del crecimiento de la cepa en estudio10,21. Diversos trabajos han demostrado que la lectura de la CIM a las 24h es la más apropiada para comparar los resultados de Vitek 2 u otros sistemas comerciales (por ejemplo, Etest®) frente al FCZ, especialmente en algunas especies que exhiben efecto trailing (persistencia de crecimiento a concentraciones superiores a la CIM)1,16,21,24,28. Por este motivo, en el presente trabajo se analizaron los resultados obtenidos a las 24h y a las 48h de incubación.
Con el sistema Vitek 2 se obtuvieron los patrones de sensibilidad en 15,5h (rango: 11,7–26,5h). La CIM50 y la CIM90 obtenidas por ambos métodos fueron equivalentes, resultados que permitieron asegurar la utilidad del Vitek 2 para evaluar la sensibilidad de Candida spp. a FCZ, AMB y VCZ.
Con respecto al CA, se obtuvieron muy buenos resultados a las 24h (> 85 %) con todos los aislamientos de Candida spp. y antifúngicos analizados.
El CA entre el sistema Vitek 2 y la microdilución a las 48h fue ligeramente menor que a las 24h, coincidiendo con otros trabajos3,24.
La mayoría de los errores menores encontrados al evaluar el FCZ y el VCZ (30/50 errores menores totales) se deben a diferencias en una dilución entre el valor de CIM obtenido por el sistema Vitek 2 y por el método de la microdilución a las 24h o a las 48h, las que provocan un cambio en la interpretación de la sensibilidad según los puntos de corte propuestos por el CLSI. Esto se relaciona con la variación propia de los métodos manuales.
Se observó solo 1 error muy mayor (falso sensible) en C. parapsilosis con FCZ al comparar los resultados obtenidos con el Vitek 2 frente a la CIM leída a las 48h.
Diferentes autores publicaron similares datos a los aquí presentados tras comparar los resultados obtenidos por el sistema Vitek 2 con aquellos obtenidos mediante microdilución en caldo en la evaluación de los antifúngicos FCZ, VCZ y AMB2,3,7,23,24,27.
Como el CLSI no ha establecido puntos de corte para AMB, ni para evaluar la sensibilidad de C. guilliermondii o C. dubliniensis, solo se determinó el EA, como anteriormente se mencionó.
Aunque la resistencia a los antifúngicos permanece baja, afecta a algunas especies en particular15,25. En nuestro trabajo se observó 15,7 % de resistencia a FCZ y 4,4 % de resistencia a VCZ al analizar los valores de CIM de las 142 cepas analizadas, los valores variaron según la especie. Es necesario desarrollar una continua vigilancia epidemiológica que permita detectar posibles cambios, no solo en la distribución de especies de cada institución, sino también en el perfil de sensibilidad a los antifúngicos que estas presentan. Es un desafío que deben afrontar los laboratorios de micología clínica, dado el impacto que esta información tiene sobre la salud del paciente.
El sistema Vitek 2 surge como una opción confiable para la determinación del perfil de sensibilidad antifúngica de Candida spp. Detecta correctamente el valor de CIM para las especies más frecuentes de Candida aisladas en las muestras clínicas y permite orientar de manera rápida y oportuna sobre el antifúngico adecuado para el tratamiento. La incorporación del espectrofotómetro otorga una lectura objetiva de la CIM, y puede eliminar las falsas resistencias observadas por efecto trailing.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesRolando Soloaga se desempeña como asesor científico de bioMérieux, Argentina.
Al personal de la Unidad Micología del Hospital de Infecciosas “Dr. Francisco J. Muñiz”, del Laboratorio de Bacteriología del Hospital de Niños “Dr. Ricardo Gutiérrez” y del Laboratorio de Micología del Hospital General de Agudos Dr. Juan A. Fernández, por brindar el espacio para desarrollar este estudio. A bioMèrieux Argentina, por haber donado las tarjetas AST-YSO1 que se utilizaron en este trabajo.
Maldonado I, Hospital Alemán; Schijman M, Hospital General de Agudos Dr. T. Álvarez; López Moral L, Hospital General de Agudos Dr. C. Argerich; Rébori J, Hospital Borda; Relloso S, Instituto Universitario CEMIC; Cataldi S, Hospital General de Agudos Dr. C.G. Durand; Nápoli P, Hospital de Niños Dr. P. Elizalde; Fernández A, Fundación Favaloro; Guelfand L, Hospital General de Agudos J.A. Fernández; Arechavala A, Unidad Micología Hospital de Infecciosas F.J. Muñiz; Bianchi M, Unidad Micología Hospital de Infecciosas F.J. Muñiz; Romeo AM, Hospital General de Agudos Dr. J.M. Penna; Franco N, Hospital General de Agudos Dr. P. Piñero; Garbasz C, Hospital General de Agudos Dr. I. Pirovano; López M, Hospital General de Agudos Dr. Ramos Mejía; Madeo MC, Hospital General de Agudos Dr. Tornú; Ciudad Autónoma de Buenos Aires, Argentina.