Evaluamos las concordancias interlaboratorio, esencial y categórica entre el panel Sensititre YeastOneTM y los métodos de referencia correspondientes al M27 4.ª ed. (Clinical and Laboratory Standards Institute [CLSI]) y al EDef 7.3.1 (European Committee on Antifungal Susceptibility Testing [EUCAST]). Estudiamos 67 cepas de Candida de distintas muestras clínicas y un panel de 9 cepas resistentes a fluconazol y equinocandinas. El mayor porcentaje de concordancia interlaboratorio se observó con anfotericina B (96,8%) y el menor porcentaje con voriconazol (77,2%). La caspofungina mostró un 5,8% de discrepancias muy mayores con el método de referencia del CLSI. Con el del EUCAST, el itraconazol, el posaconazol y la anidulafungina mostraron porcentajes de discrepancias mayores: el 17,6, el 18,1 y el 19,6%, respectivamente. El panel Sensititre YeastOneTM es una alternativa confiable y fácil de usar, que permite detectar especies de Candida resistentes a los antifúngicos, con algunas limitaciones para las equinocandinas. Los resultados son equiparables a los de los métodos de referencia.
We evaluated the interlaboratory agreement, the essential agreement, and the categorical agreement between the Sensititre YeastOneTM panel and the reference methods M27 4th Edition of the Clinical and Laboratory Standards Institute (CLSI), and the EDef 7.3.1 of the European Committee on Antifungal Susceptibility Testing (EUCAST). We studied 67 Candida strains isolated from different clinical samples and 9 Candida strains with resistance to fluconazole and echinocandins. The highest percentage of interlaboratory agreement was observed with amphotericin B (96.8%), and the lowest percentage with voriconazole (77.2%). Caspofungin showed 5.8% of very major errors when compared with the CLSI reference method. For EUCAST, itraconazole, posaconazole, and anidulafungin showed high percentages of major errors: 17.6%, 18.1%, and 19.6%, respectively. Sensititre YeastOneTM is a reliable alternative, and easy to perform for detecting Candida species resistant to antifungal drugs, with some limitations for echinocandins. Results are comparable to those of the reference methods.
El Clinical and Laboratory Standards Institute (CLSI) y el European Committee on Antifungal Susceptibility Testing (EUCAST), en sus documentos M27-4.ª ed.4 y EDEF 7.3.12, respectivamente, publicaron una técnica de referencia de microdilución en caldo para Candida spp. y Cryptococcus neoformans. Ambos estándares son fiables y reproducibles; no obstante, los 2métodos son laboriosos y no aplicables para la rutina de la mayor parte de los laboratorios hospitalarios.
En los últimos años, se ha observado en Argentina la urgencia de especies fúngicas no sensibles o resistentes a los antifúngicos5,9,11,12,14. Frente a esta situación, los laboratorios asistenciales incrementaron el interés en realizar pruebas de sensibilidad a los antifúngicos mediante técnicas comerciales estandarizadas y reproducibles, de una manera rápida y fácil de aplicar en el trabajo cotidiano de los laboratorios hospitalarios.
Entre las distintas opciones disponibles en el mercado, el panel colorimétrico Sensititre YeastOneTM (Trek-Thermo Scientific™, Argentina) (SYO) permite determinar la concentración inhibitoria mínima (CIM) por microdilución en caldo. El panel puede ser usado para efectuar pruebas de sensibilidad en especies de Candida (y otras levaduras de rápido crecimiento), Cryptococcus spp. y Aspergillus spp. (https://www.thermofisher.com/). Se trata de una metodología de costo accesible, sencilla para realizar, y ofrece resultados confiables de la CIM de distintos antifúngicos en 24 h1,6.
En Argentina, es escasa la información referida a la utilidad del panel SYO para evaluar los aislados locales y a la concordancia de resultados entre este método y los métodos de referencia.
Los propósitos de este trabajo fueron: a) evaluar la utilidad del panel SYO para detectar especies de Candida de distinto origen clínico resistentes a los antifúngicos, y b) determinar los porcentajes de concordancia interlaboratorio (CI), concordancia esencial y concordancia categórica para los antifúngicos evaluados frente a los métodos de referencia.
Se realizó un estudio multicéntrico, de laboratorio, prospectivo, no poblacional, desde junio del 2016 hasta junio del 2017. Participaron 11 laboratorios clínicos distribuidos en la Ciudad Autónoma de Buenos Aires y en las provincias de Buenos Aires, Chaco, Córdoba y Santa Fe, y también el Laboratorio Antifúngicos, Departamento Micología, INEI ANLIS Dr. C. G. Malbrán (laboratorio de referencia nacional). Se estudiaron los siguientes microorganismos, aislados de distintas muestras clínicas: 17 Candida albicans sensu stricto (s. s.), 19 Candida parapsilosis sensu stricto, 16 Candida glabrata s. s., 8 Candida tropicalis, 3 Pichia kudriavzevii (en adelante Candida krusei), 2 Meyerozyma (Candida) guilliermondii y 2 Clavispora (Candida) lusitaniae.
Se incluyó, además, un panel compuesto por 3 cepas de C. glabrata s. s. que albergaban mutaciones en regiones «hot spot» de FKS1 y FKS2, con resistencia a las equinocandinas10, y 6 cepas de C. albicans s. s. que presentaban sobreexpresión de bombas de eflujo CDR y MDR, con resistencia a los azoles.
Las especies de Candida fueron identificadas por el sistema VITEK® 2 Compact (bioMerieux, Argentina) y por espectrometría de masas (MALDI-TOF MS) (MALDI Biotyper®, BrukerDaltonics®, Alemania, y VITEK® MS [bioMerieux, Argentina]).
En todos los ensayos se usaron las cepas control C. krusei ATCC 6258 y C. parapsilosis ATCC 22019. En cada laboratorio clínico se determinó la CIM con el panel SYO-Y010 (Trek-Thermo Scientific™); luego, las cepas fueron derivadas al laboratorio de referencia, donde se determinó la CIM según los documentos EDef. 7.3.1. del EUCAST2 y M27 4.ª ed. del CLSI4, y, además, con el panel SYO-Y010. La interpretación categórica de los resultados se realizó de acuerdo con los puntos de corte especie-específicos definidos en los documentos Antifungal Break point v. 10.08 y M60 2.ª ed.3 del EUCAST y CLSI, respectivamente.
Se evaluaron los siguientes antifúngicos: anfotericina B, fluconazol, itraconazol, flucitosina, posaconazol y caspofungina (Merck, Argentina), voriconazol y anidulafungina (Pfizer, Argentina) y micafungina (Raffo-Astellas, Argentina). La lectura de los resultados se realizó con espectrofotómetro (EUCAST) o visualmente (CLSI). La lectura de la CIM con el panel SYO fue visual; se determinó el cambio de color, no se leyó turbidez.
Se calculó el porcentaje de:
- a.
CI: concordancia categórica entre el laboratorio clínico y el laboratorio de referencia.
- b.
Concordancia esencial: cuando el valor numérico obtenido por el método de referencia y por SYO fue el mismo o±2 diluciones6.
- c.
Concordancia categórica: coincidencia de la categoría interpretativa entre el método de referencia y SYO para las especies y antifúngicos que cuentan con puntos de corte clínico.
Cuando no hubo coincidencia, se asignaron las siguientes discrepancias:
- –
Discrepancia muymayor: cuando la levadura fue categorizada como resistente por el método de referencia y como sensible por SYO.
- –
Discrepancia mayor: cuando la levadura fue categorizada como sensible por el método de dilución y como resistente por SYO.
- –
Discrepancia menor: cuando la levadura fue categorizada como sensible o resistente por el método de dilución y como sensible dependiente de dosis o viceversa por SYO.
En la figura 1 a y b se muestra un círculo en el punto de lectura de CIM 0,06mg/l para la misma cepa en estudio frente al voriconazol en una placa de microdilución y en una placa SYO, respectivamente.
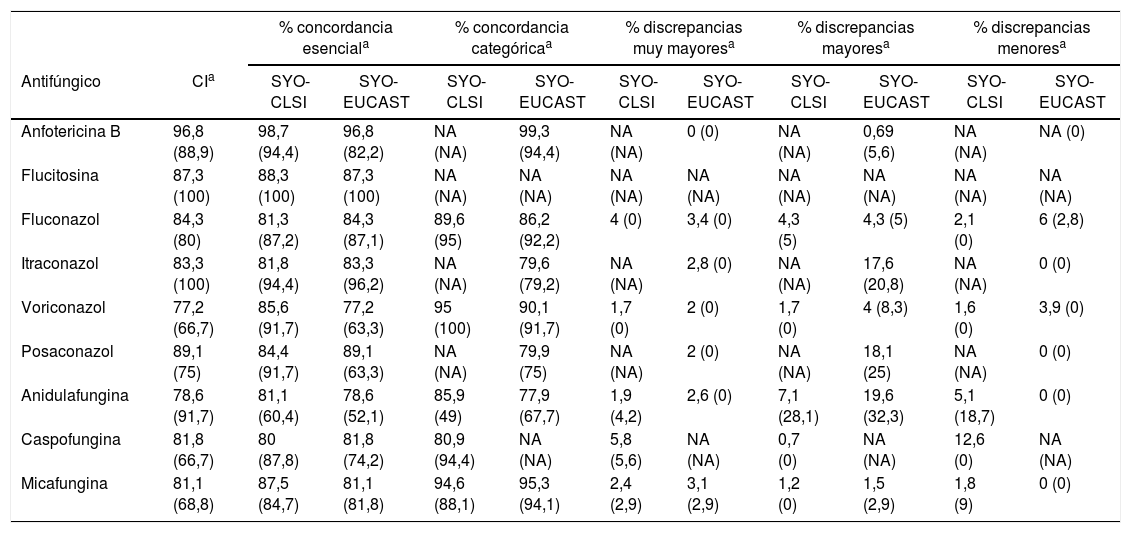
En la tabla 1 se puede ver que el rango de CI fue superior al 80% para la mayoría de los antifúngicos. El mayor porcentaje de concordancia se observó con anfotericina B (96,8%), mientras que el menor correspondió al voriconazol (77,2%).
Porcentaje de concordancias y discrepancias entre los métodos de referencia y SYO
| % concordancia esenciala | % concordancia categóricaa | % discrepancias muy mayoresa | % discrepancias mayoresa | % discrepancias menoresa | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Antifúngico | CIa | SYO-CLSI | SYO-EUCAST | SYO-CLSI | SYO-EUCAST | SYO-CLSI | SYO-EUCAST | SYO-CLSI | SYO-EUCAST | SYO-CLSI | SYO-EUCAST |
| Anfotericina B | 96,8 (88,9) | 98,7 (94,4) | 96,8 (82,2) | NA (NA) | 99,3 (94,4) | NA (NA) | 0 (0) | NA (NA) | 0,69 (5,6) | NA (NA) | NA (0) |
| Flucitosina | 87,3 (100) | 88,3 (100) | 87,3 (100) | NA (NA) | NA (NA) | NA (NA) | NA (NA) | NA (NA) | NA (NA) | NA (NA) | NA (NA) |
| Fluconazol | 84,3 (80) | 81,3 (87,2) | 84,3 (87,1) | 89,6 (95) | 86,2 (92,2) | 4 (0) | 3,4 (0) | 4,3 (5) | 4,3 (5) | 2,1 (0) | 6 (2,8) |
| Itraconazol | 83,3 (100) | 81,8 (94,4) | 83,3 (96,2) | NA (NA) | 79,6 (79,2) | NA (NA) | 2,8 (0) | NA (NA) | 17,6 (20,8) | NA (NA) | 0 (0) |
| Voriconazol | 77,2 (66,7) | 85,6 (91,7) | 77,2 (63,3) | 95 (100) | 90,1 (91,7) | 1,7 (0) | 2 (0) | 1,7 (0) | 4 (8,3) | 1,6 (0) | 3,9 (0) |
| Posaconazol | 89,1 (75) | 84,4 (91,7) | 89,1 (63,3) | NA (NA) | 79,9 (75) | NA (NA) | 2 (0) | NA (NA) | 18,1 (25) | NA (NA) | 0 (0) |
| Anidulafungina | 78,6 (91,7) | 81,1 (60,4) | 78,6 (52,1) | 85,9 (49) | 77,9 (67,7) | 1,9 (4,2) | 2,6 (0) | 7,1 (28,1) | 19,6 (32,3) | 5,1 (18,7) | 0 (0) |
| Caspofungina | 81,8 (66,7) | 80 (87,8) | 81,8 (74,2) | 80,9 (94,4) | NA (NA) | 5,8 (5,6) | NA (NA) | 0,7 (0) | NA (NA) | 12,6 (0) | NA (NA) |
| Micafungina | 81,1 (68,8) | 87,5 (84,7) | 81,1 (81,8) | 94,6 (88,1) | 95,3 (94,1) | 2,4 (2,9) | 3,1 (2,9) | 1,2 (0) | 1,5 (2,9) | 1,8 (9) | 0 (0) |
CI: concordancia interlaboratorio±2 diluciones; SYO: Sensititre YeastOneTM, NA: no aplica; CLSI: Clinical and Laboratory Standards Institute; EUCAST: European Committee on Antifungal Susceptibility Testing.
El porcentaje de discrepancias muy mayores fue ≤ 4% para todos los antifúngicos, tanto respecto del método de referencia del CLSI como del EUCAST, a excepción de la caspofungina, que resultó la fármaco con el mayor porcentaje de discrepancias muy mayores (5,8%) cuando se la comparó con el método de referencia publicado por el CLSI.
Comparados con el método de referencia del EUCAST, el itraconazol, el posaconazol y la anidulafungina mostraron los porcentajes más elevados de discrepancias mayores: el 17,6, el 18,1 y el 19,6%, respectivamente (tabla 1).
Al evaluar con las placas SYO el panel de cepas con mutaciones confirmadas molecularmente, obtuvimos concordancia categórica en un rango del 79,2 al 100% para todos los antifúngicos excepto la anidulafungina, que presentó un rango menor (49-67,7%) (tabla 1). En este panel de cepas, la caspofungina mostró el mayor porcentaje de aislados con discrepancias muy mayores (5,6%).
La aparición en el mercado del panel SYO ofrece la posibilidad de detectar resistencia a distintos antifúngicos en levaduras de importancia clínica (Candida spp., C. neoformans) en 18-24h. La técnica es sencilla de realizar, fácil de interpretar y no requiere equipamiento ni insumos adicionales1,6.
En Argentina no hay experiencia documentada sobre la utilidad y la concordancia del panel SYO con los métodos de referencia. En el presente trabajo se evaluaron especies de Candida y se calcularon los porcentajes de concordancia entre los resultados obtenidos con el panel SYO y los métodos de referencia del CLSI y del EUCAST.
El porcentaje general de concordancia esencial respecto de los métodos de referencia propuestos por el CLSI y el EUCAST fue aceptable, del 80-98,7% y el 77,2-96,8%, respectivamente. Esta valoración permitió comprobar la precisión de los ensayos en los laboratorios participantes.
Con respecto a la concordancia categórica con los métodos de referencia, los porcentajes obtenidos para la anfotericina B respecto del método del EUCAST (99,3%) y para el voriconazol respecto de los métodos del EUCAST y el CLSI (el 90,1 y el 95%, respectivamente) fueron similares a los resultados presentados por Cuenca-Estrella et al.6.
Con las equinocandinas, observamos algunas diferencias en los porcentajes de concordancia categórica según el fármaco evaluado. Así, los resultados fueron similares a los presentados por otros autores en relación con la micafungina1,13, con valores de concordancia categórica mayores del 90%. Asimismo, coincidimos con Pfaller et al.13, al señalar que la caspofungina fue el antifúngico con más discrepancias muy mayores. Es posible que estas discrepancias se deban a que la caspofungina es un fármaco que precipita en la microplaca e interfiere en la lectura e interpretación de los resultados. El CLSI y el EUCAST indican que la evaluación de la sensibilidad a esta equinocandina no debería realizarse de manera rutinaria debido a la gran variabilidad en los resultados observados in vitro2,4.
Por el contrario, a diferencia de lo comunicado por Aigner et al.1 y Pfaller et al.13, al comparar los resultados de anidulafungina, obtuvimos un porcentaje elevado de discrepancias mayores (7,1-19,6%).
Es importante resaltar que, al evaluar el panel de cepas resistentes al fluconazol y a las equinocandinas molecularmente confirmadas10, el panel SYO fue capaz de detectar la resistencia a fluconazol con una concordancia categórica del 92,2-95% y a micafungina y caspofungina con una concordancia categórica mayor del 94%, aunque no resultó eficaz con la anidulafungina, que fue el fármaco que mostró el menor porcentaje (49-67,7%). Nuestros resultados coinciden con los presentados por Espinel-Ingroff et al.7, con similares porcentajes de concordancia para la caspofungina y la micafungina, y menor concordancia para la anidulafungina.
Antes de implementar un equipo comercial para detectar la sensibilidad a los antifúngicos en los laboratorios asistenciales es importante conocer no solo el porcentaje de concordancia esencial con los métodos de referencia, sino también el porcentaje de concordancia categórica, ya que es una valoración utilizada para clasificar a los aislados en las categorías de «sensible» o «resistente». Estas categorías son una herramienta de utilidad para los profesionales al momento de elegir el tratamiento más adecuado.
El panel SYO es una alternativa útil y confiable para detectar aislamientos clínicos de Candida resistentes a los antifúngicos; además, es fácil de utilizar en los laboratorios clínicos y arroja resultados de interpretación sencilla y equiparable a los que arrojan los métodos de referencia.
Conflicto de interesesLos autores declaran que no tienen conflicto de intereses.
Los autores agradecen la asistencia técnica de Agustina Forastiero, Wanda Szusz, Walter Vivot y Florencia Rojas.
Alicia Arechavala, Hospital Muñiz, Ciudad Autónoma de Buenos Aires; Susana Carnovale, Centro de Micología, Facultad de Medicina, Universidad de Buenos Aires, Ciudad Autónoma de Buenos Aires; Cristina Canteros, Departamento Micología, Instituto Nacional de Enfermedades Infecciosas Dr. C. Malbrán, Ciudad Autónoma de Buenos Aires; Silvia Relloso, Centro de Educación Médica e Investigaciones Clínicas Norberto Quirno, Buenos Aires; Viviana Flores, Hospital Italiano de Buenos Aires, Ciudad Autónoma de Buenos Aires; Gabriela Santiso, Hospital Muñiz, Ciudad Autónoma de Buenos Aires; Julian Serrano, Hospital Independencia, Santiago del Estero, Argentina.