El herpesvirus bovino 4 [Bovine herpesvirus 4 (BoHV-4)] ha sido aislado de bovinos con infecciones respiratorias, vulvovaginitis, mastitis, abortos, endometritis y de animales aparentemente sanos en diferentes partes del mundo. Si bien no se ha reconocido como agente causal de una entidad patológica en particular, se asocia principalmente con infecciones del tracto reproductivo de los bovinos. Este virus puede infectar un amplio rango de especies tanto in vivo como in vitro. Los primeros aislamientos dieron origen a dos grupos de cepas prototipo: el grupo americano tipo DN599 y el grupo europeo tipo Movar. En Argentina, el BoHV-4 fue aislado y caracterizado en el año 2007; este aislamiento se obtuvo de muestras de mucus cérvico-vaginal de vacas que abortaron. Hasta el momento se han registrado más de 40 aislamientos, provenientes principalmente de hembras bovinas que han abortado.
Bovine herpesvirus 4 (BoHV-4) has been isolated from cattle with respiratory infections, vulvovaginitis, mastitis, abortions, endometritis and from apparently healthy animals throughout the world. Although it has not yet been established as causal agent of a specific disease entity, it is primarily associated with reproductive disorders of cattle. This virus can infect a wide range of species, either in vivo or in vitro. Two groups of prototype strains were originated from the first isolates: the DN599-type strains (American group) and the Movar-type strains (European group). In Argentina, BoHV-4 was isolated and characterized in 2007 from vaginal discharge samples taken from cows that had aborted. So far, more than 40 isolates, mainly associated with aborting bovine females have been registered in our country.
El herpesvirus bovino 4 [Bovine herpesvirus 4 (BoHV-4)] pertenece a la familia Herpesviridae y presenta marcadas diferencias con otros herpesvirus bovinos. El BoHV-4ha sido aislado en una amplia variedad de casos clínicos, así como de animales aparentemente sanos, en diferentes partes del mundo6,7,23,51,69,75,88. Si bien no se ha reconocido como agente causal de una entidad patológica específica, se asocia mayormente con infecciones del tracto reproductivo de los bovinos, particularmente durante el período posparto17. Aunque se detecta principalmente en el ganado bovino, también se ha identificado en otras especies, incluso no rumiantes, domésticas y silvestres20,38,54,56,59,73.
Los primeros aislamientos de bovinos con enfermedad respiratoria, obtenidos por Bartha en Hungría en 1963, y Mohanty en Estados Unidos en 1971, dieron origen a dos grupos considerados inicialmente como prototipos. Más tarde se identificó una extensa variedad de cepas, lo que revela la capacidad de variabilidad que posee este virus y, por ende, su complejidad, tanto biológica como epidemiológica13,21,58,75,86.
En nuestro país, este agente viral era prácticamente desconocido hasta su detección e identificación en 2007, en muestras provenientes de vacas que abortaron85. A partir de esa fecha el número de aislamientos ha ido en aumento, junto con la aparición de variantes virales que difieren filogenéticamente de las cepas prototipo americana y europea86.
El propósito de este artículo es brindar una visión general y actualizada sobre las características biológicas del BoHV-4 y su presencia en Argentina.
Clasificación y composición de la partícula viralEl BoHV-4 es un miembro de la familia Herpesviridae (orden Herpesvirales), subfamilia Gammaherpesvirinae. Inicialmente considerado como un citomegalovirus, fue clasificado luego dentro del género Rhadinovirus dada la actividad de la timidina quinasa y las semejanzas genómicas con otros virus de este subgrupo, como el herpesvirus saimiriine [Saimiriine herpesvirus 2 (SaHV-2)]61, el herpesvirus humano 8 [Human herpesvirus 8 (HHV-8)] o virus del sarcoma de Kaposi y el herpesvirus murino 4 [Murid herpesvirus 4 (MuHV-4)]. La clasificación taxonómica del orden Herpesvirales se muestra en la tabla 1.
Los gammaherpesvirus se caracterizan por su capacidad de replicar en células linfoides, donde pueden establecer latencia27. Los diferentes miembros de la familia pueden infectar específicamente a los linfocitos T o B. Algunos gammaherpesvirus producen transformación oncogénica de los linfocitos, como el virus de Epstein-Barr [Epstein-Barr virus (EBV)] o herpesvirus humano 4 (Human herpesvirus 4), mientras que otros causan infecciones citocídicas en células epiteliales y fibroblásticas.
El genoma del BoHV-4 consiste en una molécula de ADN lineal bicatenario que contiene aproximadamente 144±6kb, y está compuesto por una región central (región larga única codificante o LUR) de aproximadamente 108kb, con bajo contenido de G+C, flanqueada en ambos extremos por repeticiones múltiples de alto contenido de G+C llamadas ADN polirrepetitivo (prDNA)91. La longitud del prDNA generalmente es específica para cada cepa, aunque puede variar dentro de una misma cepa; estas diferencias se deben a la presencia de un número variable de fragmentos de 200 pb dentro del prDNA, que constituyen importantes sitios de recombinación (hot spots)11. Se ha determinado que algunas de estas secuencias polirrepetitivas intervienen en el proceso de escisión y empaquetamiento del genoma, y que pueden actuar como factor determinante del tamaño del genoma viral10.
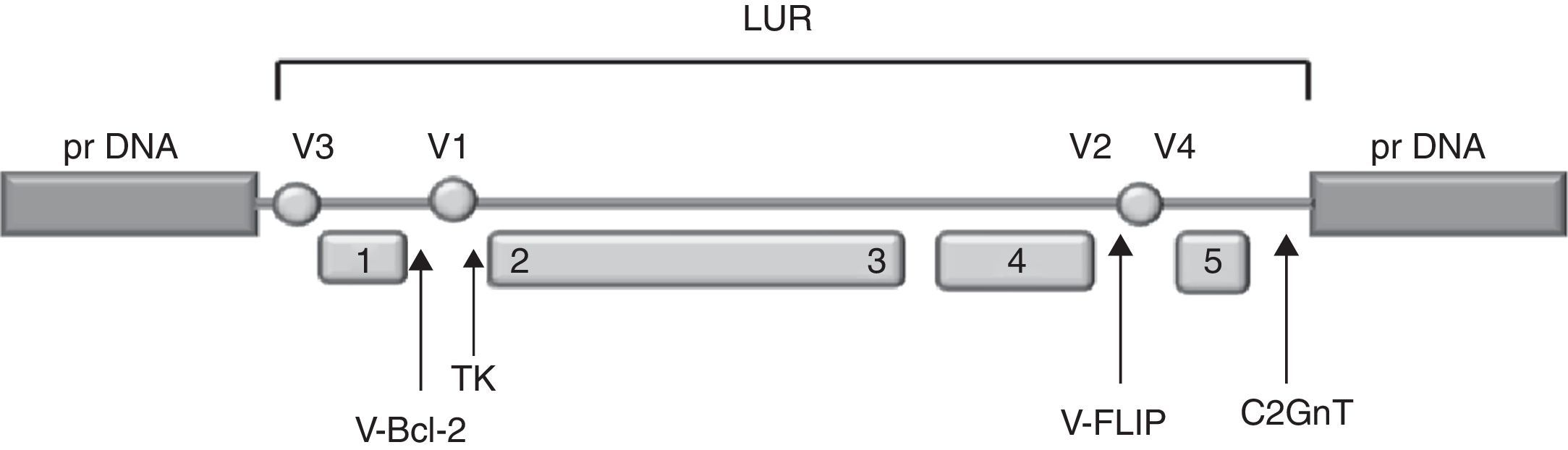
El genoma está organizado en cinco bloques de genes que se conservan entre los gammaherpesvirus, particularmente en los genomas del SaHV-2 y el EBV; entre los bloques se ubican genes específicos de cada virus en particular61 (fig. 1). El genoma viral contiene 79 marcos de lectura abierta u open reading frames (ORF); 62 de ellos comparten homología con los ORF del SaHV-2 y del HHV-8, y 17 son específicos del BoHV-4 (Bo1 a Bo17). El Bo17 codifica la β-1,6-N-acetilglucosaminiltransferasa (β-1,6GnT), que posee un 81,1% de similitud con la enzima humana. Hasta el momento no se conoce otro virus que posea este gen, que se expresa como un gen temprano, y si bien se ha sugerido que no sería esencial para la replicación viral in vitro, podría contribuir a las modificaciones postraduccionales de proteínas estructurales virales mediante la adición de glucanos. Se postula que estas modificaciones podrían provocar cambios en el tropismo o en la susceptibilidad del virus a la neutralización por anticuerpos o por el complemento, favoreciendo el mecanismo viral de evasión a la respuesta inmune68. Si bien el genoma del BoHV-4ha sido secuenciado completamente, se desconoce la función de la mayoría de sus genes30.
Organización genómica del BoHV-4. LUR: región larga única. prDNA: ADN polirrepetitivo. Los genes conservados de los herpesvirus se agrupan en 5 bloques (rectángulos 1 a 5); los genes codificantes de la timidina quinasa (TK), de las proteínas antiapoptóticas (v-Bcl-2 y v-FLIP) y de la β-1,6-N-acetilglucosaminiltransferasa (C2GnT) están indicados por flechas. V1 a V4: regiones de secuencias variables según las cepas. Adaptada de Markine-Goriaynoff et al.67.
Como en otros herpesvirus, el material genético se encuentra contenido en una cápside de simetría icosahédrica formada por 162 capsómeros (150 hexámeros y 12 pentámeros). La nucleocápside viral tiene un diámetro de 90 a 100nm y se encuentra rodeada por una sustancia amorfa denominada tegumento, que contiene proteínas de regulación. La distribución del tegumento es asimétrica y su espesor varía dependiendo de la ubicación de la partícula viral dentro de la célula. Estas estructuras están cubiertas por una bicapa lipídica que presenta proyecciones glucoproteicas de 8nm sobre la superficie del virión55.
Estas características estructurales determinan que el BoHV-4 sea un virus sensible a compuestos químicos como el éter y el cloroformo. Su replicación puede ser inhibida por el bromuro de dioxiuridina a 0,1mM. Además presenta poca resistencia a pH bajo y puede ser inactivado a temperaturas de 50°C durante 30min y mediante el proceso de pasteurización9,67.
Origen y variabilidad viralSobre la base de los resultados de análisis filogenéticos se concluyó que el gen Bo17 del BoHV-4 fue adquirido de un antecesor del búfalo africano (Syncerus caffer caffer) un millón y medio de años atrás. Se estima que el BoHV-4 coevolucionó con el búfalo africano, hasta pasar al antecesor del ganado bovino (Bos primigenius) por un salto de especie, hace alrededor de 700 000 años. Posteriormente, unos 200 000 a 300 000 años atrás, se produjo la divergencia entre cepas del ganado bovino (Bos taurus) y el cebú (Bos indicus), en coincidencia con la separación de estas especies y antes de su domesticación, hace 10 000 años66.
El análisis de los ORF 16, Bo10, Bo17, ORF 71, ORF73 y de la región entre estos últimos (IG 71-73) del genoma de un conjunto de nueve cepas del BoHV-4 (las cepas 108, 130 y Buf, aisladas de búfalos africanos; las cepas bovinas europeas V. test, Movar y LVR 140; las cepas americanas DN599 de bovino y 66-p-347 de bisonte, y la cepa de cebú M40, de origen hindú) demostró que la cepa M40 presenta mayor porcentaje de divergencia (4,7% de divergencia sobre 4093 sitios comparados por análisis filogenético de las seis regiones estudiadas), con lo cual esta cepa queda ubicada en un cluster distinto al que ocupan las americanas, las europeas y las cepas de búfalo africano20, a diferencia de lo que ocurría en clasificaciones anteriores, basadas solamente en el análisis del Bo1766. Además, se postula que el proceso evolutivo del herpesvirus incluyó recombinaciones entre cepas divergentes, y que la evolución del gen Bo17 ocurrió independientemente de la evolución del genoma viral en su conjunto. La transmisión del BoHV-4 desde el búfalo africano al antecesor del ganado bovino no se produjo de manera directa, sino que probablemente ha involucrado a especies hospedadoras intermediarias, considerando que el Bos primigenius fue encontrado solo en Eurasia y África del Norte, mientras que el búfalo africano estaba restringido al África subsahariana20.
El primer aislamiento del BoHV-4 fue realizado por Bartha en Hungría en 1963, en terneros con signos clínicos de queratoconjuntivitis y enfermedad respiratoria4; posteriormente, el virus también fue aislado en Estados Unidos de bovinos con signos respiratorios70. A partir de estos aislamientos, mediante análisis con endonucleasas de restricción, se consideraron dos prototipos del BoHV-4: el tipo DN599, conformado por la mayoría de las cepas americanas, y el tipo Movar, que comprende las cepas europeas.
El BoHV-4 presenta variaciones genómicas, lo que ha sido demostrado en estudios genéticos de cepas de referencia de los grupos americanos (DN599 y 66-p-347) y europeos (V. test, LVR140 y Movar). En dichos estudios se identificaron importantes diferencias en al menos nueve ORF77,91, en presencia o ausencia de sitios para las enzimas de restricción EcoRI y BamHI, y variaciones en la longitud de los segmentos de prDNA11. Además se ha observado variabilidad entre aislamientos de regiones diferentes y emergencia de nuevas cepas, cuyos patrones de restricción no se corresponden completamente con los prototipos mencionados previamente. Esta variabilidad sería el resultado de eventos de recombinación entre cepas y dentro de una misma cepa, principalmente en las regiones de prDNA localizadas a ambos lados de la región única, durante la replicación viral13,21,58,75,86.
EpidemiologíaEn contraste con la mayoría de los gammaherpesvirus, el BoHV-4 presenta la capacidad de replicar en un amplio rango de especies48, entre las que se encuentran el bisonte americano, el búfalo africano, diferentes especies de ciervos, cabras, ovejas, especies no rumiantes como el león, el gato doméstico y el conejo20,38,45,54,56,59,73, y una gran variedad de cultivos celulares incluyendo líneas celulares y cultivos primarios de células de bovino, ovino, caprino, canino, felino, porcino, conejo y pollo, así como en varias líneas celulares de humano26,39,49,58.
Los herpesvirus pueden transmitirse por vía horizontal y vertical41. La transmisión horizontal ocurre por contacto directo e indirecto mediante secreciones y fómites. El principal modo de transmisión del BoHV-4 aún no ha sido establecido con certeza; hay evidencias experimentales de excreción viral intermitente y detección de ADN viral en leche23,51,90. Aunque los datos sobre aislamiento y detección de virus en semen son escasos17,41,72,76, se comprobó la transmisión de cepas endometriotrópicas europeas por esta vía47.
En el caso particular del BoHV-4, la respuesta inmune se caracteriza por la escasa producción de anticuerpos neutralizantes con baja avidez; estos bajos niveles de anticuerpos en la leche y en el calostro de vacas infectadas podrían favorecer la transmisión del virus a los terneros en lactancia, y si bien estos virus son fácilmente inactivados por la acción de la luz solar o por deshidratación fuera del organismo, la leche representaría un potencial vehículo para la transmisión y diseminación viral23.
El BoHV-4ha sido aislado tanto de bovinos sanos como de ejemplares con una amplia variedad de signos clínicos (conjuntivitis, enfermedad respiratoria, vaginitis, metritis, linfosarcoma, dermatitis, endometritis supurativa posparto, mastitis) en diferentes partes del mundo7,21,51,69,75. También se ha detectado alto nivel de infección por BoHV-4 en bovinos lecheros con repetición de celo53. Asimismo, se aisló el virus del semen de toros normales60 y durante la elaboración de cultivos celulares con tejidos provenientes de bovinos aparentemente sanos55.
En los países donde el virus se ha detectado, la prevalencia en general es baja: la seropositividad varía del 16 al 30%, con bajos títulos de anticuerpos neutralizantes (1:8 a 1:64)1,47. Se detecta una mayor frecuencia de seropositivos en los animales de mayor edad y en hembras con respecto a los machos42,89. Algunos trabajos informan valores de prevalencia superiores al 50%6,73,75, particularmente en bovinos con problemas reproductivos53. También se ha detectado serología positiva en gatos de ciudad56 y de establecimientos con presencia de bovinos infectados47.
Estudios serológicos realizados en búfalos africanos salvajes revelaron que esta especie exhibe una seroprevalencia de anticuerpos contra BoHV-4 de alrededor del 70%, lo cual representa un nivel muy superior al observado en la población de ganado bovino; además se detectó una alta frecuencia (25%) de aislamientos del virus en animales sanos de esta especie salvaje. Los búfalos comparten espacios naturales con otros rumiantes silvestres y con el ganado, lo que hace suponer una posible diseminación de estos hacia los bovinos; se estima que la alta prevalencia de la infección por BoHV-4 en la población de búfalos les conferiría protección contra el agente de la fiebre catarral maligna, el cual es letal para esta especie y para los bovinos. Algunos autores sugieren que si se consideraran las diferencias filogenéticas que ubican a las cepas del búfalo africano en un grupo diferente al conformado por las cepas bovinas y la mayor frecuencia de infección en esta especie con respecto a los bovinos, los aislamientos de cepas de búfalo africano deberían ser reclasificados como un virus de búfalo, bajo el nombre de syncerine herpesvirus 166. Estas observaciones, sumadas a estudios filogenéticos sobre el gen Bo17 del BoHV-4, refuerzan la hipótesis de que el búfalo africano (o uno de sus ancestros) sería la especie hospedadora original20.
Infección y tropismo viralEl BoHV-4 puede producir diferentes tipos de infecciones dependiendo, entre otros factores, del grado de permisividad de la célula infectada. Es así que pueden identificarse diferentes dinámicas de infección: a) la infección no productiva, en la que las células infectadas producen bajos niveles de ARN viral temprano y tardío sin producción de efecto citopático (ECP); b) la infección productiva, que está caracterizada por un marcado ECP, abundante replicación viral y altos niveles de producción de virus infeccioso; c) la infección persistente, en la que, según ciertas evidencias, las células permisivas que sobreviven a una infección productiva inicial pueden mantener el genoma viral durante varios pasajes produciendo bajos niveles de virus infeccioso con diferentes efectos sobre las células infectadas, dependiendo de la naturaleza de aquellas1,22,24,48,58; y d) la infección latente, que se caracteriza por un estado de inactividad asociado al mantenimiento del genoma viral en forma episómica en el núcleo de las células infectadas.
Aunque se ha demostrado que el BoHV-4 puede infectar una variedad de tejidos, la mayoría de las evidencias sugieren que uno de los sitios de persistencia, tanto en los hospedadores naturales como en modelos experimentales, son las células de la línea monocitos/macrófagos37,40,45,63. La infección en los linfocitos frecuentemente queda detenida en un estadio prelítico, con persistencia y mínima expresión del genoma viral55.
La distribución in vivo del BoHV-4 se investigó mediante infecciones experimentales en diferentes modelos animales. En terneros infectados por vía intranasal, intratraqueal e intravenosa con cepas Movar 33/63, DN599 y B11-41, el virus fue aislado de hisopados nasales y conjuntivales, y se pudo detectar el genoma viral en cerebro, médula, ganglio trigémino, linfocitos, corazón, pulmón y bazo de terneros1,37,63. En un ensayo realizado en vacas gestantes inoculadas por vía intravenosa con la cepa LVR140, se aisló el virus en muestras de útero y loquios y de linfonódulos ilíacos, mediastínicos y cervical superficial (prescapular) después del parto88. El virus también se aisló y detectó por PCR en leche de vacas inoculadas por vía intramamaria con la cepa holandesa de origen bovino Tolakker90.
En estudios realizados en conejos, cobayos y gatos inoculados con las cepas HB420 de origen felino, 86-068 y Movar por vía intranasal, ocular, intraperitoneal e intravenosa se observaron manifestaciones clínicas respiratorias, principalmente en gatos; se aisló el virus de hisopados nasales y oculares y se detectó la presencia viral en linfonódulos, bazo, pulmón, hígado, glándulas salivales y tejidos fetales38,63,74. En ratones inoculados con recombinantes del BoHV-4 por vía intracerebral no se observó replicación viral en células del cerebro79,80.
Con respecto al análisis de infecciones naturales, se ha detectado la presencia de ADN viral y se ha aislado el virus en células epiteliales de los conductos mamarios y en leche de vacas con mastitis51,69,90, y en la fracción celular de leche de vacas serológicamente positivas, con confirmación de la infección productiva de dichas células mediante cocultivo con una línea celular de endotelio arterial bovino (BAE). Si bien no pudo determinarse el tipo de células portadoras del virus, es factible que la presencia de este en leche se deba al transporte por circulación sanguínea o linfática23, considerando que el BoHV-4 puede establecer infección persistente en tejidos linfoides y viremia asociada a la infección de linfocitos37,40. Se ha identificado el ADN viral también en el epitelio de placentas bovinas y tejidos de fetos abortados, en linfocitos y monocitos esplénicos, en células del epitelio tubular renal y en células hepáticas, en hígado, tráquea y epitelio nasal, así como en linfonódulos mesentéricos, tonsilas, timo, riñones y linfocitos de sangre periférica en bovinos que no presentaban signos clínicos de infección por BoHV-41,18,19,41. También se ha detectado en tejidos del sistema nervioso central y ganglio trigémino de bovinos con infección natural14,16.
Patogenia en el endometrioDiversos estudios han asociado al BoHV-4 con enfermedad uterina posparto en bovinos47,75,82,88. El virus presenta tropismo por las células endometriales y produce la muerte de células epiteliales y del estroma28,29. Sin embargo, la infección sería más eficiente en las células del estroma, en las cuales el ECP es mayor y se produce más rápidamente: este se inicia a las 24h posinfección y se completa a las 48h, mientras que en las células epiteliales estos parámetros se presentan a las 48 y 72h.
La eficiente replicación del virus en las células endometriales ha sido atribuida a eventos posingreso, que incluyen una potente transactivación del promotor de gen inmediato temprano 2 (IE2) mediada por un pool de factores celulares de transcripción28. También se deben considerar ciertos estímulos extracelulares asociados al microambiente intrauterino, como el lipopolisacárido (LPS) de Escherichia coli y la prostaglandina E (PGE)29,30.
La infección por el BoHV-4 estimula la secreción de la PGE en las células endometriales; esta prostaglandina es un mediador de la respuesta inflamatoria en infecciones bacterianas y desempeña una función importante en la reactivación seguida de replicación lítica del BoHV-4. La asociación de este virus con otros patógenos en los casos de metritis ha sido demostrada, por lo tanto, la metritis bacteriana en el ganado persistentemente infectado con el BoHV-4 podría ser exacerbada por el reclutamiento de macrófagos persistentemente infectados al sitio de la inflamación27,28. A su vez, la endometritis bacteriana conduciría a la secreción de PGE y, consecuentemente, a la estimulación de la replicación viral por PGE y LPS, lo cual causaría el posterior daño en el tejido endometrial y la inflamación82.
En experimentos in vitro se demostró que el factor de necrosis tumoral alfa (TNF-α) producido por macrófagos estimulados por el LPS induce la expresión del gen inmediato temprano IE2 del BoHV-4, cuyo producto (ORF50/Rta) transactiva al promotor del gen de la interleuquina 8 (IL8), quimioquina asociada a la atracción de neutrófilos en procesos inflamatorios durante la infección de células epiteliales y del estroma endometrial. Estos resultados pueden representar un mecanismo de defensa del hospedador a la infección viral o un mecanismo de virulencia mediante el cual la replicación viral estimula la producción de una quimioquina que atrae más células susceptibles al sitio de infección32,52.
En condiciones fisiológicas, las células epiteliales uterinas de bovino producen principalmente PGF2α, mientras que las células del estroma secretan mayor cantidad de PGE2,46. Se investigó la capacidad de estas células para producir prostaglandinas después de ser desafiadas con BoHV-4. Las células epiteliales no produjeron PGE en respuesta a la infección; sin embargo, la infección con bajas dosis del virus llevó al aumento de la producción de PGE en las células del estroma28.
La manifestación de los trastornos en el endometrio asociados a BoHV-4 involucraría tres factores: la exposición al virus, la colonización bacteriana del útero a través del cérvix abierto y la existencia de algún grado de disturbio metabólico o inmunosupresión; estos conducirían al desarrollo de la patogenicidad viral o reactivación desde el estado de latencia.
Durante la necropsia de bovinos con manifestaciones de endometritis entre los 3 y 28 días posparto se observó necrosis y ulceración del epitelio endometrial con inflamación leve en la lámina propia y en la submucosa (días 3 a 7) así como úlceras confluentes a difusas (1 a 4 semanas) y presencia de una lámina supurativa fibrinonecrótica en reemplazo del epitelio endometrial47, además de degeneración con descamación de células epiteliales en tejido mamario69. También se logró aislar el virus a partir de muestras de hígado de animales con endometritis en los que se evidenciaron lesiones hepáticas88, y se ha observado un alto porcentaje de animales con evidencias de lipidosis hepática moderada a grave. La presencia de enfermedad hepática concurrente en la gran mayoría de los casos justifica posteriores investigaciones. El ganado lechero con infección endémica por BoHV-4 y con una alta incidencia de enfermedades metabólicas o nutricionales crónicas probablemente presente mayor incidencia de metritis y piometra asociadas al virus47.
LatenciaEl fenómeno de latencia y reactivación de los herpesvirus ha sido profundamente estudiado, particularmente en los alfaherpesvirus, aunque el mecanismo exacto que determina el establecimiento, el mantenimiento y la reactivación de la latencia no ha sido completamente caracterizado55. De todos modos, diferentes trabajos han demostrado la producción de infecciones latentes y/o persistentes por el BoHV-415,24,26,35,58.
El ORF 73 de los rhadinovirus codifica una proteína multifuncional esencial para la latencia, la cual posibilita la asociación del episoma en cromosomas mitóticos y modula las vías celulares implicadas en los procesos de crecimiento y supervivencia de las células con infección latente. Este ORF es transcrito como un ARNm policistrónico inmediatamente temprano junto con el ORF 71. Se ha demostrado que la supresión del ORF 73 no afecta la capacidad del virus para replicar in vitro, pero su ausencia impide la producción de la infección latente en el modelo conejo. Esta propiedad derivada de la deleción del ORF 73 podría ser de utilidad en el uso del BoHV-4 como vector en la formulación de vacunas84.
Algunos resultados experimentales sugieren la posible integración del genoma del BoHV-4 en el genoma de células con infección persistente, evidenciándose la coexistencia de ADN viral integrado y episómico. De todos modos, aún no se demostró la existencia de esta condición in vivo y se desconoce si la integración ocurre en sitios específicos o al azar33.
La latencia se define como una infección que persiste de por vida en el hospedador, con replicaciones virales restringidas pero recurrentes, lo que puede derivar en la diseminación y transmisión viral, así como en el mantenimiento de una respuesta inmune detectable a nivel poblacional. La diseminación viral mediante secreciones nasales, orales o genitales representa una fuente de infección para otros animales, incluso para la transferencia desde las hembras preñadas al feto. Por lo tanto, los hospedadores latentemente infectados son fuentes potenciales de transmisión viral. Diferentes estímulos pueden cambiar el estado de latencia al de una infección productiva, fenómeno conocido como reactivación. Esta situación generalmente está asociada al estrés causado por las infecciones intercurrentes, el transporte, las condiciones inapropiadas de manejo o la administración de glucocorticoides55.
La reactivación viral en las infecciones por BoHV-4ha sido demostrada experimentalmente en bovinos inoculados por diferentes vías (nasal e intratesticular), en los que se comprobó que después de la infección inicial, generalmente asintomática, se produce un estadio de latencia. El virus latente se pudo reactivar después de la aplicación de glucocorticoides, y se efectuaron aislamientos a partir de células mononucleares, hisopados nasales, tejido nervioso, pulmón, bazo y células testiculares15,35.
ApoptosisLa apoptosis o muerte celular programada es un proceso ordenado por el cual las células experimentan una autodestrucción sistemática en respuesta a una variedad de estímulos o factores, tanto extracelulares como intracelulares. En el caso de las células infectadas por virus, la inducción de la muerte celular temprana actuaría como una respuesta no específica del organismo para limitar la replicación viral y reducir o eliminar la diseminación del virus en el hospedador, constituyendo de esta manera un mecanismo de control natural de los focos de infección.
Los virus, en su proceso evolutivo, han desarrollado mecanismos específicos para eludir las defensas del hospedador utilizando diferentes estrategias. Así, algunos virus codifican factores inhibitorios de la apoptosis durante la infección, a los efectos de prolongar la viabilidad celular para lograr una mayor producción de progenie viral, mientras que otros virus inducen la apoptosis, lo que favorece la diseminación de las partículas virales englobadas en los cuerpos apoptóticos al ser fagocitadas por células vecinas83. Asimismo, hay evidencias que indican que otros herpesvirus (EBV, citomegalovirus humano) portarían simultáneamente genes que pueden tanto inhibir como inducir la apoptosis. Aparentemente, la inducción de la apoptosis sería un evento favorable durante los estadios tardíos del ciclo replicativo viral, mientras que la inhibición de la apoptosis podría ser un paso importante en la transición a la fase de latencia. Por lo tanto, los cambios de la fase de latencia a la fase lítica serían dependientes de la regulación de la apoptosis83.
Algunos virus, entre ellos los gammaherpesvirus EBV, SaHV-2, γHV68, KSHV y BoHV-4, codifican un homólogo del gen proapoptótico celular Bcl-2. Estos homólogos virales difieren de su contraparte celular en sus efectos sobre la viabilidad celular. Aparentemente, el Bcl-2 de los herpesvirus ha conservado la actividad antiapoptótica sin mantener la función proapoptótica de sus homólogos celulares, de los cuales probablemente ha derivado. Estas proteínas virales podrían representar versiones antiapoptóticas constitutivamente activas que no serían transformadas en proteínas proapoptóticas, dado que escaparían a la escisión producida por las caspasas5. Se ha demostrado que el BoHV-4 porta un gen que codifica una proteína (BORFE2) que inhibe la apoptosis inducida por Fas y por el receptor 1 del factor de necrosis tumoral (TNFR1) mediante la interacción con la caspasa 887.
Si bien el BoHV-4 posee genes antiapoptóticos, se ha comprobado que el desarrollo completo del ciclo replicativo viral en células bovinas permisivas a la infección por este virus estaría asociado a una fase de apoptosis y no a un proceso lítico, y que la inducción de la apoptosis en células infectadas con BoHV-4 in vitro es dependiente también del inóculo viral y del tiempo de infección81.
Además de estas evidencias sobre el proceso de muerte celular programada, es interesante destacar que los resultados de un estudio reciente realizado en la línea celular Madin Darby bovine kidney (MDBK) sugieren que el BoHV-4 también induce el mecanismo de autofagia durante la fase tardía de la infección en células permisivas71. Sobre la base de esta información podría inferirse que el BoHV-4 podría actuar sobre este proceso a efectos de potenciar su replicación, a pesar de que la autofagia puede funcionar como un mecanismo antiviral.
Considerando estos aspectos, la disponibilidad de un modelo experimental para el estudio de la apoptosis in vitro podría ser de utilidad para analizar este mecanismo en función de la actividad biológica de diferentes cepas de BoHV-4.
Antigenicidad viral y respuesta inmuneEntre las 29 proteínas estructurales identificadas en el BoHV-4, existen tres grupos principales de glucoproteínas (gp)34. El primero es un complejo de tres glucoproteínas (150/120/51K) denominado gp6/gp10/gp17; el segundo está compuesto por una glucoproteína de 120kDa unida a un polipéptido no glucosilado de 16,5kDa, designado gp11/VP24; y el tercero es una glucoproteína denominada gp8. Estas glucoproteínas constituyen los principales antígenos del BoHV-4 y estarían involucradas en la unión del virus a la membrana celular.
En el complejo gp11/VP24 se identificaron seis epítopes localizados en dos dominios antigénicos adyacentes, los cuales estarían involucrados en el proceso de neutralización viral, mientras que en el complejo mayor se han identificado once epítopes que se localizan en cinco dominios antigénicos. La glucoproteína de 120kDa de este complejo sería la principal subunidad que induce la producción de anticuerpos neutralizantes, mientras que los epítopes localizados en la subunidad 51K tienen actividad débil o nula en la neutralización del virus36.
Otros trabajos realizados con la cepa DN599 revelaron la presencia de dos complejos multiméricos, aunque con una composición mayor de glucoproteínas. El primero, de más de 300kDa, estaría compuesto por seis glucoproteínas (245, 190, 152, 123 y 48/46K); y el segundo estaría compuesto por dos familias de péptidos no glucosilados: el dímero 76/70 asociado a los monómeros de 33/31/30kDa57.
Los epítopes involucrados en la neutralización del BoHV-4 son conformacionales y los anticuerpos dirigidos contra ellos no reconocen a la mayoría de los aislamientos. Esto sugiere que los dominios antigénicos, que son el blanco de esos anticuerpos, podrían estar sujetos a la presión de selección del sistema inmune y estar pobremente expuestos a aquel, lo que explicaría la débil avidez de diversos anticuerpos monoclonales neutralizantes por esos dominios involucrados en el proceso de infectividad del BoHV-436.
La glucoproteína de envoltura gp 180, codificada por el Bo10, está conservada en todos los gammaherpesvirus. La gp 180 del BoHV-4 estaría involucrada en la unión del virus a los receptores celulares y jugaría un rol en el tropismo viral. Recientemente se ha demostrado que esta proteína provee un escudo de glucanos que enmascararía epítopes en las glucoproteínas virales gB, gH y gL contribuyendo así a evadir los anticuerpos neutralizantes64,65.
De lo expuesto se deduce que la respuesta inmune humoral en los bovinos infectados con BoHV-4 se caracteriza por baja eficiencia o bajos niveles de anticuerpos neutralizantes36. En infecciones experimentales realizadas en bovinos y en conejos se detectaron altos niveles de serología positiva por ELISA e immunoblotting; sin embargo, los resultados fueron negativos en la detección de anticuerpos neutralizantes mediante pruebas de neutralización viral1,43.
Hasta el momento no se dispone de estrategias para el control de la infección por el BoHV-4. Sin embargo, este virus presenta algunas características que lo hacen una herramienta interesante como potencial vector para la producción de vacunas: posee una estructura genómica menos compleja comparada con otros herpesvirus, lo que permitiría una inserción estable de información genética adicional en su genoma para la elaboración de recombinantes, es fácilmente reproducible en cultivos celulares, no produce enfermedades fatales en sus hospedadores naturales y se dispone de modelos animales para su experimentación91.
Recientemente se han obtenido resultados satisfactorios en estudios en los que se utilizó una cepa apatógena de BoHV-4 como vector de péptidos inmunogénicos de otros agentes virales (virus de la diarrea viral bovina y herpesvirus bovino 1)31, lo cual confirma la potencialidad de su utilización como herramienta biológica.
DiagnósticoSi bien el aislamiento viral en cultivos celulares es el método gold standard, en algunas circunstancias se ve dificultado por la variabilidad en la velocidad de replicación y de presentación del ECP según las diferentes cepas virales74. Entre los cultivos celulares utilizados para el aislamiento de este virus se mencionan líneas derivadas de células renales de bovino, como MDBK8,12,13, BEK (bovine embryo kidney)21, GBK (Georgia bovine kidney)13, otras líneas celulares como BAE (bovine arterial endothelial)41, BT (bovine turbinate)6, EBL (embryo bovine lung)37,63, BOMAC (bovine macrophage cells)24, y cultivos primarios de células de testículo bovino37.
La aparición del ECP producido por diferentes cepas puede demorar de 1 a 11 días, dependiendo de la línea celular utilizada, la cantidad de pasajes del virus y el estadio del ciclo celular. En general, se puede observar un número creciente de células diseminadas en la monocapa que presentan redondeamiento y agrandamiento; posteriormente se forman agregados de células y se produce el desprendimiento3,28 (fig. 2). En un ensayo realizado sobre células de embriones bovinos in vitro se observó degeneración y vacuolización celular25.
La presencia de antígeno viral puede evidenciarse mediante inmunofluorescencia: se observa una fluorescencia granular localizada en el núcleo al inicio de la infección celular; esta se disemina hacia zonas periféricas del citoplasma después de 24h de infección3 (fig. 3). La presencia de cuerpos de inclusión intranucleares puede demostrarse con tinciones de rutina (fig. 4).
La técnica de PCR simple o anidada, combinada con otras técnicas moleculares, es una de las más utilizadas para amplificar diferentes regiones del genoma viral, principalmente el gen de la timidina quinasa (TK) y el gen que codifica la glucoproteína B (gB). Esta glucoproteína presenta una mayor homología con la gB del EBV y del SaHV-2 que con la gB del resto de los herpesvirus50,62.
También se utilizan, principalmente en investigación, el análisis con enzimas de restricción, la hibridación del ADN y la secuenciación genómica de genes como TK, gB y ORF256,8,12,30,44,74,75,91. Mediante estas técnicas se ha logrado identificar un amplio rango de variaciones en cepas de BoHV-413,21,86.
Para el diagnóstico serológico, el método más utilizado es la prueba de ELISA, y en algunos casos la IF indirecta6,30,42,53,75. También se han realizado ensayos utilizando técnicas como la inmunoperoxidasa89 y el dot immunobinding assay43, con óptimos resultados.
La técnica de seroneutralización viral es otro de los aspectos controvertidos en el diagnóstico del BoHV-4. Como se mencionó anteriormente, la respuesta inmune humoral no resulta eficiente en los bovinos infectados; esta situación parece estar asociada a una deficiente exposición de los epítopes involucrados en el mecanismo de neutralización viral por anticuerpos debido a la presencia de una barrera de glucanos36,64.
Otro aspecto que se debe considerar en las variaciones de los niveles de seropositividad es que, generalmente, la detección de anticuerpos por seroneutralización en los animales con problemas reproductivos se realiza en situaciones de estrés como es el periparto (0 a 6 semanas posparto)41,47, dado que durante este período se presenta la manifestación clínica de la infección.
Considerando que la detección de anticuerpos con la técnica de seroneutralización puede dar un alto número de falsos negativos, sería aconsejable utilizar otras técnicas serológicas alternativas para el diagnóstico de laboratorio como herramienta para relevamiento en los rodeos.
Situación en ArgentinaEn Argentina, el BoHV-4 fue aislado y caracterizado molecularmente en el año 2007 por Verna et al.85 a partir de muestras de vacas que sufrieron abortos, las que fueron remitidas al Servicio de Diagnóstico Veterinario del INTA Balcarce. Las muestras procedían de establecimientos ganaderos de la provincia de Buenos Aires. Posteriormente se registraron nuevos casos en esta provincia, donde la principal problemática fue la presentación de abortos en hembras bovinas. El BoHV-4 también fue aislado de hisopados nasales, pulmón de bovinos con diversos cuadros clínicos y de semen congelado de un bovino procedente de un centro de reproducción de la provincia de Buenos Aires60,72.
Estos aislamientos, realizados por el Grupo de Virología del INTA Balcarce, se evidenciaron por su ECP en células MDBK y fueron confirmados mediante PCR y secuenciación. Verna et al.86 realizaron un estudio de filogenia del gen TK de 17 cepas aisladas de mucus cérvico-vaginal de hembras bovinas que abortaron, donde se observó un importante grado de variabilidad genómica entre las cepas circulantes. Estos aislamientos fueron comparados con las cepas de referencia Movar 33-63 y DN599, y el resultado de los análisis reveló la existencia de tres grupos diferentes, que fueron designados como genotipos 1, 2 y 3, además de dos cepas que no presentaban relación con ninguno de estos grupos. Las cepas de los genotipos 1 y 2 presentaron mayor similitud con los tipos europeo y americano, respectivamente. Los aislamientos clasificados como genotipo 3 no se correspondían con ninguno de los grupos anteriores, por lo que constituyeron una clasificación aparte. Estos resultados demuestran un aspecto epidemiológico complejo asociado probablemente a la deriva génica.
Durante el período 2011-2012 se aisló el BoHV4 a partir de células de la granulosa y ovocitos destinados a producción de embriones in vitro (Verna, comunicación personal). Este estudio reveló que existe la posibilidad de transmisión del virus por transferencia de embriones.
En un trabajo realizado en bovinos de establecimientos de producción lechera de la provincia de Santiago del Estero, se detectó la presencia del genoma viral en los leucocitos de una alta proporción de los animales analizados (63,4%), y se demostró mediante análisis por enzimas de restricción que las cepas circulantes en esta población bovina eran genéticamente divergentes del prototipo americano78.
En la actualidad se dispone de información acerca de más de 40 aislamientos de BoHV-4 en nuestro país; el 85% de estos aislamientos se realizaron a partir de muestras de mucus cérvico-vaginal de bovinos provenientes de distintas zonas agroecológicas de la provincia de Buenos Aires, y el resto se obtuvo de muestras provenientes de las provincias de Santa Fe, Córdoba y Salta (Verna, comunicación personal).
ConclusionesEl BoHV-4 está ampliamente distribuido a nivel mundial y ha sido aislado tanto de bovinos que presentaban una variedad de signos clínicos como de animales clínicamente sanos, de modo que quedan aún muchas hipótesis que no se han contrastado sobre el rol patogénico de este virus. A diferencia de otros herpesvirus, hasta el momento no se lo ha establecido como agente causal de una entidad patológica en particular, aunque hay marcadas evidencias de la asociación de la infección por BoHV-4 con infecciones bacterianas concomitantes en el tracto reproductivo de los bovinos, principalmente en el período posparto, y un aspecto que lo hace más interesante aún es el riesgo que podría representar este virus para la salud pública.
Sobre la base de la información que aporta la bibliografía se puede inferir que existe un amplio rango de diferencias en las propiedades biológicas y en el potencial patogénico del BoHV-4, que podría ser el resultado de una adaptación del virus a las presiones de selección, lo cual incrementaría la frecuencia de aparición de variantes genéticas.
Estudios realizados en el laboratorio de virología de INTA Balcarce, en los cuales se analizaron 17 cepas locales mediante endonucleasas de restricción, demostraron la existencia de nuevos patrones génicos entre los aislamientos. Las diferentes manifestaciones clínicas resultantes de las infecciones por el BoHV-4 y la heterogeneidad en los patrones de restricción del genoma viral sugieren que las variaciones genómicas podrían ser responsables de los diferentes grados de patogenicidad.
Por otra parte, la alta variabilidad entre las cepas aisladas de muestras provenientes de vacas con presentación de abortos en Argentina resalta el significado de la investigación sobre el papel de este virus como un agente infeccioso capaz de provocar enfermedad reproductiva en el ganado bovino. Por lo tanto, la caracterización genética de las cepas aisladas dará lugar a conocimientos fundamentales sobre los aspectos moleculares del virus, además de proporcionar información para una mejor comprensión de la patogénesis de las infecciones por el BoHV-4 y los medios por los cuales estas cepas circulan en los rebaños.
Actualmente no se cuenta con técnicas de diagnóstico rápidas que permitan realizar un estudio epidemiológico con el fin de determinar en qué situación se encuentra el país frente a este virus emergente, ni existen medidas sanitarias específicas.
Por lo antes mencionado y considerando la importancia del BoHV-4 en Argentina en relación con las pérdidas reproductivas y diferentes cuadros clínicos en el ganado bovino, es necesario profundizar los estudios biológicos de este agente viral, tanto moleculares como epidemiológicos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.