El objetivo de este trabajo fue evaluar métodos para eliminar hongos nativos formadores de micorrizas arbusculares (HMA) o reducir su número en muestras de suelo, sin afectar sus propiedades edáficas y microbiológicas. Se estudió la aplicación de calor húmedo (autoclave), de calor seco (estufa), de hipoclorito de sodio (NaClO) y de formaldehído, en concentraciones entre 100,0 y 3,3μl/g y 16,7 y 3,3μl/g, respectivamente. Las semillas de raigrás (Lolium multiflorum Lam.) sembradas en sustratos que recibieron NaClO (100,0-33,3μl/g) no germinaron y el autoclave incrementó el contenido de fósforo en el sustrato. Estos tratamientos no eliminaron la micorrización por HMA y ambos fueron descartados. En un segundo ensayo se analizaron los tratamientos estufa y formaldehído (10,0μl/g), asociados o no a la descontaminación de las semillas y a la reinoculación con HMA. Ambos procedimientos redujeron o eliminaron la micorrización por HMA nativos en suelos con 12 a 29mg/kg de fósforo y permitieron la multiplicación de inóculos de HMA. El tiempo de ventilación de las muestras y los requisitos de seguridad fueron mayores con la aplicación de formaldehído.
The objective of this work was to evaluate methods to eliminate or reduce the number of indigenous arbuscular mycorrhizal fungi (AMF) from soil samples without affecting their edaphic or microbiological properties. At an early trial we evaluated moist heat (autoclaving), dry heat (oven), sodium hypochlorite (NaClO) and formaldehyde at a range of 100.0–3.3μl/g and 16.7-3.3μl/g respectively. There was no germination in plants of ryegrass (Lolium multiflorum Lam.) sown on substrates receiving NaClO (100.0-33.3μl/g), whereas autoclaving significantly increased the available soil phosphorous content. Both treatments failed to eradicate AMF colonization at 9 weeks; therefore, they were discarded. In a second trial, oven and formaldehyde (10.0μl/g) treatments were analyzed to assess the effects of seed decontamination and AMF reinoculation. Both procedures were effective in reducing or eliminating indigenous AMF at a range of soil P availability of 12–29mg/kg. However, the time between soil treatment and AMF multiplication and safety requirements were greater in the case of formaldehyde application.
Las presiones actuales para minimizar la contaminación ambiental en la producción agrícola están incentivando una mayor utilización de inoculantes microbianos. Los hongos micorrícicos arbusculares (HMA) forman asociaciones simbióticas con las raíces de las plantas, son reconocidos como promotores de crecimiento vegetal y son utilizados como biofertilizantes5, particularmente para la producción hortícola en viveros y cultivos orgánicos. Las principales fuentes de inóculo de HMA consisten en esporas, micelio externo y raíces previamente colonizadas por HMA nativos o no nativos. Jin et al.7 comunicaron que los inoculantes formados por consorcios de HMA son más eficientes que estirpes individuales. El sustrato empleado puede ser inorgánico u orgánico, estéril o asociado a la microbiota nativa, y es deseable que previamente se logre la reducción o la eliminación de las poblaciones de HMA nativos del suelo que se va a inocular, dado que esta práctica permite evitar interferencias en la multiplicación del inóculo10. Thompson14 determinó que la radiación, el aire caliente o la fumigación con bromuro de metilo eliminaron los HMA y permitieron la reinoculación. Sin embargo, el uso del bromuro de metilo está prohibido en Europa y Estados Unidos, y restringido en Argentina (http://www.senasa.gov.ar/contenido.php?to=n∈=1036&io=2772). Aunque el procedimiento de autoclavado se utiliza para la eliminación de HMA9,10, es sabido que puede producir incrementos en el contenido de compuestos orgánicos e inorgánicos (P, N, S y Mn), con efectos negativos en el crecimiento de las plantas y en la colonización de los HMA a inocular11. Covacevich y Echeverría3 determinaron que la fumigación con formaldehído (10μl/g) en un suelo con aptitud agrícola (8mg/kg de P-Bray) eliminó propágulos de HMA nativos y no afectó negativamente la multiplicación de inóculos y el crecimiento de las plantas.
Nuestro objetivo fue evaluar métodos de factible aplicación que permitan la reducción o eliminación de propágulos nativos de HMA en muestras de suelo con contenidos de fósforo (P) representativos de suelos agrícolas, sin influir en sus principales propiedades edáficas ni en las poblaciones microbianas, como así tampoco en el posterior éxito de la inoculación con HMA.
Se colectó suelo (Argiudol) de un horizonte superficial (0-20 cm) en dos sitios agrícolas próximos entre sí y representativos de la región de Balcarce (Argentina), que fueron usados para dos ensayos sucesivos. Los suelos obtenidos (peso total: 30kg) fueron el resultado de 60 submuestras colectadas al azar a partir de una superficie de 5 ha. Estos fueron separadamente tamizados (2mm) y analizados (http://web.unbc.ca/~arocenaj/lab/kalra_maynard.pdf). Datos obtenidos para el suelo del ensayo 1: pH = 6,2; P-Bray = 29,0mg/kg; MO (materia orgánica) = 5,9g /100g; para el suelo del ensayo 2: pH = 6,3; P-Bray = 12,0mg/kg; MO = 5,8g/100g.
El ensayo 1 comprendió 13 tratamientos de suelo realizados sobre muestras de 150g y con 5 repeticiones por tratamiento, según la siguiente descripción: 1) control - suelo no tratado que recibió 20ml de agua destilada estéril en cada repetición; 2) tratamientos físicos: 2.a) estufa - suelo sometido a 60 °C de calor seco en estufa (DALVO Mod MCM4) durante dos períodos alternados de 48h cada uno, con un humedecimiento similar al que recibió el control durante el período intermedio de tres días; 2.b) autoclave 2 × 15’ y autoclave 2 × 60’: suelo autoclavado (Chamberland-Alfax) durante dos ciclos de 120°C, 1 atm de presión, 15min y 60min, respectivamente, con un intervalo de 5 días entre ciclos y con un humedecimiento en el día 1 igual al del tratamiento control; 3) tratamientos químicos: 3.a) F16,7; F10,0 y F3,3, tratados con 16,7μl, 10μl y 3,3μl de formaldehído3 (Biopack, 40 %) por gramo de suelo seco, respectivamente; 3.b) NaClO100,0; NaClO66,6; NaClO33,3; NaClO16,7; NaClO10,0 y NaClO3,3, tratados con 100μl, 66,6μl, 33,3μl, 16,7, 16,7μl, 10μl y 3,3μl de NaClO (lavandina Ayudín, 5 %) por gramo de suelo seco, respectivamente. Las soluciones de los tratamientos químicos fueron preparadas con agua destilada estéril en un volumen final de 20ml. Las muestras de suelo tratadas con formaldehído o con NaClO se mantuvieron en bolsas cerradas durante un período de 48h a 15°C y en oscuridad, luego de lo cual fueron abiertas y mantenidas en las mismas condiciones hasta su utilización, dos meses después.
Para el manejo de las muestras se utilizó protección de acuerdo a http://www.insht.es/portal/site/Insht/menuitem.a82abc159115c8090128ca10060961ca/?vgnextoid=4458908b51593110VgnVCM100000dc0ca8c0RCRD. Transcurrido el intervalo de tiempo mencionado, se llenaron macetas de 150ml de capacidad con 100ml del suelo de cada tratamiento y 50ml de perlita:vermiculita (1:1 v:v), ambas previamente autoclavadas. En cada maceta se sembraron 0,5g de semillas de raigrás (Lolium multiflorum Lam.) sin desinfectar; con un poder germinativo del 97 %. Las plantas se mantuvieron durante 9 semanas en cámara de crecimiento a 23°C y 12h de luz, se realizaron riegos diarios de agua corriente y con solución de Hoagland (P 30 %) cada 15 días.
El ensayo 2 se realizó con 4 repeticiones de los siguientes tratamientos:
- •
Tratamiento de la semilla: semilla desinfectada - 3 enjuagues, etanol 90 % durante 3min, 3 enjuagues, NaClO al 3,5 %, enjuague y secado (20°C, 48h); todos los enjuagues con H2O destilada estéril, 2min c/u; semilla no desinfectada.
- •
Tratamiento del suelo: F10,0; estufa, control (como indicado en el ensayo 1).
- •
Inoculación (el inóculo fue posicionado por debajo de las semillas a la siembra): inóculo experimental (IE) con las siguientes características: pH 6,2; 36,2mg P-Bray/kg; 2,1g MO/100g; 41,3 MA%15; 16,2 A%15; 63,0 esporas HMA/g; 1,56 Log UFC bacterias y levaduras/g; 5g de ‘suelo-inóculo’ proveniente de un suelo agrícola de Rivadavia, Argentina, propagado 9 semanas en raíces de maíz (Zea mays); inóculo comercial (IC) con las siguientes características: pH 6,2; 465,2mg/kg de P-Bray; 2,5g/100g de MO; 700,0 esporas de HMA G. intrarradices/g (informado por el fabricante); 1,23 Log UFC bacterias y levaduras/g; 1g de inoculante AEGIS HYDRO (Giten); no inoculado (NI).
La preparación del sustrato, las unidades experimentales y las condiciones de crecimiento (10 semanas) fueron las mismas que en el ensayo 1. Las plantas fueron regadas diariamente con agua destilada y cada 15 días con solución de Hoagland (P 30 %).
En ambos ensayos se determinó la producción de materia seca aérea (MSA) por gravimetría. Las raíces fueron procesadas y teñidas con azul tripán15 al 0,05 %, (Biopack) en una solución de ácido láctico (Biopack): glicerina (Biopack): agua destilada (1:1:1); posteriormente se cuantificó la capacidad micotrófica15 a partir de las observaciones microscópicas (Microscopio Olympus con contraste de fases, BO61 – BH2), y se determinó la intensidad de colonización (MA %) y el contenido de arbúsculos (A %). Se analizó el pH, el porcentaje de materia orgánica (% MO), la concentración de P-Bray y se efectuaron los recuentos microbiológicos en las muestras de suelo antes y después del crecimiento de las plantas (ACP y DCP, respectivamente), y para todos los tratamientos que resultaron promisorios. Se realizó además el recuento directo de bacterias-levaduras y actinomicetes en agar nutritivo (Britania), y en el ensayo 2, se realizó el recuento de hongos filamentosos en agar papa glucosa (Britania), siguiendo los protocolos de http://www.fao.org/docrep/018/aq359e/aq359e.pdf. En el ensayo 2, para cada tratamiento de suelo, semilla e inoculación, se calculó la respuesta a la inoculación (RI) para la producción de MSA, de acuerdo a Cavagnaro et al.2.
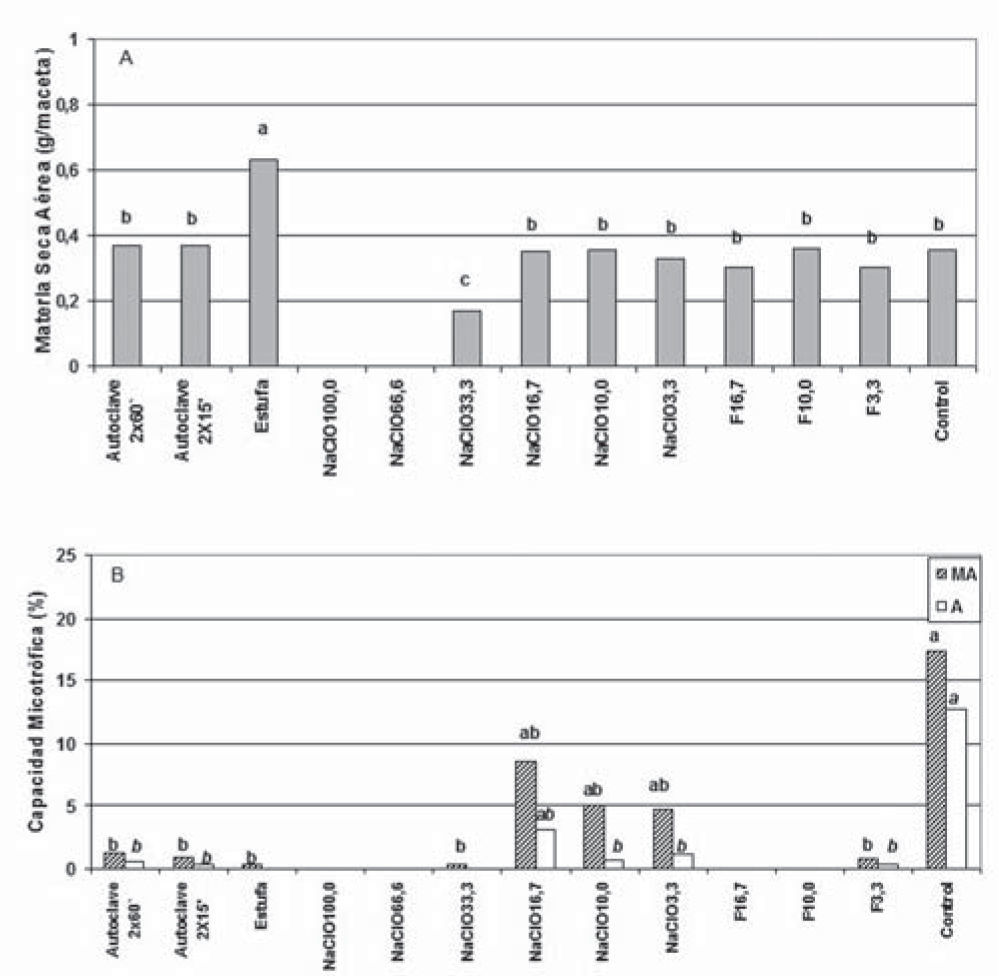
En el ensayo 1 se registró bajo o nulo crecimiento (fig. 1A) en las plantas que recibieron NaClO, y su aplicación no redujo ni eliminó la capacidad micotrófica de los HMA (fig. 1B). El autoclavado aumentó el contenido de P en el suelo de 28,7mg/kg a 38,9mg/kg y 40,2mg/kg en los tratamientos autoclave 2 × 15’y autoclave 2 × 60’, respectivamente, en coincidencia con comunicaciones previas que muestran el efecto del calentamiento del suelo sobre la mineralización del P orgánico, con el consiguiente incremento del P inorgánico5. Ni el suelo sometido a estufa ni el que recibió formaldehído evidenciaron incrementos (5 y 12mg/kg de P) significativos de P. El autoclavado del suelo aumentó la producción de MSA (fig. 1A), aunque no eliminó los propágulos de HMA (fig. 1B); similares resultados fueron comunicados por Manian et al.9 para suelos franco-arenosos de India. Se evidenciaron incrementos de pH después del crecimiento de las plantas (de 6,2±0,0 en control ACP, hasta 7,08±0,01 promedio de todos los tratamientos DCP). Debido a que se esperaban descensos del pH como resultado del crecimiento microbiano8, se consideró que el agua de riego utilizada (con presencia de NaHCO31) permitió la generación de carbonatos con consecuencias sobre el incremento del pH, aspecto que fue modificado en el ensayo 2. Las plantas que crecieron en suelo sometido a estufa evidenciaron la mayor producción de MSA (fig. 1A), y sus raíces registraron bajo porcentaje de hifas de HMA y ausencia de arbúsculos, estructuras funcionales de la simbiosis4,11 (fig. 1B). Las raíces de los tratamientos F10,0 y F16,7 no evidenciaron colonización micorrícica, lo que confirma la validez del método3 para suelos con niveles de P disponible elevados. Se registró una disminución en el valor logarítmico (Log) de los recuentos para todos tratamientos, desde 6,1139 UFC/g en el control hasta 5,4771; 4,5185 y 4,9912 para los tratamientos ACP estufa, autoclave 2 × 60’ y autoclave 2 × 15’, respectivamente. Nuestras observaciones fueron similares a las documentadas por Richardson et al.12 en suelo autoclavado, quienes hallaron una disminución y no una eliminación de microorganismos cultivables. Los recuentos DCP incrementaron en general en un orden de magnitud en los suelos tratados, lo que estaría asociado a un mayor crecimiento microbiano favorecido por la presencia de los exudados radicales6. El recuento de microorganismos arrojó resultados negativos en el tratamiento con formaldehído F10,0 ACP, mientras que F10,0 DCP mostró un incremento de 6 órdenes de magnitud; en un primer análisis estos resultados estarían indicando la eliminación de las formas vegetativas pero no las productoras de endosporas. Sin embargo, se consideró que la microbiota de las semillas sin desinfectar pudo haber actuado como inóculo inicial para el desarrollo de las comunidades microbianas, aspecto que fue analizado en el ensayo 2.
(A) Materia seca aérea y (B) capacidad micotrófica de plantas de raigrás crecidas en muestras de suelo que recibieron diferentes tratamientos para la reducción o eliminación de HMA, según se indica en la metodología del ensayo 1. MA: intensidad de colonización; A: contenido de arbúsculos.
Barras con letras distintas presentan diferencias significativas (prueba MDS; p< 0,05).
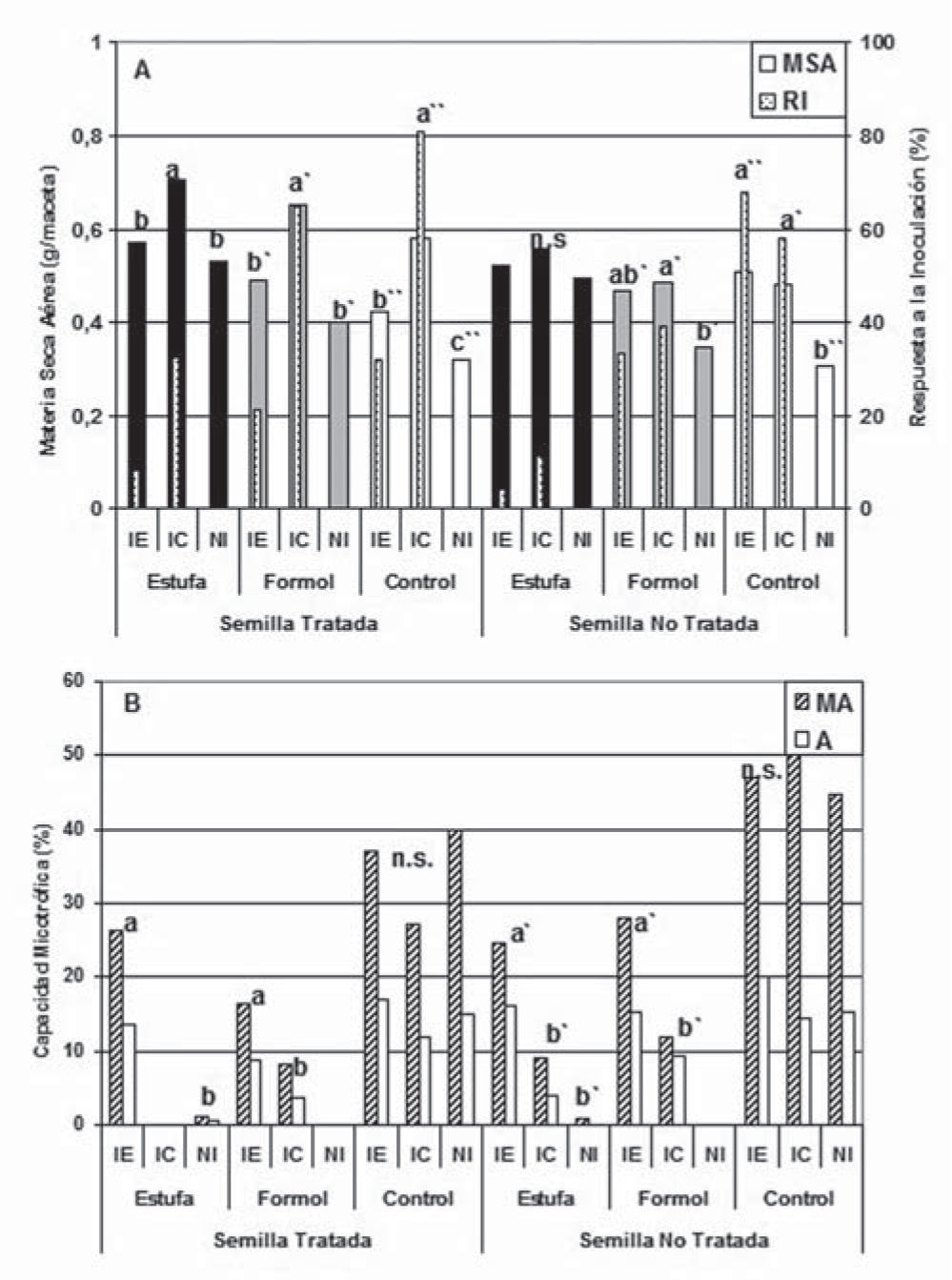
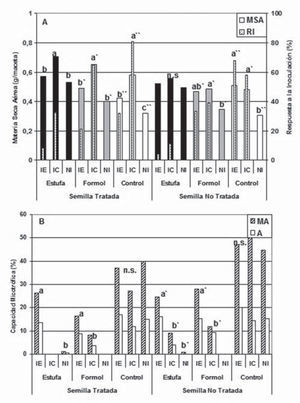
Los resultados registrados en el ensayo 2 mostraron incrementos del 10 % de MSA por la desinfección de la semilla (fig. 2A), y del 23 % y 16 % en el tratamiento estufa en relación con el control y con el F10,0, respectivamente. Los mayores incrementos de MSA se observaron con la aplicación del IC en semilla desinfectada y para las tres condiciones de tratamiento del suelo. Similares incrementos en la producción de MSA se obtuvieron con la aplicación del IC y del IE cuando la semilla no fue tratada, alcanzándose, en general, incrementos de RI en el rango de 30-80 %. Al igual que lo registrado en el ensayo 1, los tratamientos F10,0 y estufa registraron baja o nula MA % (fig. 2B) y ausencia de A %. Los mayores incrementos se observaron con IE para sustrato en estufa o con formaldehído y semilla no desinfectada. La mayor MA % se registró en las plantas control provenientes de semilla no desinfectada. Estos resultados sugerirían un mejor establecimiento de las poblaciones de HMA nativos en asociación con las poblaciones microbianas de la semilla. Si bien podría aconsejarse entonces el tratamiento de desinfección de la semilla para minimizar el impacto de la colonización con los HMA nativos y favorecer así a los inoculados eficientes, hay que considerar la practicidad del procedimiento para los productores. Al igual que lo observado en el ensayo 1, los recuentos de unicelulares DCP aumentaron con todos los tratamientos (tabla 1). Adicionalmente, no crecieron hongos luego de los tratamientos F10 y estufa, tanto ACP como DCP. Los estudios realizados por Rikiya y Tomoyoshi13 informan ausencia de crecimiento de hongos durante los primeros 12 días de aplicación de químicos o de calor al suelo, aunque en nuestro trabajo esto se mantuvo por al menos 10 semanas. No se registraron efectos de la desinfección de la semilla ni de la inoculación sobre el crecimiento de hongos y bacterias, ni sobre el pH del suelo (tabla 1). En todos los casos, y coincidiendo con lo sucedido en el ensayo 1, el contenido de P aumentó levemente luego de los tratamientos estufa y F10,0, aun ante disponibilidades iniciales de P diferentes, mientras que el pH aumentó DCP (tabla 1). Los mayores contenidos de P disponible se registraron luego de la inoculación con el IC, probablemente como consecuencia del elevado contenido del nutriente en el inóculo. Esto podría haber funcionado como estimulador del crecimiento de las plantas y debería ser tomado en cuenta para identificar separadamente los efectos producidos por los HMA del inoculante o por el producto en su conjunto.
(A) Producción de materia seca aérea y respuesta a la inoculación y (B) capacidad micotrófica, de plantas de raigrás obtenidas bajo distintas combinaciones de tratamiento de las semillas, del sustrato y de inoculación con HMA, según se indica en la metodología del ensayo 2. RI: respuesta a la inoculación; MA: intensidad de colonización; A: contenido de arbúsculos.
Barras con letras distintas presentan diferencias significativas (prueba MDS; p< 0,05) entre tratamientos de inoculación para cada tratamiento de semilla y de suelo.
n.s.: diferencias no significativas.
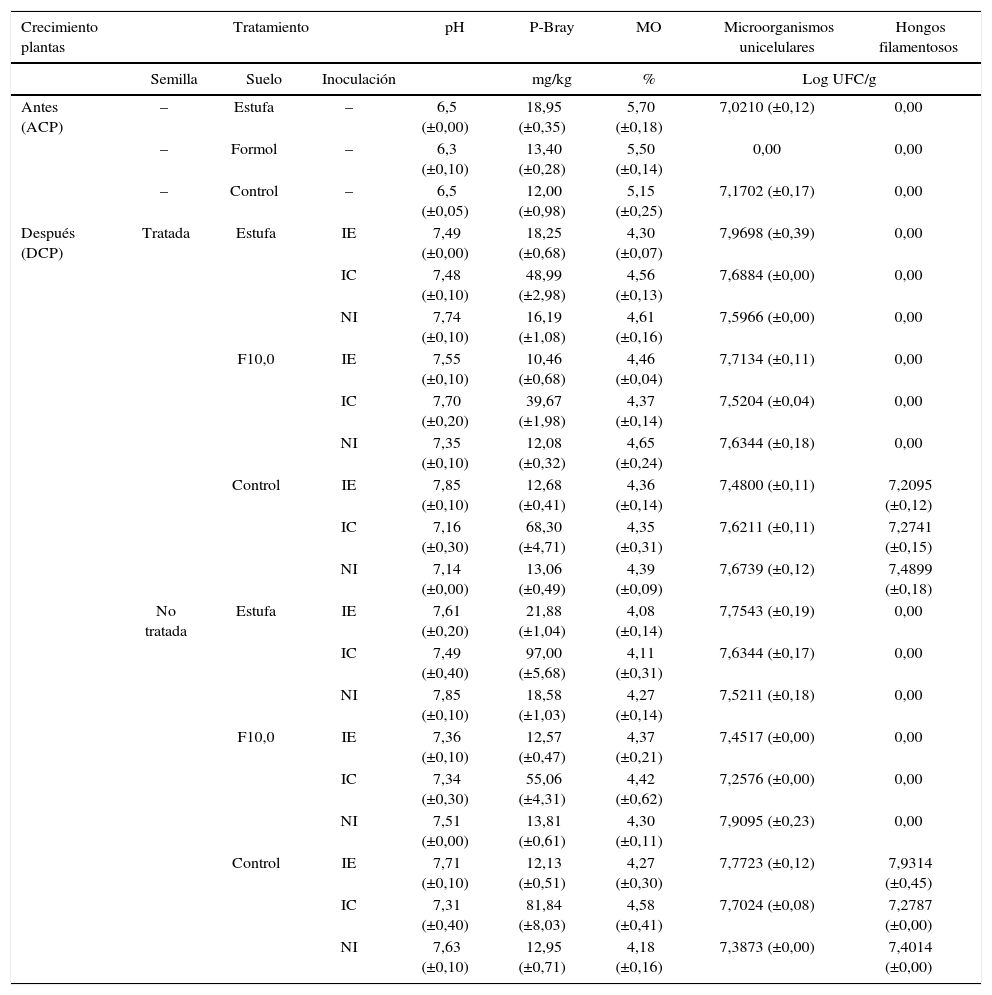
Características físicoquímicas y carga microbiana de muestras de suelo luego de los tratamientos de reducción/eliminación de HMA y antes o después del crecimiento de las plantas.
| Crecimiento plantas | Tratamiento | pH | P-Bray | MO | Microorganismos unicelulares | Hongos filamentosos | ||
|---|---|---|---|---|---|---|---|---|
| Semilla | Suelo | Inoculación | mg/kg | % | Log UFC/g | |||
| Antes (ACP) | – | Estufa | – | 6,5 (±0,00) | 18,95 (±0,35) | 5,70 (±0,18) | 7,0210 (±0,12) | 0,00 |
| – | Formol | – | 6,3 (±0,10) | 13,40 (±0,28) | 5,50 (±0,14) | 0,00 | 0,00 | |
| – | Control | – | 6,5 (±0,05) | 12,00 (±0,98) | 5,15 (±0,25) | 7,1702 (±0,17) | 0,00 | |
| Después (DCP) | Tratada | Estufa | IE | 7,49 (±0,00) | 18,25 (±0,68) | 4,30 (±0,07) | 7,9698 (±0,39) | 0,00 |
| IC | 7,48 (±0,10) | 48,99 (±2,98) | 4,56 (±0,13) | 7,6884 (±0,00) | 0,00 | |||
| NI | 7,74 (±0,10) | 16,19 (±1,08) | 4,61 (±0,16) | 7,5966 (±0,00) | 0,00 | |||
| F10,0 | IE | 7,55 (±0,10) | 10,46 (±0,68) | 4,46 (±0,04) | 7,7134 (±0,11) | 0,00 | ||
| IC | 7,70 (±0,20) | 39,67 (±1,98) | 4,37 (±0,14) | 7,5204 (±0,04) | 0,00 | |||
| NI | 7,35 (±0,10) | 12,08 (±0,32) | 4,65 (±0,24) | 7,6344 (±0,18) | 0,00 | |||
| Control | IE | 7,85 (±0,10) | 12,68 (±0,41) | 4,36 (±0,14) | 7,4800 (±0,11) | 7,2095 (±0,12) | ||
| IC | 7,16 (±0,30) | 68,30 (±4,71) | 4,35 (±0,31) | 7,6211 (±0,11) | 7,2741 (±0,15) | |||
| NI | 7,14 (±0,00) | 13,06 (±0,49) | 4,39 (±0,09) | 7,6739 (±0,12) | 7,4899 (±0,18) | |||
| No tratada | Estufa | IE | 7,61 (±0,20) | 21,88 (±1,04) | 4,08 (±0,14) | 7,7543 (±0,19) | 0,00 | |
| IC | 7,49 (±0,40) | 97,00 (±5,68) | 4,11 (±0,31) | 7,6344 (±0,17) | 0,00 | |||
| NI | 7,85 (±0,10) | 18,58 (±1,03) | 4,27 (±0,14) | 7,5211 (±0,18) | 0,00 | |||
| F10,0 | IE | 7,36 (±0,10) | 12,57 (±0,47) | 4,37 (±0,21) | 7,4517 (±0,00) | 0,00 | ||
| IC | 7,34 (±0,30) | 55,06 (±4,31) | 4,42 (±0,62) | 7,2576 (±0,00) | 0,00 | |||
| NI | 7,51 (±0,00) | 13,81 (±0,61) | 4,30 (±0,11) | 7,9095 (±0,23) | 0,00 | |||
| Control | IE | 7,71 (±0,10) | 12,13 (±0,51) | 4,27 (±0,30) | 7,7723 (±0,12) | 7,9314 (±0,45) | ||
| IC | 7,31 (±0,40) | 81,84 (±8,03) | 4,58 (±0,41) | 7,7024 (±0,08) | 7,2787 (±0,00) | |||
| NI | 7,63 (±0,10) | 12,95 (±0,71) | 4,18 (±0,16) | 7,3873 (±0,00) | 7,4014 (±0,00) | |||
Inóculo eficiente (IE), inóculo comercial (IC) y no inoculado (NI).
Valores entre paréntesis corresponden a ± 1 desvío estándar.
En síntesis, la aplicación de formaldehído (10μl/g) o de calor seco (estufa) a muestras de suelo, independientemente del tratamiento de la semilla o del agua de riego, inhibió la capacidad micotrófica de los HMA nativos y permitió la multiplicación de inóculos con HMA en un rango de disponibilidad de P entre 12 y 29mg/kg de suelo, sin afectar sus propiedades edáficas o microbiológicas. La aplicación de formaldehído requiere mayores condiciones de seguridad y tiempo de ventilación de las muestras en relación con el calor seco. Esto debería ser considerado a la hora de decidir la utilización de uno u otro tratamiento.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
El presente trabajo fue realizado con fondos de los proyectos PIP1142010010025201, PICT2011-1413, y PNSUELO1134043.