Los microbicidas constituyen una nueva herramienta, todavía en proceso de investigación, que podrían ayudar en la prevención de la infección por los virus de la inmunodeficiencia humana (Human immunodeficiency virus: HIV) y de otras infecciones de transmisión sexual (ITS). Una serie de evidencias ha demostrado que la complejidad de la transmisión sexual de patógenos virales requiere de la identificación de compuestos capaces de bloquear los eventos tempranos del ciclo de infección viral. En este manuscrito hacemos una revisión exhaustiva de las diferentes estrategias que se han estudiado o se están considerando para prevenir ITS mediante el uso de microbicidas, haciendo particular énfasis en aquellos con el potencial de bloquear la infección por el HIV. También se revisa el proceso complejo de evaluación preclínica que se requiere para llegar a estudios en humanos y se concluye con un breve análisis de las estrategias que podrían formar parte del futuro inmediato en la investigación de microbicidas.
Microbicides are a new tool, still under investigation, which could help prevent infection by the human immunodeficiency virus (HIV) and other sexually transmitted infections (STIs). Increasing evidence shows that the complexity of sexual transmission of viral pathogens requires the identification of compounds able to block the early events during the cycle of viral infection. In this manuscript we provide a comprehensive review of the different microbicide strategies that have been studied or are currently being considered for STI prevention, particularly emphasizing those having the potential to block HIV infection. The manuscript also reviews the complex process that is required to conduct future clinical studies in humans and concludes with a brief discussion of the strategies that could be part of the immediate future in microbicide research.
Según la definición de la OMS, los microbicidas son compuestos que pueden ser aplicados de forma intravaginal o intrarrectal para prevenir infecciones de transmisión sexual (ITS), en particular, la ocasionada por el HIV, y otras, como las asociadas a los virus del herpes simplex 2 (Herpes simplex virus type 2: HSV-2) y del papiloma humano (Human papillomavirus: HPV), así como las producidas por Trichomonas vaginalis, Chlamydia trachomatis y Neisseria gonorrhoeae, entre otras. Los microbicidas pueden ser formulados como geles, cremas, láminas flexibles o supositorios, y pueden tener o no efecto anticonceptivo. Todavía no existe un microbicida efectivo que haya sido aprobado para la prevención de ITS. Sin embargo, el concepto antes expuesto puede ampliarse aún más si consideramos como microbicidas a otros sistemas para formular y administrar drogas, como son los anillos vaginales, las tabletas o dispositivos intrauterinos e incluso probióticos que han sido modificados genéticamente para expresar moléculas que puedan inhibir ITS.
La transmisión sexual es responsable hoy en día del mayor número de nuevas infecciones por HIV a nivel mundial. Cambios en los hábitos sexuales vinculados con el asesoramiento, el uso de condones para hombres o mujeres, el uso de terapia antirretroviral en la persona infectada en parejas serodiscordantes, la circuncisión en el hombre y el tratamiento de otras ITS pueden todos reducir el riesgo de adquirir el HIV. Sin embargo, a pesar de que se dispone de todas estas herramientas, la epidemia sigue estable o aumenta en varias partes del mundo, con una incidencia global anual de 2,7 millones de infecciones. De este total de personas infectadas el 50 % son mujeres, y otro alto porcentaje, difícil de estimar globalmente, corresponde a hombres que tienen sexo con hombres (Organización Mundial de la Salud-OMS, Estadísticas sanitarias mundiales 2013. http://apps.who.int/iris/bitstream/10665/82218/1/9789243564586_spa.pdf?ua=1).
La transmisión heterosexual u homosexual juega un importante rol en la infección de mujeres y hombres, y entre las opciones disponibles para reducir la transmisión, virtualmente todas requieren del consentimiento de la pareja para ser efectivas. En esta situación, la desigualdad entre géneros, la dependencia de la pareja para la seguridad económica y la dinámica de relaciones entre parejas son algunos de los factores que contribuyen a la falla de estas herramientas para prevenir la transmisión del HIV.
En conclusión, se necesitan nuevas estrategias que den múltiples opciones para prevenir la infección por HIV. En este contexto, los microbicidas ofrecen el potencial de un método que podría ser controlado por el miembro dependiente de la pareja sin el necesario consentimiento del otro. Los microbicidas pueden ser formulados en anillos vaginales, tabletas o láminas flexibles que logran pasar inadvertidos durante el acto sexual. Quizá los geles, en especial si se utilizan justo antes del coito, son los que tienen más posibilidades de ser percibidos, pero podrían sustituir el uso de lubricantes sexuales, los cuales gozan de buena aceptación.
La evolución en la investigación de microbicidasEl inicio en la investigación de microbicidas se basó en la búsqueda de compuestos capaces de inactivar el HIV o bloquear su entrada en las células blanco. Para muchos de estos candidatos, que iniciaron el proceso en la búsqueda de microbicidas, no existió un estudio profundo de su seguridad y eficacia. Esto se debió a la falta de modelos in vitro o in vivo para evaluar estos parámetros, ya que se trataba de un acercamiento novedoso a la prevención de las ITS. Lo que hemos aprendido con el paso del tiempo es que estos candidatos mostraron resultados adversos probablemente por la baja selectividad de la actividad antiviral, la baja potencia y la poca durabilidad74.
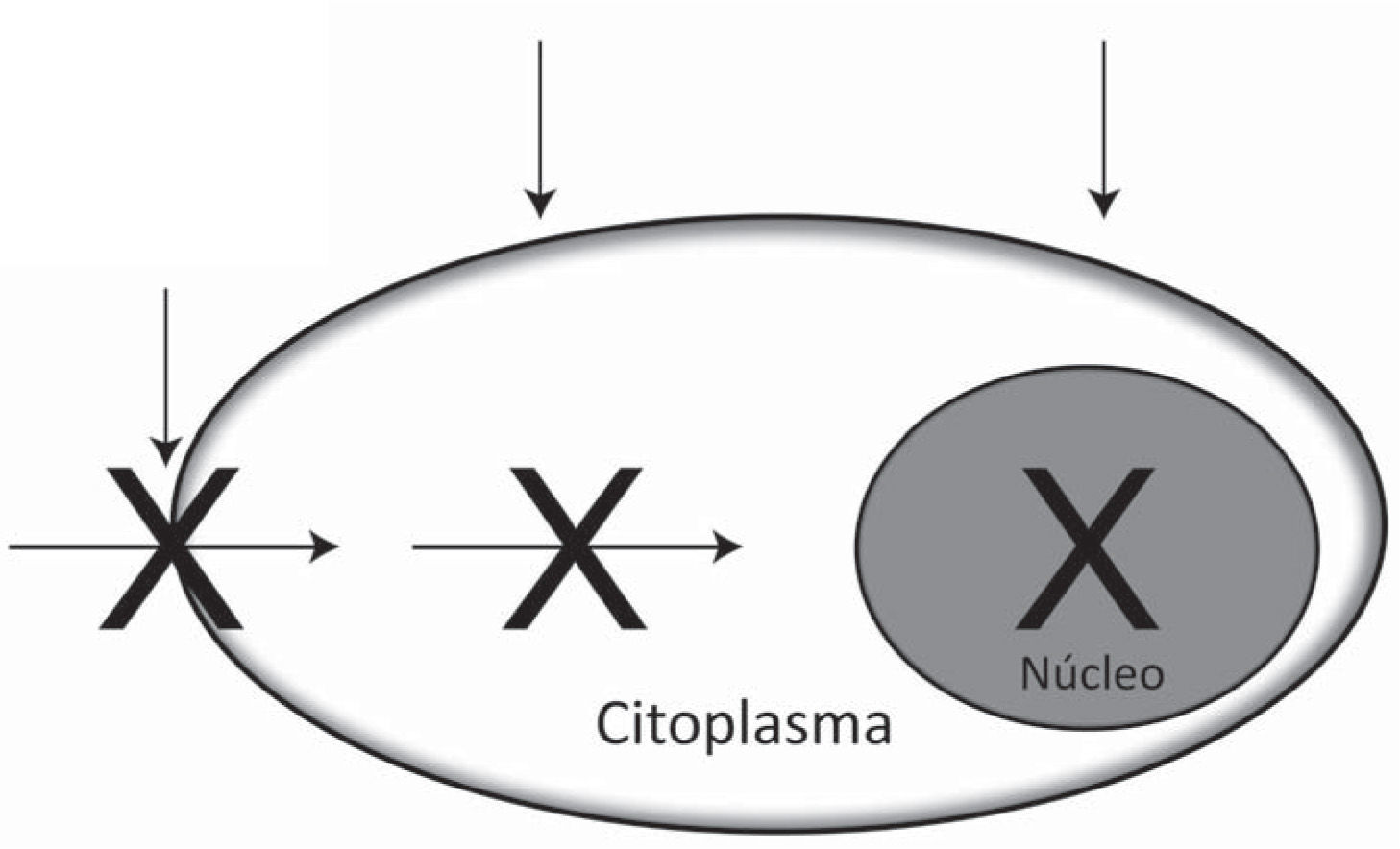
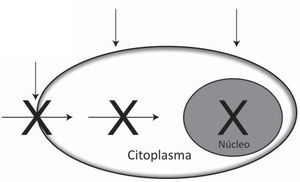
En la actualidad, los esfuerzos están dirigidos a evaluar compuestos más potentes, con índices de selectividad altos, que buscan inhibir enzimas o proteínas virales claves en la replicación del HIV. Entre estos se encuentran aquellos inhibidores de la adsorción o fusión del virus a la célula hospedera y los inhibidores de la transcriptasa inversa (TI) y de la integrasa viral75 (IN). También, usando como paradigma la efectividad de la terapia antirretroviral de alta actividad, se está explorando la combinación de varios compuestos con diferente modo de acción. Esta estrategia no solo ayudaría a minimizar una posible resistencia viral del HIV, sino que también podría generar microbicidas de amplio espectro, capaces de bloquear diferentes ITS. La figura 1 muestra algunos de los blancos para prevenir la infección por HIV y a continuación se describen de forma específica los diferentes microbicidas que han sido contemplados desde el inicio en la investigación de este novedoso enfoque para la prevención del HIV y otras ITS.
El agente surfactante no iónico nonoxynol-9 es considerado el primer microbicida estudiado en ensayos clínicos. Esta fórmula ya había sido creada y aprobada para su venta como agente espermicida sin necesidad de prescripción médica30. Los ensayos clínicos realizados en trabajadores sexuales en África y Tailandia demostraron un incremento en el riesgo de contraer HIV, posiblemente debido a la disrupción del epitelio vaginal tras el uso de este producto101.
El surfactante anfotérico C31G o SAVVY fue rápidamente suspendido en los ensayos clínicos debido a su futilidad22. El surfactante catiónico cloruro de benzalconio, con un historial parecido al nonoxynol-9 en relación con su uso como espermicida, también fue contemplado como posible microbicida. Sin embargo, al igual que el nonoxynol-9, la posibilidad de causar irritación vaginal e incrementar las citocinas proinflamatorias impidió su evaluación como microbicida24.
Inhibidores de entrada/fusión viralEntre las moléculas que forman parte de estrategias ya evaluadas sin resultados positivos cabe señalar los polianiones y agentes acidificantes. Las lectinas, los anticuerpos neutralizantes contra la glicoproteína gp120 del HIV, péptidos inhibidores de la fusión viral, inhibidores del correceptor CCR5 y aptámeros forman parte del presente y futuro.
Los polianiones con cargas negativas, debido a la presencia de grupos sulfatos o sulfonatos, tienen la habilidad de interactuar con cargas positivas de la glicoproteína viral gp120 y bloquear la entrada del virus a las células blanco. Un aspecto interesante es la capacidad de bloquear aquellos virus que utilizan el correceptor CXCR4 con mayor facilidad que los que usan el correceptor CCR525,77,80. La explicación de este fenómeno podría estar relacionada con la mayor carga positiva en la gp120 de los virus que utilizan el correceptor CXCR48,80. Sin embargo, son los virus que utilizan CCR5 los que están mayormente vinculados con la transmisión del HIV86. La potencia más baja contra estos virus, la disminución de la actividad antiviral en presencia de fluidos biológicos, al igual que una duración corta del efecto antiviral, pueden dar cuenta de por qué estos agentes no mostraron eficacia contra el HIV en los ensayos clínicos28,35,74,78.
Carraguard®, un gel desarrollado por Population Council y que contiene carragenina -polisacárido derivado de algas (Rhodophyceae)-, fue el primer polianión evaluado en ensayos clínicos. Si bien este compuesto no mostró eficacia contra el HIV, demostró ser seguro, sin efecto dañino por su uso83. También mostró buena aceptabilidad, lo cual, unido a sus propiedades reológicas favorables, lo convierten en un vehículo adecuado para formular otros compuestos más potentes con actividad antiviral contra el HIV u otras ITS23,38,39,48,52,67,83,93,99,100. A su vez, un estudio realizado en un subgrupo de mujeres que participaron en el ensayo clínico de fase 3 de Carraguard® también sugirió que la carragenina podría bloquear la transmisión sexual del HPV47. A ello se suman una serie de evidencias in vitro e in vivo que han demostrado la potente actividad antiviral de la carragenina contra este virus10,71.
El polianión PRO2000 también fue evaluado en humanos y no demostró eficacia contra HIV en un ensayo clínico que comparó dos dosis diferentes (0,5 % y 2 %) de su compuesto activo49 (sulfonato de naftaleno). En la actualidad se está estudiando otro polianión, VivaGel®, como posible candidato a microbicida. Este se basa en polímeros de dendrímeros con un mayor tamaño que los polianiones antes descritos y mayor capacidad de atrapar virus. Al igual que otros polianiones, Vivagel® ha mostrado actividad antiviral contra varias ITS como HIV, HSV-2 y HPV76.
En el grupo de agentes acidificantes, el candidato a microbicida más estudiado ha sido BufferGel®. La fórmula consiste en una solución tampón fuerte capaz de mantener la acidez normal de la vagina, aun en presencia del eyaculado. Varios estudios han sugerido que el HIV puede ser inactivado fácilmente a pH < 4. Los estudios en fases clínicas 1 y 2/2b sugieren que la fórmula es segura, pero ineficaz contra el HIV33.
Los anticuerpos monoclonales neutralizantes que reconocen la glicoproteína gp120 han mostrado eficacia en modelos animales96. Entre los anticuerpos con posible actividad microbicida se destacan b12, 2G12 y PRO14058,66,79. La principal desventaja de estas moléculas radica en la necesidad de fórmulas con concentraciones altas de anticuerpos. La tecnología actual no permite la producción de estos anticuerpos a gran escala y con bajo costo, como para que puedan ser utilizados como agentes microbicidas.
Las lectinas como la cianovirina-N tienen un modo de acción parecido a estos anticuerpos y han mostrado ser eficaces en modelos animales vaginales y rectales88,89. La grifitsina es quizá la molécula más prometedora de este grupo. Muestra valores de concentración efectiva media (CE50) en el orden de picomolares y baja capacidad de inducir respuestas inflamatorias; además, se ha podido expresarla en plantas y purificarla a partir de estas, lo que permite su producción a gran escala60. Esta lectina tiene un amplio espectro de actividad antiviral in vitro, que incluye virus envueltos. La actividad antiviral in vitro contra HSV-2 es moderada, pero ha mostrado una potente actividad antiviral en un modelo animal murino59. Los péptidos con secuencias basadas en la glicoproteína viral gp41 del HIV han sido empleados para inhibir la fusión viral a células blanco43. De hecho, el efurvitide (T-20) se emplea en el tratamiento de individuos infectados con el HIV. Se han evaluado el T-20, el C52L y el T1249 en modelos animales para prevenir la infección por una quimera viral entre el virus de la inmunodeficiencia de los simios y el HIV97,98 (Simian-human immunodeficiency virus: SHIV). Estas moléculas tienen la ventaja de tener un amplio espectro antiviral contra la mayoría de los diferentes subtipos del HIV, pero su uso está limitado por su alto costo de producción.
Un grupo bien particular lo constituyen aquellos antivirales que bloquean moléculas de la célula hospedera, tal es el caso de Maraviroc y PC-RANTES. Estas moléculas no solo pueden competir con el virus por la unión al correceptor CCR5, sino que también pueden regular de forma negativa su expresión40,42. Una de las ventajas de estas moléculas se vincula con la posibilidad de poder evadir mutaciones virales, ya que el blanco es una proteína del hospedador. Sin embargo, el virus ha mostrado la capacidad de utilizar diferentes correceptores y se desconoce si esto puede resultar en la selección de nuevas cepas virales con afinidad por otros correceptores. Estas moléculas también cuentan con el inconveniente del costo de producción y la posible aparición de respuestas inflamatorias o humorales.
Inhibidores de enzimas viralesHace casi 30 años, el análogo nucleosídico azidotimidina (zidovudina) se convirtió en la primera droga que demostró actividad antiviral contra el HIV13. Se describió como un inhibidor competitivo de la TI, que, una vez metabolizado por las células, se convertía en análogo nucleotídico. De esta forma se estableció la primera clase de agentes antirretrovirales: los inhibidores nucleosídicos de la TI [nucleoside reverse transcriptase inhibitor (NRTI)].
Los compuestos de esta clase son inactivos en su forma original y requieren de sucesivos pasos de fosforilación por quinasas y fosfotransferasas celulares para convertirse en análogos de nucleótidos. Los NRTI compiten con los nucleótidos endógenos por su incorporación en la TI durante la polimerización y funcionan como terminadores de cadena13.
Hoy en día se cuenta con un total de 8 NRTI que se utilizan en el tratamiento de pacientes con HIV, mientras otros NRTI o sus prodrogas se encuentran en diferentes etapas de desarrollo clínico. Entre los NRTI en uso para el tratamiento del HIV está la zidovudina (antes mencionada), además de la didanosina, la zalcitabina, la estavudina, la lamivudina, el abacavir, la prodroga tenofovir (TFV) disoproxil fumarato y la emtricitabina. A la combinación de TFV disoproxil fumarato y emtricitabina se la conoce como TRUVADA13. Estos dos últimos NRTI y su combinación han revolucionado la investigación de microbicidas y, en general, de métodos novedosos para la prevención de la infección por HIV.
En el año 2010, el ensayo clínico de fase 2b CAPRISA 004 mostró que un gel que contiene 1 % de TFV reducía en un 39 % la incidencia de HIV32 (intervalo de confianza al 95 %: 6–60). Este ensayo se convirtió en la primera prueba de concepto de que un antirretroviral suministrado por vía intravaginal podría ser un microbicida efectivo. Algo inesperado en CAPRISA 004 fue un 51 % de reducción en la incidencia del HSV-2, ya que estudios preclínicos no habían sugerido que el TFV tuviera una alta potencia o índice selectivo contra HSV-22. En 2011, la red MTN (Microbicide Trial Network) inició un estudio llamado VOICE (Vaginal and Oral Interventions to Control the Epidemic), para examinar la seguridad y efectividad del gel que contiene 1 % de TFV suministrado diariamente, y también se evaluó la droga TRUVADA suministrada diariamente, pero de forma oral. Este ensayo clínico arrojó un resultado inesperado, ya que tuvo que ser detenido por futilidad12. En la actualidad se desarrolla un estudio confirmatorio (FACTS 001) que busca extender los hallazgos del ensayo clínico CAPRISA 004. Este ensayo consiste en administrar el gel de TFV por vía intravaginal, antes y después del coito, en mujeres entre 18 y 30 años (Facts Consortium, actualizado 2013, http://www.factsconsortium.co.za/?page_id=83).
Otros estudios relacionados con estrategias para la prevención de la infección por HIV, y que también han utilizado las drogas TFV y TRUVADA, arrojaron resultados muy alentadores. Entre estos estudios se destacan los siguientes ensayos clínicos de preexposición oral:
- •
iPrEx, Partners PrEP y TDF2. Se realizaron en hombres que tienen sexo con hombres, transgéneros y parejas serodiscordantes al HIV; mostraron una reducción entre 44 y 63 % de la incidencia del HIV12.
- •
FEM-PrEP. Realizado en mujeres con alto riesgo de contraer el HIV, al igual que VOICE, mostró ausencia de eficacia. Esto puede deberse a la falta de adhesión de las participantes en el estudio92,94.
Otro grupo de drogas antirretrovirales, también contemplado en el desarrollo de microbicidas, son los inhibidores no nucleosídicos de la RT [non-nucleoside reverse transcriptase inhibitors (NNRTI)]. Los NNRTI son inhibidores no competitivos que se unen a un sitio alostérico de la TI e inducen cambios conformacionales que afectan el sitio activo de la enzima. Se caracterizan por una alta potencia, son entre 100 y 1000 veces más potentes que los NRTI cuando se comparan las CE50. Los NNRTI juegan un papel fundamental en la terapia combinada contra el HIV debido no solo a su alta potencia, sino también a su relativa baja toxicidad cuando se comparan con otros antirretrovirales.
La era de los NNRTI comenzó hace más de dos décadas con el descubrimiento del HEPT y el TIBO como inhibidores específicos de la TI. Desde entonces se han descrito cerca de 30 clases estructurales diferentes, de las cuales solo 5 [nevirapina, delavirdina, efavirenz, etravirina y rilpivirina (RPV)] se han utilizado o se utilizan en el tratamiento de pacientes con HIV.
La principal desventaja de los NNRTI quizá radica en la resistencia viral rápida que el HIV puede desarrollar, así como problemas farmacocinéticos. Es por ello que el estudio minucioso del perfil de resistencia viral constituye un paso fundamental a la hora de elegir un NNRTI como candidato a microbicida. Los primeros informes de mutantes con baja sensibilidad a NNRTI se basaban en mutaciones localizadas en el bolsillo hidrofóbico de la TI, sitio alostérico que los NNRTI utilizan en su unión a la enzima. Estas mutaciones se observan fundamentalmente en dominios de la subunidad p66 de la TI, que abarcan los aminoácidos 98–108, 178–190 y 225–23868. Las mutaciones más frecuentes en virus aislados de pacientes donde el tratamiento con NNRTI ha fallado son K103N y Y181C. También se han identificado mutaciones fuera de estos dominios, como es el caso de Y318F y E138G/K/Q. En total son cerca de 40 las sustituciones aminoacídicas que han sido vinculadas con resistencia a los NNRTI16.
Varios NNRTI se han estudiado o se están estudiando como agentes microbicidas. Entre ellos se encuentran MIV-150, UC781, dalpivirina (DPV) y RPV. Estos NNRTI se consideran moléculas con una alta afinidad por la TI, con posible actividad virucida, además de un efecto denominado “efecto memoria”57. El efecto memoria consiste en una persistencia prolongada de la actividad antiviral in vitro, aun cuando las células expuestas a estas moléculas son lavadas extensivamente antes de ser inoculadas con el HIV.
El MIV-150, un NNRTI desarrollado por Medivir y que en la actualidad está siendo evaluado por Population Council, es quizá el NNRTI con la más amplia evaluación preclínica. Este NNRTI, formulado en un anillo vaginal, fue el primero en ofrecer una prueba de concepto en modelo animal que mostró su capacidad de bloquear la infección vaginal de macacos con SHIV81. También la formulación de MIV-150 en un gel de carragenina y acetato de zinc ha mostrado una protección completa de macacos infectados con una dosis alta de SHIV 8 horas luego de la aplicación del gel y una disminución significativa de la infección cuando se aplicó el gel 24 horas antes de la infección14,31,36,37,82,90. El gel ha demostrado ser seguro, además de tener un amplio espectro de actividad antiviral al bloquear la infección vaginal y rectal por SHIV en macacos y por HSV-2 y HPV en modelos murinos41.
Se han realizado estudios preclínicos y clínicos de fase 1 con UC781 formulado al 0,1 % o 0,25 % en geles, sin embargo, dificultades asociadas con la obtención de fórmulas estables hicieron que se detuviera el desarrollo de este NNRTI. Por su parte, el DPV ha sido formulado en geles y anillos vaginales, los que han servido para realizar varios estudios preclínicos y clínicos con el fin de acceder a la seguridad y farmacocinética de estas formulaciones. En la actualidad, un estudio de fase clínica 3 (ASPIRE) está evaluando la eficacia de un anillo vaginal que contiene DPV. El anillo, denominado Ring-004, consiste en DPV formulado en silicona catalizada con platino, para mejorar la estabilidad (MTN, actualizado 2013, http://www.mtnstopshiv.org/news/studies/mtn020/backgrounder). Adicionalmente, se está estudiando el NNRTI RPV en ensayos clínicos. El compuesto se ha formulado para ser inyectado intramuscularmente (600mg) y mantener en el organismo niveles de la droga capaces de prevenir la adquisición del HIV por un largo período de tiempo91.
Los inhibidores de la IN del HIV es otro grupo que recientemente se ha unido al arsenal de compuestos con potencial de ser desarrollados como microbicidas. Al igual que los NNRTI, se caracterizan por presentar CE50 subnanomolares y no requieren ser activados por las células blanco. Los inhibidores de la IN se clasifican de acuerdo al sitio de inhibición en inhibidores de 3′-P, inhibidores de la transferencia de cadena e inhibidores del complejo macromolecular LEDGF/p75-IN17. Entre los compuestos que más se destacan en este grupo están el raltegravir, el elvitegravir y el dolutegravir29,34.
Si bien la mayoría de las estrategias en el desarrollo de microbicidas se han centrado en formulaciones vaginales, el estudio de microbicidas rectales ha encontrado en los NNRTI y NRTI sus mejores aliados. El NNRTI UC-781 fue el primer candidato a microbicida rectal en ser evaluado en estudios de fase clínica 1. Los estudios demostraron que geles que contenían 0,1 % o 0,25 % de UC781 son seguros, sin efectos adversos, y las biopsias rectales de pacientes que recibieron los geles mostraron una marcada supresión de la infección por HIV ex vivo3. Por otra parte, el gel que contiene 1 % de TFV, el mismo que fue utilizado en el ensayo clínico de fase 2b CAPRISA 004, se empleó en estudios de fase 1 para evaluar su seguridad como microbicida rectal. El estudio clínico no arrojó los mejores resultados, y se presentaron efectos adversos gastrointestinales4. Las causas de dichos resultados fueron relacionadas con la naturaleza hiperosmolar de la formulación inicial, lo que llevó a la reformulación del gel con menos glicerina para su uso rectal. El gel reformulado demostró ser seguro y tolerado en el estudio de fase clínica 151 (MTN-007), y entrará en un estudio de fase clínica 2 (MTN-017) en el curso del año 2014 para controlar su seguridad, así como la aceptabilidad y adherencia al uso de este potencial microbicida rectal50.
Una estrategia interesante para la prevención de la transmisión vaginal y rectal del HIV es la formulación de inhibidores de las enzimas virales en nanofórmulas inyectables de larga duración. El NNRTI RPV y el inhibidor de la IN GSK1265744 son los dos compuestos que marcan el liderazgo en esta novedosa propuesta. Los ensayos de fase clínica 1 para el estudio de la farmacocinética y la seguridad de dichas formulaciones indican que una dosis mensual inyectable podría ser suficiente para el tratamiento del HIV, y quizá también, una prometedora opción profiláctica84.
ProbióticosEl reconocimiento de miembros de este grupo como posibles microbicidas ha ido creciendo. Se trata de promover la colonización de la vagina por microorganismos modificados genéticamente para expresar moléculas capaces de inhibir al HIV o a otros responsables de ITS44,65. Estos probióticos utilizan, en su mayoría, bacterias del género Lactobacillus o Bifidobacterium. Estos mismos géneros se han evaluado en ensayos clínicos con otros fines: para la prevención de enterocolitis, de diarrea y de reacciones alérgicas87. El principal desafío está en lograr que estos probióticos mantengan estabilidad genética, se adhieran y persistan, produzcan el compuesto en concentraciones suficientes y sostenidas para bloquear la transmisión del HIV u otras ITS y que, además, mantengan el balance normal de la microflora vaginal.
Estrategias para la investigación preclínica de microbicidas contra HIV y HSV-2Antes de iniciar estudios clínicos con cualquier droga o dispositivo con fines terapéuticos o preventivos en humanos, se requiere un estudio minucioso utilizando sistemas in vitro y modelos animales, con el objeto de obtener información sobre la seguridad y eficacia de dicha droga o dispositivo. Estos estudios, en su mayoría guiados por prerrequisitos sugeridos o impuestos por las agencias reguladoras que aprueban los ensayos clínicos, ayudan a un acercamiento racional y ético, que finalmente permite el estudio en humanos.
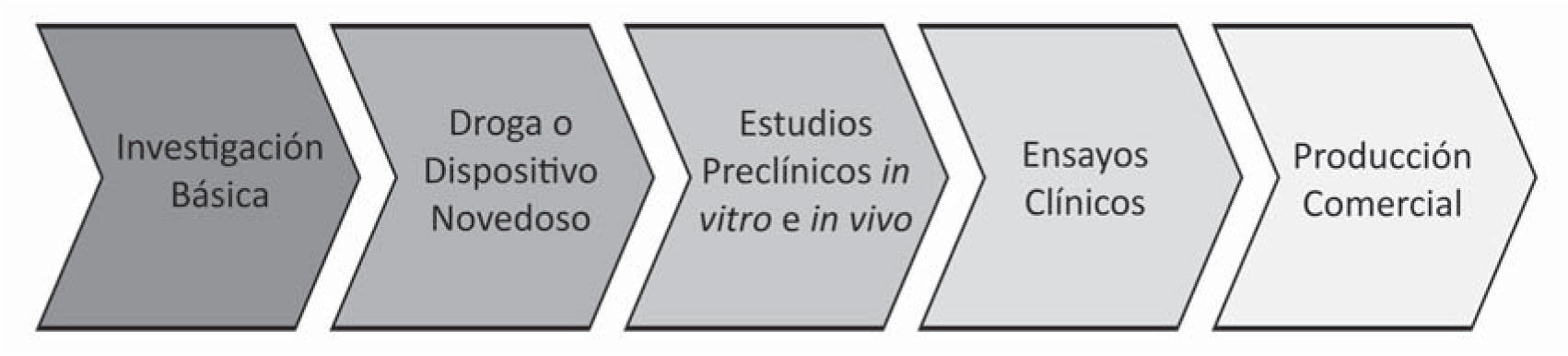
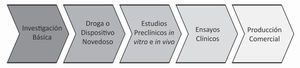
La figura 2 muestra el algoritmo que se debe seguir en el desarrollo de cualquier producto con fines terapéuticos o preventivos. Las cinco fases descritas se inician con la investigación básica, donde se trata de ampliar el conocimiento de los principios fundamentales que rigen el fenómeno que se estudia. En el caso específico de microbicidas contra HIV y HSV-2, la investigación básica se centra en tratar de entender con el mayor lujo de detalles posible el proceso de transmisión viral, cuáles son los factores claves que propician el establecimiento de la infección y las debilidades de este proceso que se pueden convertir en blanco de nuevas estrategias para la prevención. Estas nuevas estrategias podrían ser drogas o dispositivos novedosos que bloquean el establecimiento de la infección, lo cual requiere una serie de estudios preclínicos que comprueben la selectividad de la droga o el dispositivo para bloquear al agente infeccioso, sin causar daño en el hospedador (humanos).
En las dos últimas fases se prueba la seguridad y eficacia en humanos a través de diferentes fases clínicas, seguidas por la introducción del producto en el mercado. Aunque el diagrama parece un proceso simple y rápido, estos estudios, desde la investigación básica hasta la producción comercial, pueden tardar un promedio de 12 a 15 años.
Caracterización de las propiedades físico-químicas, liberación de las drogas formuladas y permeabilidadLos estudios preclínicos de microbicidas empiezan con una evaluación extensa de las propiedades físico-químicas de los candidatos. Entre los estudios que preceden a la formulación destacan los de solubilidad, estabilidad física y química, compatibilidad con excipientes y estudios de combinaciones. Una vez formulado el microbicida, se debe tener en cuenta el pH, la osmolaridad, las propiedades reológicas en el caso de un gel, la apariencia, el olor, el contenido y la uniformidad de la droga, las impurezas, el volumen de las dosis y las dimensiones del producto, entre otras características.
Luego de contar con un prototipo de la formulación, se deben realizar estudios de estabilidad química y física. Se recomienda hacer estudios de almacenamiento prolongado (25°C/60 % de humedad relativa o 30°C/65 % de humedad relativa) o acelerado (40°C/75 % de humedad relativa, > 40°C para anillos vaginales), así como frente a otras condiciones, como por ejemplo, exposición a la luz20.
También durante el desarrollo temprano de la investigación de un microbicida se deben realizar estudios de disolución in vitro, que se realizan utilizando diversos procedimientos, dependiendo del tipo de formulación. En el caso de un gel, los estudios de liberación se realizan empleando celdas tipo Franz, mientras que los anillos vaginales emplean sistemas de incubación con agitación orbital45. Otros estudios relevantes incluyen la permeabilidad en los tejidos, para lo cual se han desarrollado diferentes sistemas in vitro e in vivo, entre los que se destacan los explantes ectocervicales y colorrectales72.
Actividad antiviral in vitro y toxicidad celularA diferencia de los ensayos de sensibilidad en bacterias, no existe un ensayo estándar para determinar actividad antiviral, y numerosas variables pueden afectar el resultado de este tipo de ensayo:
- •
El ensayo de la actividad antiviral contra un mismo virus en diferentes cultivos celulares (línea celular indicadora o cultivo primario) puede generar resultados diferentes.
- •
El uso de cepas virales semilla o aislamientos primarios puede revelar diferente sensibilidad a un agente antiviral.
- •
El uso de inóculos virales muy concentrados puede traducirse en una falsa resistencia al agente antiviral; de igual forma, el uso de un inóculo muy diluido puede aparentar una sensibilidad extrema al mismo agente.
- •
La opción del ensayo antiviral per se es otra variable debido a la diversidad de métodos disponibles.
En los últimos tiempos se han desarrollado múltiples bioensayos para la evaluación in vitro de compuestos con potencial antiviral. Estos métodos se basan en determinar la CE50 teniendo en cuenta la concentración citotóxica media (CC50), para establecer la relación CC50/CE50, también conocida como índice selectivo (IS). El criterio de verdadero agente antiviral basado en los valores del IS varía entre diferentes laboratorios y puede tener valores umbrales entre 10 y 100. En general, se requiere disponer de una línea celular o células primarias sobre las que se replicará el virus, y donde será posible notar los efectos citopáticos característicos o cuantificar proteínas o ácidos nucleicos virales. No obstante, para los virus que no poseen un sistema biológico donde replicarse, se han desarrollado técnicas capaces de estimar la actividad antiviral. Tal es el caso de los pseudovirus de HPV, que contienen genomas reporteros y permiten estimar la actividad de compuestos capaces de interferir con la adsorción y fusión del HPV a células sensibles10.
Técnicas fluorescentes o colorimétricas como el CyQuant, Vibrant Assay, Presto Blue, Rojo Neutro, MTT y XTT son de gran utilidad en la determinación de la CC50 y la CE50, y ofrecen grandes ventajas en velocidad, simplicidad, costo y seguridad de estos ensayos5. Otro método de uso tradicional en virología es la disminución del número de placas de lisis virales, que a pesar de ser un procedimiento tedioso, es altamente confiable y está avalado por su alta sensibilidad y reproducibilidad5. En el caso específico del HSV-2, el ensayo de placas es aceptado como el gold standard para determinar la sensibilidad a agentes antivirales.
En el caso específico del HIV, recientemente la Food and Drug Administration (FDA) publicó una guía para el estudio preclínico de microbicidas, donde recomienda el uso de determinados ensayos en un intento de estandarizar los procedimientos y así poder comparar resultados entre los diferentes agentes microbicidas que están siendo desarrollados. Entre los ensayos y criterios para tener en cuenta, se incluyen los siguientes puntos:
- •
Determinar las curvas de dosis-respuesta en células mononucleares de sangre periférica [peripheral blood mononuclear cells (PBMC)] contra un amplio rango de aislamientos primarios geográficamente diferentes y con fenotipos diferentes, incluyendo al menos una cepa semilla de laboratorio bien caracterizada.
- •
Determinar la actividad antiviral en explantos cérvico-vaginales y colorrectales.
- •
Considerar solo aquellos agentes con IS>10.
- •
Utilizar un rango adecuado de multiplicidades de infección.
- •
Comprobar la actividad antiviral contra virus asociados o no a células.
- •
Determinar la posible interferencia de fluidos biológicos (semen o fluido vaginal) y la transición de pH en la actividad antiviral del agente en estudio.
La resistencia a antivirales se define como una disminución en la sensibilidad del virus a un agente antiviral y se comprueba por la determinación in vitro de la CE50, cuyo valor, en el caso específico del HIV, se incrementa de 5 a 10 veces en una resistencia moderada, o más de 10 veces en una resistencia bien establecida. Este resultado puede ser confirmado mediante el análisis genético del virus y el estudio bioquímico de la proteína viral alterada.
Los experimentos para seleccionar y caracterizar cepas virales resistentes son de vital importancia. Una característica de los retrovirus -y en particular del HIV- con implicaciones para la patogénesis, el diagnóstico, la terapia y la prevención es la variabilidad genética determinada por los siguientes factores54:
- •
La participación de polimerasas virales y celulares en el ciclo replicativo, sin actividad correctora (TI y ARN polimerasa II celular).
- •
La naturaleza diploide del genoma, que facilita deleciones, duplicaciones, inversiones o combinaciones de estos, mediante mecanismos de recombinación.
- •
La integración del ADN provírico en el ADN celular.
Estos mecanismos facilitan la existencia del virus en forma de cuasiespecies virales, donde la secuencia viral predominante está en constante cambio según la presión selectiva que se ejerce sobre el virus56. En la monoterapia contra HIV, esto facilita, por ejemplo, que se seleccionen rápidamente virus resistentes al antirretroviral y se produzca el fracaso del tratamiento, lo que se manifiesta en el incremento de la carga viral en plasma. La mejor estrategia para controlar la resistencia del virus es combinar varias drogas con diferentes mecanismos de acción, ya que se necesitarían múltiples mutaciones en un mismo genoma viral para que el virus pueda mostrar resistencia. Este tratamiento con combinación de antivirales se conoce como terapia antirretroviral altamente activa46. Aun así, se han podido aislar HIV multirresistentes a varias clases de drogas (NRTI, NNRTI e inhibidores de proteasas), especialmente en contextos en los que el tratamiento no se ha seguido con estricta disciplina.
¿Qué relación puede tener el uso de microbicidas para la prevención del HIV con el desarrollo de resistencia viral a estos productos? En un escenario ideal, estos productos serían utilizados solo por personas HIV negativas, pero en realidad existe la posibilidad de que una persona que conozca o no su seropositividad al HIV también use estos productos. Otra pregunta que todavía no tiene respuesta es si el uso meramente tópico de estos productos (no sistémico, como en el tratamiento de personas infectadas) es capaz de ejercer la presión necesaria para seleccionar resistencia viral. Es oportuno señalar que muchos de los compuestos con potencial de ser desarrollados como microbicidas no se absorben eficientemente a través de las mucosas genitales o rectales, lo que hace que estén ausentes o a concentraciones muy bajas en el plasma. Aun así, como se mencionaba anteriormente, habría que demostrar que la población viral en la mucosa genital o rectal de personas infectadas no es propensa a seleccionar mutantes resistentes al microbicida.
Por esta razón, es necesario realizar experimentos in vitro que permitan seleccionar mutantes resistentes, para caracterizarlos genética y fenotípicamente. Esto ayudaría a predecir una posible reducción en la sensibilidad del virus al microbicida e indicaría mutaciones que deben ser monitoreadas en estudios clínicos. De igual forma, estos experimentos permiten indagar en el mecanismo de acción de los microbicidas, ya que mutaciones en proteínas virales indicarían el blanco de la actividad antiviral del compuesto.
Teniendo como paradigma la eficacia de la terapia antirretroviral altamente activa, el mejor enfoque para evitar resistencia viral con microbicidas quizá sea el empleo de combinaciones de microbicidas con diferentes mecanismos de acción.
Efectos en la microflora normalAdemás de evitar la adquisición de ITS, el uso de microbicidas vaginales o rectales tiene que garantizar la seguridad y la ausencia de efectos tóxicos. Un ejemplo de estos efectos tóxicos puede ser el desequilibrio bacteriano en las mucosas, que podría implicar la eliminación de la flora bacteriana. Independientemente de la potencia del candidato microbicida contra cualquier ITS, si afecta la viabilidad de bacterias de la microbiota, como los lactobacilos, no se debe continuar su desarrollo. Es por ello que los ensayos in vitro en los que se incuba Lactobacillus con el candidato a microbicida deben ser realizados en un inicio.
Una vez formulados en geles, anillos vaginales, láminas flexibles o tabletas, se pueden hacer estudios in vivo en monos, donde se estudia la microflora normal antes y después del suministro continuo del producto. Otros estudios incluyen monitoreo del pH vaginal o rectal así como la producción de citocinas, que pueden predecir algún proceso inflamatorio62,63.
Estudios farmacocinéticos y farmacodinámicosEstos estudios permiten indagar en todo el proceso que sigue un fármaco, desde que se aplica a un organismo hasta que se elimina de aquel. También nos dan información sobre los efectos bioquímicos y fisiológicos, el mecanismo de acción y la relación entre la concentración del fármaco y su eficacia. El microbicida ideal debe ser distribuido en los tejidos de las mucosas susceptibles de ser infectadas por el HIV, debe ser metabolizado (si es necesario) de forma eficiente en estos tejidos y debe alcanzar una concentración adecuada y sostenida. Adicionalmente, como se discutió en la sección de resistencia viral, se debe evitar el paso a la circulación sistémica para minimizar el desarrollo de resistencia viral, así como cualquier efecto tóxico.
La mayoría de los estudios farmacocinéticos y farmacodinámicos con microbicidas contra HIV se han realizado utilizando monos como modelo animal o en estudios clínicos de fase 1 o 21. Muchos de los estudios se han basado en comparar diferentes dosis del microbicida luego de una simple o múltiple aplicación, monitoreando los niveles del microbicida en fluidos vaginales o rectales, biopsias vaginales, cervicales o rectales, así como en el plasma. También se han empleado muestras de tejidos rectales colectadas luego de la aplicación del microbicida, para explorar la protección de estos tejidos ex vivo cuando son inoculados con HIV69. Se han observado resultados alentadores en algunos de los microbicidas estudiados, pero la relevancia de estos resultados aún está por ser determinada, ya que estos métodos no han sido validados.
Estudios de la seguridad y eficacia en modelos animalesExisten diferentes modelos animales para el estudio de la seguridad y eficacia de microbicidas. Aunque los modelos para el estudio de la seguridad constituyen un requisito primordial para avanzar hacia las fases clínicas, las agencias reguladoras todavía no consideran relevantes los modelos animales para estudiar eficacia contra el HIV. Esto se debe a la ausencia de modelos animales validados para predecir eficacia en humanos. Sin embargo, el contar con datos de eficacia para un microbicida, especialmente cuando se realizan ensayos muy rigurosos y exigentes, que requieren de un microbicida de alta potencia, puede considerarse útil a la hora de querer elegir, entre muchos candidatos, cuál podría ser el más apto para entrar en estudios clínicos.
Modelos animales para el estudio de la seguridadLa evaluación preclínica de la seguridad de los microbicidas se basa fundamentalmente en ensayos in vitro que miden citotoxicidad en cultivos celulares o explantes de tejidos cérvico-vaginales o colorrectales. Sin embargo, estos sistemas in vitro no contemplan procedimientos que permitan la exposición prolongada o repetida a un microbicida y carecen de tejidos de la mucosa intactos, donde realmente se pueda evaluar una respuesta inflamatoria.
Se han utilizado modelos animales en conejos, cerdos, ratones y monos para evaluar el potencial inflamatorio y de irritabilidad de formulaciones concebidas para uso vaginal11,15,21. El modelo de irritación vaginal en conejos es, quizás, el más utilizado y el único aprobado por la FDA para la evaluación de la irritación vaginal. El modelo consiste en la aplicación repetida de la fórmula en la vagina de conejos y el monitoreo de la presencia de eritemas, edemas y secreciones vaginales. El estudio también incluye la obtención de cortes histológicos de tejido expuesto a la formulación para evaluar la presencia de exfoliación epitelial, infiltración de leucocitos, edemas y congestión vascular.
Otro modelo importante comprende la aplicación del candidato a microbicida por vía vaginal o rectal (de forma repetida o persistente) en monos macacos rhesus (Macaca mulatta). Estos estudios permiten monitorear el pH vaginal o rectal y los componentes y constituyentes microbiológicos en lavados vaginales o rectales, para obtener medidas indicadoras de la salud general de la mucosa vaginal o rectal62,63.
Recientemente se ha descrito el modelo de incremento de la sensibilidad a la infección por HSV-2 en ratones, que se utiliza como biomarcador para predecir el incremento del riesgo a la infección por HIV102. Este modelo consiste en la aplicación sucesiva en ratones de varias dosis del microbicida por vía vaginal, antes de infectar con una dosis subóptima del HSV-2. La dosis de virus empleada permite detectar un incremento en la infección del HSV-2 en caso de que ocurran daños que perjudiquen la integridad de la mucosa vaginal.
Modelos animales para el estudio de la eficacia contra HIV, HSV-2 o HPVExisten modelos en primates no humanos donde virus quiméricos preparados a partir del virus de la inmunodeficiencia de los simios, que portan información genética del HIV, se utilizan para infectar macacos rhesus26. Por ejemplo, cuando se estudia el efecto de un compuesto que tiene como mecanismo de acción el bloqueo de la transcripción inversa, se utiliza un virus quimérico SHIV que porta la enzima TI del HIV, al que se lo denomina SHIV-TI.
Con estos modelos en monos macacos rhesus se puede evaluar una sola dosis alta de SHIV o dosis repetidas bajas, que intentan asemejar el escenario real de exposición en humanos al HIV. Ambos esquemas tienen sus ventajas y desventajas. El esquema de dosis única alta se realiza en monos pretratados con progesterona, lo que conduce a una reducción del grosor del epitelio vaginal, facilitando la transmisión del virus. Este tratamiento puede representar, junto con la dosis alta del virus, un escenario demasiado riguroso y exigente para un candidato a microbicida. Sin embargo, si el candidato bloquea la transmisión en estas condiciones, se lo puede considerar como un microbicida con actividad robusta contra el HIV95.
El esquema de dosis repetidas bajas consiste en exponer los monos macacos rhesus al SHIV semanalmente. Este facilita la evaluación de la eficacia del candidato a microbicida en condiciones controladas, pero tiene como desventaja la complejidad en la logística. Un experimento puede tardar cerca de un año27,61,85. Los dos esquemas tienen como desventaja el no poder utilizar virus asociado a células.
Un modelo reciente, con resultados prometedores, es la quimera ratón/humana a través del injerto de células del sistema inmunitario humano en ratones con inmunodeficiencia18 (modelo de ratón BLT). En este modelo se utilizan células humanas fetales de médula ósea, de hígado y de timo. A través de este modelo se ha estudiado la eficacia de candidatos microbicidas empleando como inóculo viral virus asociado o no a células19. La principal desventaja de este modelo es la disponibilidad de tejidos humanos, así como el costo del procedimiento.
El modelo de ratón (Mus musculus) para estudiar la eficacia de compuestos con actividad antiviral contra HSV-2 tiene un largo historial y es el más utilizado. Existen diferentes modelos en ratón dependiendo de la vía que se utilice para la infección, ya sea vaginal, rectal, intranasal o por escarificación lumbosacra2,9,23,64,104. Tiene la ventaja del bajo costo y el uso de una línea consanguínea de ratón, pero el modelo carece de reactivación espontánea y excreción del virus en las mucosas. Otros modelos animales como el de cobayos (Cavia porcellus) o el de la rata del algodón (del inglés, cotton rat: Sigmodon hispidus) sí reproducen la reactivación espontánea y la excreción del virus que se ve en humanos7,103. También existen modelos en primates no humanos, como es el caso del mono lechuza (Aotus trivirgatus), con una sensibilidad y mortalidad alta luego de la infección con el HSV-2, y más recientemente, un modelo en monos macacos rhesus en el que se observan lesiones genitales en un 10 % de los animales14,53.
En el caso del HPV se ha descrito un modelo en ratones y macacos70,71. Este modelo consiste en el uso de pseudovirus del HPV que carecen del genoma viral, y en su lugar, contienen un plásmido con genes reporteros en el interior de la cápside compuesta por las proteínas L1 y L2. El pseudovirus tiene la capacidad de imitar los pasos tempranos de la infección por HPV hasta que el pseudovirus entra a las células blanco y el gen reportero (luciferasa) se expresa70,71. Utilizando este modelo se pueden estudiar microbicidas con la capacidad de bloquear cualquier paso de la replicación viral antes de la entrada a la célula blanco.
ConclusionesLos microbicidas para la prevención de ITS aportan un indiscutible valor al arsenal de herramientas (establecidas o en estudio) dirigidas a disminuir la prevalencia de ITS. Se han dado pasos importantes con pruebas de conceptos que justifican el desarrollo de esta tecnología, y nuevas ideas, como las “tecnologías preventivas multipropósito” [multipurpose prevention technologies (MPT)], auguran ampliar el espectro de las aplicaciones de los microbicidas. Las MPT buscan desarrollar microbicidas que combinen diferentes compuestos con la capacidad de bloquear diferentes ITS o incluso también prevenir embarazos no deseados.
A pesar de la indiscutible promesa que brindan los microbicidas para la prevención del HIV y otras ITS, los ensayos clínicos han identificado el factor adherencia como uno de los puntos críticos que se debe mejorar. Teniendo en cuenta que la adherencia es fundamental para el éxito de los ensayos clínicos, es importante también identificar el grado en que la aceptación es un factor en el uso del microbicida55. La introducción de anticonceptivos en las fórmulas microbicidas y la posibilidad de prevenir simultáneamente otras ITS (además del HIV) podrían disminuir el estigma asociado a un producto anti-HIV y hacerlo más aceptable. También el desarrollo de diferentes opciones para suministrar estos microbicidas puede ayudar a incrementar la adherencia a estos productos. Con este objetivo se están diseñando y estudiando novedosos sistemas para formular y aplicar combinaciones de drogas, como es el ejemplo de anillos vaginales73 o nanofibras6,41.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.