Este trabajo tuvo por objetivo aislar, identificar y caracterizar morfológicamente hongos entomopatógenos presentes en suelos cultivados con yerba mate (Ilex paraguariensis St. Hil.). Se realizó una prospección de hongos entomopatógenos nativos a partir de 40 muestras de suelos cultivados con yerba mate ubicados en la provincia de Misiones, República Argentina, desde mayo de 2008 hasta junio de 2010. Las muestras de suelo se obtuvieron en cercanías de plantas de yerba mate, se aplicó la técnica de dilución seriada en medios de cultivos selectivos. Después de obtenidos los cultivos puros, los hongos fueron caracterizados macroscópica y microscópicamente, y se los identificó mediante el uso de claves taxonómicas específicas. Se aislaron 29 cepas fúngicas pertenecientes a las especies Beauveria bassiana (n = 17), Metarhizium anisopliae (n = 2) y Purpureocillium lilacinum (n = 10).
This study aimed to morphologically isolate, identify and characterize entomopathogenic fungi present in soils cultivated with Paraguay tea (Ilex paraguariensis). A survey of native entomopathogenic fungi was conducted from 40 soil samples grown with Paraguay tea in the province of Misiones, Argentina, from May 2008 to June 2010. The soil dilution plate methodology on selective culture media was used to isolate microorganisms. Taxonomic identification was performed using macroscopic and microscopic characters and specific keys. Twenty nine strains, belonging to the species Beauveria bassiana (n = 17), Metarhizium anisopliae (n = 2) and Purpureocillium lilacinum (n = 10) were isolated and identified.
La yerba mate (Ilex paraguariensis St. Hil.) es una planta arbórea típica de las regiones subtropicales y templadas de América del Sur. El área de dispersión geográfica de esta especie está restringida a Argentina, Brasil y Paraguay. Los hongos entomopatógenos son microorganismos que tienen la particularidad de parasitar a diferentes grupos de insectos y algunos artrópodos, como las arañas y los ácaros4; estos hongos pertenecen al reino Mycota y se ubican en los Phyla Ascomycota y Entomophthoromycota3,7.
El ciclo biológico de los hongos entomopatógenos presenta 2 fases, una parasítica y otra saprofítica. La primera se inicia con la adhesión de estructuras infectivas del hongo (conidios o blastosporas) en la epicutícula del insecto, seguida de la penetración vía tegumento, que ocurre debido a la acción física y enzimática. Después de la penetración, el hongo crece dentro del hospedador, secreta sustancias tóxicas y coloniza los tejidos del insecto. Luego ocurre la esporulación externa del patógeno: a través de la cutícula se forman los conidióforos, estructuras responsables de la producción de conidios. Los conidios son dispersados por agentes abióticos (viento, lluvia, etc.) y bióticos (hospederos primarios y secundarios). La fase saprofítica ocurre en el ambiente cuando el hongo crece fuera del cuerpo del hospedero1,4. El ambiente del suelo constituye un importante reservorio para una diversidad de hongos entomopatógenos, que pueden contribuir significativamente a la regulación de las poblaciones de insectos.
Muchas especies de hongos pertenecientes al orden Hypocreales (Phylum: Ascomycota) habitan en el suelo para cumplir una parte de su ciclo de vida, entre ellos los géneros más comunes son Beauveria, Metarhizium e Isaria8. En la estabilidad de estos hongos influyen tanto factores bióticos como abióticos del ambiente, la supervivencia del hongo depende de la temperatura y el contenido de agua. La temperatura ideal del suelo para la persistencia de los hongos entomopatógenos varía de acuerdo con el aislamiento del hongo, el tipo de suelo y su grado de compactación, la humedad, el pH y la presencia de antagonistas10. El ambiente del suelo puede ser visto como un ecosistema extremadamente complejo que interfiere con las interacciones primarias entre insectos hospederos y patógenos, o bien como un ecosistema simple y estable que actúa en la interacción patógeno-hospedero11.
El presente trabajo tuvo por objetivo aislar, identificar y caracterizar morfológicamente hongos entomopatógenos presentes en suelos cultivados con yerba mate (I. paraguariensis) en la provincia de Misiones, República Argentina.
Se recolectaron 40 muestras de suelo de cultivos de yerba mate desde mayo de 2008 hasta junio de 2010 en 5 localidades de la provincia de Misiones: Santa Inés, Jardín América, Apóstoles, Campo Ramón y Ruiz de Montoya. En cada sector de muestreo se delimitó una parcela de 25 m2 y con una pala estéril a una profundidad de 0-20cm se recolectaron independientemente 3 submuestras de 500g de suelo cada una.
Para el aislamiento de hongos entomopatógenos se aplicó la técnica de dilución seriada en medio de cultivo selectivo con dodine (acetato de N-dodecilguanidinio)5 (40g de glucosa, 10g de peptona, 15g de agar, 0,01g de cristal violeta, 0,25g de cicloheximida, 0,25g de Dodine®, 0,5g de cloranfenicol y 1 l de agua destilada). Los hongos así aislados fueron identificados a partir de la descripción macroscópica y microscópica de las estructuras vegetativas y reproductivas, las que luego se compararon con las detalladas en las claves taxonómicas6.
Para estudiar la dinámica de crecimiento y esporulación, cilindros de 4mm de diámetro fueron obtenidos a partir de cultivos jóvenes, cada cilindro se colocó en el centro de una caja de Petri que contenía agar dextrosa Sabouraud enriquecido con 1% de extracto de levadura (SDYA, Difco, Detroit, EE. UU.); se realizaron 5 repeticiones por cada aislamiento y se incubaron a 25°C en condiciones de oscuridad durante 10 días. El diámetro de las colonias fue medido diariamente empleando una regla milimetrada. A partir de cultivos fúngicos esporulados se hicieron preparados para observar los conidios, las células conidiógenas (fiálides o conidióforos) y las hifas de cada aislamiento, se empleó un microscopio óptico con contraste de fases (400 ×) (Olympus BX41); para cada cultivo se midió un mínimo de 25 unidades, esto permitió determinar la media y el error estándar de los datos.
A partir de un total de 40 muestras de suelo de cultivos de yerba mate de diferentes localidades de la provincia de Misiones se obtuvieron 29 aislamientos correspondientes al grupo de hongos entomopatógenos, los que comprendieron 3 especies y se distribuyeron del siguiente modo: 17 cepas de Beauveria bassiana (Bals.) Vuill.; 2 cepas de Metarhizium anisopliae (Metsch.) Sorok y 10 cepas de Purpureocillium lilacinum (Thom) Luangsa-ard, Hywel-Jones, Houbraken & Samsom3,7,8. Todos los aislamientos obtenidos fueron depositados en la Colección Micológica del Centro de Estudios Parasitológicos y de Vectores (CEPAVE-CONICET-UNLP), con el objetivo de realizar en el futuro bioensayos de patogenicidad y virulencia con estos hongos entomopatógenos, para evaluar su posible uso en el control biológico de insectos plaga de la yerba mate.
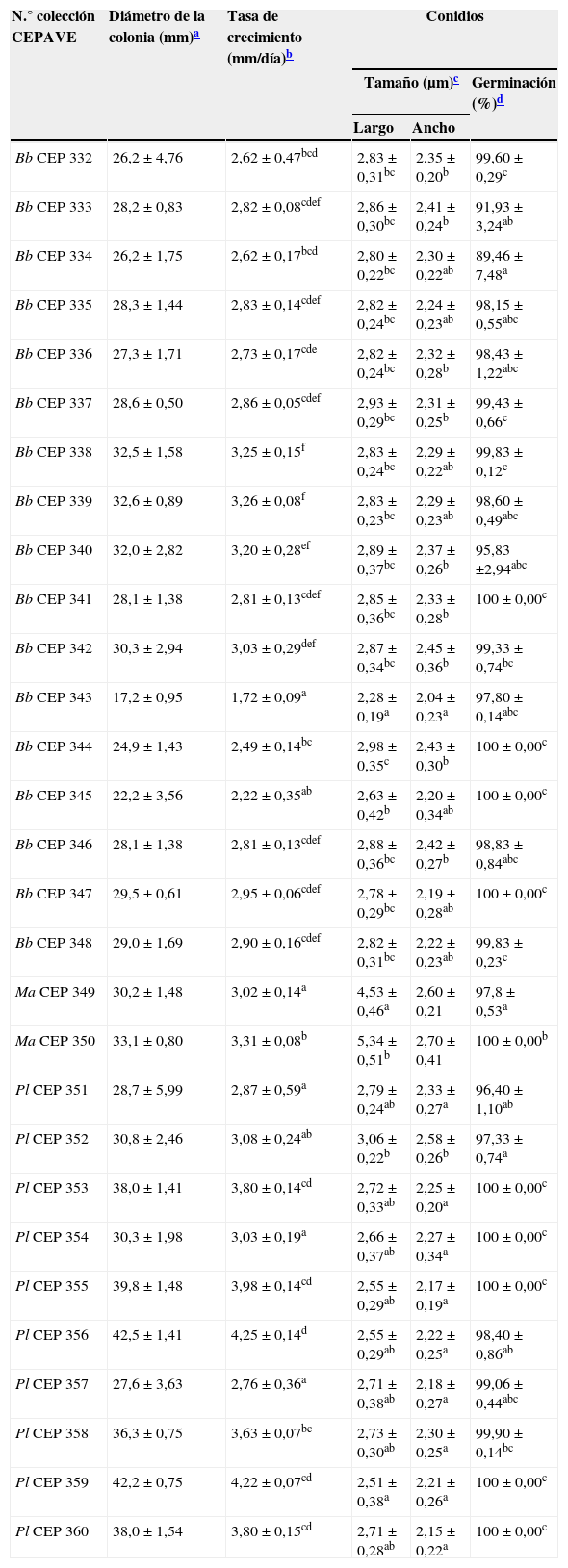
Se observó que los aislamientos obtenidos de una misma especie presentaban diferencias en la tasa de crecimiento, la coloración del micelio, las dimensiones de las estructuras reproductivas y el porcentaje de germinación de los conidios (tabla 1). Las colonias de B. bassiana presentaron un crecimiento moderadamente rápido: alcanzaron un diámetro promedio de 27,8±4,01mm a los 10 días de incubación. La diferencia en la tasa de crecimiento fue altamente significativa al comparar los distintos aislamientos (F=14,90;g.l=16; p<0,0001). El micelio presentó un aspecto pulverulento y coloración blanca, los conidióforos se mostraron agrupados en racimos, con fiálides con parte basal dilatada y terminadas en un raquis en zigzag y los conidios presentaron una forma globosa a subglobosa. Las diferencias en el largo y el ancho de los conidios entre los diferentes aislamientos fúngicos fueron altamente significativas (largo: F=6,10;g.l=16; p<0,0001; ancho: F=3,81;g.l=16; p<0,0001). La diferencia en el porcentaje de germinación de los conidios también fue altamente significativa (F=4,66;g.l=16; p<0,0001), en todos los casos estos fueron superiores al 90%, excepto en el aislamiento CEP 334, cuyo porcentaje de germinación fue del 89,40%. Las colonias de M. anisopliae presentaron un crecimiento moderadamente rápido y alcanzaron un diámetro promedio de 31,6±1,91mm a los 10 días de incubación. La diferencia en la tasa de crecimiento de los 2 aislamientos obtenidos fue altamente significativa (F=14,02;g.l=1; p=0,0057); el micelio fúngico presentó un aspecto fino y abundante, elevado del medio de cultivo y formando agrupaciones casi esféricas, sobre las cuales se observó la esporulación verde oliváceo oscura; en cultivo presentó hifas lisas, septadas, con conidióforos cilíndricos en grupos. Los conidios presentaron forma cilíndrica, eran ahusados y con ambos extremos redondeados, hialinos a oliváceos o verdes. Se encontró una diferencia altamente significativa entre estos 2 aislamientos en el largo de los conidios (F=34,87;g.l=1; p<0,0001), no así en el ancho (F=1,32;g.l=1; p=0,2559). El porcentaje de germinación de los conidios fue significativamente diferente entre los aislamientos fúngicos, con valores superiores al 90% en ambos casos. Las colonias de P. lilacinum presentaron un crecimiento moderadamente rápido y alcanzaron un diámetro promedio de 35,6±5,86mm a los 10 días de incubación. La diferencia en la tasa de crecimiento de estos aislamientos fue altamente significativa (F=21,80,g.l=9; p<0,0001). El micelio fúngico mostró un aspecto algodonoso y pulverulento, de color blanco al comienzo, tornándose con el correr de los días rosáceo; tanto las hifas vegetativas como los conidióforos presentaron paredes hialinas y lisas. Los conidióforos fueron ramificados e irregulares, con fiálides que presentaban una porción basal cilíndrica o hinchada, que se adelgazaba abruptamente para formar a menudo un cuello muy notorio. Los conidios presentaron forma ovoide. Las diferencias en el largo y el ancho de los conidios entre los diferentes aislamientos fúngicos fueron altamente significativas (largo: F=6,36;g.l=9; p<0,0001; ancho: F=5,88;g.l=9; p<0,0001). La diferencia en el porcentaje de germinación de los conidios fue altamente significativa (F=7,52;g.l=9; p=0,0001), con valores superiores al 90% en todos los casos.
Características de los aislamientos de B. bassiana, M. anisopliae y P. lilacinum obtenidos de muestras de suelos cultivados con I. paraguariensis
| N.° colección CEPAVE | Diámetro de la colonia (mm)a | Tasa de crecimiento (mm/día)b | Conidios | ||
|---|---|---|---|---|---|
| Tamaño (μm)c | Germinación (%)d | ||||
| Largo | Ancho | ||||
| Bb CEP 332 | 26,2±4,76 | 2,62±0,47bcd | 2,83±0,31bc | 2,35±0,20b | 99,60±0,29c |
| Bb CEP 333 | 28,2±0,83 | 2,82±0,08cdef | 2,86±0,30bc | 2,41±0,24b | 91,93±3,24ab |
| Bb CEP 334 | 26,2±1,75 | 2,62±0,17bcd | 2,80±0,22bc | 2,30±0,22ab | 89,46±7,48a |
| Bb CEP 335 | 28,3±1,44 | 2,83±0,14cdef | 2,82±0,24bc | 2,24±0,23ab | 98,15±0,55abc |
| Bb CEP 336 | 27,3±1,71 | 2,73±0,17cde | 2,82±0,24bc | 2,32±0,28b | 98,43±1,22abc |
| Bb CEP 337 | 28,6±0,50 | 2,86±0,05cdef | 2,93±0,29bc | 2,31±0,25b | 99,43±0,66c |
| Bb CEP 338 | 32,5±1,58 | 3,25±0,15f | 2,83±0,24bc | 2,29±0,22ab | 99,83±0,12c |
| Bb CEP 339 | 32,6±0,89 | 3,26±0,08f | 2,83±0,23bc | 2,29±0,23ab | 98,60±0,49abc |
| Bb CEP 340 | 32,0±2,82 | 3,20±0,28ef | 2,89±0,37bc | 2,37±0,26b | 95,83 ±2,94abc |
| Bb CEP 341 | 28,1±1,38 | 2,81±0,13cdef | 2,85±0,36bc | 2,33±0,28b | 100±0,00c |
| Bb CEP 342 | 30,3±2,94 | 3,03±0,29def | 2,87±0,34bc | 2,45±0,36b | 99,33±0,74bc |
| Bb CEP 343 | 17,2±0,95 | 1,72±0,09a | 2,28±0,19a | 2,04±0,23a | 97,80±0,14abc |
| Bb CEP 344 | 24,9±1,43 | 2,49±0,14bc | 2,98±0,35c | 2,43±0,30b | 100±0,00c |
| Bb CEP 345 | 22,2±3,56 | 2,22±0,35ab | 2,63±0,42b | 2,20±0,34ab | 100±0,00c |
| Bb CEP 346 | 28,1±1,38 | 2,81±0,13cdef | 2,88±0,36bc | 2,42±0,27b | 98,83±0,84abc |
| Bb CEP 347 | 29,5±0,61 | 2,95±0,06cdef | 2,78±0,29bc | 2,19±0,28ab | 100±0,00c |
| Bb CEP 348 | 29,0±1,69 | 2,90±0,16cdef | 2,82±0,31bc | 2,22±0,23ab | 99,83±0,23c |
| Ma CEP 349 | 30,2±1,48 | 3,02±0,14a | 4,53±0,46a | 2,60±0,21 | 97,8±0,53a |
| Ma CEP 350 | 33,1±0,80 | 3,31±0,08b | 5,34±0,51b | 2,70±0,41 | 100±0,00b |
| Pl CEP 351 | 28,7±5,99 | 2,87±0,59a | 2,79±0,24ab | 2,33±0,27a | 96,40±1,10ab |
| Pl CEP 352 | 30,8±2,46 | 3,08±0,24ab | 3,06±0,22b | 2,58±0,26b | 97,33±0,74a |
| Pl CEP 353 | 38,0±1,41 | 3,80±0,14cd | 2,72±0,33ab | 2,25±0,20a | 100±0,00c |
| Pl CEP 354 | 30,3±1,98 | 3,03±0,19a | 2,66±0,37ab | 2,27±0,34a | 100±0,00c |
| Pl CEP 355 | 39,8±1,48 | 3,98±0,14cd | 2,55±0,29ab | 2,17±0,19a | 100±0,00c |
| Pl CEP 356 | 42,5±1,41 | 4,25±0,14d | 2,55±0,29ab | 2,22±0,25a | 98,40±0,86ab |
| Pl CEP 357 | 27,6±3,63 | 2,76±0,36a | 2,71±0,38ab | 2,18±0,27a | 99,06±0,44abc |
| Pl CEP 358 | 36,3±0,75 | 3,63±0,07bc | 2,73±0,30ab | 2,30±0,25a | 99,90±0,14bc |
| Pl CEP 359 | 42,2±0,75 | 4,22±0,07cd | 2,51±0,38a | 2,21±0,26a | 100±0,00c |
| Pl CEP 360 | 38,0±1,54 | 3,80±0,15cd | 2,71±0,28ab | 2,15±0,22a | 100±0,00c |
Se indican en el cuerpo de la tabla valor promedio ± error estándar. Letras diferentes dentro de las columnas indican diferencias significativas entre aislamientos según el test de Tukey, p<0,05.
Los presentes resultados muestran que los hongos entomopatógenos son habitantes comunes de suelos cultivados con yerba mate en la provincia argentina de Misiones. B. bassiana fue la especie más abundante y representó el 59% de los aislamientos, seguida por P. lilacinum (34%) y M. anisopliae (7%). Estos hongos entomopatógenos son citados por otros autores como los más comunes en el suelo9,13,14. Que se hayan obtenido aislamientos de B. bassiana, P. lilacinum, M. anisopliae y no de Nomuraea rileyi u otros entomopatógenos también habitualmente presentes en el suelo pudo deberse a la utilización del medio selectivo5.
En campos de soja de Londrina (Paraná, Brasil), los hongos entomopatógenos aislados en medio de cultivo selectivo avena-dodine (20g de harina de avena, 20g de agar, 550mg de dodine, 5mg de tetraciclina, 10mg de cristal violeta y 1 l de agua destilada) fueron M. anisopliae, B. bassiana y P. lilacinum13, lo que concuerda con los resultados de este trabajo, en el que también se utilizó un medio selectivo con dodine.
Diversos factores pueden afectar la persistencia de los hongos entomopatógenos en el suelo. La supervivencia de los conidios de B. bassiana depende de la temperatura, el contenido de agua y el tipo de suelo10. Asimismo, se conoce que B. basssiana sobrevive por más tiempo en áreas de clima templado y donde existen huéspedes para tener continuidad en su ciclo de infección15. Por otra parte, en términos generales M. anisopliae puede llegar a estar presente en el suelo más frecuentemente que B. bassiana, ya que este último parece ser más sensible a la interacción con la microbiota del suelo2; sin embargo, en el presente estudio la prevalencia de B. bassiana fue mayor que la de M. anisopliae. Las prácticas agrícolas como la fertilización y el uso de insecticidas, funguicidas y herbicidas afectan la persistencia de los hongos en el suelo. En cultivos de soja bajo labranza mínima se favorece la prevalencia en el suelo de algunas especies de hongos entomopatógenos como B. bassiana, M. anisopliae y Paecilomyces spp. en comparación con zonas bajo labranza convencional12, lo que concuerda con nuestros resultados, ya que todas las muestras de suelo se tomaron de lotes con labranza mínima.
Los resultados obtenidos en el presente estudio contribuyen a avalar la hipótesis planteada por otros autores acerca de que los suelos son un importante reservorio de hongos entomopatógenos, antagonistas potenciales para el control de insectos plaga.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo de investigación fue financiado por la Universidad Nacional de La Plata (UNLP) y el Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), a través de una beca doctoral.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Dr. Richard A. Humber (USDA-ARS Plant Soil and Nutrition Laboratory, Ithaca), por su colaboración con la confirmación de las especies fúngicas identificadas. A la Colección Micológica del Centro de Estudios Parasitológicos y de Vectores (CEPAVE), por permitir la preservación de cultivos y material de herbario. A la Universidad Nacional de La Plata (UNLP) y al Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), por financiar este estudio a través de una beca doctoral.