En contraste con la simbiosis entre rizobios y leguminosas, la especificidad de las Pseudomonas en la colonización radicular parece menos estricta. Sin embargo, estudios sobre la diversidad bacteriana del nicho rizosférico resaltan la influencia de la especie vegetal en la selección específica de ciertos microorganismos a partir de la flora residente del suelo. Para evaluar el efecto que los cultivos extensivos de nuestro país tienen sobre la estructura de las comunidades de Pseudomonas, se realizaron experimentos con plantas trampa, partiendo de semillas de trigo, maíz y soja desinfectadas superficialmente y sembradas en un mismo suelo prístino. A partir de las suspensiones representativas de la microflora del rizoplano, se realizaron recuentos en placa en medio selectivo para Pseudomonas. El conjunto de colonias originado a partir de los distintos rizoplanos se utilizó como fuente de ADN para analizar la estructura de comunidad a través del perfil de restricción de amplicones de los genes oprF y gacA. El análisis comparativo de estos perfiles agrupó a las muestras por especie de planta y las distinguió del patrón obtenido a partir del suelo prístino. La secuenciación parcial del gen 16S ADNr de aislamientos bacterianos representativos confirmó la existencia de genotipos enriquecidos diferencialmente en el rizoplano de cada especie vegetal. Estos resultados apoyan la hipótesis de la existencia de mecanismos de selección específica de estirpes de Pseudomonas a partir de la flora nativa del suelo en la interacción cooperativa entre estas PGPR y las raíces de diferentes cultivos como trigo, soja y maíz.
In contrast to rhizobia-legume symbiosis, the specificity for root colonization by pseudomonads seems to be less strict. However, several studies about bacterial diversity in the rhizosphere highlight the influence of plant species on the selective enrichment of certain microorganisms from the bulk soil community. In order to evaluate the effect that different crops have on the structure of pseudomonad community on the root surface, we performed plant trap experiments, using surface-disinfected maize, wheat or soybean seeds that were sown in pots containing the same pristine soil as substrate. Rhizoplane suspensions were plated on a selective medium for Pseudomonas, and pooled colonies served as DNA source to carry out PCR-RFLP community structure analysis of the pseudomonads-specific marker genes oprF and gacA. PCR-RFLP profiles were grouped by plant species, and were distinguished from those of bulk soil samples. Partial sequencing of 16S rDNA genes of some representative colonies of Pseudomonas confirmed the selective enrichment of distinctive genotypes in the rhizoplane of each plant species. These results support the idea that the root systems of agricultural crops such as soybean, maize and wheat, select differential sets of pseudomonads from the native microbial repertoire inhabiting the bulk soil.
La porción de suelo bajo la influencia directa de las raíces de las plantas se denomina rizósfera y en la práctica comprende las partículas de suelo que se encuentran firmemente adheridas a la superficie radicular en un espacio de unos pocos milímetros alrededor de las raíces9. El rizoplano comprende la zona inmediatamente exterior a la epidermis radicular, en donde ocurren procesos de adhesión bacteriana y fúngica5,9. En la rizósfera y el rizoplano, existe una intensa actividad microbiana, y la interacción entre las plantas y los microorganismos desempeña un papel fundamental en la nutrición y la salud de aquellas y en la composición de las comunidades microbianas4. Entre los microorganismos probióticos que habitan este nicho encontramos las rizobacterias promotoras del crecimiento vegetal o PGPR (sigla derivada de su denominación en inglés: plant growth promoting rhizobacteria), que entre los géneros cultivables incluyen a Bacillus, Azospirillum, Pseudomonas, Azotobacter, Pantoea, Burkholderia y Streptomyces.
En la naturaleza existen diferentes clases de asociaciones entre plantas y microorganismos de acuerdo con el grado de especificidad, las señales moleculares implicadas y las consecuencias que resultan de ellas: parasitismo, mutualismo o asociaciones cooperativas5. En el parasitismo, las consecuencias dependen en términos moleculares de la interacción específica de proteínas de resistencia («avirulencia») de la planta hospedadora y de «factores de virulencia» liberados por los patógenos, como en el caso de diferentes patovares de Pseudomonas syringae10. En el mutualismo, asociación típica entre rizobios y leguminosas, las señales moleculares específicas de reconocimiento de ambos simbiontes son determinantes para la asociación11. En la cooperación, las características de especificidad entre la bacteria y la planta parecen ser menos estrictas, aunque existiría una tendencia de reconocimiento y adaptación de cepas «no específicas» hacia rasgos «específicos» del genotipo vegetal, lo que implicaría un papel relevante por parte de los exudados de las plantas hacia las PGPR5. Por lo tanto, se hipotetiza que existirían mecanismos específicos aún desconocidos en las PGPR para el reconocimiento de las raíces del hospedador y el posible control de las plantas sobre la colonización y la expresión de actividades benéficas5. Diversos estudios indican la existencia de efectos específicos de las plantas sobre la composición y la abundancia relativa de las poblaciones microbianas en la rizósfera de cultivos y plantas nativas, que apoyarían el concepto de la cooperación4,12. Las bacterias de las familias Burkholderiaceae y Pseudomonadaceae son miembros dominantes en la microbiota rizosférica por su habilidad para utilizar un amplio rango de sustratos carbonados12, por lo que se cree que estas bacterias son atraídas y estimuladas por la presencia y la composición de distintos exudados radiculares4,5. Ensayos con cepas de Pseudomonas fluorescens y Pseudomonas putida indicaron que los exudados radiculares aumentan la capacidad de competir y colonizar la rizósfera de plantas de tomate, mientras que sus mutantes mostraron deficiencia en la colonización de las raíces8. Se ha señalado la preferencia de Pseudomonas productoras del antibiótico DAPG (2,4-diacetilfluoroglucinol) para colonizar las raíces de un genotipo particular de trigo15, mientras que otros ensayos en lotes experimentales reflejaron el efecto de ciertos híbridos de maíz sobre la diversidad genética de Pseudomonas productoras de DAPG y de auxinas, comparadas con sus líneas parentales13,14.
En función de estos antecedentes, la hipótesis de este trabajo propone que en el rizoplano —región en la que se espera se produzca la colonización por parte de las especies bacterianas más competitivas y agresivas— de plantas cultivadas, se podrán encontrar cepas reclutadas en forma diferencial, según la especie vegetal, a partir de una comunidad autóctona de Pseudomonas de un suelo que no posee historia de cultivo agrícola, reflejando el efecto de selección de la planta sobre la población de Pseudomonas nativas del suelo. El objetivo de este trabajo fue analizar en forma comparativa los genotipos de las poblaciones de Pseudomonas asociadas íntimamente a las raíces de diferentes plantas (soja, maíz y trigo) introducidas por primera vez en una muestra de un mismo suelo prístino. Para ello, se realizaron experimentos con plantas trampa, partiendo de semillas de trigo, maíz y soja desinfectadas superficialmente y sembradas en un sustrato que contenía suelo sin historia de manejo agrícola. La muestra de suelo se obtuvo de la reserva Santa Catalina (Llavallol, provincia de Buenos Aires (34° 47’ S, 58° 26’ O), en una parcela elegida por sus características de ambiente natural no perturbado por el hombre, donde la dinámica de las comunidades microbianas se relaciona únicamente con aspectos del ecosistema. Se muestrearon los primeros 10cm de suelo y se transportaron al laboratorio en recipientes desinfectados superficialmente con solución 30% v/v de hipoclorito de sodio comercial. Se tamizó el suelo a través de una malla de 2mm y se mezcló a razón de 1 en 3 (v/v) con perlita estéril. Semillas de trigo (Triticum aestivum variedad Baguette 19), maíz (Zea mays híbrido experimental Sursem C3) y soja (Glycine max cv DM4870) se desinfectaron superficialmente por tratamiento con etanol 70% v/v (1 min) e hipoclorito de sodio comercial 20% v/v (maíz y trigo) o 2% v/v (soja), dejando actuar 10 min a 200rpm, seguido de 6 enjuagues con agua destilada estéril (10 min cada uno). Para analizar el contenido de Pseudomonas spp. endófitas, se trituraron 2g de semillas desinfectadas en 35ml de solución salina (SS, NaCl 0,9% p/v), se agitó a 250rpm durante 10 min y se realizaron plaqueos por triplicado en medio de cultivo selectivo S1, selectivo para el género Pseudomonas spp.7. Las placas se incubaron a 28°C durante 2 días.
La mezcla suelo-perlita se colocó en macetas de plástico negro hasta llenar ¾ de su capacidad (1000 cm3), luego se sembraron 5 semillas/maceta de maíz y trigo, y 7 semillas/maceta de soja. Las macetas se dispusieron en invernáculo en bandejas desinfectadas bajo condiciones controladas de luz y temperatura (16:8 horas de ciclo luz:oscuridad y temperatura promedio diurna de 23±2°C), y se mantuvieron irrigadas con agua destilada estéril a capacidad de campo. Al cabo de 4 semanas, se descalzaron las plantas y se lavaron cuidadosamente las raíces con agua corriente. Para cada repetición (n=3) se pesaron aproximadamente 2g de raíces lavadas de diferentes ejemplares de plantas y se colocaron en tubos de plástico estériles con 40ml de SS, se sonicaron (1 min, 40kHz, 160W; sonicador Testlab TB04, Argentina) a temperatura ambiente, se agitaron 15 min a 250rpm y se prepararon diluciones decimales seriadas en SS para plaquear en medio de cultivo S1. Las placas se incubaron a 28°C durante 2 días y se registró el número de colonias (UFC) por gramo de raíz fresca1. La carga de Pseudomonas en la muestra de suelo tamizado se analizó según lo descrito anteriormente1 y se registró el número de colonias (UFC) por gramo de suelo fresco.
Para analizar comparativamente la estructura de comunidad de Pseudomonas del rizoplano de cada especie de planta trampa, se estudió el perfil de restricción de los genes oprF y gacA amplificados por PCR (PCR-RFLP) a partir del conjunto de colonias desarrolladas en el medio S1, según protocolos establecidos1. A cada una de las 3 placas de cada repetición se agregó 1ml de agua desionizada (MilliQ) estéril y, con la ayuda de una espátula de Drigalsky, se rastrilló la superficie reiteradas veces, hasta que la biomasa de todas las colonias se resuspendió en el líquido agregado. La suspensión se transfirió a un microtubo de 1,5ml estéril, se incubó a 100°C durante 15 min para lisar las células y se centrifugó luego a 14000rpm durante 2 min. Se recuperó y alicuotó el sobrenadante para su conservación a –20°C. Se generó una muestra de ADN representativa de cada grupo por combinación de una alícuota equivalente de cada una de las 3 suspensiones réplica. Se amplificaron regiones internas de los genes oprF y gacA, marcadores del género Pseudomonas spp., según procedimientos establecidos1. La eficiencia y la especificidad de las reacciones se analizó por electroforesis de alícuotas de 2μl en gel de agarosa, tinción con bromuro de etidio y visualización en transiluminador UV1. Para el análisis por RFLP, se tomaron 10μl de cada reacción con suficiente producto esperado y se agregó 1U de la enzima de restricción HaeIII (Promega) o TaqI (Fermentas) para el amplicón oprF, y HaeIII o MboI (Fermentas) para el amplicón gacA. Luego se llevó a un volumen final de 20μl y se incubó a 37°C (HaeIII y MboI) o a 62°C (TaqI) durante 3 h1. Los productos de digestión se separaron en gel de agarosa al 2% y se visualizaron por tinción con bromuro de etidio en transiluminador UV1. Los patrones RFLP fueron analizados con el software GelCompar II V. 4.602 (Applied Maths, Kortrijk, Bélgica) mediante el agrupamiento basado en la correlación de Pearson, usando las curvas densitométricas extraídas de los geles. El dendrograma se realizó con el algoritmo de Ward. Los valores de correlaciones cofenéticas superiores de 80 indican que el dendrograma resultante se corresponde con la matriz original. El análisis de todos los patrones combinados de RFLP (con las 2 enzimas para cada uno de los 2 genes) se efectuó usando el set de herramientas de datos compuestos del software (Composite data set), normalizando todos los geles con los marcadores de peso molecular incluidos en cada uno (Ladder 50 pb precision, PB-L)2.
Para la aproximación taxonómica de colonias representativas aisladas de suelo y rizoplano de maíz, trigo y soja, se realizó la secuenciación parcial del gen ribosomal 16S de amplicones de PCR obtenidos con los oligonucleótidos P0 y P6 sobre lisados térmicos de los aislamientos, según protocolos establecidos1,13. La secuenciación parcial de la región 5′ del amplicón se realizó con el oligonucleótido P0 en Macrogen Inc. (Seúl, Corea). Las secuencias parciales obtenidas se depositaron en la base de datos GenBank (NCBI) bajo los códigos de acceso KP851794 a KP851842. Las secuencias parciales obtenidas se compilaron junto a secuencias de cepas de referencia para su posterior análisis de similitud basado en alineamiento múltiple con la herramienta ClustalW2 2.0.
La tabla 1 muestra la carga de Pseudomonas totales detectada para cada muestra de rizoplano y para el suelo utilizado libre de raíces. La carga de Pseudomonas totales del suelo prístino fue de 7,2±0,1 log10 UFC/g de suelo fresco (o 7,3±0,2 log10 UFC/g de suelo seco); esta carga resulta notablemente superior a la registrada con anterioridad en sitios naturales sin actividad agrícola próximos a lotes con laboreo, con valores promedio entre 3,5 y 5,6 log10 UFC/g de suelo seco2. La carga bacteriana puede verse influenciada por el tipo de suelo y sus características fisicoquímicas, por la composición de especies vegetales, así como por el contenido de humedad y la época del año en que se realizan los muestreos2,4,6. Dado que no se detectaron colonias en los plaqueos directos de suspensiones de macerados de semillas de trigo, soja o maíz previamente desinfectadas superficialmente (datos no mostrados), se asume que la densidad de Pseudomonas totales detectada en rizoplano corresponde a genotipos que fueron atraídos desde el banco de recursos de Pseudomonas naturalizadas del suelo prístino hacia la rizósfera por las raíces de las plantas y que lograron colonizar su rizoplano. El análisis estadístico mostró diferencias significativas en los valores medios de carga de Pseudomonas totales del suelo y de los rizoplanos de los distintos cultivos (tabla 1); dentro de éstos fue significativamente mayor en trigo (6,2±0,3 log10 UFC/g de raíz fresca) que en maíz (5,4±0,3 log10 UFC/g de raíz fresca) y soja (5,7± 0,4 log10 UFC/g de raíz fresca). Estas diferencias podrían relacionarse con la atracción diferencial y la colonización selectiva del rizoplano del cultivo de trigo, y con el posterior enriquecimiento en la rizósfera de aquel, debido a que los exudados radiculares difieren en abundancia y composición entre las especies vegetales y sus genotipos12. No se descarta, sin embargo, el hecho de que el sistema radicular en cabellera del trigo provea mayor superficie expuesta por gramo de tejido debido a la abundancia de raíces adventicias delgadas.
Recuento de Pseudomonas totales en suelo libre y en rizoplano de las especies cultivadas
| Muestra | Carga de Pseudomonas (log10UFC/g)* |
|---|---|
| Suelo | 7,2±0,1c |
| Maíz | 5,4±0,3a |
| Trigo | 6,2±0,3b |
| Soja | 5,7±0,4a |
Se muestran los valores promedio de las 3 réplicas por grupo de estudio y triplicados de los plaqueos de cada suspensión (n=9). Letras diferentes en superíndice indican diferencias estadísticamente significativas entre la carga de Pseudomonas, según ANOVA seguido de test de comparaciones múltiples de Tukey (p<0,05).
*UFC: unidades formadoras de colonias por gramo de peso fresco de raíz o de suelo, según corresponda.
Independientemente de las diferencias en los valores de carga ya comentados (tabla 1), se destaca que la densidad de Pseudomonas en el rizoplano fue notablemente inferior, en varios órdenes de magnitud que la determinada para la rizósfera de maíz (8,9 log10 UFC/g de raíz fresca) y soja (9,6 log10 UFC/g de raíz fresca) en plantas cultivadas a campo2. Tal diferencia se atribuye al procedimiento de aislamiento de Pseudomonas, ya que las suspensiones rizosféricas se obtienen a partir de raíces sin remoción del material particulado de suelo que se encuentra naturalmente adherido1,2, mientras que en este trabajo se lavaron exhaustivamente las raíces antes de proceder a recuperar las bacterias firmemente adheridas, de manera de recuperar aquellos genotipos con mayor competitividad para colonizar solo el rizoplano. La densidad de Pseudomonas registrada en el rizoplano de plántulas de trigo, maíz y soja (tabla 1) es comparable con la carga de Pseudomonas comunicada por otros grupos en el rizoplano de maíz en suelo natural3.
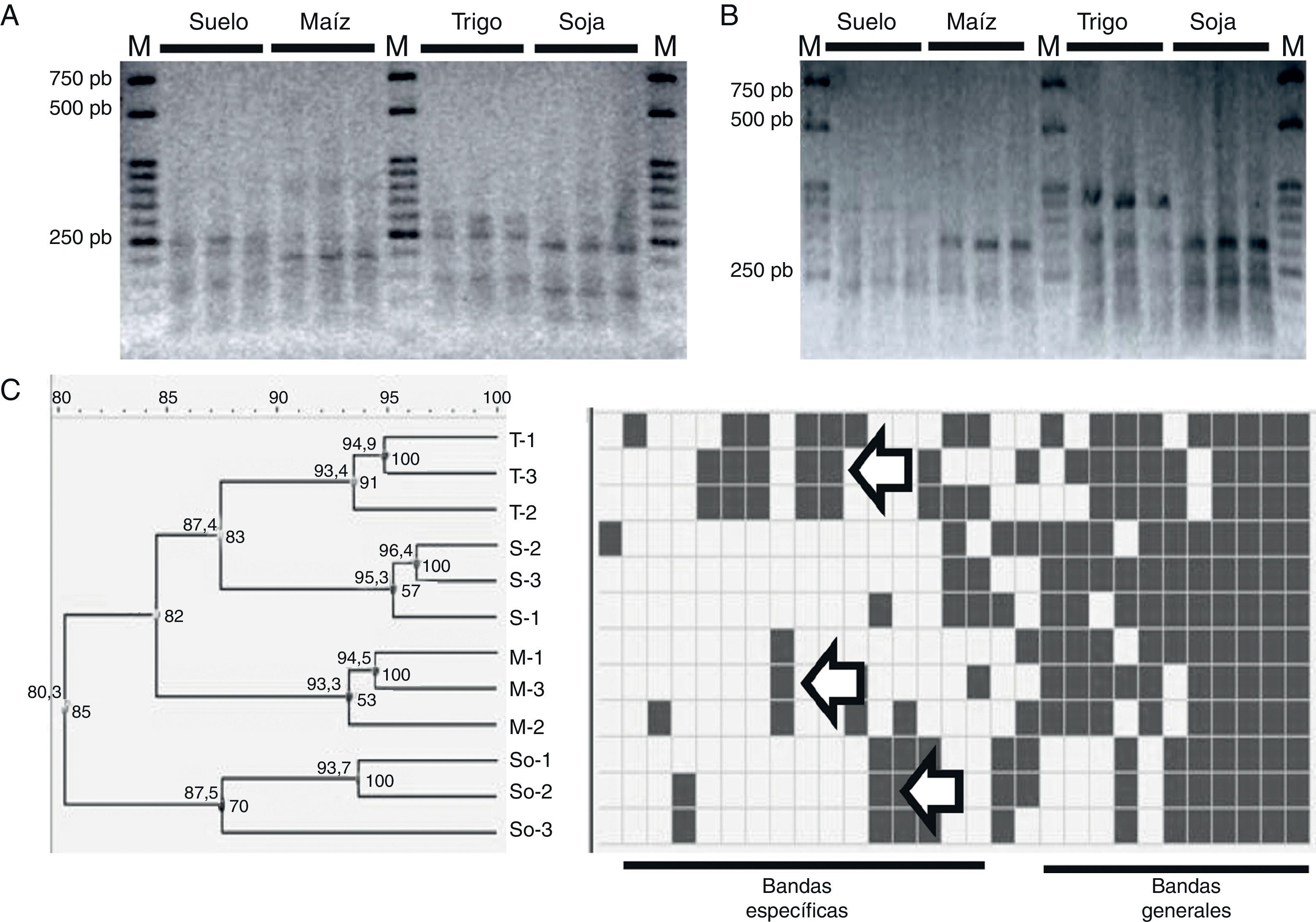
A partir de las poblaciones de Pseudomonas más abundantes del rizoplano de maíz, trigo y soja recuperadas en medio selectivo, se analizó comparativamente su composición genotípica a través del perfil PCR-RFLP de 2 genes marcadores de Pseudomonas spp., oprF y gacA1,2. En todos los casos, los amplicones obtenidos fueron consistentes con los productos esperados para cada gen (600-700 pb para oprF y 425 pb para gacA)1. Tanto en los perfiles RFLP individuales de cada amplicón y cada muestra (fig. 1A y B), como en el perfil RFLP compuesto de ambos genes y ambas enzimas (fig. 1C), se puede apreciar que el patrón genético de Pseudomonas más abundantes del rizoplano de cada especie difiere del patrón de Pseudomonas mayoritarias del suelo prístino en el que fueron cultivadas. Se detectaron fragmentos de restricción específicos en cada una de las muestras de rizoplano (señalados con flechas en la figura 1C) y otros fragmentos que solo son comunes a las muestras de suelo y maíz, o de suelo y trigo (fig. 1C). Esto indica que entre las poblaciones de Pseudomonas del suelo sin historia agrícola utilizado en este estudio existen genotipos poco abundantes, que colonizan preferencialmente el rizoplano de cada planta y aumentan allí su densidad poblacional.
Análisis comparativo del perfil genético de Pseudomonas más abundantes en el rizoplano de soja (So), trigo (T) y maíz (M), cultivados en un mesocosmos con suelo prístino (S) como sustrato. Se muestran ejemplos representativos de los bandeos de PCR-RFLP gacA-HaeIII (A) y oprF-TaqI (B), así como el dendrograma del análisis combinado de los perfiles genéticos de ADN obtenidos a partir de las 2 digestiones efectuadas para cada gen (oprF y gacA) y la identificación de bandas realizada por el programa GelCompar (C). Se aprecian bandas comunes a todas las muestras y bandas específicas, presentes diferencialmente en 2 o más réplicas de las muestras de cada rizoplano (flechas). En los nodos se muestran los valores de las correlaciones cofenéticas (en negro, por dentro) y de similitud entre muestras (en gris, por encima).
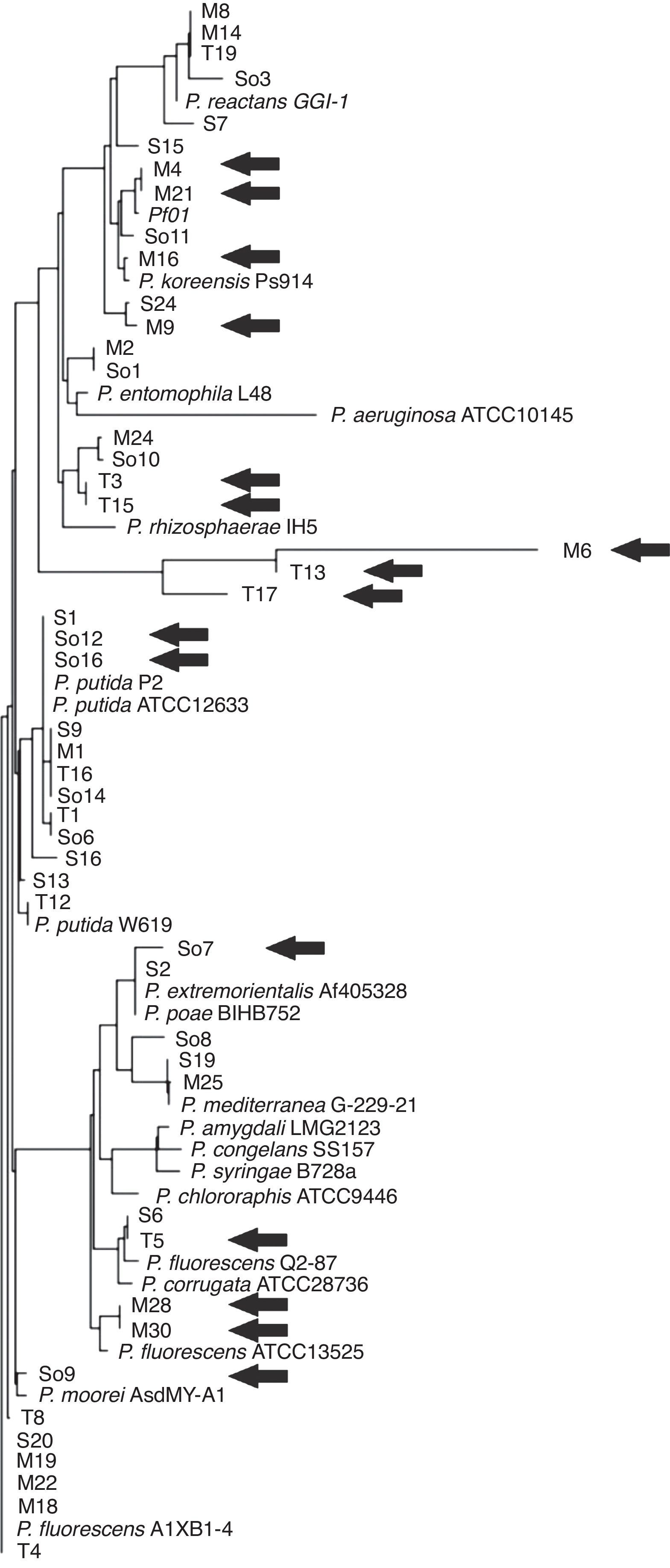
Para obtener evidencias de la proximidad taxonómica de los genotipos que colonizarían selectivamente cada rizoplano, se repitió el procedimiento de cultivo de semillas desinfectadas superficialmente en suelo prístino y plaqueo selectivo en medio S1 de las suspensiones de rizoplano, y se realizó una selección de colonias sobre la base de la diversidad de morfotipos en cada grupo de estudio (según tamaño, color, tipo de borde y mucosidad de la colonia en placas de agar nutritivo) y de su perfil PCR-RFLP del gen oprF. De esta forma, se seleccionaron aislamientos representativos con rasgos fenotípicos y/o perfiles PCR-RFLP oprF diferenciales, para determinar la secuencia parcial del gen ribosomal 16S. La figura 2 ilustra las relaciones filogenéticas de los aislamientos seleccionados luego del alineamiento múltiple de las secuencias parciales obtenidas junto a secuencias de cepas de referencia pertenecientes a los diferentes subgrupos taxonómicos de Pseudomonas. Las secuencias de los aislamientos M1 (rizoplano de maíz), T16 (rizoplano de trigo) y So14 (rizoplano de soja), que resultaron posicionados en el complejo P. putida, fueron prácticamente indistinguibles de la correspondiente al aislamiento S9 obtenido a partir de suspensiones de suelo (fig. 2). Esto sugiere que esos genotipos de Pseudomonas recuperados del rizoplano de las especies cultivadas poseen escasa o nula preferencia de planta hospedadora. Por el contrario, los aislamientos So7, So9, So12 y So16 (soja), M4, M6, M9, M16, M21, M28 y M30 (maíz) y T3, T5, T13, T15 y T17 (trigo) (indicados con flechas en la figura 2), que se posicionaron en diferentes subgrupos taxonómicos de Pseudomonas y que se encuentran más alejados filogenéticamente entre sí (fig. 2), representarían cepas con mayor preferencia por alguna de las especies vegetales, que colonizaron y se enriquecieron selectivamente en el rizoplano de las plantas correspondientes a partir de Pseudomonas nativas presentes en el suelo prístino muestreado.
Análisis filogenético del gen ribosomal 16S de aislamientos representativos de Pseudomonas más abundantes en el rizoplano de soja (So), trigo (T) y maíz (M), cultivados en un mesocosmos con suelo prístino (S) como sustrato. Las flechas señalan aquellas secuencias de aislamientos que fueron recuperados diferencialmente solo en el rizoplano de uno de los cultivos, sugiriendo que se trata de estirpes de Pseudomonas que muestran preferencia de colonización por las variedades ensayadas de soja, trigo o maíz.
Las bacterias probióticas o bacterias PGPR colonizan la rizósfera de las plantas mediante la atracción que ejercen los distintos exudados radiculares, lo que indica que las plantas seleccionan de manera específica aquellas cepas beneficiosas entre el reservorio genético de la población de bacterias nativas del suelo a través de estos compuestos4,5. Aunque los alcances de este estudio resultan acotados, ya que se analizó un solo genotipo de cada especie de cultivo y una condición edáfica en mesocosmos bajo condiciones de invernáculo, los resultados están en línea con la hipótesis planteada, ya que se observó que dentro de la biodiversidad microbiana existente en el suelo elegido por su impronta de ambiente conservado, ciertas cepas de Pseudomonas nativas que habitan el suelo y se encuentran en baja proporción en éste colonizan preferencialmente la rizósfera de las variedades sembradas de maíz, soja o trigo, transformándose en las poblaciones más abundantes que colonizaron dichas raíces en forma diferencial (figs. 1 y 2). De ello se desprende que el manejo agrícola en términos de rotación de cultivos en un determinado ambiente podría tener un impacto considerable en la composición del grupo de las Pseudomonas residentes en el suelo bajo cultivo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo ha sido financiado por los proyectos BID PAE 36976-PID 52 (Agencia Nacional de Promoción Científica y Tecnológica, Argentina), PIP 112-200801-02271 (CONICET, Argentina) y PUNQ 1009/11 (Universidad Nacional de Quilmes, Argentina). BA es becaria posdoctoral CONICET. LGW y CV son investigadores del CONICET.