La colección de hongos patógenos y simbiontes de insectos y otros artrópodos del Centro de Estudios Parasitológicos y de Vectores es única por sus características específicas en la Argentina y por preservar hongos en cultivo, in vitro e in vivo. Esta colección está abierta para actividades de investigación, docencia, servicios y asesoramiento público y privado. Un total de 421 aislamientos pertenecientes a 23 géneros (Ascomycota: 16, Entomophthoromycotina: 4 Glomeromycota: 2 y Oomycota: 1) son preservados en la colección mediante diversos métodos: criopreservación en freezer a −20°C y −70°C, agua destilada estéril, papel, arena y liofilización. Las cepas que integran la colección fueron aisladas de insectos y de otros artrópodos; y a partir de suelo (usando insectos trampa o aislamiento directo en medios selectivos). La identificación se realizó mediante estudios de caracterización morfológicos y, en algunos casos, por taxonomía molecular. Esta colección se utiliza como centro de referencia para identificación de especies, certificaciones, estudios de investigación y docencia, transferencia tecnológica, servicios a terceros, depósito de cepas y preservación de la diversidad y conservación del germoplasma. Las cepas preservadas son, en su mayor parte, nativas de distintas regiones de la Argentina. La colección fue originada en el año 1988 y está registrada en la base de la Federación Latinoamericana de Colecciones de Cultivos y en la World Federation of Culture Collections.
The collection of fungal pathogens and symbionts of insects and other arthropods of the Centro de Estudios Parasitológicos y de Vectores, La Plata, Argentina, is unique because it preserves in vivo and in vitro cultures of fungal pathogens. This culture collection is open for research, teaching, consulting services, and strain deposit. It contains 421 strains belonging to 23 genera (16 Ascomycota, 4 Entomophthoromycotina, 2 Glomeromycota and 1 Oomycota), and the cultures are preserved by different methods such as cryopreservation in freezer at −20°C and −70°C, paper, distilled water and lyophilization. Fungi were isolated from insects, other arthropods, and soil (by using insect baits and selective media). Species were identified by morphological features and in a few strains by molecular taxonomy (PCR of rDNA). This collection is a reference center for species identification/certifications, research and teaching purposes, strain deposit, transference and consultancy services, and its overall goal is to preserve the fungal germplasm and ex situ diversity. Most of the strains are native of Argentina. The collection was originated in 1988 and is registered in the Latin American Federation for Culture Collections and in the World Federation of Culture Collections.
Las colecciones de cultivos de microorganismos tienen gran importancia para la conservación del recurso genético y de la diversidad, y constituyen fuentes de referencia, certificación, investigación y docencia. Asimismo, mediante estas colecciones se brindan servicios de asesoramiento y de transferencia del conocimiento científico y tecnológico al sector público y privado. La función principal de las colecciones es la conservación de cultivos microbianos axénicos, sin alteraciones genéticas o mutaciones, ni cambios morfológicos o fisiológicos. Las colecciones deben permitir la preservación de las cepas en un estado estable y asegurar su viabilidad a largo plazo22. En la Argentina existen 19 colecciones registradas en la Federación Latinoamericana de Colecciones de Cultivos5, que incluyen bacterias y hongos (hongos filamentosos y levaduras). Estas colecciones son dependientes, en su mayoría, de universidades u otras instituciones nacionales.
Para poder mantener y conservar una colección de microorganismos, en particular una de cultivos de hongos, se requiere una constante atención y vigilancia para preservar las características morfológicas macro y microscópicas de las cepas. Es fundamental conocer las condiciones de crecimiento y temperaturas apropiadas, las propiedades bioquímicas y las necesidades fisiológicas de cada microorganismo, así como también los métodos de preservación más favorables para su conservación y mantenimiento en el tiempo18. Los objetivos primordiales que persigue la conservación de cepas de hongos son el mantenimiento de la pureza, de la viabilidad y de la estabilidad morfológica y genética9.
La colección de hongos patógenos y simbiontes de insectos y otros artrópodos descripta en este estudio es una colección específica que funciona en el Centro de Estudios Parasitológicos y de Vectores (CEPAVE) (CONICET-UNLP), que tiene por finalidad preservar y conservar la diversidad de los aislamientos de especies de hongos entomopatógenos y simbiontes de artrópodos (principalmente insectos) a través del tiempo, sin modificar sus características fenotípicas. Las cepas preservadas en esta colección son nativas y proceden de diversas áreas geográficas, entre ellas, áreas naturales protegidas, sistemas agrícolas, sistemas acuáticos, etc. Esta colección de cultivos, además, aporta continuamente el recurso genético necesario para el desarrollo de diferentes líneas de investigación que pertenecen al CEPAVE. Estas líneas incluyen la interacción hongo-insecto y hongo-artrópodo, estudios de la actividad biológica, estudios de sus metabolitos, caracterización molecular de las especies fúngicas y de sus cepas, producción masiva y estudios epizootiológicos. Los usos posibles de los cultivos de hongos incluyen el desarrollo de insecticidas microbianos o de metabolitos antimicrobianos para su futura aplicación en la industria farmacéutica, agrícola y otras19,20.
Finalmente, colecciones como aquella de la que dispone el CEPAVE no solo permiten la preservación y la conservación del recurso genético, sino también la continuidad del trabajo científico a largo plazo y el desarrollo tecnológico para su posible aplicación en el control biológico de insectos y otros artrópodos considerados plaga. Los objetivos del presente trabajo son describir los alcances y el estado actual de la colección y los métodos de preservación utilizados.
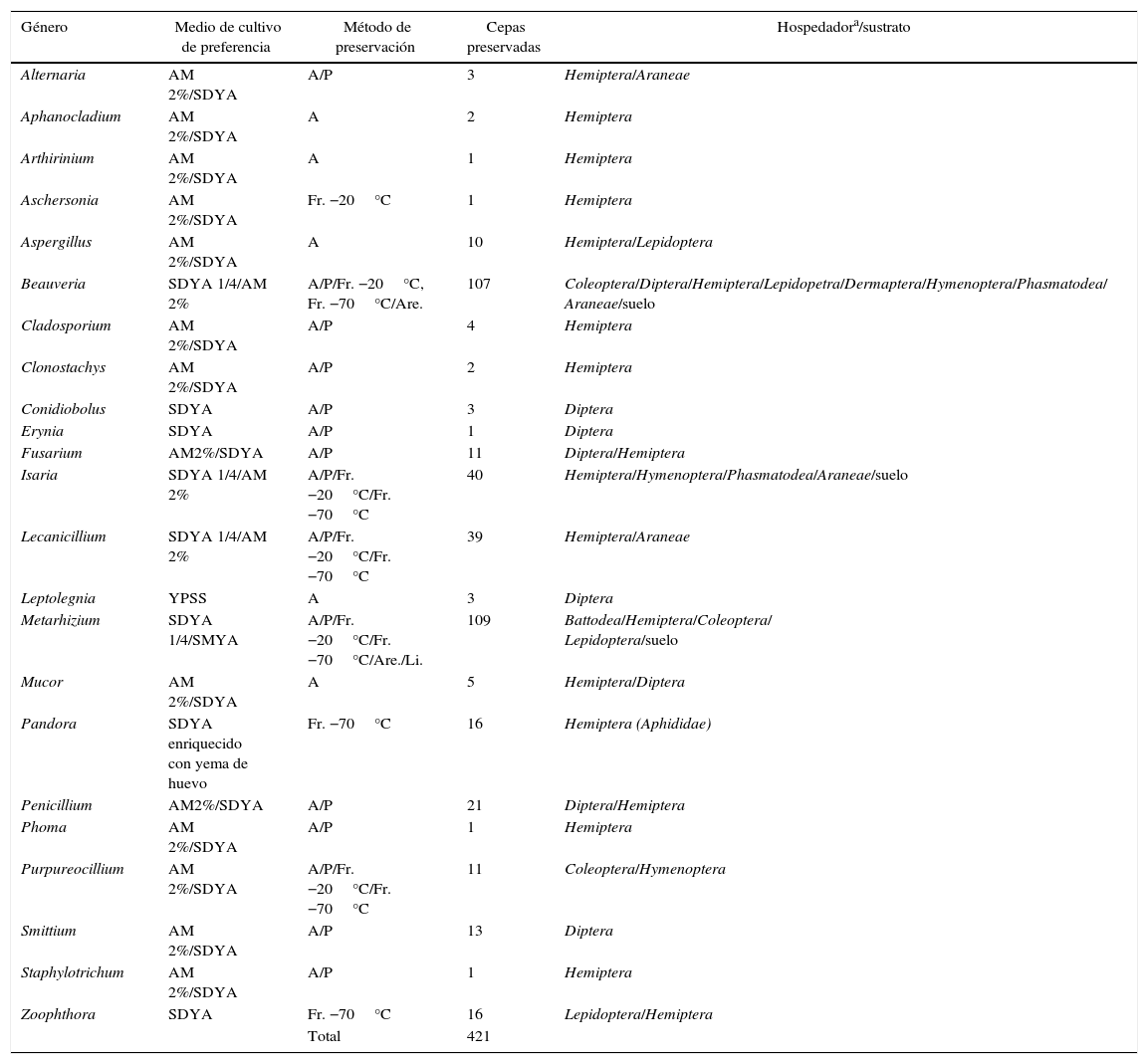
Materiales y métodosCaracterísticas de la colección de hongos entomopatógenos y simbiontes del CEPAVELa colección fue iniciada en 1988 con material aislado de insectos (contando originalmente con 25 aislamientos de aproximadamente 9 especies). Actualmente, cuenta con una micoteca de 421 aislamientos pertenecientes a 23 géneros diferentes (tabla 1). La mayor parte de la colección está compuesta por Ascomycota representados por el Orden Hypocreales, con un predominio de los géneros Metarhizium spp., Beauveria spp., Isaria spp. y Lecanicillium spp. Dentro del Orden Entomophthorales (Entomophthoromycotina), se encuentran en mayor número los géneros Pandora spp. y Zoophthora spp. (tabla 1). Las cepas proceden de relevamientos realizados durante 25 años y en otros casos son producto del muestreo de campo realizado para los trabajos de las tesis doctorales y publicaciones científicas.
Descripción de los hongos presentes en la colección de hongos patógenos y simbiontes de insectos y otros artrópodos del CEPAVE
| Género | Medio de cultivo de preferencia | Método de preservación | Cepas preservadas | Hospedadora/sustrato |
|---|---|---|---|---|
| Alternaria | AM 2%/SDYA | A/P | 3 | Hemiptera/Araneae |
| Aphanocladium | AM 2%/SDYA | A | 2 | Hemiptera |
| Arthirinium | AM 2%/SDYA | A | 1 | Hemiptera |
| Aschersonia | AM 2%/SDYA | Fr. −20°C | 1 | Hemiptera |
| Aspergillus | AM 2%/SDYA | A | 10 | Hemiptera/Lepidoptera |
| Beauveria | SDYA 1/4/AM 2% | A/P/Fr. −20°C, Fr. −70°C/Are. | 107 | Coleoptera/Diptera/Hemiptera/Lepidopetra/Dermaptera/Hymenoptera/Phasmatodea/ Araneae/suelo |
| Cladosporium | AM 2%/SDYA | A/P | 4 | Hemiptera |
| Clonostachys | AM 2%/SDYA | A/P | 2 | Hemiptera |
| Conidiobolus | SDYA | A/P | 3 | Diptera |
| Erynia | SDYA | A/P | 1 | Diptera |
| Fusarium | AM2%/SDYA | A/P | 11 | Diptera/Hemiptera |
| Isaria | SDYA 1/4/AM 2% | A/P/Fr. −20°C/Fr. −70°C | 40 | Hemiptera/Hymenoptera/Phasmatodea/Araneae/suelo |
| Lecanicillium | SDYA 1/4/AM 2% | A/P/Fr. −20°C/Fr. −70°C | 39 | Hemiptera/Araneae |
| Leptolegnia | YPSS | A | 3 | Diptera |
| Metarhizium | SDYA 1/4/SMYA | A/P/Fr. −20°C/Fr. −70°C/Are./Li. | 109 | Battodea/Hemiptera/Coleoptera/ Lepidoptera/suelo |
| Mucor | AM 2%/SDYA | A | 5 | Hemiptera/Diptera |
| Pandora | SDYA enriquecido con yema de huevo | Fr. −70°C | 16 | Hemiptera (Aphididae) |
| Penicillium | AM2%/SDYA | A/P | 21 | Diptera/Hemiptera |
| Phoma | AM 2%/SDYA | A/P | 1 | Hemiptera |
| Purpureocillium | AM 2%/SDYA | A/P/Fr. −20°C/Fr. −70°C | 11 | Coleoptera/Hymenoptera |
| Smittium | AM 2%/SDYA | A/P | 13 | Diptera |
| Staphylotrichum | AM 2%/SDYA | A/P | 1 | Hemiptera |
| Zoophthora | SDYA | Fr. −70°C | 16 | Lepidoptera/Hemiptera |
| Total | 421 |
AM: agar extracto de malta; SDYA: agar Sabouraud dextrosa con extracto de levadura; YPSS: medio Emerson agar con extracto de levadura; SMYA: agar Sabouraud maltosa con extracto de levadura; A: agua destilada estéril; Are.: arena; P: papel de filtro; Fr. −20: freezer a −20°C; Fr. −70: freezer a −70°C; Li.: liofilización.
La colección de cultivos dispone de un reglamento propio y de un manual de control de calidad, además se establecen los acuerdos de transferencia de materiales establecidos para las colecciones de cultivos17. La acronimia de esta colección es CEP y está registrada en la World Federation for Culture Collections (WFCC) con el número de registro 973, en la Federación Latinoamericana de Colecciones de Cultivos (FELACC), registro S1-06, y se encuentra en proceso de registro en el Sistema Nacional de Datos Biológicos (SNDB).
La colección se ha establecido de acuerdo con los requerimientos especificados por la WFCC25. Para la sistematización se han confeccionado fichas que corresponden a cada cepa e incluyen los datos de fecha de recolección; hospedante/sustrato; localidad, provincia/estado, país; nombre del recolector; ambiente; coordenadas geográficas; fecha de aislamiento; medio de cultivo en el cual se aisló; nombre de quien identificó la especie y del legit; y métodos de identificación y de preservación. Los datos de referencia se encuentran sistematizados en una base de datos que se actualiza en forma permanente y a la que se puede acceder por género, especie fúngica o especie/género del hospedante. El acceso a la colección a través de los buscadores estándares será posible mediante la digitalización de la colección en un blog que está en etapa de diseño.
Métodos de aislamiento e identificación taxonómicaLos aislamientos fueron obtenidos de los relevamientos desarrollados a campo desde el año 1988 hasta el presente. Los muestreos fueron planificados y realizados considerando el tipo de ambiente, de sustrato y de artrópodos hospedantes13,24. Las cepas fúngicas han sido aisladas directamente de insectos, o de otros artrópodos infectados16,23. Asimismo, un número importante de cepas se han obtenido a partir de muestras de suelo, lo que fue posible gracias a la condición de muchas especies fúngicas de tener una etapa de su ciclo de vida saprofítico. Los aislamientos de muestras de suelo se obtuvieron mediante el método in vivo, con insectos cebo o trampa, o in vitro, a través de un medio de cultivo selectivo21. La mayoría de los aislamientos se han preservado como monospóricos, para evitar la variabilidad genética y mutaciones a largo plazo.
La identificación taxonómica se realizó de acuerdo con los caracteres morfológicos en cultivo, en el hospedador o en ambos mediante las claves y monografías citadas previamente10. En algunos casos, la identificación morfológica se complementó con el análisis molecular utilizando la técnica de reacción en cadena de la polimerasa (PCR). Se han caracterizado las regiones ribosomales ITS1, 5.8S e ITS2, la primera parte del gen 28S del ARNr o subunidad grande (LSU) ARNr, y una parte del gen de la deshidrogenasa gliceraldehído-3-fosfato (GPD), entre otros, de acuerdo con las especies consideradas en los casos de identificación por taxonomía molecular3,11.
Métodos de preservaciónDesde 1988 hasta 2008, las cepas fueron preservadas mediante el método de repique sucesivo, a partir de entonces se incorporaron otros métodos de preservación. La transferencia periódica o repique consistió en guardar un cultivo activo en tubos de vidrio en «pico de flauta» o «en estría» en el medio seleccionado. Luego de que el cultivo creció, se mantuvo a 4°C para alargar el período entre repiques. La preservación en agua destilada estéril, método modificado de Bueno y Gallardo2, consistió en cortar cubos de 1 cm3 de un cultivo esporulado y colocarlos dentro de un tubo de centrífuga de 15ml de polipropileno esterilizado, que contenía 10ml de agua destilada estéril. Cada tubo se conservó en la heladera a 4°C. El método de preservación de cultivos en papel fue modificado y adaptado de la técnica descripta por Fong et al.7. Se colocaron tiras de papel de filtro Whatman N.° 4 de 2mm×50mm (previamente esterilizadas en autoclave durante 20 min a 120°C y secadas en estufa) sobre cultivos esporulados; estas se dejaron durante 60 min. Posteriormente, se dejaron secar bajo cámara de flujo laminar y se conservaron en heladera a 4°C en sobres de papel (15cm×15cm), esterilizados o dentro de tubos de microcentrífuga tipo Eppendorf (1,5ml) estériles. Para el método de congelación de los cultivos en freezer a −20°C y a −70°C, se realizaron cortes de cubos de 1 cm3 de un cultivo esporulado, que luego fueron colocados dentro de frascos estériles de 1,5ml que contenían glicerol estéril al 10% (utilizado como crioprotector)14,15.
El método de desecación de los cultivos en arena consistió en preparar una suspensión de un cultivo esporulado y colocar 1ml de esta en 4g del sustrato dentro de un tubo Eppendorf estéril. Luego se dejó secar en estufa. Dependiendo de la especie fúngica, estos cultivos se pueden conservar a −20°C o a temperatura ambiente. La conservación por liofilización es un método estándar usado para muchos hongos, que consiste en extraer toda el agua de un cultivo y preservar el material fúngico en ampollas cerradas al vacío, a 4°C. Si bien nuestra colección no cuenta con el equipo, algunos cultivos han sido preservados por este método mediante la colaboración de otra institución10.
ViabilidadLos controles de viabilidad se realizaron al inicio del proceso (tiempo 0), al mes, a los 6 meses y a los 12 meses, de acuerdo con la técnica citada previamente12. Se consideró viable un cultivo cuando hubo crecimiento, se observaron los caracteres macroscópicos y microscópicos. Asimismo, para evitar la pérdida de las características de patogenicidad y virulencia de los aislamientos fúngicos, se inocularon insectos sanos procedentes de crías artificiales mantenidas en el CEPAVE. Para estas pruebas, los insectos fueron seleccionados sobre la base de su susceptibilidad hacia las especies fúngicas, se utilizaron larvas de Galleria melonella (Lepidoptera: Pyralidae) o de Tenebrio molitor (Coleoptera: Tenebrionidae).
Resultados y discusiónSi bien la colección surgió como una necesidad de preservar los cultivos fúngicos para el uso de las líneas de investigación que se encuentran en el CEPAVE, actualmente es una colección de referencia, tanto para el sector público como privado, y continuamente aporta conocimiento e interacciona con empresas e instituciones científicas. La colección cuenta actualmente con 421 cepas disponibles (tabla 1). El mayor porcentaje de cepas preservadas corresponden a especies incluidas en los géneros Metarhizium y Beauveria, con un 25,9 y un 25,4%, respectivamente. Las técnicas de preservación utilizadas se han ido modificando a lo largo del tiempo según las necesidades de la colección y a partir del 2009 se incorporaron diferentes métodos de preservación.
Desde hace 7 años ya no se utiliza en esta colección el «repique» o método de preservación de transferencias sucesivas en medios de cultivo, debido a su costo y a que este ocasionó la pérdida de características esenciales para este tipo de hongos, como la patogenicidad, la virulencia o la capacidad de esporular en medio de cultivo. Como característica relevante debemos destacar la necesidad de disponer de crías artificiales de insectos en el laboratorio, para poder activar la virulencia de los aislamientos a través de infecciones experimentales. Actualmente, el 90% del material de la colección está preservado en igual proporción en papel, agua destilada y freezer a −20°C (tabla 1), en menor porcentaje está preservado en freezer a −70°C (4%), en arena (3%) y liofilizado (3%). A lo largo del tiempo, en esta colección se han aislado y preservado una gran diversidad de hongos, el mayor porcentaje de cepas se han aislado de suelo y de insectos, en su mayoría pertenecientes a los órdenes Hemiptera y Coleoptera (tabla 1). En cuanto a la metodología de preservación utilizada, en esta colección hemos observado mayor coincidencia con los resultados presentados por colecciones de hongos de importancia médica6,18.
La utilización de herramientas moleculares nos permitió diferenciar a través de PCR-RFLP usando los genes EF1-a y ITS1-5.8-ITS2 ciertas especies problema, como Isaria fumosorosea, Isaria farinosa, Isaria tenuipes y Purpureocillium lilacinum (tabla 2), ya que las características morfológicas para identificar al género Isaria con frecuencia no definen claramente a nivel de especie los aislamientos nuevos3.
Iniciadores para identificar las especies presentes en el género Isaria
| Especiesa | Genes | Marcador molecular | Tamaño del producto (pb) |
|---|---|---|---|
| Isaria farinosa (4); I. fumosorosea (17); I. javanica (1) | EF1-α | 983F 5‘-GCYCCYGGHCAYGGTGAYTTYAT-3‘ | 1000 |
| 2218R 5‘-ATGACACCRACRGCRACRGTYTG-3‘ | |||
| ITS-5,5.8rDNA,ITS2 | TW81F 5‘-GTTTCCGTAGGTGAACCTGC-3‘ | 500 | |
| AB28R 5‘-ATATGCTTAAGTTCAGCGGGT-3‘ |
En cuanto a los trabajos citados previamente sobre colecciones de cultivos fúngicos, la mayoría corresponde a hongos de importancia médica17,18. Con respecto a los hongos entomopatógenos, Estrada y Velez4 describen colecciones de similares características en Colombia. No obstante, existen catálogos de cultivos de hongos entomopatógenos a nivel mundial, como por ejemplo ARSEF y EMBRAPA1,8. En Latinoamérica existen 51 colecciones de cultivos microbianos registradas en la FELACC, de las cuales solo 19 corresponden a cultivos fúngicos de la Argentina5. Con este trabajo damos a conocer el estado actual de una de las colecciones de cultivos micológicos que existen en la República Argentina y en Latinoamérica.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosAl Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), a la Universidad Nacional de La Plata (UNLP), a la Comisión de Investigaciones Científicas (CIC) de la Provincia de Buenos Aires) y a la Agencia Nacional de Promoción Científica y Tecnológica (ANPCyT), por otorgar subsidios parciales para investigaciones, lo que ha financiado parcialmente este trabajo. Al Dr. Richard Humber, por brindar su colección para la preservación alternativa de algunas de las cepas de esta colección. Al Sr. Jorge Chayle, por colaborar con la organización de la base de datos.