Las especies termotolerantes de Campylobacter han tomado gran relevancia en los últimos años debido a que son los principales agentes zoonóticos causantes de enfermedades transmitidas por alimentos. Adicionalmente, Campylobacter jejuni serotipo O:19ha sido relacionado con el desarrollo del síndrome posdiarreico de Guillain-Barré. El objetivo de este trabajo fue determinar la proporción de cepas de C. jejuni que se corresponden con el serotipo O:19 dentro de las aisladas en diferentes etapas de 3 cadenas de producción de carne aviar en la provincia de Santa Fe.
Se observó que el 18% del total de cepas de C. jejuni recuperadas (10/55) pertenecían al serotipo O:19; estas se aislaron en 4 de las 5 etapas de producción de carne aviar elegidas a los fines de este estudio. Este hallazgo da cuenta de un riesgo importante para la salud pública de los consumidores y debería ser considerado en los estudios epidemiológicos de Campylobacter, para implementar en forma urgente medidas de control sobre este microorganismo.
Thermotolerant species of Campylobacter have been focus of attention in the last years because they are the major agent causing zoonotic foodborne diseases. In addition, Campylobacter jejuni O:19 serotype was associated with Guillain Barré syndrome. The aim of this study was to determine the proportion of C. jejuni O:19 serotype isolated at different stages of three poultry meat supply chain in Santa Fe, Argentina. The analysis showed that 18% of isolated C. jejuni belong to serotype O:19. It was also determined that the presence of these strains is given in almost all production stages. These results reflect a significant risk to public health of consumers. Epidemiological studies of Campylobacter should be considered to establish a risk manager policy.
Desde el punto de vista de la salud pública, las especies termotolerantes de Campylobacter han tomado gran importancia como patógenos zoonóticos causantes de infecciones entéricas en seres humanos (campilobacteriosis)1,3. Las principales especies patogénicas dentro de este género son Campylobacter jejuni y Campylobacter coli14.
A nivel internacional, la incidencia de la campilobacteriosis humana ha ido en aumento hasta convertirse en la zoonosis de mayor relevancia. Tanto la Unión Europea como los Estados Unidos consideran a Campylobacter como el principal agente zoonótico transmitido por alimentos1,3. En Argentina, los estudios acerca de estos patógenos son incipientes; sin embargo, también en nuestro país Campylobacter ha sido reportado como uno de los principales agentes zoonóticos de origen alimentario4,15.
La transmisión de C. jejuni y C. coli al hombre se produce directamente por contacto de la persona con materia fecal de animales, o indirectamente, por el consumo de alimentos de origen animal (principalmente carne aviar) poco cocidos o por la contaminación cruzada con alimentos preparados listos para consumir14.
La mayoría de los casos de enteritis en humanos causados por Campylobacter termotolerantes son leves o autolimitados y no requieren terapia antimicrobiana. Sin embargo, sí se requiere un tratamiento con antibióticos para tratar las infecciones sistémicas por Campylobacter en pacientes inmunodeprimidos o en casos de infecciones crónicas7. Los agentes antimicrobianos más utilizados para el tratamiento de la campilobacteriosis humana son eritromicina, ciprofloxacina y tetraciclina7,14. No obstante, en los últimos años se ha encontrado una elevada resistencia de Campylobacter a estos antimicrobianos, posiblemente debido a su uso en la producción primaria de alimentos y, lo que es más preocupante, a la aparición de cepas multirresistentes en las diferentes etapas de producción7,15.
Además de ser agentes causales de gastroenteritis, las bacterias del género Campylobacter, principalmente C. jejuni, han sido asociadas al desarrollo de síndromes posdiarreicos graves, fundamentalmente al síndrome de Guillain-Barré (GBS). Este síndrome es un desorden autoinmune del sistema nervioso periférico caracterizado por una parálisis ascendente, debilidad progresiva y carencia de reflejos, que puede derivar en un compromiso de la musculatura respiratoria y la muerte del paciente9.
La relación entre C. jejuni y GBS se debe a un mecanismo biológico que involucra un mimetismo molecular y una reacción cruzada de la respuesta inmunitaria. El ser humano genera anticuerpos frente a antígenos de tipo lipopolisacáridos de membrana de C. jejuni, los cuales exhiben reactividad cruzada con gangliósidos presentes en el tejido nervioso periférico, principalmente con el gangliósido GM1, asociado al nervio motor. Esta reacción genera una neuropatía axonal motora y provoca la parálisis ascendente9.
Por otra parte, el desarrollo de GBS está mayormente asociado a la infección previa con determinados serotipos de C. jejuni. Diferentes estudios en China, Japón y Estados Unidos han encontrado relación entre el serotipo O:19 y el GBS, mientras que en Sudáfrica se relacionó con el serotipo O:415,9.
Mediante el uso de herramientas de biología molecular es posible distinguir entre cepas de C. jejuni serotipo O:19 y no O:19; su diferencia reside en el extremo 3’ del gen que codifica la subunidad B de la DNA girasa (gyrB)8.
El objetivo del presente trabajo fue determinar la presencia de los serotipos O:19 y no O:19 de C. jejuni en aislamientos de pollos de engorde en la cadena cárnica aviar, para aportar elementos al estudio epidemiológico de este patógeno en Argentina.
Se trabajó con una colección de aislamientos de C. jejuni (n=55) obtenidos durante el año 2012 a partir de muestras tomadas en diferentes puntos de la cadena de producción aviar (granja de reproductores, granja de engorde, frigorífico y punto de venta final). Los muestreos y los análisis microbiológicos fueron realizados en el Laboratorio de Análisis de Alimentos del Departamento de Salud Pública de la Facultad de Ciencias Veterinarias, Universidad Nacional del Litoral (Lab. AA., DSPV, FCV-UNL).
Se muestrearon 3 cadenas de producción de carne aviar presentes en la zona centro-sur santafesina. En cada una de ellas se tomaron muestras en diferentes puntos. En todos los puntos, los animales muestreados fueron elegidos al azar dentro del mismo lote. Inicialmente se muestrearon gallinas reproductoras mediante hisopados cloacales. El segundo punto muestreado fue en la etapa de engorde de pollos nacidos de los huevos provenientes del lote de gallinas reproductoras muestreadas. El mismo lote de pollos fue muestreado en granja en 2 oportunidades, a los 7 días y a los 45 días de vida. Posteriormente, se identificó en el frigorífico el lote de animales muestreados con anterioridad en la etapa de granja y se tomaron muestras de lavados de canales. Por último, en el punto de venta final se tomaron muestras de lavados de carcasas de los productos distribuidos por el frigorífico.
El número de aislamientos obtenidos en cada etapa y los identificados como C. jejuni (aislamientos/C. jejuni) fueron los siguientes: gallinas reproductoras (28/13), pollos de 7 días (16/8), pollos de 45 días (39/17), canales en frigorífico (33/13) y canales en punto de venta (5/4).
El aislamiento de los microorganismos se realizó mediante el cultivo de las muestras en condiciones de microaerofilia (3-5% de O2, 2-10% de CO2, 85% N2) a 42°C, primero en caldo Bolton durante 24h (Oxoid®, Hampsire, Reino Unido)6 y luego en agar Skirrow durante 48h (Oxoid®)2.
La confirmación presuntiva del género de los microorganismos se realizó mediante métodos fenotípicos: microscopia de contraste de fases y prueba de oxidasa y de catalasa. Posteriormente, se realizó la confirmación por técnicas de biología molecular mediante PCR-multiplex, la cual permitió la identificación de las cepas a nivel de género y especie12. Las colonias así identificadas fueron conservadas a –80°C en viales con medio crioprotector de caldo triptona de soya estéril suplementado con glicerol al 17 y 5% de suero equino inactivado11.
Las 55 cepas conservadas a –80°C se reactivaron en agar sangre Columbia base (Oxoid) suplementado con 5% de sangre equina hemolizada y se incubaron en condiciones de microaerofilia (3-5% de O2, 2-10% de CO2, 85% N2) a 42°C durante 48h en jarras de anaerobiosis (Oxoid HP0011)2. Para el control de calidad del crecimiento de las cepas se utilizó como control positivo la cepa de C. jejuni ATCC 33560.
Para la identificación de cepas de C. jejuni O:19 y no O:19 se realizó inicialmente una extracción de ADN genómico a partir de una suspensión de cultivo fresco mediante la utilización de un kit comercial (Wizard Promega®, Wisconsin, Estados Unidos de América). Se cuantificó la concentración de ADN obtenido (ng/μl) utilizando un lector multimodal de placas (Biotek®, Vermont, Estados Unidos de América) y se ajustó a una concentración de 20ng/μl. Posteriormente, se realizaron 2 PCR por muestra utilizando dos pares de cebadores específicos; un par para identificar cepas de C. jejuni serotipo O:19 (Forward C3647: 5’-CAAGCTATACTGCCTTTG-3’ y Reverse C3650: 5’- TCAAGATCTTTTAAAATT-3’) y otro par para reconocer las cepas no O:19 (Forward C3647 y Reverse C3652: 5’-TCAAGATCTTTTAAAATC-3’), siguiendo la técnica descripta por Misawa et al.8.
Finalmente, para visualizar los productos amplificados se llevó a cabo una electroforesis en gel de agarosa al 1% teñido con Gel Red® (Genbiotech®, Buenos Aires, Argentina), utilizando como buffer de corrida TBE 1X (tris/borato/EDTA) a 80V durante 45 min. En el gel de agarosa se sembraron el marcador de peso molecular (PB-L 100 pb Ladder, Embiotec®, Buenos Aires, Argentina) y los productos de PCR. La visualización de fragmentos amplificados se realizó utilizando un transiluminador de luz UV (Labnet®, Nueva Jersey, Estados Unidos de América). El fragmento amplificado esperado era de 435 pb en los 2 casos, ya que la única diferencia está en un solo nucleótido en la secuencia del primer reverse. Como controles se utilizaron la cepa de C. jejuni ATCC 33560 y una cepa de Escherichia coli de la colección de nuestro laboratorio.
Para evaluar si existe asociación entre la frecuencia de aislamiento de cepas de C. jejuni pertenecientes al serotipo O:19 con el punto de muestreo dentro de la cadena cárnica aviar, se utilizó el test de la chi al cuadrado o test exacto de Fisher (dependiendo del número de observaciones), con un nivel de significación p=0,05.
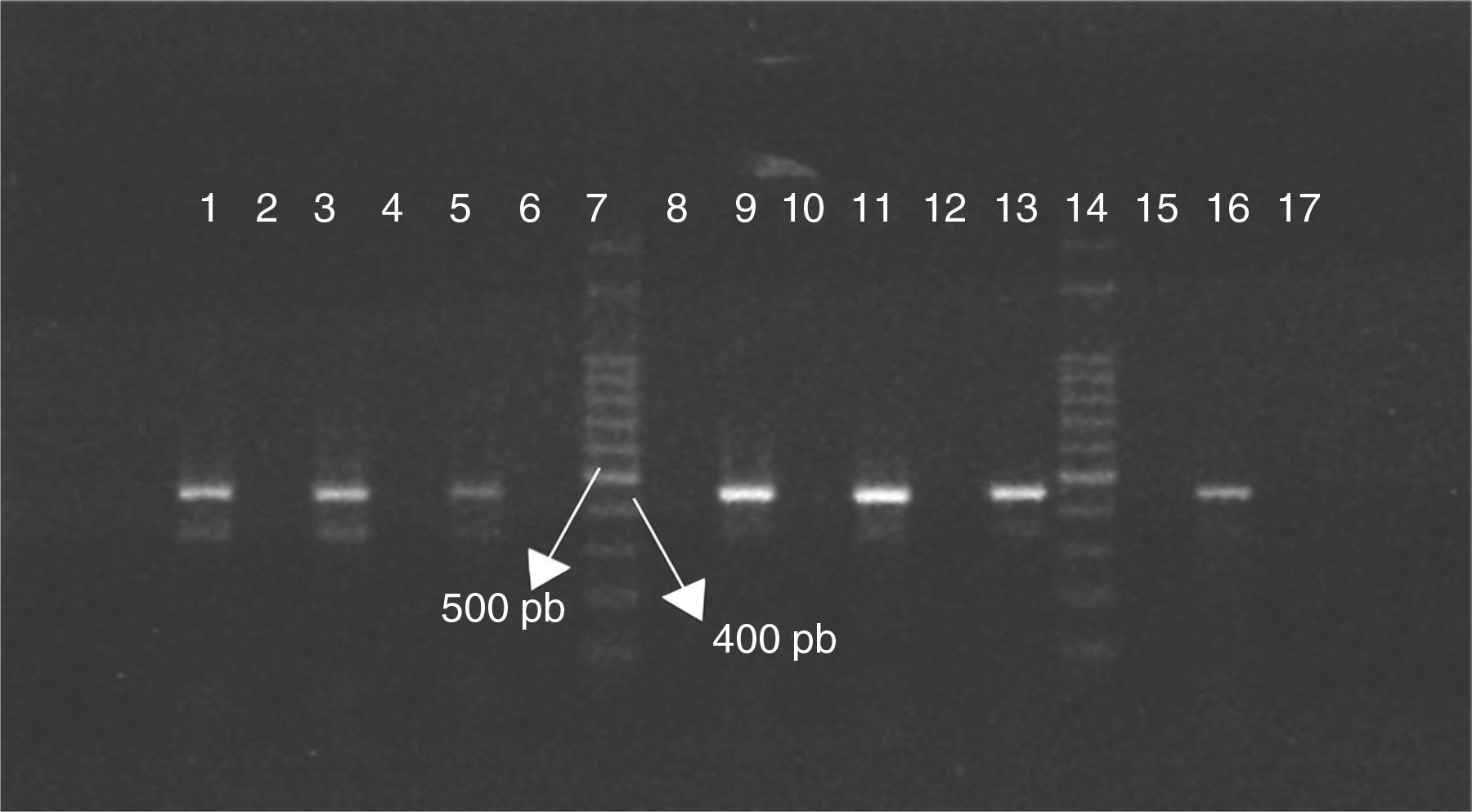
El análisis de los serotipos reveló que 45 de las 55 cepas de C. jejuni que habían sido aisladas (82%) fueron no O:19 y las 10 restantes (18%) fueron serotipo O:19. La figura 1 muestra algunos ejemplos de los resultados de las PCR que permitieron discriminar entre cepas O:19 y cepas no O:19.
Diferenciación por PCR de cepas de Campylobacter jejuni O:19 y no O:19 utilizando primers específicos.
Cepas O:19 líneas 1, 3 y 5, y cepas no O:19 líneas 9, 11 y 13. Cepa de referencia C. jejuni ATCC 33560 línea 16. Control negativo de reacción línea 17. Marcador de peso molecular línea 7 y 14.
Se detectaron aislamientos de C. jejuni serotipo O:19 en todos los puntos de muestreo, excepto en el frigorífico. Fueron positivos al serotipo O:19 el 15% de los aislamientos de C. jejuni obtenidos en la etapa de gallinas reproductoras y el 13% de los aislamientos de pollos de 7 días, y tanto en pollos de 45 días como en el punto de venta final la proporción de cepas O:19 fue del 33% (respecto del total de aislamientos de cada etapa). No hubo asociación entre la etapa de producción y la presencia de C. jejuni serotipo O:19 (p=0,186).
Estos resultados demostraron que la proporción de cepas de C. jejuni serotipo O:19 en la cadena cárnica aviar es elevada, lo que da cuenta de un riesgo importante para la salud pública, ya que estas cepas podrían llegar al consumidor final a través de la carne de pollo o de otros alimentos relacionados mediante contaminación cruzada.
La presencia de cepas de C. jejuni serotipo O:19 en casi la totalidad de los puntos de muestreo puede deberse a la transmisión horizontal de las cepas. Se ha demostrado que Campylobacter puede difundirse y permanecer en las diferentes granjas y los diferentes ciclos productivos a través de diversos vectores o fómites, como la cama de crianza de pollos, así como a través del agua de bebida, del alimento o de los roedores y las aves silvestres que habitan en las granjas. Otra posibilidad es el ingreso o el mantenimiento de estos patógenos en las granjas a partir de otro tipo de vectores, como moscas o los cascarudos de la cama (Alphitobius diaperinus)10.
Por otro lado, no hubo aislamientos de C. jejuni serotipo O:19 en frigorífico; esto podría deberse a que el número de aislamientos obtenidos a partir de este punto de la cadena cárnica aviar no fue elevado (n=13). Sin embargo, no es posible descartar el riesgo de contaminación cruzada durante la faena de las aves. Cada granja supone variaciones en la prevalencia de C. jejuni y en los frigoríficos son faenados pollos provenientes de numerosas granjas, por lo que la presencia de esta bacteria suele ser mayor que en cualquier otra etapa de la cadena10. La existencia en las canales de los pollos de un número elevado de cepas de C. jejuni, de las cuales algunas son potencialmente desencadenantes del SGB, incrementa el riesgo de contaminación cruzada durante las diferentes etapas de la faena, lo que a su vez aumenta la proporción de carcasas contaminadas con el patógeno, con el consiguiente riesgo de exposición para el consumidor final13. La presencia de un número elevado de aislamientos de C. jejuni serotipo O:19, tanto en la etapa de pollos de 45 días como en la etapa de punto de venta final, refuerza esta idea.
A pesar de que existen estudios que respaldan la posible relación de C. jejuni serotipo O:19 con el SGB5,9, la información existente no permite asegurar que un microorganismo de este serotipo provoque GBS. Es necesario entonces utilizar y combinar técnicas moleculares modernas con herramientas serológicas para un mejor entendimiento de esta patología. La realización de estudios epidemiológicos más complejos, que incorporen la tipificación de secuencias multilocus, en conjunto con los datos de campo recabados en hospitales y con estudios fenotípicos de este patógeno, permitirá comprender la relación entre el SGB y el microorganismo.
En este estudio fue evidente la presencia de cepas de C. jejuni O:19 potencialmente relacionadas con el desarrollo del SGB en la cadena de producción avícola, de modo que existe la posibilidad de que dichas cepas sean transmitidas a los seres humanos a través de alimentos de origen aviar. Esto constituye un riesgo importante para la salud de los consumidores, por lo que se debe destacar la necesidad de realizar estudios epidemiológicos completos de Campylobacter, que permitan implementar en forma urgente las medidas de control y prevención más oportunas, teniendo en cuenta las aves que son reconocidas como principales reservorios de este agente a nivel mundial1,3.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este estudio fue parte de un proyecto PICT financiado por la Agencia Nacional de Promoción científica y tecnológica. Laureano S. Frizzo, Lorena P. Soto, María V. Zbrun y Marcelo L. Signorini son investigadores miembros del Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET, Argentina). Jesica E. Blajman, Ayelén P. Berisvil, Analía Romero-Scharpen, Eugenia Rossler y Diego M. Astesana, Jorge A. Zimmermann son estudiantes de doctorado de CONICET.