Las parasitosis intestinales se encuentran ampliamente distribuidas en el mundo, con mayor prevalencia en los países en desarrollo. Principalmente afectan a los niños, en los que además provocan disminución del desarrollo físico y mental, situación que puede potenciarse enormemente cuando se suma a un estado nutricional deficiente. La Organización Mundial de la Salud las considera una de las principales causas de morbilidad, estrechamente ligada a la pobreza y relacionada con inadecuada higiene personal, incorrecta manipulación de los alimentos crudos, falta de servicios sanitarios, falta de provisión de agua potable y contaminación fecal del ambiente.
Algunas enfermedades parasitarias se vinculan con condiciones de transmisión que existen universalmente, por lo que son cosmopolitas, mientras que otras tienen distribución geográfica variable. En los últimos años, debido a la globalización, el movimiento de personas de zonas endémicas a regiones no endémicas ha permitido la diseminación de ciertas parasitosis. Y aunque también influyen en la frecuencia de algunas de estas enfermedades las costumbres de los pueblos, las condiciones ambientales son un factor determinante para la supervivencia de los parásitos. En nuestro país, debido a la diversidad de suelos y condiciones climáticas que existen, es posible hallar variedad de agentes causales de estas parasitosis.
El objetivo de este trabajo fue realizar una revisión bibliográfica de los agentes parasitarios causantes de enfermedades entéricas encontrados en la República Argentina, tanto en materia fecal de personas como en el ambiente, ya que la contaminación parasitaria de este último constituye un indicador directo del riesgo de infección por parásitos intestinales.
Intestinal parasitic diseases are widely spread in the world, with the highest prevalence in developing countries. Children are mainly affected, showing a decrease in physical and mental development, as well as the expected manifestations of the disease. This situation can be greatly enhanced in children with poor nutritional status. The World Health Organization considers intestinal parasitic diseases a major cause of morbidity, closely linked to poverty and poor personal hygiene, inappropriate handling of raw food, lack of sanitation, lack of potable water supply, and environmental fecal contamination.
Some parasitic diseases are cosmopolitan while others have variable geographic distribution, due to different factors such as the presence of exclusive intermediate hosts. In the past few years, globalization allowed the spread of certain parasites from endemic to non-endemic regions. Even though people's customs influence on the frequency of certain parasites, environmental conditions are a determinant factor for parasite survival. In our country, due to the variety of soils and climatic conditions, several causative agents of these parasitoses can be found.
The aim of this work was to review the literature on the intestinal parasitic agents found in Argentina in human fecal samples and its environment, as parasitic contamination constitutes a direct indicator of the infection risk by intestinal parasites.
Las parasitosis intestinales afectan principalmente a los niños. Hay numerosos datos de estudios que muestran una elevada prevalencia de este tipo de enfermedades, tanto en nuestro país32,51,53,54 como en el resto del mundo43,69. No obstante, los registros subestiman la real magnitud de estos parásitos, que se mantienen en altas tasas, especialmente en países en vías de desarrollo, a causa de las deficientes condiciones de saneamiento ambiental y de la falta de control, prevención y educación sanitaria, entre otros factores. La contaminación fecal del suelo, el agua y los alimentos son fuentes de infección y reinfección, sumada a malos hábitos higiénicos, y si bien las formas latentes de los parásitos (quistes, ooquistes, huevos) no pueden multiplicarse en el ambiente, sí pueden hacerlo formas de vida libre, como algunas amebas74 y Strongyloides stercoralis79.
La incidencia y la prevalencia de parasitosis intestinales se han tomado como indicadores del estado de salud de la población en distintos contextos. Tanto las tasas de infestación por parásitos intestinales como el espectro de especies predominantes varían considerablemente de una localidad a otra. En Argentina, estudios descriptivos han informado prevalencias de parasitosis por encima del 80% en algunas localidades del norte y sur del país83,86, mientras que en la zona central se registran porcentajes cercanos a 45%7.
En este trabajo se realizó una revisión de las especies de parásitos intestinales encontradas en el ambiente (suelo, agua, heces animales, etc.) y en materia fecal de personas, a fin de listar los agentes hallados en nuestro país en los últimos doce años, para finalmente analizar la correlación entre dichos hallazgos, y evaluar así el rol que juega la contaminación ambiental en la transmisión de este tipo de patógenos humanos.
Parásitos entéricos en el ambienteLos hallazgos en el ambiente en el territorio de la República Argentina informados en bibliografía se muestran en las tablas 1 y 2. Las condiciones ambientales (temperatura, humedad, vientos, suelo) son determinantes en la viabilidad y maduración de los huevos de helmintos patógenos72,89, mientras que los quistes y ooquistes de protozoarios son relativamente más resistentes a condiciones adversas3,64.
Protozoos intestinales encontrados en muestras ambientales de la República Argentina.
| Protozoos | Encontrado en | Provincia |
| Amebas | Agua de consumo | Buenos Aires26 |
| Agua de río | Salta59 | |
| Suelo | Buenos Aires13 | |
| Amebas comensales* | Agua de consumo y suelo | Buenos Aires7 |
| Balantidium coli | Agua de río | Salta59 |
| Chilomastix mesnili | Suelo | Buenos Aires13 |
| Coccidios | Agua de consumo | Buenos Aires7 |
| Aguas recreacionales | Buenos Aires14 | |
| Suelo | Buenos Aires7,13 | |
| Cryptosporidium spp. | Agua de consumo | Buenos Aires6, Santa Fe40 |
| Agua de consumo subterránea | Santa Fe2 | |
| Agua de río, de arroyo y canal | Salta59, Buenos Aires14 | |
| Aguas recreacionales | Buenos Aires14 | |
| Agua superficial | Santa Fe1 | |
| Materia fecal de terneros | Córdoba88, Santa Fe19,52 | |
| Cyclospora sp. | Agua de río | Salta59 |
| Efluentes agroindustriales | Mendoza22 | |
| Dientamoeba fragilis | Agua de río | Salta59 |
| Endolimax nana | Agua de río | Salta59 |
| Suelo | Neuquén82 | |
| Endolimax sp. | Agua de arroyo y canal | Buenos Aires14 |
| Entamoeba coli | Agua de consumo | Buenos Aires7,26, Santa Fe40 |
| Agua de río | Salta59 | |
| Suelo | Neuquén82 | |
| Entamoeba histolytica/E. dispar | Agua de río | Salta59 |
| Agua de consumo | Santa Fe40 | |
| Entamoeba spp. | Agua de arroyo y canal | Buenos Aires14 |
| Heces de perro | Neuquén84 | |
| Enteromonas hominis | Suelo | Neuquén82 |
| Giardia lamblia | Agua de consumo | Buenos Aires7, Santa Fe40 |
| Agua de río | Salta59 | |
| Agua superficial | Santa Fe1 | |
| Materia fecal de terneros | Córdoba88 | |
| Materia fecal de perros y vacas | Buenos Aires50 | |
| Suelo | Buenos Aires7 | |
| Giardia sp. | Aguas recreacionales | Buenos Aires14 |
| Aguas de arroyo y canal | Buenos Aires14 | |
| Heces de perro | Neuquén84 | |
| Efluentes domiciliarios | Río Negro75 | |
| Suelo | Buenos Aires13, Neuquén75,82 | |
| Isospora belli | Efluentes agroindustriales | Mendoza22 |
| Isospora spp. | Efluentes agroindustriales | Mendoza22 |
| Heces de perro | Neuquén84 | |
| Microsporidium spp. | Agua de río | Salta59 |
| Sarcocystis spp. | Heces de perro | Neuquén84 |
| Suelo | Neuquén82 | |
| Trichomonas spp. | Agua de río | Salta59 |
Helmintos entéricos encontrados en muestras ambientales en Argentina.
| Helmintos | Encontrado en | Provincia |
| Ancilostomídeos | Heces de perro | Buenos Aires y Misiones24 |
| Suelo | Buenos Aires13,24, Misiones24 | |
| Ancylostoma duodenale | Efluentes domiciliarios | Neuquén y Río Negro75 |
| Ancylostoma sp. | Heces de perro | Neuquén98 |
| Ascaris lumbricoides | Agua de río | Salta59 |
| Efluentes domiciliarios | Neuquén y Río Negro75 | |
| Heces de perro | Buenos Aires26 | |
| Suelo | Buenos Aires13,24,26, Misiones24 | |
| Ascaris spp. | Aguas de arroyo y canal | Buenos Aires14 |
| Aguas recreacionales | Buenos Aires14 | |
| Heces de perro | Buenos Aires y Misiones24 | |
| Capillaria spp. | Heces de perro | Neuquén84 |
| Suelo | Buenos Aires13 | |
| Diphyllobothrium spp. | Heces de perro | Neuquén84, Chubut98 |
| Dipylidium caninum | Agua de río | Salta59 |
| Heces de perro | Neuquén84 | |
| Suelo | Buenos Aires13 | |
| Dipylidium sp. | Heces de perro | Chubut98 |
| Enterobius vermicularis | Agua de río | Salta59 |
| Aguas recreacionales | Buenos Aires14 | |
| Efluentes domiciliarios | Neuquén y Río Negro75 | |
| Suelo | Buenos Aires13 | |
| Echinococcus granulosus | Aguas recreacionales | Buenos Aires14 |
| Fasciola hepatica | Heces de cabra | Mendoza16 |
| Agua de río | Salta59 | |
| Cabras, ovejas, bovinos, caracoles | Neuquén67 | |
| Hymenolepis diminuta | Aguas de arroyo y canal | Buenos Aires14 |
| Efluentes domiciliarios | Neuquén y Río Negro75 | |
| Hymenolepis nana | Agua de río | Salta59 |
| Suelo | Buenos Aires13,24, Misiones24 | |
| Larvas de la familia Oxyuridae | Aguas de arroyo y canal | Buenos Aires14 |
| Larvas de nematodes | Aguas de arroyo y canal | Buenos Aires14 |
| Suelo y agua de consumo | Buenos Aires26 | |
| Heces de perro | Buenos Aires y Misiones24 | |
| Suelo | Buenos Aires13, Misiones24 | |
| Necator americanus | Agua de río | Salta59 |
| Strongyloides sp. | Heces de perro | Chubut98 |
| Strongyloides stercoralis | Agua de río | Salta59 |
| Taenia spp. | Suelo | Buenos Aires13,24 |
| Taenia spp. /Echinococcus spp. | Suelo | Buenos Aires26 |
| Heces de perro | Neuquén84 | |
| Trichostrongylus spp. | Aguas de arroyo y canal | Buenos Aires14 |
| Agua de río | Salta59 | |
| Trichuris sp. | Aguas recreacionales | Buenos Aires14 |
| Suelo | Buenos Aires13 | |
| Heces de perro | Chubut98 | |
| Trichuris trichiura | Agua de río | Salta59 |
| Efluentes domiciliarios | Neuquén y Río Negro75 | |
| Trichuris vulpis | Heces de perro | Buenos Aires24,26, Misiones24, Neuquén84 |
Los protozoos generalmente se encuentran asociados a enfermedades transmitidas por agua, por lo que pueden hallarse frecuentemente en estas muestras. Los agentes patógenos y parásitos transmitidos por el agua más comunes son los que tienen infectividad alta, los que pueden proliferar en ella o los que demuestran resistencia alta fuera del organismo11,36.
Se informaron amebas en general, sin especificar género, en aguas en las provincias de Salta59 y Buenos Aires26, y en suelo de esta última13. Si bien no todas las amebas encontradas en el ambiente tienen potencial para causar enfermedad, algunas de ellas tienen la capacidad de alojar bacterias como Legionella, que puede causar legionelosis en poblaciones de inmunodeprimidos39.
Entamoeba coli se encuentra presente en la población de todo el mundo, aunque es más común entre las poblaciones nativas de los países de climas cálidos y húmedos. Desde siempre fue considerada comensal, pero existe información respecto de casos en los que causó enfermedad31. Fue encontrada de norte a sur de la Argentina en aguas7,26,40,59 y suelo82.
Otras amebas informadas fueron Entamoeba histolytica y Entamoeba dispar. La primera es agente causal de amebiosis en humanos y permanece como una causa significativa de morbilidad y mortalidad en países en desarrollo87, en tanto la segunda, morfológicamente indistinguible de E. histolytica y considerada no patógena, es más común en humanos de muchas partes del mundo70. De igual manera, en muestras ambientales es importante considerar a la ameba de vida libre Entamoeba moshkovskii. Esta también es morfológicamente idéntica a E. histolytica y E. dispar, y es altamente prevalente en algunos países donde E. histolytica es endémica. Fue aislada de aguas residuales de muchas partes del mundo y, recientemente, ha sido informada en 21% de los niños de Bangladesh como comensal no invasivo4.
En Argentina se informó este grupo de amebas de igual morfología tanto en aguas de consumo40 como de río59. Se ha comunicado la presencia de Entamoeba spp. en heces de perro en la provincia del Neuquén84, y también en aguas de arroyo y canal en la provincia de Buenos Aires14. Endolimax nana, ameba cosmopolita de patogenicidad dudosa y de igual prevalencia que Entamoeba coli, se identificó en aguas en Salta59 y Buenos Aires14 y en suelo en Neuquén82. Iodamoeba bütschlii, ameba de distribución mundial pero mucho menos prevalente que las anteriores, se encontró en agua de consumo de la provincia de Buenos Aires26 y en suelo de Neuquén82.
Dientamoeba fragilis, protozoo también de distribución mundial y habitante del tracto gastrointestinal humano, solo fue informado por nuestro grupo de trabajo en agua de río de la provincia de Salta59. Al momento de su descubrimiento este organismo fue considerado una ameba por su movilidad mediante pseudópodos, pero estudios ultraestructurales y moleculares lo han ubicado definitivamente dentro de los flagelados34. Actualmente existe evidencia que apoya su patogenicidad5,31. Otro dato interesante es que solamente se encuentra en forma de trofozoíto, por lo que se postula que podría ser transportado por los huevos de algunos nematodes parásitos comunes, como los de Enterobius vermicularis28. Para demostrar esta hipótesis, investigadores del país y del exterior han llevado a cabo trabajos interesantes usando métodos de biología molecular49,66.
Basualdo et al.7 informaron el hallazgo de amebas comensales (diferentes de E. coli) en suelo y agua de consumo en la provincia de Buenos Aires. Si bien estos organismos se consideran no patógenos, su presencia en agua de consumo indica que otros organismos podrían haber sobrevivido a los tratamientos de potabilización, o que el agua pudo haber estado expuesta a la contaminación fecal en un paso posterior. Hay que considerar también que la línea demarcatoria entre comensalismo y parasitismo no es rígida, muchas veces los parásitos viven como comensales en un hospedador y solo en determinadas ocasiones producen daño95.
Entre los apicomplejos, el más frecuentemente reconocido fue Cryptosporidium spp. Se aisló en aguas de Salta59, Santa Fe1,2,40 y Buenos Aires6,14, y en materia fecal de terneros de Córdoba88 y Santa Fe52. Los brotes de criptosporidiosis están asociados al agua de consumo, tal como ocurrió en el conocido caso de Milwakee (Wisconsin, EE.UU.), en 199441, y en muchos otros similares23. El ooquiste maduro −la forma infectante del parásito− es resistente a condiciones adversas, como la cloración a los niveles usados en la potabilización del agua (0,2 a 0,5mg/l de cloro residual), y la dosis infectiva es muy baja (de 1 a 10 ooquistes)10. Un rasgo distintivo de esta parasitosis es que la duración y gravedad de la infección dependen del estado inmunológico del paciente37. Desde el punto de vista epidemiológico, los terneros representan una importante fuente de contaminación del agua y del suelo19 y son el principal reservorio de Cryptosporidium parvum, especie con mayor potencial zoonótico del género. La criptosporidiosis constituye un importante problema de salud pública mundial, aun en países desarrollados, hasta el punto de ser considerada en la actualidad como una enfermedad emergente20.
Otros esporozoarios informados fueron Isospora belli22 y otras especies del género84, Sarcocystis spp.84, Cyclospora sp.59 y coccidios sin especificar7,13,14,82. Todos estos fueron encontrados del norte al sur del país en muestras de agua, efluentes, suelo y heces de terneros y perros. Cyclospora cayetanensis es un coccidio reconocido como patógeno entérico causante de diarreas prolongadas en humanos55. I. belli y Sarcocystis hominis también son productores de coccidiosis intestinales33. En este punto cabe aclarar que la especie I. belli ha sido revisada recientemente por el Centro para el Control y la Prevención de enfermedades (CDC) y reclasificada como Cystoisospora belli sobre la base de sus características morfológicas y de su ciclo biológico. Dado que no en todos los casos la nomenclatura ha sido actualizada, ambas denominaciones se consideran sinónimos para la clínica42.
Giardia spp. fue el flagelado más encontrado, y coincidentemente con su distribución cosmopolita, se lo informó a lo largo del territorio argentino en muestras de agua1,7,14,40,59, efluentes domiciliarios75, suelo7,13,82 y heces animales50,84,88. Giardia lamblia es causante de brotes transmitidos por el agua, al igual que Cryptosporidium spp. y Cyclospora spp., debido a que sus quistes pueden permanecer y persistir largos períodos en ella. Además, tienen la ventaja de ser infecciosos inmediatamente después de su excreción por el hospedador previo, como ocurre con los de Cryptosporidium spp., mientras que los ooquistes de Cyclospora spp. requieren maduración65.
Otros flagelados informados en suelo fueron Chilomastix mesnili13 y Enteromonas hominis82, habitantes normales del ciego humano, y en agua de río, Trichomonas spp.59, estas últimas (en el caso de las intestinales) son consideradas los flagelados de distribución cosmopolita más comunes, después de G. lamblia.
El género parásito intracelular obligado Microsporidium y el ciliado Balantidium coli, ambos cosmopolitas, solo fueron informados en el ambiente de nuestro país en agua de río de Salta por nuestro grupo de trabajo59. Microsporidium, género artificial que abarca especies de microsporidios insuficientemente descritos o clasificados y en el que se agrupan varias especies patógenas humanas, ha sido informado en aguas superficiales y subterráneas, y en aguas residuales tratadas, en un trabajo sobre patógenos emergentes transmitidos por el agua78, lo que indica su potencial para ser incluido dentro de este grupo. Se considera que afecta no solo al tracto digestivo, sino también a otros órganos, pero con mucha mayor frecuencia a personas HIV positivas80,92. Sin embargo, también ha sido implicado en casos de individuos sanos29. Asimismo, el agua es el principal vehículo en el caso de B. coli, protozoario de gran tamaño que infecta a humanos y causa diarrea y disentería73. La balantidiosis es una enfermedad zoonótica, su principal transmisor al hombre es el cerdo y los casos extraintestinales son raros, aunque se ha publicado este año un caso ocurrido en la India21.
Blastocystis spp., organismo oportunista31, fue informado por nuestro grupo en agua de río de Salta59 y por otros investigadores en agua de consumo7, en aguas de arroyo y de canal14 y en suelo de Buenos Aires13. La ubicación sistemática de este género fue controversial97, hasta que recientemente fue reclasificado como el único parásito humano perteneciente al reino Chromista, donde se encuentran también las algas marrones y las diatomeas, circunstancia que lo aleja de los hongos y los protozoarios37,68. En general, en los países en desarrollo existe una mayor prevalencia del parásito que en los países desarrollados, relacionando esto con la falta de higiene, la exposición a los animales y el consumo de alimentos o agua contaminados37.
HelmintosLa variedad de helmintos encontrada en el ambiente fue amplia. Un grupo muy importante entre ellos son los geohelmintos, agentes transmitidos por el suelo debido a que sus formas de propagación necesitan pasar un período de tiempo en la tierra para madurar y volverse infectivas para sus hospedadores; por lo que su desarrollo y viabilidad dependen de las condiciones que este sustrato les brinde. Se han documentado geohelmintos como Ascaris lumbricoides13,59, Ascaris spp.14,24, Trichuris trichiura59, Trichuris sp.13,14; ancilostomídeos24 como Ancylostoma duodenale75 y Necator americanus59, y S. stercoralis59. A pesar de que las bajas temperaturas no son favorables para el desarrollo de este tipo de helmintos82, algunos han sido encontrados en muestras ambientales de Neuquén y Río Negro75,98.
Trichuris vulpis es una especie productora de parasitosis intestinales en perros, fue hallada en heces de estos animales en Neuquén84, Buenos Aires y Misiones24,26. Hace mucho tiempo se han comunicado casos de humanos parasitados por esta especie35. Trichostrongylus spp., helminto encontrado en aguas de río de Salta59 y en aguas de arroyo y de canal de Buenos Aires14, parasita el intestino delgado de muchos mamíferos y aves, algunas especies también pueden infectar a humanos93.
Enterobius vermicularis, a la inversa de la gran mayoría de los parásitos, muestra los más altos porcentajes de prevalencia en zonas frías y templadas. Es probablemente el más común de los helmintos que infectan a los seres humanos, se han registrado tasas de prevalencia de hasta el 100% en el noroeste de Europa y los EE.UU. En nuestro país ha sido encontrado en Salta59, Buenos Aires13,14, Neuquén y Río Negro75.
Se ha documentado el hallazgo de larvas de nematodes en suelo13, en agua de consumo26 en aguas de arroyo y de canal14 y en heces de perro24 en Misiones y Buenos Aires.
Si bien no se han descrito casos de capilariosis humana en el país, se ha informado Capillaria spp. –género transmitido por el consumo de peces pequeños infectados– en heces de perro y en suelo de Neuquén84 y de Buenos Aires13. Se han informado más de 250 especies de Capillaria, pero solo cuatro de ellas fueron encontradas en humanos: Capillaria hepatica, Capillaria aerophila, Capillaria plica y Capillaria philippinensis. Son raros los informes de infecciones humanas con las tres primeras especies, sin embargo, los casos en donde se encuentra involucrada C. philippinensis parecen aumentar y expandirse geográficamente, dicha especie ha sido causante de epidemias y muertes en las Filipinas y Tailandia15.
Se encontraron en el país huevos de Toxocara spp. en suelo, aguas y heces de perro14,26. Este género no fue incluido en los listados de esta revisión debido a que se encuentra fuera de nuestro objetivo el análisis de parasitosis extraintestinales, como lo es la toxocariosis humana, que consiste en una migración larval por las vísceras y en la que el intestino solo es un lugar de paso, sin patología en este órgano.
Fasciola hepatica, trematodo informado por nuestro grupo en agua de río de Salta59, fue incluido en la tabla 2. Si bien no se localiza en el intestino propiamente dicho, lo hace en el hígado, anexo del tracto gastrointestinal. Este hallazgo es relevante considerando que este parásito requiere condiciones ecológicas bastante precisas para cumplir su ciclo biológico, por lo que es un patógeno de baja prevalencia en humanos. Sin embargo, uno de los más altos niveles de prevalencia de fasciolosis hepática fue encontrado en Bolivia, país que tiene límites con la provincia de Salta56.
Recientemente fue publicado un estudio en cabras criollas de la región andina mendocina, donde se muestra una prevalencia del 85% de este parásito en esos animales16.
Dentro del grupo de los cestodos, Dipylidium caninum, especie potencialmente zoonótica llamada vulgarmente ‘tenia canina’, fue hallada en Salta59, Neuquén84, Buenos Aires13 y Chubut98. En el ciclo de vida de este parásito el hombre puede actuar como hospedador accidental por la ingestión de pulgas infectadas. Las mascotas, principalmente los perros, desempeñan un papel importante en su transmisión.
Diphyllobothrium latum, cestodo transmitido por peces infectados, que usa como hospedador definitivo al hombre y como hospedador accesorio al perro, fue hallado en heces de perro en Neuquén y Chubut84, provincias donde se practica la pesca de trucha.
Hymenolepis nana es el único cestodo que no requiere de un hospedador intermediario, aunque puede pasar por este (pulga), y es el hombre el que alberga los estadios de larva y adulto simultáneamente. Tal característica, sumada a la inmediata infectividad que presentan los huevos de H. nana, convierte a este parásito en potencial productor de enfermedad masiva44. Esta especie, parásita normal del hombre, fue encontrada en agua de río en Salta59 y en suelo en Buenos Aires y Misiones24. En el sur del país se informó Hymenolepis diminuta proveniente de efluentes domiciliarios75 y en aguas de arroyo y canal de la provincia de Buenos Aires14. Se trata de un parásito normal de roedores murinos que tiene al hombre como un hospedador accesorio.
Los huevos de la familia Taenidae son morfológicamente indistinguibles45, las especies de mayor interés en nuestro medio son Taenia saginata, Taenia solium y Echinococcus granulosus. Se informó la presencia de Taenia spp./Echinococcus sp. en suelo de la provincia de Buenos Aires13,24,26. En Neuquén se encontraron huevos de esta familia en heces de perro84. E. granulosus es un parásito ubicuo ampliamente difundido en el territorio argentino, en el que se documentan seis focos endémicos bien diferenciados30. Dentro de aquellos más estudiados se encuentra el del sur de la Argentina96. En piscinas públicas de la ciudad de Bahía Blanca, provincia de Buenos Aires, Costamagna et al.14 informaron un ejemplar adulto de E. granulosus.
Parásitos entéricos en muestras fecales humanasEn las tablas 3, 4 y 5 se listan los parásitos intestinales encontrados en muestras fecales humanas en la República Argentina.
Protozoos entéricos en muestras fecales humanas de la República Argentina.
| Protozoos | Características de la zona | Provincia |
| Amebas | Urbana y rural | Buenos Aires57 |
| Amebas comensales | Rural | Buenos Aires7,57 |
| Chilomastix mesnili | Suburbana | Misiones54, Santa Fe32 |
| Urbana | Buenos Aires57, Neuquén82, Santa Fe40 | |
| No informada* | Buenos Aires25,26 | |
| Rural | Misiones54, Salta48 | |
| Coccidios | Rural | Buenos Aires7,57 |
| Urbana | Buenos Aires57 | |
| Cryptosporidium spp. | Rural y suburbana | Misiones54 |
| Rural | Buenos Aires57 | |
| Urbana | Buenos Aires57, Santa Fe40 | |
| No informada* | Santa Fe32 | |
| Cyclospora sp. | Rural y suburbana | Misiones54 |
| Dientamoeba fragilis | Rural | Salta48 |
| Endolimax nana | Rural | Buenos Aires57, Misiones54, Salta48 |
| Suburbana | Buenos Aires25,26,53, Misiones54 | |
| Urbana | Buenos Aires57, Santa Fe40, Neuquén82 | |
| No informada* | Santa Fe32 | |
| Entamoeba coli | Rural | Buenos Aires7,57, Salta48, Misiones54 |
| Suburbana | Buenos Aires25,26,53, Misiones54 | |
| Urbana | Buenos Aires57, Neuquén82, Santa Fe40 | |
| Villa de emergencia | Buenos Aires50 | |
| No informada* | Santa Fe32 | |
| Entamoeba histolytica | No informada* | Santa Fe8 |
| Entamoeba histolytica/E. dispar | Rural | Misiones54, Salta48 |
| Suburbana | Misiones54 | |
| Urbana | Santa Fe40 | |
| No informada* | Santa Fe8 | |
| Enteromonas hominis | Rural | Misiones54 |
| Suburbana | Buenos Aires25,26, Misiones54 | |
| Urbana | Neuquén82 | |
| Giardia lamblia | Rural | Buenos Aires7,50,51,57, Misiones54, Salta48 |
| Suburbana | Buenos Aires25,26,53, Misiones54 | |
| Urbana | Buenos Aires51,57, Neuquén82, Santa Fe40 | |
| Villa de emergencia | Buenos Aires50 | |
| No informada* | Santa Fe8,32 | |
| Iodamoeba bütschlii | Rural | Buenos Aires54, Salta48 |
| Suburbana | Buenos Aires25,54 | |
| Urbana | Neuquén82 | |
| No informada* | Santa Fe32 | |
| Isospora belli | Urbana y rural | Buenos Aires57 |
| Pentatrichomonas hominis | No informada* | Santa Fe32 |
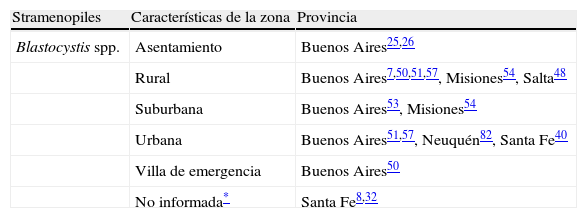
Blastocystis spp. encontradas en muestras fecales humanas de la República Argentina.
Helmintos entéricos en muestras fecales humanas de la República Argentina.
| Helmintos | Características de la zona | Provincia |
| Ancilostomídeos | Rural | Buenos Aires25, Misiones25,54, Salta48 |
| Suburbana | Buenos Aires25, Misiones25,54 | |
| Ascaris lumbricoides | Rural | Buenos Aires7,24,50,57, Misiones24,54 |
| Suburbana | Buenos Aires24,26,53, Misiones24,54 | |
| Urbana | Buenos Aires24,50, Misiones24 | |
| Villa de emergencia | Buenos Aires57 | |
| No informadaa | Santa Fe32 | |
| Diphyllobothrium latum | Rural | Mendoza9 |
| Urbana | Buenos Aires47 | |
| No informadaa | Neuquén y Río Negro76 | |
| Enterobius vermicularisb | Rural | Buenos Aires50,57, Misiones54, Salta48 |
| Suburbana | Buenos Aires26,53, Misiones54 | |
| Urbana | Buenos Aires57, Neuquén82 | |
| Villa de emergencia | Buenos Aires50 | |
| Hymenolepis nana | Rural | Buenos Aires7,24,57, Misiones24,54, Salta48 |
| Suburbana | Buenos Aires24,26,53, Misiones24,54 | |
| Urbana | Buenos Aires24,57, Misiones24 | |
| No informadaa | Santa Fe32 | |
| Strongyloides stercoralis | Rural | Buenos Aires24,26,50,57, Misiones24,54, Salta48 |
| Suburbana | Buenos Aires24,26, Misiones24,54 | |
| Urbana | Buenos Aires57 | |
| Villa de emergencia | Buenos Aires50 | |
| No informadaa | Santa Fe32 | |
| Trichuris spp. | Rural | Buenos Aires7,53 |
| Trichuris trichiura | Rural | Buenos Aires24,50,57, Misiones24,54, Salta48 |
| Suburbana | Buenos Aires24,26, Misiones24,54 | |
| Urbana | Buenos Aires57 | |
| Villa de emergencia | Buenos Aires50 | |
| No informadaa | Santa Fe32 |
Entre las amebas, la especie más hallada fue la comensal Entamoeba coli7,40,48,50,53,54,57,82. En segundo y tercer lugar en frecuencia de hallazgo se encuentran Endolimax nana32,40,48,53,54,57,82 e Iodamoeba bütschlii48,54,82. Todos estos aislamientos se asociaron a personas residentes en zonas tanto urbanas como rurales. E. nana, ameba de distribución mundial con predominancia en regiones tropicales, fue documentada como causante de infección junto con Blastocystis spp. Se postula como razón de ello la coinfección debido al idéntico modo de transmisión de ambos parásitos, ya que condiciones de vida poco higiénicas y el consumo de alimentos y agua contaminados pueden conducir a un poliparasitismo. Otro mecanismo que se ha sugerido tiene en cuenta la susceptibilidad provocada por la irritación y la inflamación de la mucosa producida por una infección inicial del lumen intestinal, lo que permitiría a otro organismo parásito infiltrarla77. Finalmente, la incidencia de poliparasitosis depende del estado inmune de cada individuo38.
Iodamoeba es un género de parásitos intestinales encontrado en humanos, primates y otros animales; su nombre deriva de la gran masa iodofílica de glucógeno presente en sus quistes. Las cepas patógenas humanas han sido asignadas a la especie I. bütschlii. La identidad de este género ha sido controversial, hasta que recientemente se ha encontrado un ancestro común específico y compartido con Endolimax62,85. El trofozoíto de Dientamoeba fragilis fue encontrado por el mismo grupo de trabajo en personas residentes en zona rural de la provincia de Salta48, y anteriormente en pacientes concurrentes a un hospital de la ciudad de Buenos Aires, con mayor frecuencia en los HIV positivos46.
Se informaron también amebas morfológicamente compatibles con Entamoeba histolytica/Entamoeba dispar, especies de morfología indiferenciable8. En Santa Fe, por métodos como coloración o ELISA se corroboró la presencia de E. histolytica, organismo productor de disentería amebiana. En la provincia de Buenos Aires se informaron amebas comensales y amebas en general57. La bibliografía informa dos brotes mundiales importantes: un brote escolar, que involucró a E. histolytica y a Shigella sonnei, informado en 2001 en Taiwán17, y otro brote comunicado en 1992, que afectó a personas que hicieron turismo por Tailandia18 y que involucró a E. histolytica y a G. lamblia.
Se hallaron coccidios en muestras fecales de las provincias de Misiones, Santa Fe y Buenos Aires, en zonas urbanas y rurales7,32,40,54,57. Entre ellos, los más frecuentes fueron Cryptosporidium spp., Cyclospora sp. e Isospora belli. Algunos coccidios son de difícil reconocimiento en exámenes en fresco; en el caso de Cryptosporidium sp., debido a que su forma y tamaño es similar al de muchas levaduras y su contenido es un tanto confuso, y en el de I. belli, debido a que los ooquistes no maduran en materia fecal sin presencia de oxígeno.
Giardia lamblia, flagelado cosmopolita prevalente en climas cálidos y templados, fue informado por grupos de investigación en el norte48, en el sur82 y en el este54 del país, pero principalmente en el centro del territorio7,8,26,32,40,50,51,53,57. La giardiosis es la principal causa de diarrea no viral y afecta a millones de personas en todo el mundo71. Aunque hay tratamientos efectivos disponibles, en algunos casos el parásito es refractario y en otros los síntomas debilitantes pueden continuar incluso después de que el parásito ha sido eliminado, con el consiguiente impacto en la calidad de vida. Esta es otra carga para la población ya desfavorecida de los países en desarrollo63.
Otros flagelados informados fueron Trichomonas hominis (Pentatrichomonas hominis)32, Enteromonas hominis26 y Chilomastix mesnili32,40,48,54,57,82, los tres son considerados no productores de patologías, aunque hay un informe de diarrea por T. hominis27.
Coincidentemente, los mismos trabajos que informaron G. lamblia y E. coli en muestras fecales también informaron Blastocystis spp.7,8,40,48,50,51,53,54,57,82. Es común que la parasitosis se produzca de forma conjunta entre Blastocystis spp. y Giardia spp.; las infecciones intestinales causadas por estos parásitos están asociadas a factores climáticos, condiciones sanitarias básicas y características socioculturales51.
En Argentina se han informado casos humanos de microsporidiosis en pacientes HIV positivos concurrentes a hospitales bonaerenses90,91. No fueron incluidos en la tabla 3 debido a que su reconocimiento se realizó casi todas las veces en muestras de biopsias intestinales y no en exámenes de materia fecal.
HelmintosLa gran mayoría de los nematodes encontrados en las muestras fecales fueron geohelmintos. Se informó Strongyloides stercoralis y Trichuris trichiura en Buenos Aires53, Santa Fe32, Misiones24,54 y Salta48. Ascaris lumbricoides se halló en Buenos Aires7,24,26,50,53,57, Santa Fe32 y Misiones24,54. Se encontraron ancilostomídeos en Salta48, Buenos Aires24 y Misiones24,54. Las parasitosis provocadas por geohelmintos son endémicas en los países en desarrollo y constituyen un indicador de las condiciones sanitarias y ecológicas del entorno de sus hospedadores54. De hecho, como se observa en la tabla 5, la gran mayoría de los aislamientos de este grupo de parásitos se efectuó en zonas suburbanas y rurales.
Enterobius vermicularis, parásito cosmopolita y prevalente en zonas frías y templadas, se encontró en muestras fecales o de mucus anal por el test de Graham (en casi todos los casos) en habitantes de Buenos Aires26,50,53,57, Misiones54, Neuquén82 y Salta48. Este helminto generalmente se considera una molestia más que una causa de enfermedad grave, pero es significativa la morbilidad a él asociada, especialmente en los niños. Además, la eliminación del parásito de un grupo familiar o de una institución a menudo plantea problemas importantes debido a curado incompleto, o a reinfección12.
En las mismas provincias en donde se informó S. stercoralis y T. trichiura (Buenos Aires, Santa Fe, Misiones y Salta) se encontró el pseudogeohelminto Hymenolepis nana7,26,32,48,53,54,57, considerado el más prevalente entre los cestodos.
En Sudamérica se encontraron solo tres especies del género Diphyllobothrium: Diphyllobothrium latum, Diphyllobothrium pacificum y Diphyllobothrium dendriticum. D. latum es considerado el único agente etiológico de difilobotriosis en Argentina, y a pesar de que la enfermedad se encuentra restringida a la Patagonia andina, donde hay informes de pescadores o guías de pesca infectados con esta especie76, también se han informado casos aislados en la ciudad de Buenos Aires47 y en la provincia de Mendoza9. No se ha informado ningún otro platelminto en personas.
Correlación de agentes encontrados en el ambiente y en humanosEn un informe de la Organización Mundial de la Salud, se estima que el 24% de las enfermedades y el 23% de las muertes globales pueden atribuirse a factores ambientales61.
La población más afectada son los niños entre 0 y 14 años, y para este grupo, el 1,5% de las enfermedades se deben a infecciones intestinales por nematodes, principalmente debido a la mala calidad del agua, el escaso o insuficiente saneamiento y la falta de higiene60. Por otro lado, las diarreas causadas por protozoos intestinales también son motivo de una morbilidad y mortalidad significativas en todo el mundo, en variedad de poblaciones de pacientes58.
Gran cantidad de los trabajos que documentan el hallazgo de parásitos en la República Argentina provienen de estudios realizados en muestras ambientales o humanas, que no necesariamente remiten a las mismas coordenadas espaciales y temporales. En general, se encontraron amebas tanto en el ambiente como en personas, a excepción de Iodamoeba bütschlii, la que se informó solo en personas. En el caso particular de Dientamoeba fragilis, se encontró en la misma provincia (Salta) en muestras de agua de río59 y en habitantes de una zona rural48, y coincidentemente con la teoría de que su trofozoíto es transportado por huevos de E. vermicularis, los dos grupos que comunicaron estos datos también informaron la presencia de estos huevos en sus muestras. Asimismo, los hallazgos en muestras de materia fecal de residentes en una zona rural de Salta comunicados por Menghi et al.48 muestran que la franja etaria en la que se encontró mayor prevalencia de D. fragilis coincidió con la que tuvo mayor prevalencia de E. vermicularis.
También se encontraron coccidios en materia fecal humana y en el ambiente, aunque Sarcocystis spp. solo fue informado en el ambiente, y en muchas provincias argentinas se hallaron flagelados intestinales, tanto en el ambiente como en humanos.
Balantidium coli solo se encontró en agua de río de la provincia de Salta. Cabe señalar que en la mayoría de las zonas templadas del mundo, la balantidiosis humana solo se encuentra como hallazgo incidental. Los cerdos son los hospedadores más comunes de este parásito, cuyos quistes son relativamente resistentes a medios desfavorables, pero sucumben pronto a la desecación y a la acción directa de los rayos solares. Lo mismo ocurrió con los microsporidios y, en este caso, se cree que podría deberse a la dificultad de detección de este género, por su pequeñísimo tamaño94.
Se han informado con mayor frecuencia hallazgos de Blastocystis spp. en materia fecal que en el ambiente. Esto puede deberse a que este parásito cosmopolita es anaerobio estricto y muy sensible al oxígeno atmosférico, lo que hace que vayan desapareciendo con el transcurso de las horas de heces no recogidas con líquido preservador. También los destruye el frío68,97. Otra razón sería la dificultad para identificar al parásito en etapas distintas de la forma vacuolar37, la forma quística es muy pequeña (ronda los 5μm) y puede confundirse fácilmente con detritus.
Se encontraron helmintos en el ambiente y en personas en varias provincias argentinas. En Chubut y Río Negro se encontró A. duodenale en efluentes domiciliarios utilizados como fertilizantes de cultivos; sin embargo, no se encontraron datos de este tipo de parasitosis intestinal en personas en estas provincias.
Gamboa et al.24 afirman que la distribución geográfica de los ancilostomídeos y S. stercoralis depende, en gran medida de las condiciones climáticas, el tipo de suelo y el comportamiento de las poblaciones susceptibles, y que su frecuencia disminuye a medida que se avanza hacia el sur del país, en tanto que la frecuencia de A. lumbricoides, T. trichiura e H. nana depende de factores socioambientales, como el hacinamiento, la alimentación, las condiciones de la vivienda, la higiene y el método de disposición de excretas empleado.
Las diferencias observadas en cuanto a la distribución de las especies de geohelmintos pueden deberse a las condiciones de humedad y temperatura ambiental, así como al tipo de sustrato en el cual se desarrollan y transmiten los huevos y las larvas. Las larvas de ancilostomídeos y S. stercoralis, por ejemplo, tienen una vida corta en el suelo, ya que generalmente no sobreviven más de un mes81. Está demostrado que la humedad y la temperatura elevadas, unidas al hábito de defecar a cielo abierto y andar descalzo, favorecen la transmisión y dispersión de ancilostomídeos y S. stercoralis.
En el ambiente se encontraron una variedad de géneros de cestodos, sin embargo, los únicos informados en humanos fueron D. latum e H. nana; este último es el cestode más prevalente transmitido por fecalismo.
En esta investigación bibliográfica se encontraron solo informes ambientales de Fasciola hepatica, aunque en uno de los estudios solo se lo buscó en el ambiente para estudiar el foco de un caso de fasciolosis humana ocurrido en Neuquén en 2002. Este es un parásito considerado de baja prevalencia en el hombre, pero tiene altas tasas de infección en humanos en un país limítrofe (Bolivia) y en cabras en una zona andina en nuestro país, como se expuso con anterioridad.
Aunque en la mayoría de los casos no se ha establecido correlación directa entre la contaminación ambiental y las parasitosis en personas, el ambiente actúa como receptor de la contaminación humana y animal, y se constituye, a su vez, en un reservorio de parásitos potencialmente riesgosos para la salud pública. Esto hace que la mayoría de los parásitos intestinales se transmitan por contaminación del ambiente, y en este aspecto, el agua y los alimentos juegan un papel importante. Si las heces no se eliminan de manera apropiada, los quistes, ooquistes y huevos de los parásitos pueden quedar en el ambiente de las casas o contaminar fuentes de agua o cultivos regados con aguas residuales.
Otro punto que se debe considerar son las catástrofes naturales, como las inundaciones; en tal sentido cabe recordar el lamentable hecho recientemente ocurrido en nuestro país en la ciudad de La Plata, Provincia de Buenos Aires. Las inundaciones contaminan el ambiente y los recursos hídricos debido a las corrientes de agua que transportan residuos, lo cual puede generar una grave diseminación de agentes microbiológicos patógenos.
ConclusionesEn Argentina los datos disponibles de los últimos años sobre parásitos intestinales encontrados en el ambiente y en personas son abundantes. Naturalmente, estos hallazgos se encuentran acotados por varios factores: la presencia o no en cada región de un grupo de investigación sobre el tema; la baja cantidad de parásitos en el ambiente, que se encuentra muchas veces por debajo del límite de sensibilidad de las técnicas, lo que requiere de etapas de concentración de las muestras para la correcta detección; y la dificultad del diagnóstico de algunas parasitosis, lo que lleva a la subestimación del número y el tipo de agentes encontrados, entre otros. La gran mayoría de las veces la detección se realiza mediante métodos parasitoscópicos, por lo que la correcta identificación del organismo depende en su totalidad del entrenamiento y la experiencia personal del analista.
En esta revisión se encontró coincidencia entre los géneros informados en muestras fecales con los encontrados en el ambiente, por lo que los parásitos que pueden causar patologías intestinales en humanos se aíslan frecuentemente de muestras ambientales. Sin embargo, no todas las especies potencialmente patógenas encontradas en el ambiente se informaron en humanos, una de las razones radica en el bajo porcentaje de infección a humanos en el caso de algunas de ellas. Los parásitos más informados en Argentina, tanto en la población como en el ambiente, fueron G. lamblia y A. lumbricoides, mientras que en personas también existen muchos informes que documentan la presencia de Blastocystis spp., S. stercoralis y T. trichiura.
Dependiendo de la especie involucrada en la infección, los parásitos intestinales pueden causar síntomas abruptos y graves, y en algunos casos, tener desenlace fatal, tal como sucede en la estrongiloidiosis en personas con desnutrición o inmunocompromiso. También pueden pasar inadvertidos por largos períodos, hasta que el cuerpo, en algún momento, desarrolle los síntomas digestivos típicos, lo que redundará en la disminución de la tasa de crecimiento físico y mental en los niños, debido a su cronicidad. Por lo tanto, es de suma importancia conocer la ubicación en el ambiente de los elementos infectivos, ya que ello permite saber el lugar, el momento y la forma de aplicación de medidas de prevención para combatir estas enfermedades de distribución mundial, con prevalencia en países en desarrollo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosLa presente revisión bibliográfica se enmarca en el Proyecto N.° 2070/4 financiado por el Consejo de Investigaciones de la Universidad Nacional de Salta.