Describimos el primer caso en Argentina de Staphylococcus aureus resistente a la meticilina adquirido en la comunidad con sensibilidad intermedia a la vancomicina y no sensibilidad a la daptomicina.
Caso clínico: Paciente masculino, con antecedente de insuficiencia renal crónica en hemodiálisis y osteosíntesis de cadera debido a una fractura. Se internó por síndrome febril persistente luego del desplazamiento de la prótesis por un traumatismo. Se aisló de hemocultivos S. aureus resistente a la meticilina adquirido en la comunidad. Durante el tratamiento con vancomicina y daptomicina, se observó un aumento gradual de la CIM de vancomicina de 1μg/ml (VSSA) a 2μg/ml (h-VISA) y a 4μg/ml (VISA), y la emergencia de no sensibilidad a daptomicina (CIM=4μg/ml). Al suspender la vancomicina y la daptomicina, la cepa revirtió al fenotipo de sensibilidad a ambas drogas. Es mandatorio evaluar por CIM la sensibilidad a vancomicina y a daptomicina intratratamiento cuando estas drogas se usan como terapia.
We report the first case in Argentina of community-acquired methicillin-resistant Staphylococcus aureus with intermediate susceptibility to vancomycin and nonsusceptibility to daptomycin.
Case report: A male patient with a history of chronic renal failure on hemodialysis and hip fracture osteosynthesis was admitted to hospital for persistent febrile syndrome following the displacement of the prosthesis by trauma. Blood cultures grew communityacquired methicillin-resistant Staphylococcus aureus. During treatment with vancomycin and daptomycin, a gradual increase in vancomycin MIC of 1 μg/ml (VSSA) to 2μg/ml (h-VISA) and 4μg/ml (VISA) was observed, as well as the emergence of non-susceptibility to daptomycin (MIC=4μg/ml). By suspending vancomycin and daptomycin, the strain reversed to the susceptible phenotype to both drugs. It is mandatory to evaluate by MIC the susceptibility to vancomycin and daptomycin during treatment when these drugs are used as therapy.
Staphylococcus aureus es una de las causas más frecuentes de infección nosocomial y de la comunidad. En los últimos 50 años, este microorganismo desarrolló diferentes mecanismos de resistencia a antibióticos. Primero se detectó la resistencia a la meticilina (SARM), primariamente en cepas hospitalarias y de modo más reciente en cepas de la comunidad (SARM-AC), y desde el año 1997 se han identificado cepas h-VISA y VISA1,2. Estas cepas, cuya denominación deriva del inglés [heterogeneous/homogeneous vancomycinintermediate Staphylococcus aureus (h-VISA/VISA, respectivamente)], emergen como consecuencia de una serie de mutaciones secuenciales en S. aureus sensible a vancomicina que conducen a alteraciones en el metabolismo de la pared celular bacteriana, a una actividad autolítica reducida y al engrosamiento de la pared1. Las cepas VISA se definen como aquellas que presentan una CIM de vancomicina de 4–8μg/ml3. Las cepas h-VISA presentan CIM de sensibilidad a vancomicina, en su mayoría de 2μg/ml, pero contienen subpoblaciones que pueden crecer en presencia de concentraciones de vancomicina ≥ 4μg/ml a una frecuencia de 10−5-10−6, por lo que no son detectadas por los métodos de rutina como el antibiograma por difusión, la CIM o los métodos automatizados2,4.
La vancomicina se ha utilizado desde sus inicios para el tratamiento de bacteriemia y otras infecciones graves producidas por S. aureus resistente a la meticilina, pero a partir de la aparición de cepas h-VISA/VISA comenzaron a observarse fallas de tratamiento2,5. Los fenotipos h-VISA y VISA pueden emerger tanto en S. aureus de origen hospitalario como de la comunidad2.
Se han descrito varios factores predisponentes para la emergencia de cepas h-VISA, VISA o no sensibles a daptomicina (DAP-NS): insuficiencia renal crónica, hemodiálisis, cirugía reciente, bacteriemia persistente por S. aureus resistente a meticilina, tratamiento prolongado con vancomicina en los meses previos, tratamiento combinado con vancomicina y rifampicina, infección de alto inóculo (bacteriemia, endocarditis, infección protésica), escasa disponibilidad de antibiótico en el sitio de la infección, demora en la remoción quirúrgica del foco y concentraciones de vancomicina en el valle inferiores a 15μg/ml1,2,6,7.
La daptomicina es un lipopéptido cíclico aprobado por la FDA para el tratamiento de infecciones complicadas de piel y partes blandas y bacteriemia por S. aureus. Atraviesa la pared celular bacteriana y forma un complejo catiónico con Ca++ que se une a la membrana citoplasmática, tras lo cual se produce una rápida despolarización de su potencial. Esta pérdida del potencial causa inhibición de la síntesis de proteínas, ADN y ARN, hecho que provoca la muerte de la bacteria6. Tiene una masa molecular comparable a la de la vancomicina, por lo tanto, la pared celular engrosada presente en las cepas h-VISA/VISA podría actuar como una barrera que le impide alcanzar su blanco de acción en la membrana citoplasmática. Se ha demostrado que la exposición previa a vancomicina podría favorecer la aparición de cepas de S. aureus DAP-NS6,8,9.
El objetivo del presente estudio es describir un caso clínico de falla de tratamiento de una bacteriemia con vancomicina y daptomicina, y documentar las características moleculares de la primera cepa de S. aureus resistente a la meticilina adquirida en la comunidad (SARM-AC) de Argentina, que evolucionó a h-VISA, VISA y DAP-NS intratratamiento con vancomicina y daptomicina, para revertir luego a fenotipo de sensibilidad a vancomicina y daptomicina al desaparecer la presión de ambos antibióticos.
Se presenta el caso de un paciente masculino de 22 años con antecedentes de insuficiencia renal crónica, en hemodiálisis trisemanal desde 2002 mediante fístula arteriovenosa (FAV) húmero-cefálica derecha. En mayo de 2009, debido a una fractura espontánea, se le realizó una osteosíntesis de cadera izquierda en otra institución. En julio de 2009 sufrió una caída de altura que le provocó un desplazamiento de la prótesis sobre el fémur. El cuadro infeccioso se inició con diarrea y vómitos; por tal motivo, el 20/7/2009 el paciente se internó nuevamente y se le tomaron muestras para hemocultivos y coprocultivo; con un alta transitoria a las 48h se retiró a su domicilio con la indicación de ciprofloxacina 500mg por vía oral dos veces por día. El coprocultivo fue negativo y de los hemocultivos se aisló S. aureus resistente a la meticilina con sensibilidad al resto de los antibióticos. Debido a que el paciente evolucionó febril, se inició vancomicina (1g intravenoso posdiálisis) en el centro de diálisis. Se le realizó un ecocardiograma transtorácico que no mostró vegetaciones. El paciente continuó febril, por lo que se decidió su derivación a nuestra institución el 7/8/2009. A su ingreso presentó soplo sistólico en foco mitral, diarrea de característica no inflamatoria, accesos vasculares sin signos de infección y herida quirúrgica de osteosíntesis sin signos de flogosis, y dolor a la movilización desde la luxación de la prótesis. Continuó tratamiento con vancomicina. Se le realizaron los siguientes estudios: radiografía de tórax, ecografía abdominal, ecodoppler de FAV y ecocardiograma transtorácico y transesofágico. Ningún estudio mostró alteraciones, por lo que se descartó la infección endovascular.
El 8/8/2009 se obtuvieron 2/2 hemocultivos positivos para S. aureus (SARM-AC 1) resistente a la meticilina, sensible al resto de los antibióticos y CIM de vancomicina ≤ 1μg/ml. Se agregó rifampicina 600mg/día vía oral. El paciente persistió febril, por lo que el 19/8/2009 se decidió el dosaje de vancocinemia y se tomaron nuevos hemocultivos. La vancocinemia fue 11,3mg/l y el hemocultivo fue positivo para S. aureus (SARM-AC 2) resistente a meticilina y a rifampicina, sensible al resto de los antibióticos y CIM de vancomicina 2μg/ml. Debido a la falta de mejoría del paciente, se suspendieron la vancomicina y la rifampicina y se inició tratamiento con daptomicina 6mg/kg/día. Tras haber descartado inicialmente el foco endovascular y en la búsqueda de un foco profundo que permitiera explicar la bacteriemia persistente, se realizó una tomografía axial computada de cadera, que presentó una imagen hipodensa delante de la prótesis, y un centellograma con ciprofloxacina marcada con Tc99m, que mostró hipercaptación en cadera izquierda. Debido a que el paciente continuó febril, el 1/9/2009 se realizaron nuevos hemocultivos. Estos fueron positivos para S. aureus (SARM-AC 3) resistente a meticilina y rifampicina, DAP-NS, fenotipo VISA (CIM de vancomicina 4μg/ml) y sensible al resto de los antibióticos. Se suspendió la daptomicina y se inició linezolid 600mg 2 veces por día intravenoso ajustado a diálisis. El 7/9/2009 se realizó una limpieza quirúrgica con retiro del material de osteosíntesis. Las muestras que se enviaron para cultivo (herida, partes blandas y hueso) fueron negativas. La anatomía patológica mostró tejido fibroso con escaso infiltrado inflamatorio linfoplasmocitario y algunos polimorfonucleares. El paciente presentó una evolución favorable con hemocultivos negativos y mejoría de sus parámetros de laboratorio. El 23/9/2009 se suspendió el linezolid y se rotó a vía oral con ciprofloxacina (500mg dos veces por día) y trimetoprima sulfametoxazol. Se le otorgó el alta hospitalaria y se continuó su seguimiento en forma ambulatoria, durante el que se constató su evolución. Tres meses después reingresó a la institución con fiebre. Se aisló de hemocultivo S. aureus (SARM-AC 4), resistente a la rifampicina, con sensibilidad intermedia a la ciprofloxacina, con CIM de vancomicina 1 μg/ml y de daptomicina ≤ 1μg/ml. Se realizó centellograma, que mostró hipercaptación en FAV, sin captación en cadera izquierda. Se inició tratamiento con linezolid (igual dosis) y trimetoprima sulfametoxazol (800/160mg/día IV), y se retiró la prótesis de la FAV. El cultivo de la FAV fue positivo para S. aureus con fenotipo similar a SARM-AC 4. El paciente fue dado de alta afebril, tras obtener hemocultivos negativos y corroborar su buena evolución posterior.
A lo largo de su seguimiento, se obtuvieron de este paciente 4 hemocultivos positivos para S. aureus: SARM-AC 1, SARM-AC 2, SARM-AC 3 y SARM-AC 4. Los aislamientos se estudiaron con el sistema automatizado Phoenix (Becton Dickinson, BD Argentina) para identificación bioquímica y sensibilidad. La identificación se confirmó por los métodos convencionales. Los aislamientos identificados como SARMAC 2, 3 y 4 fueron derivados al Laboratorio Nacional de Referencia (Servicio Antimicrobianos INEI-ANLIS «Dr. Carlos G. Malbrán») y estuvieron disponibles para los siguientes estudios: CIM de vancomicina por método de dilución en agar3 y sistema automatizado Vitek 2C (bioMèrieux, Marcie l’Étoile, Francia), CIM de daptomicina por Etest, detección de la leucocidina de Panton-Valentine (PVL) por PCR mediante cebadores específicos10, caracterización del SCCmec por PCR múltiple11, Smal-PFGE12 utilizando la cepa de S. aureus M2847 como representante del clon epidémico de S. aureus resistente a la meticilina adquirido en la comunidad predominante en Argentina (ST5-SCCmec tipo IV, PVL +), Etest por macrométodo13, Etest GRD VAN/TEI + S14 y MLST (http:// www.mlst.net/).
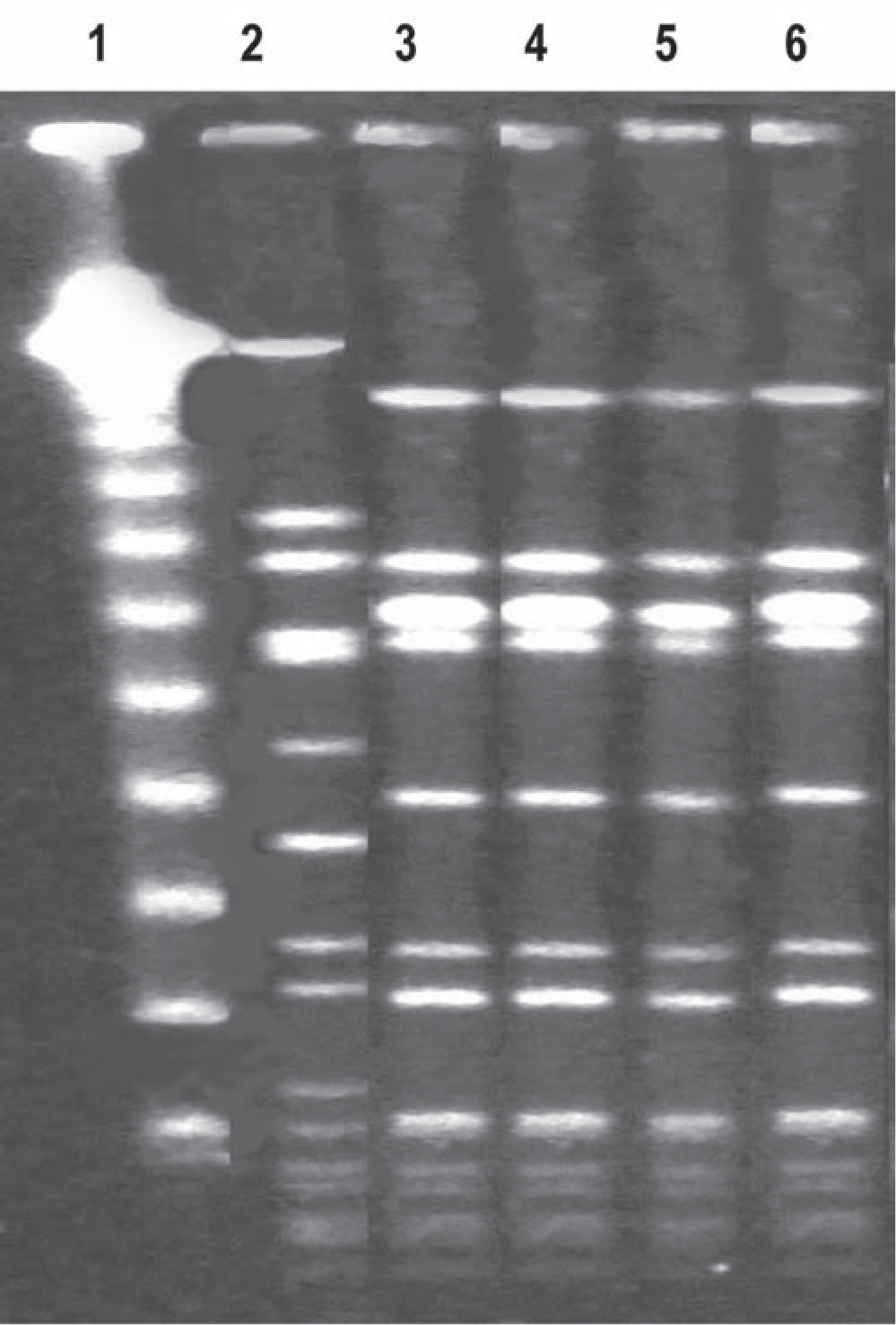
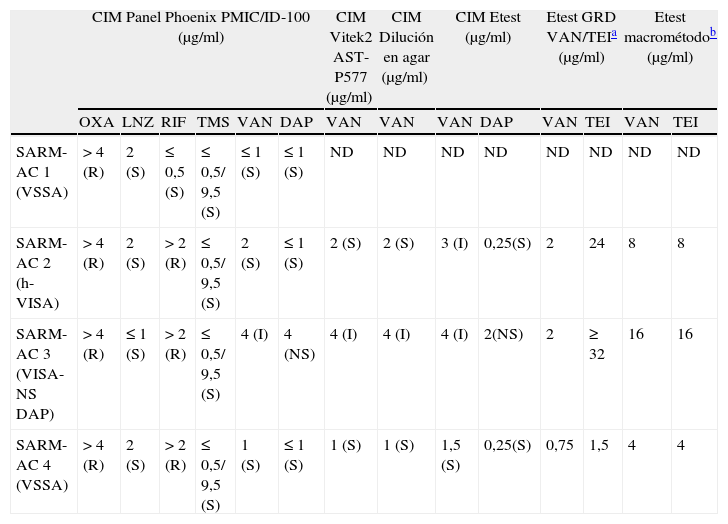
El perfil de sensibilidad de los aislamientos se puede observar en la tabla 1. Todos presentaron el fenotipo correspondiente a S. aureus resistente a la meticilina adquirido en la comunidad e idéntico perfil de restricción por Smal PFGE, hecho que confirma la identidad clonal entre ellos. De acuerdo a sus características genotípicas y MLST, se determinó que los tres aislamientos pertenecieron al clon epidémico de S. aureus resistente a la meticilina adquirido en la comunidad predominante en la Argentina: ST5-SCCmec tipo IV, PVL + y perfil de sensibilidad a múltiples antibióticos (fig. 115). Según los métodos de screening Etest por macrométodo y Etest GRD se determinó que SARM-AC 2 y SARM-AC 3 presentaron fenotipo h-VISA y VISA, respectivamente. Se confirmó que SARM-AC 3 fue VISA mediante CIM por dilución en agar (método de referencia). Se confirmó por Etest la no sensibilidad a daptomicina de SARM-AC 3 (tabla 1) detectada mediante el sistema automatizado Phoenix.
Perfil de sensibilidad de los aislamientos de Staphylococcus aureus resistente a la meticilina adquirido en la comunidad (SARM-AC) 1, 2, 3 y 4.
| CIM Panel Phoenix PMIC/ID-100 (μg/ml) | CIM Vitek2 AST-P577 (μg/ml) | CIM Dilución en agar (μg/ml) | CIM Etest (μg/ml) | Etest GRD VAN/TEIa (μg/ml) | Etest macrométodob (μg/ml) | |||||||||
| OXA | LNZ | RIF | TMS | VAN | DAP | VAN | VAN | VAN | DAP | VAN | TEI | VAN | TEI | |
| SARM-AC 1 (VSSA) | > 4 (R) | 2 (S) | ≤ 0,5 (S) | ≤ 0,5/ 9,5 (S) | ≤ 1 (S) | ≤ 1 (S) | ND | ND | ND | ND | ND | ND | ND | ND |
| SARM-AC 2 (h-VISA) | > 4 (R) | 2 (S) | > 2 (R) | ≤ 0,5/ 9,5 (S) | 2 (S) | ≤ 1 (S) | 2 (S) | 2 (S) | 3 (I) | 0,25(S) | 2 | 24 | 8 | 8 |
| SARM-AC 3 (VISA-NS DAP) | > 4 (R) | ≤ 1 (S) | > 2 (R) | ≤ 0,5/ 9,5 (S) | 4 (I) | 4 (NS) | 4 (I) | 4 (I) | 4 (I) | 2(NS) | 2 | ≥ 32 | 16 | 16 |
| SARM-AC 4 (VSSA) | > 4 (R) | 2 (S) | > 2 (R) | ≤ 0,5/ 9,5 (S) | 1 (S) | ≤ 1 (S) | 1 (S) | 1 (S) | 1,5 (S) | 0,25(S) | 0,75 | 1,5 | 4 | 4 |
S: sensible, I: intermedio, R: resistente, ND: no determinado, NS: no sensible; OXA: oxacilina, LNZ: linezolid, RIF: rifampicina, TMS: trimetoprima sulfametoxazol, VAN: vancomicina, DAP: daptomicina, TEI: teicoplanina. Valores de referencia:
Patrones de Smal PFGE de los aislamientos SARM-AC 2, 3 y 4. Línea 1: Marcador de peso molecular (Lambda PFG ladder New England Biolabs); línea 2: NCTC 8325 (cepa de referencia SARM); línea 3: SARM-AC 2 (h-VISA); línea 4: SARM-AC 3 (VISA-NS DAP); línea 5: SARM-AC 4 (VSSA); línea 6: M 2847 [SARM-AC Argentina: ST5 SCCmec IV PVL (+)].
Se observó muy buena correlación entre todos los métodos utilizados, tanto para establecer la CIM de la cepa VISA como para detectar la no sensibilidad a daptomicina (tabla 1).
El paciente del caso descrito presentaba varios factores de riesgo para seleccionar una cepa h-VISA, VISA y DAP-NS: enfermedad renal crónica en hemodiálisis, bacteriemia persistente por S. aureus resistente a la meticilina, tratamiento prolongado con vancomicina, tratamiento combinado con vancomicina y rifampicina, infección de alto inóculo con pobre llegada del antibiótico (infección protésica) y concentraciones bajas de vancomicina en el valle. Estos factores de riesgo podrían haber contribuido a no alcanzar el parámetro PK/PD establecido como de éxito terapéutico para vancomicina en infecciones graves por S. aureus de AUC/CIM ≥ 4008. En el mismo sentido, la baja concentración de vancomicina obtenida en el valle (11,3μg/ml) podría haber contribuido a la selección de las cepas h-VISA y VISA. Se ha establecido que, en S. aureus que presentan CIM de vancomicina ≥ 2μ/ml, las dosis de esta droga habitualmente utilizadas (15–20mg/kg/dosis cada 8-12h en pacientes con función renal normal) no serían suficientes para alcanzar el parámetro PK/PD de éxito clínico establecido8. Con respecto al tratamiento combinado de vancomicina con rifampicina, Watanabe et al.7 demostraron que la exposición de cepas h-VISA a rifampicina frecuentemente selecciona cepas VISA. Todos estos factores podrían explicar la falla en el tratamiento con vancomicina.
Con respecto a daptomicina, ya se comunicó la falla de tratamiento cuando es administrada en pacientes tratados con vancomicina9. La daptomicina y la vancomicina tienen diferentes mecanismos de acción, por lo tanto, no deberían presentar resistencia cruzada. Sin embargo, el engrosamiento de la pared celular que presentan las cepas h-VISA/ VISA actuaría como un obstáculo para la llegada de daptomicina a la membrana citoplasmática. El engrosamiento de la pared celular sumado a los factores de riesgo que presentaba el paciente podrían explicar la selección de SARM-AC 3 DAP-NS.
En suma, presentamos el primer caso en Argentina de S. aureus resistente a la meticilina adquirido en la comunidad, con sensibilidad intermedia a la vancomicina y no sensibilidad a la daptomicina. Consideramos que la resistencia pudo haber sido seleccionada a partir de tratamientos previos con vancomicina y rifampicina, y que revirtió al desaparecer la presión antibiótica. Concluimos que el uso combinado de vancomicina y rifampicina para el tratamiento de SARM debería ser reevaluado en vista del riesgo de que segenere resistencia a la vancomicina7. Asimismo, se debería prestar especial atención a los incrementos en los valores de CIM de vancomicina y monitorear la CIM de daptomicina en cepas aisladas de pacientes en los que se prescribirá esta droga como terapia de rescate, debido a la probabilidad de selección de cepas no sensibles.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.





![Patrones de Smal PFGE de los aislamientos SARM-AC 2, 3 y 4. Línea 1: Marcador de peso molecular (Lambda PFG ladder New England Biolabs); línea 2: NCTC 8325 (cepa de referencia SARM); línea 3: SARM-AC 2 (h-VISA); línea 4: SARM-AC 3 (VISA-NS DAP); línea 5: SARM-AC 4 (VSSA); línea 6: M 2847 [SARM-AC Argentina: ST5 SCCmec IV PVL (+)]. Patrones de Smal PFGE de los aislamientos SARM-AC 2, 3 y 4. Línea 1: Marcador de peso molecular (Lambda PFG ladder New England Biolabs); línea 2: NCTC 8325 (cepa de referencia SARM); línea 3: SARM-AC 2 (h-VISA); línea 4: SARM-AC 3 (VISA-NS DAP); línea 5: SARM-AC 4 (VSSA); línea 6: M 2847 [SARM-AC Argentina: ST5 SCCmec IV PVL (+)].](https://static.elsevier.es/multimedia/03257541/0000004500000002/v2_201308300022/S0325754113700075/v2_201308300022/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
