Las infecciones por amebas de vida libre causan compromiso cutáneo y neurológico. Estas afecciones presentan una baja frecuencia pero una alta letalidad, mayor al 98%. Generalmente el cuadro clínico es inespecífico y los exámenes de laboratorio no son de gran ayuda, por lo que representa un reto diagnóstico y terapéutico. En este informe presentamos el caso de un paciente de 21años que fue hospitalizado por un síndrome convulsivo con tumoraciones cerebrales, además de una lesión cutánea en el muslo derecho. El análisis histopatológico, PCR y el cuadro clínico permitieron el diagnóstico de encefalitis amebiana granulomatosa. A pesar del tratamiento, el paciente tuvo un desenlace fatal.
Infections by free-living amoebas cause cutaneous and neurological compromise. These conditions have a low frequency, but a high lethality more than 98%. Generally, the clinical picture is nonspecific; the laboratory tests dońt help, so it represents a diagnostic and therapeutic challenge. In this report, we present the case of a 21-year-old patient, who was hospitalized for a convulsive syndrome with brain tumors, in addition to a cutaneous lesion on the right thigh. Histopathological analysis, PCR and the clinical picture allowed the diagnosis of granulomatous amebic encephalitis. Despite the treatment, the patient had a fatal outcome.
Las amebas de vida libre son microorganismos que habitan el agua y el suelo. Algunas especies han mostrado capacidad patogénica para invadir a humanos y animales6. Existen cuatro especies que pueden causar enfermedad en humanos: Balamuthia mandrillaris, Acanthamoeba genotipo4 principalmente, y otras dos de menor frecuencia, Naegleria fowleri y finalmente Sappinia pedata1-3.
B.mandrillaris se aisló en la primavera de 1986 del cerebro de una mandril preñada de 3años y 10meses de edad (Papio sphinx) que murió de una enfermedad neurológica en el zoológico de San Diego, California. B.mandrillaris se describió inicialmente como una ameba Leptomyxid sp. Sin embargo, hoy en día B.mandrillaris lleva el nombre en honor del difunto profesor William Balamuth (1914-1981) de la Universidad de California en Berkeley, un eminente protozoólogo conocido por sus contribuciones a los estudios en protistas y amebas de vida libre.
La infección por B.mandrillaris muestra dos presentaciones clínicas principalmente: lesiones cutáneas y/o lesiones cerebrales. En la mayoría de casos la lesión cutánea precede a la lesión cerebral. Esto sucede en Sudamérica con una mayor frecuencia en comparación a otras partes del mundo.
En Estados Unidos el número de pacientes infectados por B.mandrillaris llega a 109 casos5. En Sudamérica se reportan muy pocos casos, siendo Perú el que posee la mayor casuística en los últimos 40años, con más de 55casos1. Recientemente en Japón se ha aislado B.mandrillaris del suelo del norte de las islas15. Japón no es considerado un país cálido por su ubicación en el hemisferio norte. Sin embargo, se han informado en ese país 18casos de infección por B.mandrillaris8.
No se dispone de ningún argumento convincente para explicar la alta frecuencia de casos por B.mandrillaris con lesiones cutáneas en Perú. Sin embargo, se han planteado hipótesis como la predisposición genética propuesta por Schuster et al.13 y la de Cabello-Vílchez et al.3,4, quienes proponen que la exposición a luz ultravioleta podría ser un factor predisponente a las lesiones cutáneas.
El presente caso clínico es el primer informe de B.mandrillaris en la provincia de Camaná, Departamento de Arequipa, Perú. El paciente presentó un cuadro de encefalitis amebiana granulomatosa de curso agudo con lesión cutánea previa y desenlace fatal.
El estudio fue avalado por el Comité de Ética del Hospital Nacional Carlos Alberto Seguín Escobedo-Essalud.
Paciente varón de 21 años, natural de Camaná, provincia de Arequipa, con ocupación técnico en mantenimiento de maquinaria pesada (desde hace 3años). El año 2015 tuvo un trauma contuso-cortante en muslo derecho por caída de motor, que dejó como secuela una cicatriz hipertrófica. Como antecedente epidemiológico, el paciente estuvo expuesto a fuentes de aguas naturales como las acequias de la provincia de Camaná-Arequipa desde su niñez y torrenteras del área urbana (Mercado Palomar) de la ciudad de Arequipa. El paciente frecuentaba las acequias y riachuelos para bañarse, antes y después de presentar la lesión cutánea, producto del corte con la máquina. No se dispone del lugar preciso de aquella(s) acequia(s) a la(s) que concurría, pero es probable que haya sido muy cerca del Mercado Palomar-Camaná.
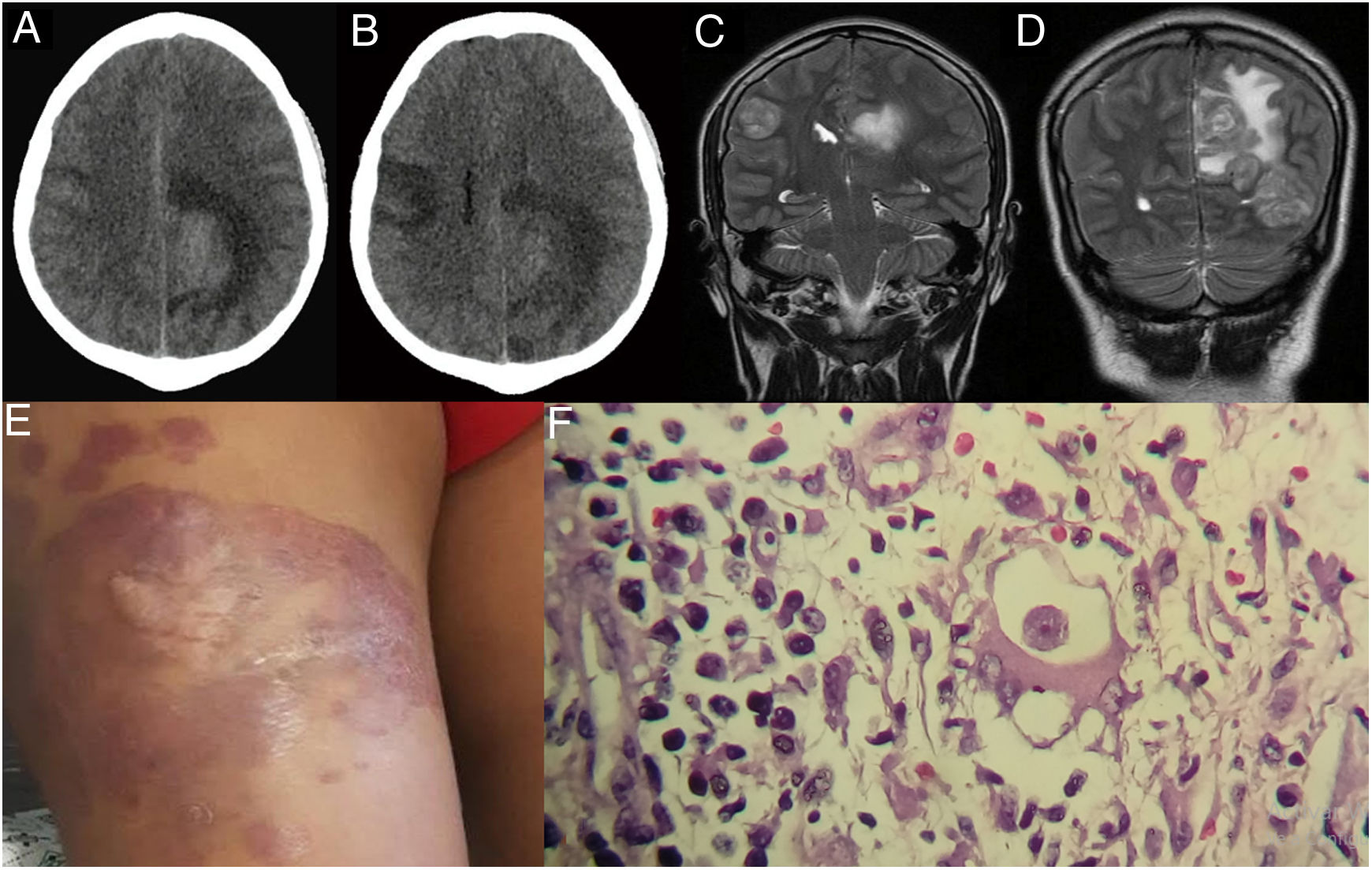
Tres meses antes de su hospitalización presentó sobre la cicatriz del muslo derecho una lesión indurada eritematosa y dolorosa de crecimiento progresivo; la primera vez que el paciente acudió al hospital (28/08/2017) presentaba una convulsión tónico-clónica y se le realizó un estudio tomográfico cerebral, el cual mostró una imagen hipodensa que captaba contraste con edema periférico en la región parietal izquierda, probable glioma de bajo grado (fig. 1A,B). Se recomendó tratamiento con manitol, fenitoína, dexametasona y fue dado de alta para estudio por consultorio externo (03/09/17), y no regresó a consulta externa. El día 18 de septiembre de 2017 ingresa a emergencia con náuseas y cefalea y pide su alta voluntaria, sin ningún estudio adicional. El día de su hospitalización (21/09/17) en la unidad de cuidados intensivos (UCI), al examen físico se le encontró un Glasgow 14/15, con un control tomográfico que mostraba mayor compromiso (fig. 1C,D). A pesar de la sintomatología, el paciente solicita su alta voluntaria (23/09/17).
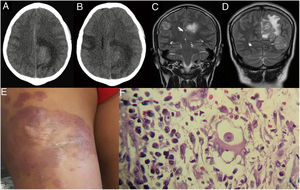
A)Tomografía cerebral con contraste. B)24 días antes de su hospitalización (control a los 21días). C y D)Resonancia magnética cerebral, tres lesiones expansivas intracraneales en ambos hemisferios. E)Se observa una placa eritematoviolácea en el muslo derecho del paciente. F)Biopsia de lesión cutánea: trofozoíto de Balamuthia mandrillaris (100×).
Reingresó por emergencia (30/09/17) porque presentó cefalea, vómitos y disminución de la fuerza muscular. Se le realizó una resonancia magnética cerebral (RMC), encontrándose tres lesiones expansivas intracraneales en ambos hemisferios, llegando a los diagnósticos presuntivos de múltiples procesos expansivos intracraneales sospechosos de metástasis versus tuberculosis cerebral. En los siguientes seis días presentó un aumento de cefalea, con tendencia al sueño, y asimetría facial. A la evaluación del paciente lo encontramos con compromiso del estado neurológico, somnoliento y funciones vitales conservadas; al examen preferencial de piel se encontró en cara anterior lateral externa del tercio medio del muslo una placa eritematoviolácea, de 18×12cm, con bordes poco definidos, consistencia semidura, infiltrada (fig. 1E). Se le realizó una ecografía de partes blandas, la cual reveló lesiones dérmicas, la mayor con un espesor de 39mm y un tamaño de 22×41mm que contacta con plano muscular, y otra de menor tamaño, con un espesor aproximadamente de 5mm limitados al tejido celular subcutáneo. Por otro lado, el estudio de líquido cefalorraquídeo (LCR) no mostró alteraciones significativas.
Se tomó una biopsia de la lesión cutánea (27/09/17), donde se evidenció por estudios histopatológicos un infiltrado inflamatorio nodular difuso de la dermis superficial y profunda, con predominio de células mononucleares que formaban áreas nodulares. Además, se observaron células gigantes multinucleadas, células plasmáticas y una estructura unicelular, morfológicamente compatible con trofozoíto de amebas de vida libre (fig. 1F). Una porción de la biopsia fue enviada al laboratorio LPEP del Instituto de Medicina Tropical (IMT) Alexander von Humboldt en Lima para ser analizada por biología molecular, realizándose PCR, secuenciación y filogenia, donde se obtuvo un producto de amplificación de 1.075pb. Los cebadores empleados fueron: 5’ Balspec 16s (5-CGCATGTATGAAGAAGACCA-3) y 3’ Balspec 16s (5-TTACCTATATAATTGTCGATACCA-3). Con el producto de la PCR se realizó la búsqueda de secuencias homólogas depositadas en Genbank mediante la herramienta Basic Local Alignment Search Tool (BLAST) (https://blast.ncbi.nlm.nih.gov/Blast.cgi). El análisis de alineación fue con CLUSTALW y el árbol filogenético se construyó con el programa Molecular Evolution Genetic Analysis software (MEGA7) (http://megasofware.net), empleado el método neighbor-joining con el modelo de 3 parámetros de Tamura y con 1.000 bootstraps de replicaciones (fig. 2).
Árbol filogenético. *Amplificación y secuenciación de la cepa Balamuthia mandrillaris (Nel-2017/AMCV-19). El algoritmo utilizado para construir el árbol filogenético fue el neighbor-joining con el modelo Tamura 3-parámetros y los valores de bootstraps (1.000 réplicas). El producto de la PCR de ADN mitocondrial del gen 16S rRNA (mitochondrial 16S rRNA gene DNA) es de 1.075pb. GenBank: MN176994 (la barra horizontal=0,10 sustituciones por posición de nucleótidos).
Se le inició tratamiento múltiple con anfotericinaB 50mg cada 24h, fluconazol 400mg cada 24h, albendazol 600mg cada 12h, doxiciclina 100g cada 12h, rifampicina 600mg cada 24h, etambutol 1.200mg cada 24h y meropenem 1g cada 24h, con mala respuesta al tratamiento en general; 17días después del segundo ingreso se agrega a la terapia miltefosina 50mg cada 8h; a pesar de ello, el compromiso neurológico del paciente se exacerbó, entrando en coma profundo y muerte cerebral el 10/10/17. La familia se negó a la necropsia.
El presente caso clínico es de un residente del distrito y provincia de Camaná del departamento de Arequipa (16°37′24″S 72°42′33″O), al sur del departamento de Lima. Esta se ubica a 3h de la ciudad de Arequipa, aproximadamente a 180km de distancia, y se encuentra a 15msnm. Su temperatura ambiental va de 17°C en agosto a 23°C en febrero. Las características climatológicas y geográficas no difieren significativamente de otras zonas costeras de Perú.
Algunas especies de amebas de vida libre son causantes de enfermedades en humanos. Las especies causantes de patologías en humanos son de distribución mundial, sin embargo, poseen baja frecuencia de infección, aunque se informa una letalidad del 98%.
Se han descrito más de 200 casos clínicos por B.mandrillaris a nivel mundial. Recientemente el CDC ha informado la serie completa, con 109 casos descritos desde 1974 a 20165. En Sudamérica también se describen casos por B.mandrillaris3. El 75,6% de los casos a nivel mundial se encuentran ubicados en el continente americano3,4. Más de 55 casos se han registrado en la costa de Perú.
La infección se presenta en pacientes inmunocompetentes e inmunocomprometidos. La puerta de ingreso de esta ameba aún no está muy clara, sin embargo, se sabe que puede ingresar por vía cutánea y por la cavidad nasal, diseminándose por vía hematógena11. Se desconoce el tiempo de incubación, pero es posible suponer que es suficientemente largo, entre un mes y dos años, ya que la tasa de duplicación celular de B.mandrillaris es de 34 a 52h en medio de cultivo axénico12.
En Perú, la ubicación anatómica más frecuente de las lesiones cutáneas es la centrofacial y en segundo lugar la rodilla, aunque se han informado esporádicamente otras partes del cuerpo. La enfermedad es más frecuente en el sexo masculino en una proporción de 2,5:114. Este caso, así como los anteriores, se presenta solo en la costa peruana4. El presente caso constituye el primer informe clínico de B.mandrillaris de la provincia de Arequipa (al sur del departamento de Lima), evidenciado por un cuadro clínico-patológico y biología molecular. Posiblemente existan más casos en el sur del país, como Moquegua y Tacna.
Cabello-Vílchez et al.2 han aislado B.mandrillaris del suelo de la costa de Piura y Lima. Es necesario el análisis molecular para establecer la etiología de esta enfermedad. Con respecto a nuestro caso, se construyó un árbol filogenético utilizando el programa MEGA 7.0 (fig. 2). Los resultados fueron inferidos por el método neighbor-joining, el cual permitió establecer que existe muy poca variación genética entre las cepas de B.mandrillaris del Perú y el resto del mundo. La secuencia de la cepa Nel-2017/AMCV-19 informada aquí permite ampliar el conocimiento de la diversidad genética de B.mandrillaris. El presente trabajo describe el primer caso clínico en Arequipa, Perú, y se depositó la secuencia del ADN mitocondrial del gen 16S rRNA (mitochondrial 16S rRNA gene DNA) en el banco de genes, identificado este con el número de acceso GenBank MN176994.
En nuestro caso clínico, pasaron 3meses desde el inicio de la lesión cutánea hasta el compromiso neurológico. Las manifestaciones clínicas con compromiso neurológico producidas por las amebas de vida libre suelen ser inespecíficas, como cambios de personalidad y comportamiento, hemiparesia, afasia, fiebre, convulsiones, fotofobia, pérdida de la visión, rigidez nucal y aumento de la presión intracraneana (cefalea, náuseas, vómitos, disminución de la conciencia). Esta presentación clínica es frecuentemente confundida con encefalitis viral, bacteriana o tumor cerebral10.
Las lesiones cutáneas poseen algunas características importantes que deben tenerse en cuenta; por ejemplo, comienzan con un nódulo o placas, algunas veces solas y en otras ocasiones con lesiones satélite; los bordes a veces parecen anulares, con diámetro muy variable, ligeramente rojos a violáceos, de superficie lisa o rugosa11.
Nuestro paciente inició su cuadro con un síndrome convulsivo. Su primer diagnóstico presuntivo fue glioma de bajo grado y posteriormente metástasis cerebral múltiple.
El estudio histopatológico de las lesiones cutáneas y/o cerebrales permitió detectar trofozoítos y quistes, pero no diferenciar entre Acanthamoeba o B.mandrillaris. Además, es difícil distinguirlos de los macrófagos en algunos casos, y en el estudio de piel se observan granulomas rodeados de infiltrados ricos en linfocitos y células plasmáticas, con células gigantes multinucleadas dentro o fuera de los granulomas. Por ello es fundamental el análisis molecular para establecer el agente causal. Las muestras más representativas para el análisis molecular podrían ser el LCR, el suero y la biopsia cerebral o cutánea. A partir de la identificación molecular podremos establecer esquemas de tratamiento oportuno y efectivo para los pacientes.
Desafortunadamente no existe una prueba de laboratorio clínico que permita establecer infecciones por amebas de vida libre, excepto el análisis directo del LCR (cuando hay la sospecha clínica), en el cual se encuentra pleocitosis linfocítica, proteínas aumentadas y glucosa de normal a baja, y en algunos casos es posible observar Naegleria fowleri y Acanthamoeba sp., pero muy rara vez B.mandrillaris. Además de los estudios histopatológicos, en la tomografía y la resonancia magnética se pudieron observar las lesiones cerebrales, muchas veces compatibles con lesiones granulomatosas14.
No existe un tratamiento efectivo para los casos por B.mandrillaris. Sin embargo, se han empleado algunos esquemas terapéuticos con resultados satisfactorios: pentamidina (i.v., 4mg/kg/día); sulfadiazina (oral, 200mg/kg/día); flucitosina (oral; 150mg/kg/día repartidos en 4 tomas cada 6h); fluconazol (oral o i.v., 12mg hasta 400mg/kg/día), azitromicina (oral, 20mg/kg/día), claritromicina (oral, 14mg/kg/día); miltefosina (oral; 150mg por día durante 12días, seguidos de 100mg por día durante 7meses; en casos pediátricos la dosis de miltefosina será de 2,5 a 100mg/kg/día. En Estados Unidos han empleado pentamidina, 5-flucitosina, fluconazol y un macrólido (claritromicina o azitromicina) además de cualquiera de los siguientes: sulfadiazina, miltefosina, tioridazina o anfotericinaB liposomal7,9.
En Perú, siete pacientes de doce con y sin compromiso neurológico han sobrevivido a esquemas de tratamiento combinado con fluconazol o itraconazol más albendazol y miltefosina. Cuatro pacientes tuvieron lesiones cerebrales en el momento de la presentación clínica, pero solo tres con lesión cutánea (Dalila Y. Martínez, comunicación personal, 2019).
La presencia de lesiones cutáneas centrofaciales o extrafaciales que no tienen una clara etiología, casos que desarrollan sinusitis, úlceras necrosantes que no han sido tratadas y que no curan por meses, deben ser estudiados con mayor cuidado e incluir en sus diagnósticos el descarte de amebas de vida libre. Posterior a la lesión cutánea aparecerán las lesiones neurológicas, las cuales son un signo de mal pronóstico.
Es urgente establecer esquemas terapéuticos eficaces frente a esta entidad clínica que es de difícil diagnóstico y alta letalidad.
FinanciaciónLa presente investigación no ha recibido ninguna beca específica de agencias de los sectores público, comercial o sin ánimo de lucro.
Conflicto de interesesLos autores declaran que no existen conflictos de intereses.
Los autores expresan su agradecimiento a Blga. M. Isabel Ruíz Ruíz por el apoyo en la obtención de la secuencia consenso de la cepa de Balamutia mandrillaris.
El autor AMCV: deseo expresar mi agradecimiento a mi familia, mi hija Belén y mi esposa Veronnika por su paciencia y comprensión.Esta investigación clínica está dedicada a la memoria de nuestro amigo, compañero y coautor: Dr. Ferdinand de Amat.