La introducción de la vacuna contra Haemophilus influenzae tipo b en los programas de inmunización de muchos países produjo una reducción marcada en la incidencia de en-fermedad invasiva causada por este serotipo y en su portación y un incremento de otros tipos capsulares y de aislamientos no capsulados. Se estudiaron 313 aislamientos de H. influenzae recuperados de sitio estéril, provenientes de pacientes pediátricos y adul-tos con enfermedad invasiva atendidos en 90 hospitales de la Red Nacional de Laborato-rios para Meningitis e Infecciones Respiratorias Agudas Bacterianas durante el período 2005–2010. Las patologías más frecuentes fueron neumonía, 40,3 % (n=126), meningitis, 30,0 % (n=94) y bacteriemia, 26,5 % (n=83). En los pacientes pediátricos (n=279), la mayor frecuencia de aislamientos correspondió a menores de 2 años, 74,5 % (n=208). Con respecto a la distribución de tipos, el 61,3 %, correspondió a H. influenzae no capsu-lados (n=192); el 20,1 % al b (n=63); 11,2 % al a (n=35); 4,8 % al f y 2,6 % a otros. En meningitis predominaron H. influenzae capsulados mientras que en neumonía y bacterie-mia resultaron dominantes los tipos no capsulados. Se determinó el biotipo en 306 aislamientos. Todos los aislamientos de tipo a correspondieron al biotipo II; el 66,7 % de los tipo b pertenecieron al biotipo I. Mediante las técnicas de aglutinación en lámina y PCR se estudiaron 220 aislamientos; la concordancia entre ambas fue de 0,982 (IC: 0,92–1,00). En el último año se encontró un aumento significativo del tipo b, lo cual indi-ca la importancia de mantener la vigilancia clínica y laboratorial de la enfermedad inva-siva por H. influenzae.
The introduction of the Haemophilus influenzae type b vaccine in the immunization programs of many countries has greatly reduced this invasive disease and the carriage caused by this serotype, also increasing other capsular types and non-capsular isolations. There were 313 isolations of H. influenzae under study, which were recovered from a sterile site coming from pediatric and adult patients carrying the invasive disease. Patients were treated at 90 different hospitals belonging to the Red Nacional de Laboratorios para Meningitis e Infecciones Respiratorias Agudas Bacterianas (National Lab Network for Meningitis and Acute Bacterial Respiratory Infections) from 2005 to 2010 for the following disorders: pneumonia, 40.3% (n=126), meningitis, 30.0% (n=94) and bacteremia, 26.5% (n=83). In pediatric patients (n=279), the highest frequency of isolations corresponded to children under the age of 2 years, 74.5% (n=208). Regarding type distribution, 61.3% corresponded to non-capsular H. influenzae (n=192), 20.1% to type b (n=63), 11.2% to type a (n=35), 4.8% to type f, and 2.6% to other types. Capsular H. influenzae was predominant in meningitis whereas non-capsular H. influenzae in pneumonia and bacteremia. The biotype was determined in 306 isolations. The totality (100%) of type a (n=35) was biotype II whereas 66.7% of type b (n=63) was biotype I. Slide agglutination and PCR tests were used in 220 isolations. There was a match of 0.982 (IC: 0.92-1.00) between them. During the last year, there was a great increase in type b, showing the importance of clinical and laboratory-based surveillance of the invasive disease caused by H. influenzae.
Haemophilus influenzae coloniza normalmente la nasofaringe humana y puede causar enfermedades sistémicas, entre ellas neumonía, meningitis, bacteriemia, celulitis, osteoartritis y sepsis, y enfermedades localizadas, como otitis, sinusitis o conjuntivitis. Fue identificado como patógeno por Robert Koch en 1883. Los aislamientos de H. influenzae capsulados (HiC) expresan uno de los seis polisacáridos capsulares antigénicamente distintos (a, b, c, d, e, f) que se pueden identificar con antisueros específicos. También existen cepas no capsuladas (HiNC), fenotípicamente no tipificables. Se han informado aislamientos que, a pesar de presentar el gen capsular cap específico de tipo b, no expresan el polisacárido correspondiente, a estos se los denomina H. influenzae b-(Hib-)16. Espontáneamente ocurren mutantes que han sufrido la pérdida del gen bexA, necesario para la exportación del polisacárido capsular. Estos aislamientos no se detectan mediante el diagnóstico serológico y solo pueden ser identificados por la técnica de reacción en cadena de la polimerasa (PCR)9.
H. influenzae tipo b (Hib) fue el más importante desde el punto de vista epidemiológico como causa de una alta morbimortalidad en menores de 5 años antes de la introducción de la vacuna conjugada3,27. La portación nasofaríngea oscilaba entre 10 y 35 % en niños en la comunidad y alcanzaba un 45% en jardines maternales e instituciones de menores21,22.
HiNC es reconocido como causa importante de sinusitis, otitis media aguda y bronquitis. Además, es una de las causas más frecuentes de exacerbaciones en pacientes que sufren enfermedad pulmonar obstructiva crónica23. También puede causar enfermedad invasiva como bacteriemia, neumonía, meningitis y sepsis neonatal19.
La introducción de la vacuna contra Hib en los programas de inmunización de muchos países produjo una reducción marcada en la incidencia de enfermedad invasiva causada por este serotipo y en su portación2,20, y un incremento de otros tipos capsulares (principalmente del a y del f) y de aislamientos no capsulados en esas patologías1,24.
Se ha comunicado la reemergencia de enfermedad invasiva por Hib en algunos países como Reino Unido y España en niños con esquema de vacunación completo para la edad, la que ha sido asociada a menor respuesta inmune por combinación del componente Hib con el componente acelular de Bordetella pertussis y con una inadecuada respuesta inmune en pacientes con patologías de base. Esto motivó en el Reino Unido la incorporación de una dosis de refuerzo7,13.
Estudios llevados a cabo en algunos países de Latinoamérica con distintos esquemas de vacunación sugirieron que una alta cobertura vacunal sostenida en el tiempo mantiene una baja incidencia de meningitis y baja prevalencia de portación de Hib11. En Argentina, el 80 % de los casos de enfermedad invasiva por Hib en la era prevacunal ocurría en niños menores de un año de vida; la tasa de incidencia global en menores de 5 años era de 30–120/100 000. La tasa de incidencia en menores de un año en la provincia de Buenos Aires era 25/100 00012. En 1994 la tasa de incidencia de meningitis por Hib en Argentina era de 1,1/100 000; con la introducción de la vacuna al Calendario Nacional de Vacunación en 1998 la incidencia se redujo a 0,06/100 000 en el año 2005, según datos del Sistema Nacional de Vigilancia de la Salud (SNVS), Dirección de Epidemiología del Ministerio de Salud de la Nación, 2006.
Los objetivos de este estudio fueron determinar la frecuencia de serotipos de H. influenzae en infecciones invasivas en distintos grupos etarios en la era de la vacuna conjugada contra Hib y evaluar la concordancia entre los resultados obtenidos con las técnicas de aglutinación en lámina y de PCR.
Materiales y métodosSe estudiaron 313 aislamientos de H. influenzae provenientes de pacientes pediátricos y adultos (rango de edad: desde 1día hasta 93 años; mediana: 10 meses) con enfermedad invasiva, atendidos entre el 1 de enero de 2005 y el 31 de diciembre de 2010 en los 90 hospitales que conforman la Red Nacional de Laboratorios para Meningitis e Infecciones Respiratorias Agudas Bacterianas. Se definió como enfermedad invasiva a aquella infección vinculada con el aislamiento de H. influenzae de sitios normalmente estériles (sangre, líquido cefalorraquídeo, líquido pleural, líquido articular y otros materiales de punción).
Los aislamientos se enviaron al Laboratorio Nacional de Referencia, donde fueron subcultivados en agar infusión cerebro corazón con 10% de sangre de caballo suplementado con medio de enriquecimiento Isovitalex (BBL™) al 1 % e incubados en atmósfera de 5% de CO2 a 37°C durante 18–24horas. Fueron confirmados como H. influenzae a través de la coloración de Gram, el reconocimiento de la morfología típica de las colonias y el requerimiento de factores V y X. La determinación de biotipos se realizó por evaluación de las actividades de ureasa y ornitina descarboxilasa y de la producción de indol.
Se realizó la serotipificación de 220 aislamientos por el test de aglutinación en lámina con antisueros tipo específi-cos a-f (Laboratorios DIFCO, Detroit, Michigan, EE.UU.). En todos los aislamientos se investigó mediante la técnica de PCR9 la presencia del gen OmpP2, que codifica una proteína de membrana externa exclusiva de H. influenzae10; del gen bexA, necesario para la expresión de la cápsula25; y de los genes cap, específicos de los tipos capsulares a-f9. Un aislamiento fue considerado «capsulado» cuando se obtuvo amplificación del gen bexA y de uno de los genes cap; «mutante deficiente en la cápsula» cuando se amplificó el gen cap específico, pero no se obtuvo amplificación del gen bexA, y «no capsulado» cuando ninguno de los dos genes se amplificaron. La técnica de PCR se consideró el método de referencia para la determinación del tipo capsular.
Análisis estadísticoToda vez que se evaluó la relación entre variables codificadas se utilizó el estadístico χ2 con los grados correspondientes a cada caso. Cuando se compararon proporciones se utilizó la prueba de homogeneidad. Para la comparación entre los tiempos de aparición de Hib y HiNC se utilizó el estadístico de Wilcoxon. Para evaluar la concordancia entre las técnicas de aglutinación en lámina y de PCR se utilizó el índice de Kappa. En todos los casos se consideró significativo un p<0,05.
Los datos crudos fueron importados en el entorno de programación estadística R versión 2.15.1. (http://www.Rproject. org/).
ResultadosEl 55,3 % (n=173) de los aislamientos correspondió a pacientes del sexo masculino y el 44,1% (n=138) del femenino (en dos casos no se contó con este dato).
Las patologías más frecuentes fueron neumonía, 40,3% (n=126), meningitis aguda primaria, 30,0% (n=94) y bacteriemia, 26,5% (n=83). El 3,2 % restante (n=10), agrupado como «otros», estuvo representado por artritis (n=3), peritonitis (n=1), absceso de pulmón (n=2), mediastinitis (n=1), meningitis relacionada con infección de catéter peritoneal (n=1), sepsis neonatal (n=1) y artritis séptica con meningitis (n=1).
El 62,6% de los aislamientos provinieron de sangre (n=196), el 16% de LCR (n=50), el 13,1 % de LCR y sangre (n=41), el 5,1 % de líquido pleural (n=16) y el 1 % (n=3) de líquido pleural y sangre. El 2,2 % restante (n=7) se distribuyó en 3 aislamientos de líquido articular, 2 de absceso de pulmón, 1 de líquido peritoneal y 1 de secreción de mediastino.
En los pacientes pediátricos (menores de 14 años; n=279), la mayor frecuencia de aislamientos correspondió a los menores de 2 años, 74,5 % (n=208), y dentro de estos, el 82,2 % (n=171) a los menores de 1 año. El grupo de 24 a 59 meses comprendió el 16,1 % (n=45) y el grupo de 5 a 14 años, el 9,3 % (n=26). El 10% de todos los aislamientos correspondió a pacientes mayores de 14 años (n=31). En el 1 % (n=3) no se contó con el dato de edad.
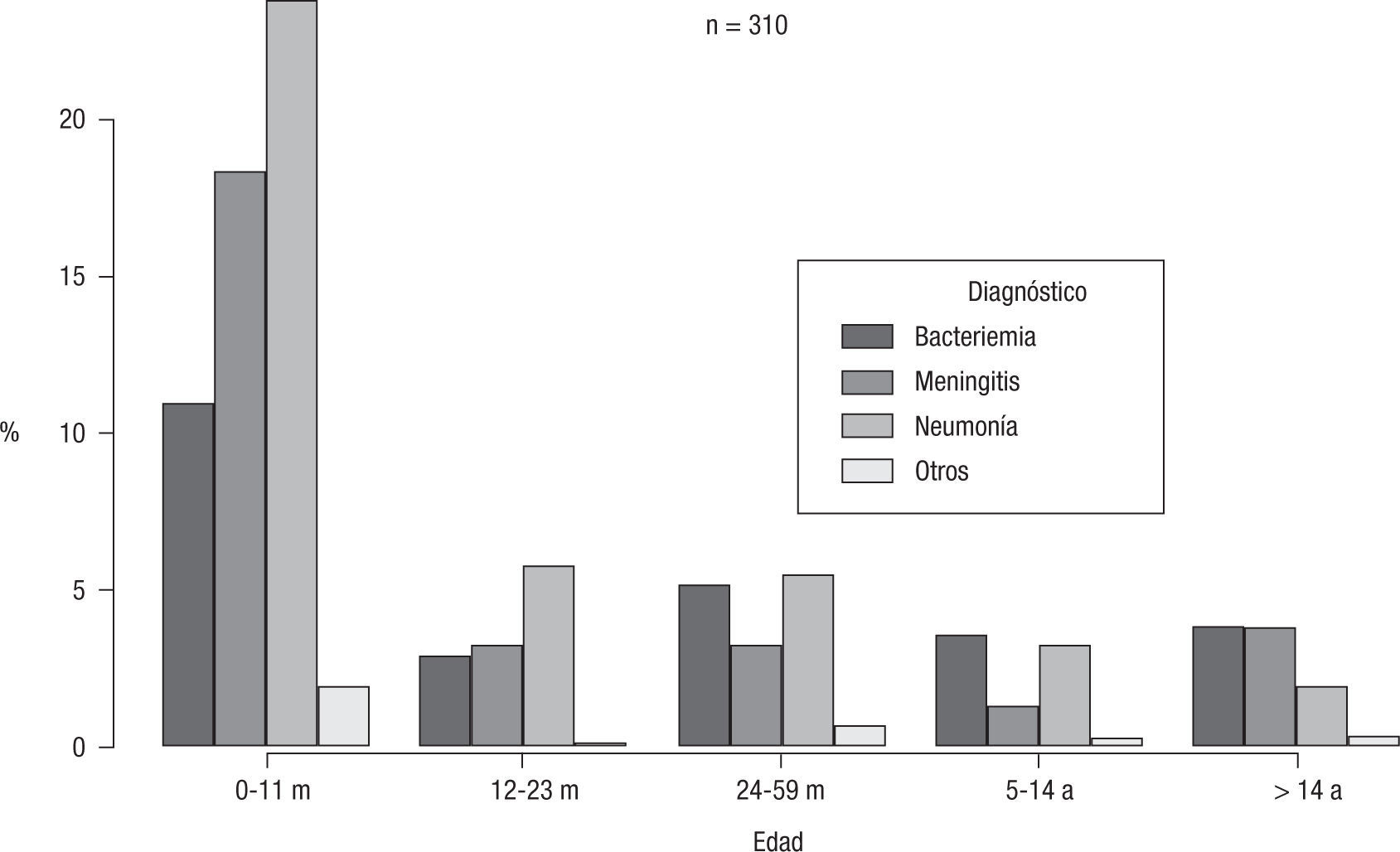
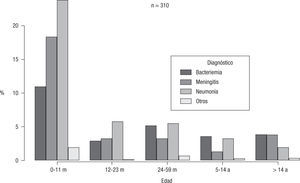
A pesar de que con el estadístico utilizado este dato no resultó significativo (χ2=18,7, p=0,09), se observó que en los menores de 2 años (y, particularmente, en los menores de 1 año) predominaron las neumonías, seguidas por las meningitis y luego por las bacteriemias. En los mayores de 14 años predominaron bacteriemias y meningitis frente a las neumonías. Los 3 casos de artritis se presentaron en niños menores de 12 meses (fig. 1).
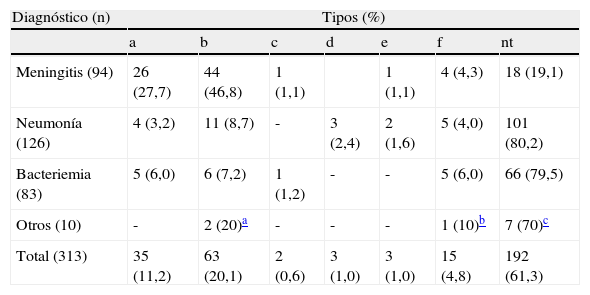
Con respecto a la distribución de tipos entre los aislamientos de H. influenzae, el mayor porcentaje correspondió a los HiNC (61,3 %, n=192), seguido por el b, luego el a, y, en menor proporción, los otros tipos capsulares (tabla 1). La diferencia en las proporciones de HiNC y HiC resultó significativa (χ2=101,2; p<0,01).
Distribución de tipos de H. influenzae según diagnóstico en el período 2005–2010.
| Diagnóstico (n) | Tipos (%) | ||||||
| a | b | c | d | e | f | nt | |
| Meningitis (94) | 26 (27,7) | 44 (46,8) | 1 (1,1) | 1 (1,1) | 4 (4,3) | 18 (19,1) | |
| Neumonía (126) | 4 (3,2) | 11 (8,7) | - | 3 (2,4) | 2 (1,6) | 5 (4,0) | 101 (80,2) |
| Bacteriemia (83) | 5 (6,0) | 6 (7,2) | 1 (1,2) | - | - | 5 (6,0) | 66 (79,5) |
| Otros (10) | - | 2 (20)a | - | - | - | 1 (10)b | 7 (70)c |
| Total (313) | 35 (11,2) | 63 (20,1) | 2 (0,6) | 3 (1,0) | 3 (1,0) | 15 (4,8) | 192 (61,3) |
nt: no tipables (no capsulados);
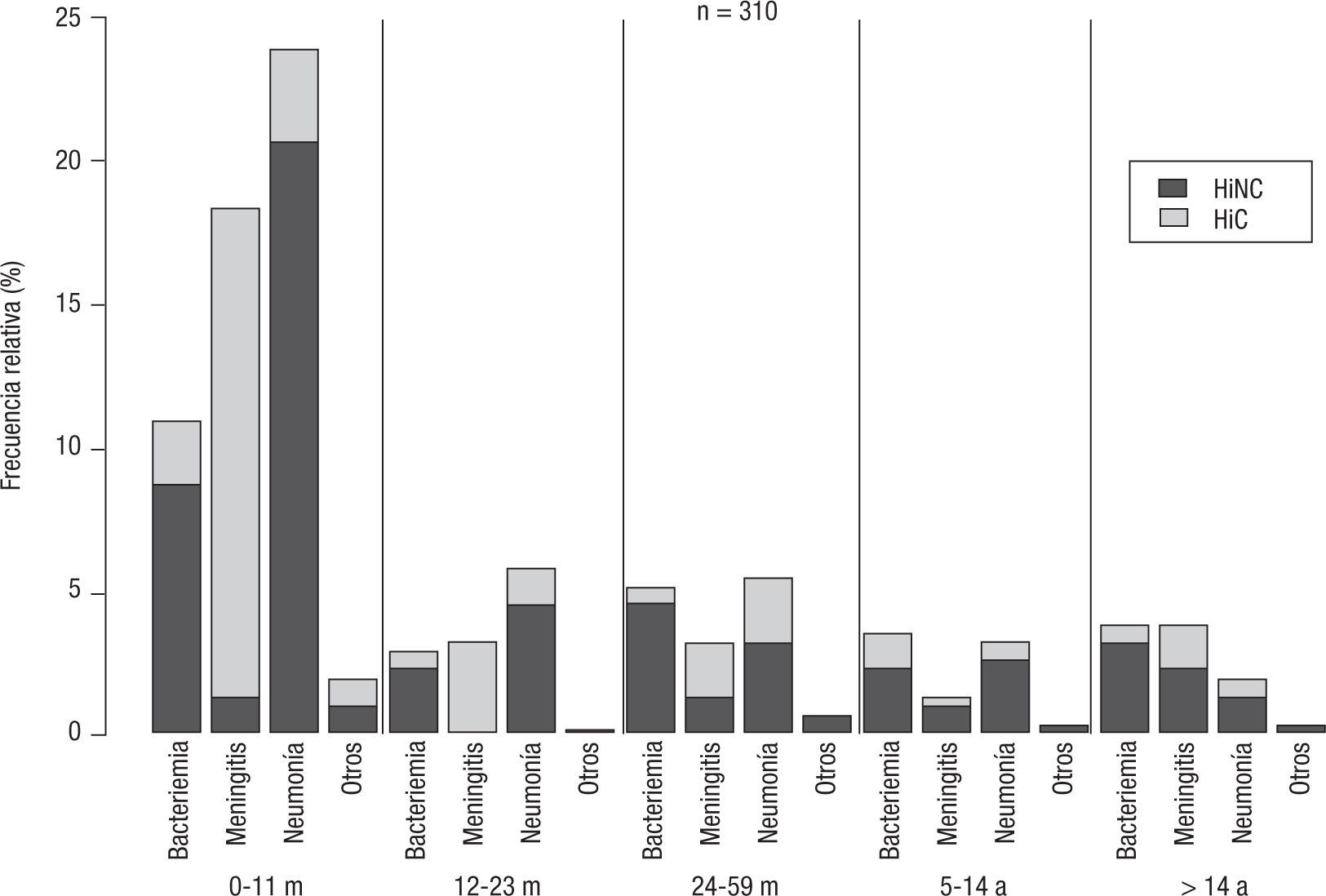
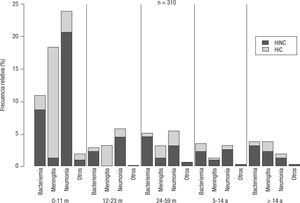
En meningitis predominó HiC y en neumonía y bacteriemia HiNC (p < 0,05) (fig. 2). Con respecto a HiC, los tipos b y a predominaron en meningitis, mientras que en neumonía y bacteriemia no se observó predominio de ningún tipo capsular (χ2=129,01; p<0,01) (tabla 1).
No hubo diferencia significativa en las proporciones de HiC y HiNC entre los distintos grupos etarios (χ2=4,75; p=0,31) (fig. 2); en todos predominó HiNC seguido por el tipo b y luego el a. La edad de aparición del tipo b (mediana=5) resultó significativamente menor que la de HiNC (mediana=11) (p<0,001).
Se determinó el biotipo en 306 aislamientos. Se encontró asociación estadísticamente significativa entre tipos y biotipos (χ2=227,3; p < 0,01). Predominó el biotipo II seguido por el I y el III. El 100 % de los aislamientos tipo a (n=35) perteneció al biotipo II. De los tipo b (n=63), el 66,7 % (n=42) perteneció al biotipo I, el 27% (n=17) al biotipo II y el 6,3 % (n=4) al biotipo IV. De los tipo f (n=14), el 92,9 % (n=13) perteneció al biotipo I. Los 2 aislamientos tipo c fueron biotipo I y IV. En el resto de los capsulados predominaron los biotipos III y IV. Los aislamientos de HiNC (n=186) se asociaron principalmente a los biotipos II (40,9 %; n=76) y III (32,8 %; n=61), seguidos por el biotipo I (16,7 %; n=31), el V (7,0 %; n=13), el IV (2,2 %; n=4) y el VII (0,5 %; n=1). No se encontraron biotipos VI y VIII.
Concordancia entre las técnicas de aglutinación en lámina y PCRMediante las técnicas de aglutinación en lámina y de PCR se investigaron 220 aislamientos. Para evaluar la concordancia entre los resultados obtenidos por ambas técnicas se utilizó el índice de Kappa (no se consideraron 26 aislamientos autoaglutinantes). El valor obtenido fue de 0,982 (IC: 0,92–1,00). Un aislamiento HiNC por la técnica de aglutinación resultó b por PCR y uno f resultó HiNC. De los 26 aislamientos autoaglutinantes, 25 resultaron HiNC por la técnica de PCR y uno b. No se encontraron aislamientos con genotipo b-.
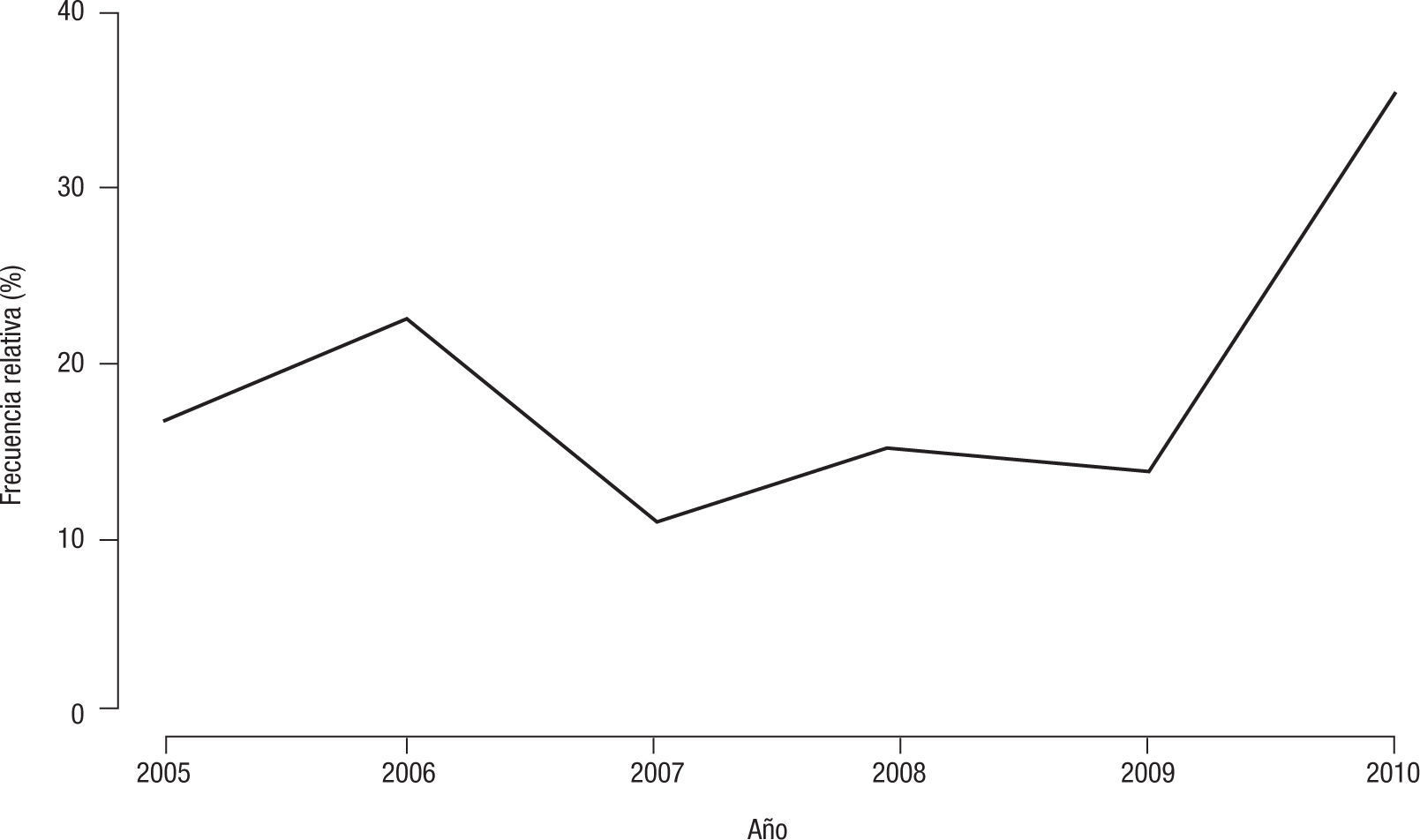
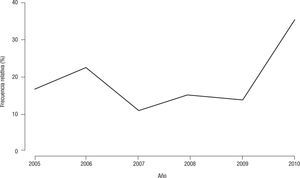
Evolución del tipo b en el período estudiadoEn el período 2005–2009 no se observaron diferencias estadísticamente significativas en relación con la frecuencia relativa anual del tipo b.
En el año 2009 se estudiaron 58 aislamientos, de los cuales el 13,8 % (n=8) correspondió al tipo b. En el año 2010, de 75 aislamientos, el 36 % (n=27) resultó b. La diferencia de proporciones entre estos dos últimos años fue significativa (p<0,007) (fig. 3).
DiscusiónLa implementación de la vacuna conjugada contra Hib en países en vías de desarrollo en las últimas dos décadas constituyó un gran avance para la salud pública. H. influenzae permanece como un importante agente de meningitis, neumonía y bacteriemia en niños en países donde la vacuna no es accesible. La disminución de infecciones causadas por Hib (principalmente meningitis) como resultado de los programas de inmunización ha sido notable. Se ha demostrado la emergencia de enfermedad invasiva causada por capsulados no b y no capsulados, con presencia de estos últimos especialmente en patología respiratoria.
La distribución de la enfermedad invasiva por HiC no b y su presentación clínica varía geográficamente4,8,15.
En un estudio realizado en Brasil se encontró que en la era posvacunal, en meningitis, los tipos capsulares más frecuentes fueron el b (59 %) y el a (14 %), seguidos por HiNC (22 %) y otros HiC (5 %)28. En el presente estudio se observó predominio de HiNC, seguidos por los tipos capsulares b y a. En cuanto a las patologías, en meningitis predominaron los aislamientos HiC y dentro de ellos los tipos b y a, mientras que en neumonía y bacteriemia predominó HiNC y no se observó diferencia significativa entre las frecuencias de HiC. No se recibieron materiales de celulitis periorbitaria o facial.
En coincidencia con otros trabajos, se encontró que la mediana de la edad de aparición del tipo b es menor que la correspondiente a HiNC14,17. Asimismo, la mayor frecuencia de aislamientos en pacientes pediátricos correspondió a los menores de 1 año, coincidentemente con otros estudios5,29.
La biotipificación se usa para propósitos epidemiológicos, pero es de menor valor con respecto a la clínica. En este estudio se halló un predominio del biotipo II seguido por el I y el III. Además, se encontró asociación entre tipos y biotipos, como el tipo a asociado al biotipo II y el tipo b principalmente al I. En HiNC se encontró mayor variabilidad de biotipos. Estas asociaciones fueron encontradas por otros autores24,29.
La técnica de aglutinación en lámina presenta sus limitaciones y se han publicado discrepancias en los resultados obtenidos entre laboratorios. Se encontraron diferencias significativas en la prevalencia de serotipo b cuando se comparó la prueba de aglutinación en lámina que usa como screening el antisuero mono específico b con la técnica de PCR. Lo mismo ocurrió con HiNC. No se detectaron diferencias significativas cuando se utilizaron los seis antisueros mono específicos en paralelo6,18.
Para evitar errores, cuando se utiliza la técnica de aglutinación en lámina es indispensable utilizar solución fisiológica para detectar reacciones de autoaglutinación (aislamientos rugosos) y los seis antisueros en paralelo para determinar la ausencia de reacciones cruzadas. Las discrepancias en la identificación de serotipos sugieren que la carga de enfermedad por Hib, como así también el estado de portador, pueden ser erróneamente estimados, con la consiguiente distorsión en la evaluación del impacto de la vacuna conjugada contra Hib. La técnica de PCR resuelve los errores de interpretación del test de aglutinación y provee el tipo capsular de cepas auto y poliaglutinantes. Además, reconoce mutantes deficientes en cápsula. Por lo tanto, es el método de elección para la identificación del tipo capsular. Con respecto a la concordancia de ambas técnicas, nuestros datos son congruentes con los encontrados en la literatura6,18,26. En nuestro estudio no hallamos cepas con genotipo b-La búsqueda de cepas b-es importante para no sobreestimar la eficacia de la vacuna.
En el último año del período estudiado se encontró un aumento significativo de la frecuencia relativa del tipo b con respecto a los años anteriores, lo cual indica la importancia de mantener la vigilancia clínica y laboratorial de la enfermedad invasiva por H. influenzae. Se señala como limitación de este estudio no contar con el total de los datos de vacunación de la población estudiada, lo que no permite hablar de reemergencia del tipo b.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosAgradecemos al licenciado Ricardo Bello por la realización del análisis estadístico, a Cristina Correa por la asistencia técnica y a la Red Nacional de Laboratorios para Meningitis e Infecciones Respiratorias Agudas Bacterianas por el envío de los aislamientos de Haemophilus influenzae: BUENOS AIRES: H.I.G.A. Pte. Perón, María Adelaida Rossetti; H.I.G.A. «Dr. Pedro Fiorito», Silvia Beatriz Fernández; Hospital Zonal. Esp. Materno Infantil «Argentina Diego», Ana María Mola; Hospital Municipal de Agudos «Dr. Leónidas Lucero », Laura Paniccia; H.I.G.A. «Dr. José Penna», María Luz Benvenutti; H.I.G.A. «Dr. A. Eurnequian», Ricardo Pereyra; Hospital Municipal Gral. Villegas, Alejandra Sale; H.I.G.A. Vicente López y Planes, Hebe Gullo, Adriana Di Bella; Hospital Nacional Prof. Dr. Alejandro Posadas, Adriana Fernández Laussi, Graciela Pelufo; Hospital Gobernador Domingo Mercante, Sandra Bognanni; H.I.G.A. «Dr. A. Piñeyro», Mónica Machain; H.I.G.A. «D. Paroissien», Maria R. Cervelli; Hospital Inter Zonal de Agudos y Crónicos «San Juan de Dios», Andrea Pacha; Hospital de Niños Sor María Ludovica, Cecilia Vescina; H.I.G.A. Evita, Ana Togneri; Hospital Dr. Carlos Bocalandro, Nory Cerda; Hospital Privado de la Comunidad, Mónica Vallejo; Hospital Materno Infantil Victorio Tetamanti, Victoria Monzani; Hospital Universitario Austral, Viviana Vilches; Hospital Del Niño, Liliana Meccia; H.I.G.A. Eva Perón, Marisa Almuzara; Hospital Municipal Ramón Santamarina, Mónica Sparo; Hospital Zonal «Dr. Pedro Orelllana», María Cecilia Barrachia; H.I.G.A Virgen del Carmen, Adriana Melo. CABA: Hospital de Niños «Dr. Pedro Elizalde », Rosana Pereda; Hospital de Clínicas «José de San Martín», Ángela Famiglietti; Hospital General de Agudos J. A. Fernández, Sara Kaufman; Sanatorio Mitre, Ana Di Martino; Hospital General de Agudos Dr. Cosme Argerich, Nora Gómez; Hospital General de Agudos P. Piñero, Daniela Ballester; Hospital de Niños Dr. Ricardo Gutiérrez, Miryam Vázquez, Adriana Procopio, Marisa Turco; FLENI, Nora Orellana; Hospital de Pediatría Prof. Dr. Juan P. Garrahan, Horacio Lopardo, Lidia Casimir; CEMIC, Jorgelina Smayevsky; Hospital Italiano, Graciela Greco; Hospital Británico, Marta Giovanakis; Hospital Alemán, Liliana Fernández Canigia. CATAMARCA: Hospital Interzonal San Juan Bautista, Viviana David; Hospital de Niños, Patricia Valdez; Laboratorio Central de Salud Pública, Daniela Carrizo. CHACO: Hospital Pediátrico «Dr. Avelino Castelán», Ana María Zaloff Dakoff; Hospital «Dr. Julio Perrando», Bettina Irigoyen, Laura Piccoli; Hospital 4 de Junio «Dr. Ramón Carrillo», Norma Cech. CHUBUT: Hospital «Dr. Sanguinetti», Susana Ortiz; Hospital Zonal Esquel; Omar Daher; Hospital Zonal Trelew, Mario Flores. CÓRDOBA: Hospital de Niños de la Santísima Trinidad, Catalina Culasso, Patricia Montanaro; Clínica Privada «Reina Fabiola», Marina Botiglieri; Hospital «Guillermo Rawson», Ana María Litvik; Hospital Infantil Municipal, Liliana González; Clínica Privada Vélez Sarsfield, Lidia Wolff; Hospital Regional «Domingo Funes», Lilia Camisassa; Hospital Regional Pasteur, Claudia Costabella. CORRIENTES: Hospital Pediátrico Juan Pablo II, Viviana García Saito, Celia Monzón. ENTRE RIOS: Hospital Masvernat, Ofelia Moulins; Hospital Materno Infantil San Roque, Lorena del Barco, Adriana Franchini. FORMOSA: Hospital Central, Nancy Pereyra; Hospital de la Madre y el Niño, Silvana Vivaldo, Nancy Comello. JUJUY: Hospital de Niños «Héctor Quintana», Marcelo Toffoli; Hospital Central de Salud Pública, María Rosa Pizarro. LA PAMPA: Establecimiento Asistencial Gobernador Centeno, Adriana Pereyra; Hospital «Lucio Molas», Gladys Almada. LA RIOJA: Hospital Regional «Dr. Enrique Vera Barros», Sonia Flores, Mónica Romanazi. MENDOZA: Hospital «Teodoro J. Schestakow», Adriana Acosta, Ada Zanuso; Hospital de Pediatría «Dr. Humberto Notti», Beatriz García, Laura Balbi. MISIONES: Hospital SAMIC El Dorado, Ana María Miranda; Hospital Provincial de Pediatría «Dr. F. Barreyro», Martha Von Spech, Sandra Grenón; Hospital Ramón Madariaga, Viviana Villalba. NEUQUÉN: Hospital Heller, Fernanda Bulgueroni; Hospital Provincial «Dr. Castro Rendón», Cristina Pérez: RÍO NEGRO: Hospital Zonal Bariloche, Sabrina de Bunder, Néstor Blázquez: Hospital Área Cipolletti, María Cristina Carranza; Hospital Artemides Zatti, Graciela María Stafforini. SALTA: Hospital San Vicente de Paul, María Luisa Cacace, Luisa Ayala; Hospital Público Materno Infantil, Norma Sponton Jorgelina Mulki.SAN JUAN: Hospital Marcial Quiroga, Hugo Castro; Hospital Guillermo Rawson,Marisa López, Osvaldo Navarro. SAN LUIS: Policlínico Central de San Luis, Hugo Rigo; Policlínico Regional de Villa Mercedes; Ema María Fernández. SANTA CRUZ: Hospital Zonal Caleta Olivia, Josefina Villegas, Guillermo García; Hospital Regional Río Gallegos, Hortensia Cano,Wilma Krause. SANTA FE: Maternidad Martín - CEMAR - DSLAC, María Inés Zamboni; Hospital de Niños V. J. Vilela, Adriana Ernst, Andrea Badano; Hospital de Niños «Dr. O. Alasia», Stella Maris Virgolini, María Rosa Baroni; Laboratorio Central de Salud Pública, Andrea Nepote. SANTIAGO DEL ESTERO: Hospital de Niños Eva Perón, María Elisa Pavón; Hospital Regional «Dr. Ramón Carrillo», Ana María Nanni de Fuster. TIERRA DEL FUEGO: Hospital Regional Río Grande, Marcela Vargas; Hospital Regional de Ushuaia, Gabriel Castro. TUCUMÁN: Hospital de Clínicas «Dr. Nicolás Avellaneda», Norma Cudmani; Hospital del Niño Jesús, Ana María Trejo.