El hiperinsulinismo congénito (HIC) es una enfermedad poco frecuente, de causa genética, que produce hipoglucemia debido a la secreción excesiva y/o desordenada de insulina. De no ser detectada tempranamente produce un severo daño neurológico con un impacto importante en el desarrollo del niño. Se han descrito mutaciones en nueve genes como causa de HIC, aunque histológicamente se describen tres tipos mayores de esta entidad (difuso [50%], focal [40%] y atípico [10%]), cuyo manejo difiere drásticamente1. Los pacientes con enfermedad focal requieren una pancreatectomía parcial que remueva la zona de la lesión para proveer una cura completa sin las comorbilidades de la pancreatectomía total. Esta intervención queda restringida para la enfermedad difusa sin respuesta al tratamiento médico, cuya morbilidad es la diabetes mellitus iatrogénica y la insuficiencia pancreática exócrina2.
En Finlandia la incidencia del HIC se calcula en 1 por cada 50 000 recién nacidos en población general, cifra que aumenta hasta 1 por cada 2500 recién nacidos en cohortes con consanguinidad, como las estudiadas en Arabia3. Hasta la fecha, en Argentina no existen estadísticas ni publicaciones sobre el diagnóstico con 3,4-dihidroxi-6- 18 F-fluoro-L-fenilalanina (18F-DOPA) por tomografía computada por emisión de positrones (PET/TC) de esta enfermedad.
La 18F-DOPA es un radiotrazador análogo de la L-DOPA, que ingresa a las células a través del sistema transportador de aminoácidos, para posteriormente ser transformada en dopamina por la acción de la L-DOPA decarboxilasa. Se ha demostrado que las células neuroendocrinas y las células B de los islotes pancreáticos expresan la enzima decarboxilasa, por lo que el radiotrazador es captado, decarboxilado y almacenado en el citoplasma para ser excretado mediante gránulos por las células exócrinas y endócrinas del páncreas4. Por ello, el HIC puede ser diagnosticado mediante el estudio de 18F-DOPA PET/TC.
No obstante, la posibilidad de falsas interpretaciones debe ser considerada por múltiples factores. Entre ellos, la subestimación de la captación de lesiones de menor tamaño que la resolución espacial del equipo, las imágenes no corregidas por el efecto del volumen parcial, la lesión focal amplia que puede confundirse con la variante difusa, la lesión localizada junto al órgano que capta fisiológicamente 18F-DOPA (como la vía biliar y el sistema urinario) y la absorción insuficiente del radiotrazador en la lesión en relación con las células exócrinas adyacentes.
La imagen de PET/TC con 18F-DOPA dentro del algoritmo diagnóstico para la localización del tejido hiperplásico hiperfuncionante fue utilizado por primera vez en el año 2005 por Rivero et al.5 Desde entonces los diferentes centros del mundo dedicados al diagnóstico y tratamiento del HIC han mostrado su alto valor diagnostico (especificidad del 100%)2. En Latinoamérica el primer estudio de 18F-DOPA PET/TC se realizó en Argentina en el año 2015 y hasta la fecha es el único país de la región que ha implementado este método, considerado actualmente como el de referencia para diferenciar entre el tipo difuso y focal.
Queremos compartir con usted y los lectores de la RAR nuestra experiencia inicial en el diagnóstico de HIC por medio de 18F-DOPA PET/TC mediante dos casos representativos, uno de la variante histológica focal y otro de la variante histológica difusa.
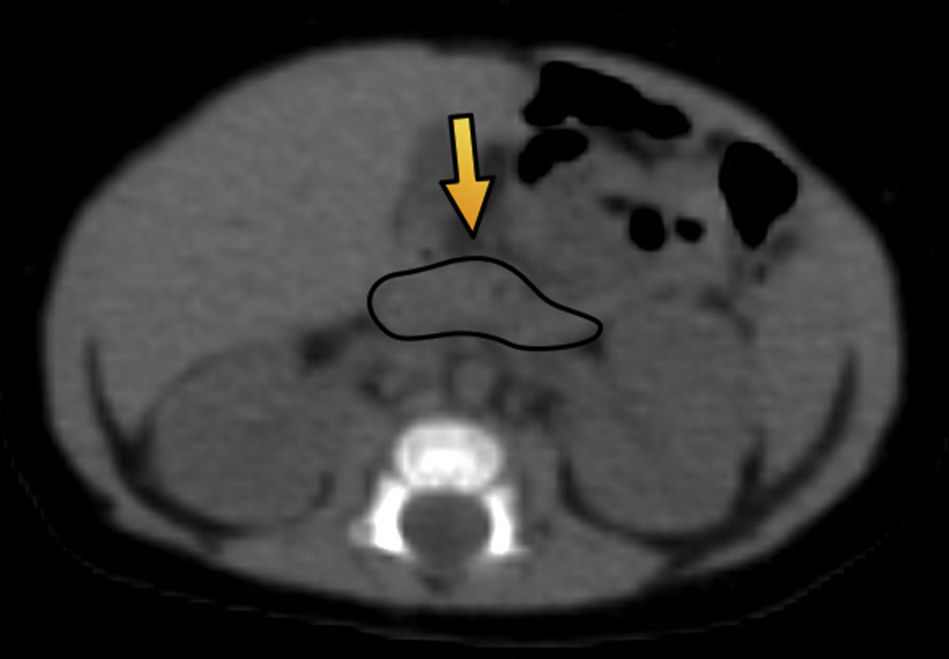
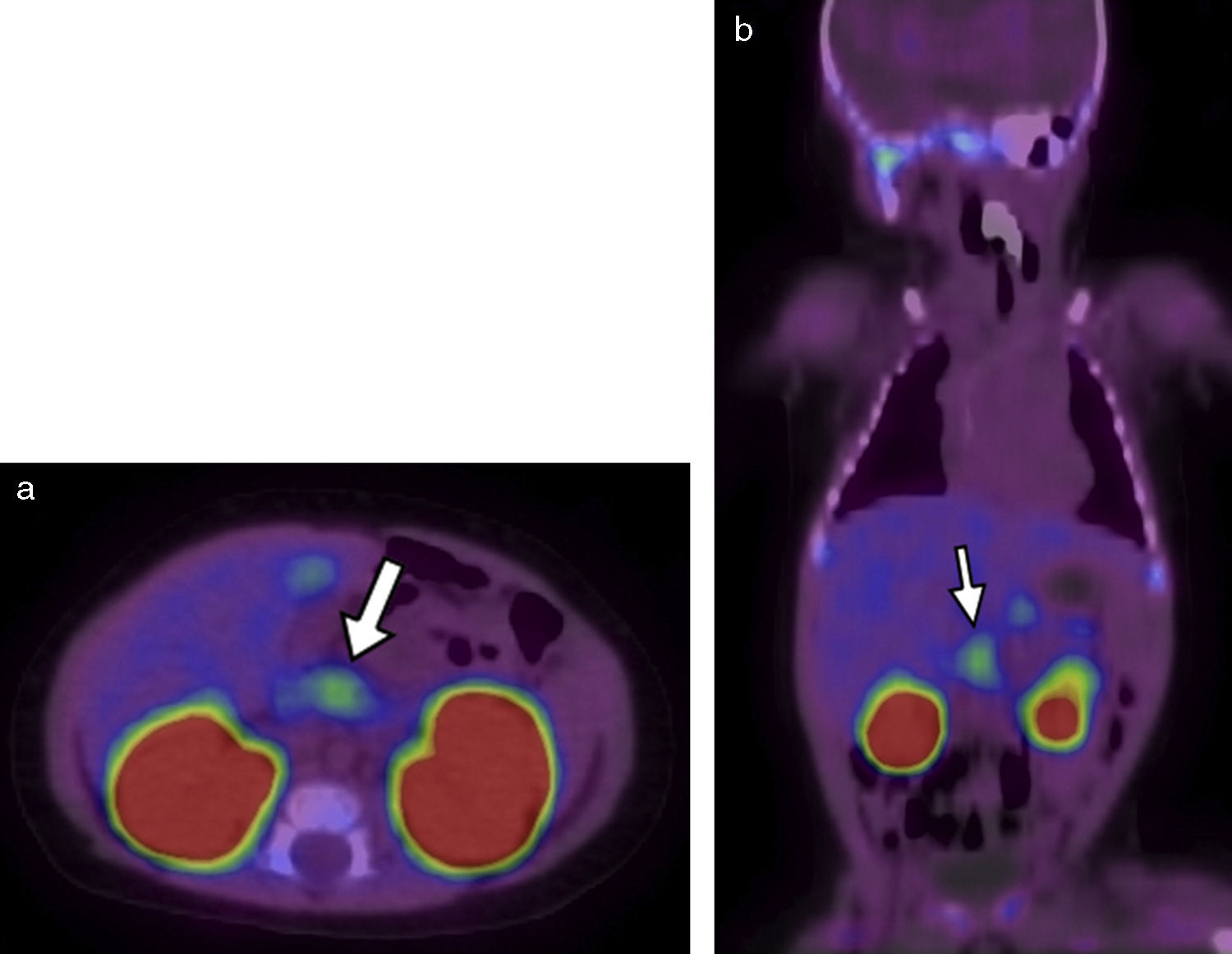
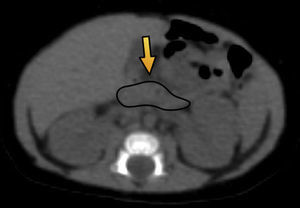
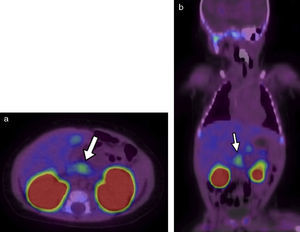
El primer paciente, que tenía 12 días de vida, presentó hipoglucemia en la primera hora posterior al nacimiento (19mg/dl) y fue tratado con suero dextrosado e hidrocortisona. El examen de insulinemia en hipoglucemia crítica (glucemia<50mg/dl) reportó 38 mUI/ml (valor de referencia insulinemia<2) y se diagnosticó hipoglicemia por hiperinsulinismo (relación insulinemia/glucemia=46 ([valor normal<5]). Ante la sospecha de hiperplasia pancreática difusa, se solicitó una tomografía computada (TC) de páncreas que resultó normal. Por este motivo, se derivó a nuestro hospital para ser estudiado mediante 18F-DOPA PET/TC. El equipo utilizado fue un Philips Gemini 64 TF. Las imágenes evidenciaron un foco hipermetabólico a nivel de la porción cefálica del páncreas, con un valor de captación estándar máximo (SUV máx) de 1,4. Esta cifra estaba 16% arriba del resto del parénquima pancreático, lo cual fue compatible con foco de captación focal (figs. 1 y 2).
18F-DOPA PET/TC en (a) plano axial al mismo nivel que la Figura 1 y (b) en plano coronal evidencia una imagen focal de alta avidez por el radiotrazador (flechas blancas). También se destacan sitios de captación fisiológica de18F-DOPA, como la vesícula biliar y los riñones.
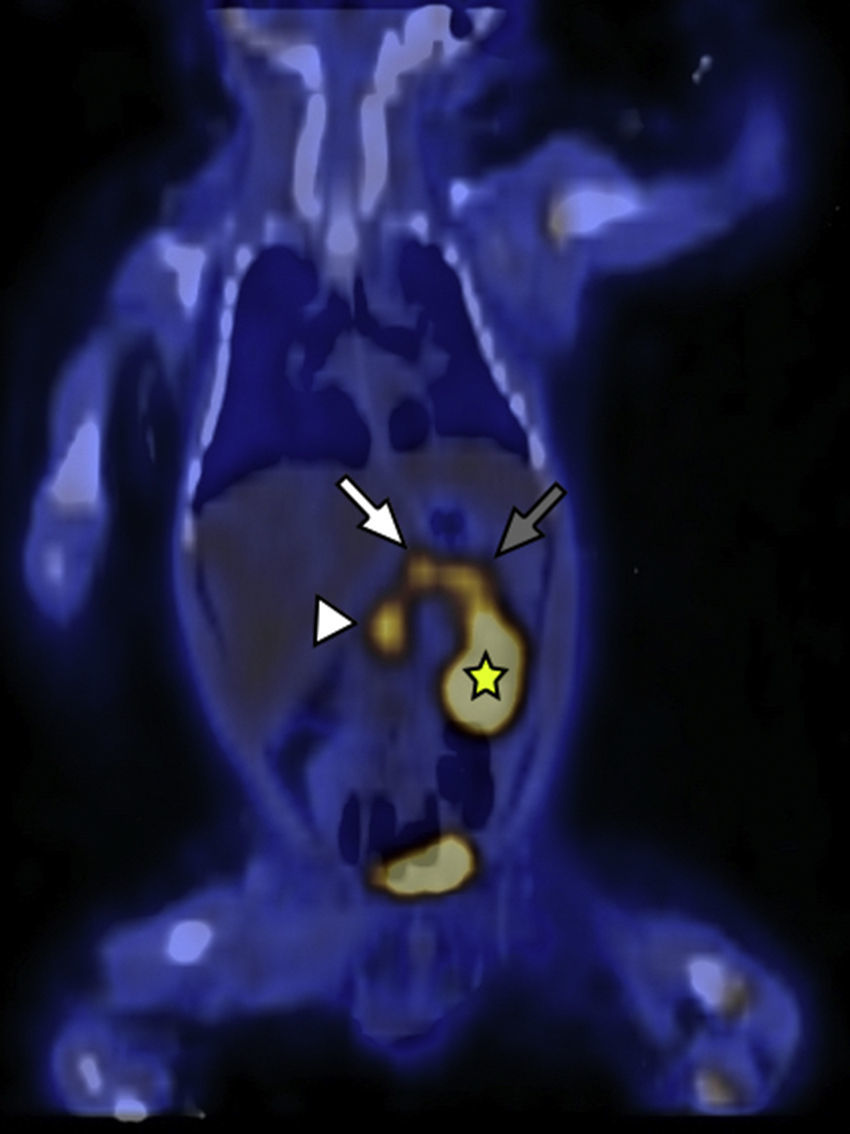
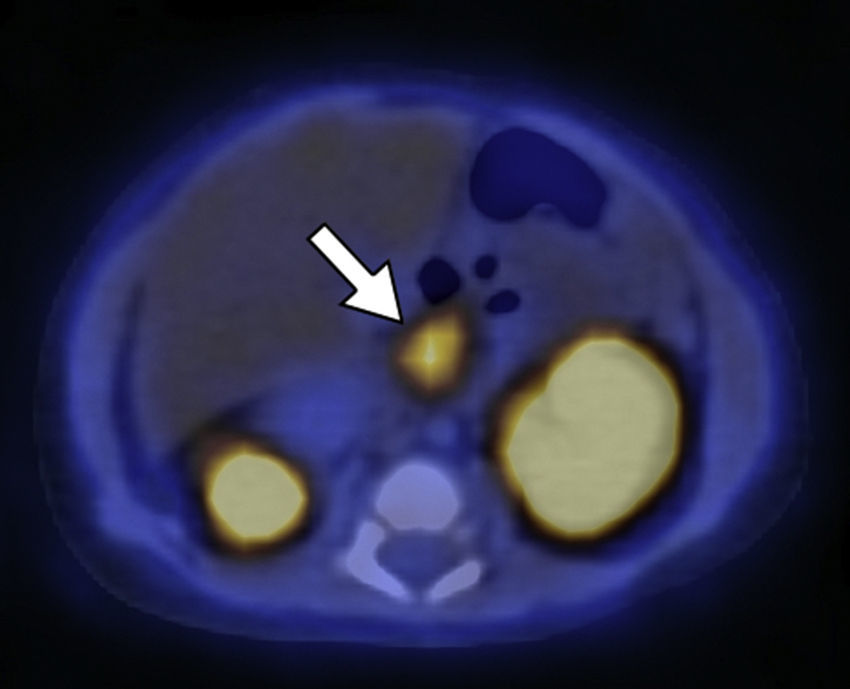
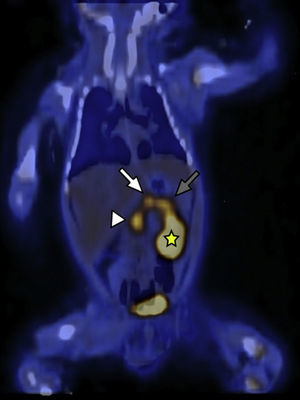
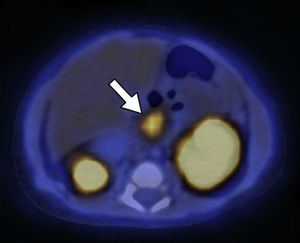
El segundo paciente de 3 días de vida presentó hipoglucemia de 12mg/dl en las primeras horas posteriores al nacimiento. Fue ingresado a la unidad de terapia intensidad neonatal, donde se registraron hipoglucemias de hasta 20mg/dl a pesar del tratamiento con suero dextrosado. Se realizaron muestras críticas de hipoglucemias, valores de insulinemia de hasta 177, 223, 208 y 271 mUI/ml. Se descartó hipoglucemia por déficit de hormona adrenocorticotropa (ACTH) y hormona de crecimiento (GH), y se planteó como hipótesis diagnóstica el HIC. Se inició tratamiento farmacológico con diazoxido y octreotide, pero el paciente continuó con hipoglucemia. Por ello, se planteó la necesidad de manejo quirúrgico y fue derivado a nuestra institución para la realización del estudio 18F-DOPA PET/TC. Este identificó una captación difusa del radiotrazador con focos hipermetabólicos a lo largo de todo el órgano (cabeza, SUV máx 3,8; cuerpo, SUV máx 3,3; y cola, SUV máx 3,8) (figs. 3 y 4).
18F-DOPA PET/TC en plano coronal identifica a nivel del parénquima pancreático una acumulación difusa del radiotrazador y tres focos hipermetabólicos a nivel de la cabeza (cabeza de flecha), cuerpo (flecha blanca) y cola (flecha gris). Se señala, además, el riñón izquierdo (estrella amarilla) excretando el radiotrazador.
18F-DOPA PET/TC en plano axial del mismo paciente que la Figura 3 muestra una de las zonas de acumulación patológica del radiotrazador localizada en la cabeza pancreática.
Ambos pacientes fueron sometidos a tratamiento quirúrgico: en el primer caso se realizó pancreatectomía parcial y en el segundo una total. El análisis histopatológico confirmó el diagnóstico en los dos pacientes.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Conflicto de interesesLos autores del trabajo declaran no tener ningún conflicto de intereses.