En nuestro país el cáncer de próstata es la neoplasia más frecuente en hombres de edad avanzada. Por ello, resulta indispensable una adecuada estadificación al momento de establecer la estrategia terapéutica. En este artículo se presenta la 7.a edición del sistema TNM de estadificación para el cáncer de próstata, vigente desde el 1.º de enero de 2010. El mismo ha tenido modificaciones mayores con respecto a la 6.a edición.
In our country prostate cancer is the most common malignancy in older men. An accurate staging is very important to establish treatment strategies.This article presents the 7th edition TNM staging system for prostate cancer, effective January 1, 2010. This has undergone major changes over the 6th edition.
El carcinoma de próstata es una neoplasia que se presenta predominantemente en hombres de edad avanzada. En nuestro país es el cáncer más frecuente del sexo masculino y el tercero (luego del de mama y colon), si se toman en cuenta ambos sexos1.
La mayoría de los cánceres de próstata son adenocarcinomas con un patrón de crecimiento lento y buena respuesta al tratamiento2 (pudiendo, incluso, remitir en forma completa cuando el compromiso es localizado). Por ello, muchos pacientes tienen una supervivencia prolongada, aun después de la diseminación del tumor primario hasta sitios distantes como el hueso3. No obstante, también hay que tener en cuenta que existen algunos tumores prostáticos agresivos, con una evolución y extensión sistémica rápida2.
El cáncer de próstata suele ser multifocal en la anatomía patológica, originándose en el 80-85% en la zona periférica (accesible al tacto rectal), en el 10-15% en la zona transicional y en el 5-10% en la próstata central4.
La estadificación local del cáncer de próstata (T y N clínico) sigue siendo difícil, a pesar de los avances en el Diagnóstico por Imágenes. La disociación clínico-patológica es alta, tanto en el diagnóstico clínico de la enfermedad intraprostática (cT1-2) con demostración pos-prostatectomía radical (PR) de compromiso extraprostático (pT3-4 o pN1), como en el diagnóstico clínico de la enfermedad extraprostática (cT3) que pos-PR se demuestra intraprostática (pT2). La sobreestadificación de este grupo ocurre en el 13-27% de los casos.
El cáncer de próstata se clasifica en grupos de riesgo (bajo, intermedio, elevado) en función de las cifras del antígeno prostático específico (PSA, por sus siglas en inglés), la escala de Gleason y el estadio clínico5. Algunos autores, como D'Amico et al., limitan la clasificación de riesgo a la enfermedad localizada en la próstata6 (pT2), mientras que otros incluyen en los de alto riesgo a los carcinomas que infiltran el tejido periprostático7 (pT3a). En el National Comprehensive Cancer Network (NCCN) se dividen los grupos de riesgo en 5 categorías8. Por un lado, se agrega un grupo de muy bajo riesgo, factible de vigilancia activa (T1c, Gleason 6 o menos, PSA < 10 ng/ml, menos de 3 cores de la biopsia positivos, todos con < 50% del core comprometido y PSA density < 15 ng/ml/gr); y por otro, se incluye un grupo de muy alto riesgo con T3b-T4.
Por todos estos factores aún hay controversias con respecto al tratamiento más adecuado para cada etapa (cirugía, radioterapia, terapia hormonal o vigilancia activa). El enfoque terapéutico, en este sentido, dependerá del estadio, pero también de las condiciones de salud del paciente, su edad, la escala de Gleason y el PSA, sin dejar de tener en cuenta los efectos adversos y las preferencias personales de cada individuo.
La sospecha clínica del cáncer de próstata se basa en el tacto rectal y en las cifras elevadas de PSA, pero el diagnóstico requiere de confirmación histológica mediante biopsia guiada por ecografía transrectal (ETR). Este enfoque diagnóstico, sin embargo, presenta sus limitaciones, ya que existe un elevado porcentaje de tumores clínicamente significativos que no son identificados (falsos negativos) por la ETR. Además, la frecuente elevación de las cifras del PSA en la hipertrofia benigna de próstata o en otras situaciones (como, por ejemplo, en la prostatitis) conduce a la práctica innecesaria de biopsias.
Los métodos de imágenes han evolucionado rápidamente, mostrando cada vez mayores beneficios en el diagnóstico y seguimiento de los pacientes con cáncer de próstata. Tradicionalmente la ETR ha sido utilizada como guía para la toma de biopsias prostáticas, mientras que la tomografía computada (TC) ha tenido un papel destacado en la estadificación general (con escasa precisión para la estadificación locorregional). No obstante, en la actualidad, los avances técnicos en resonancia magnética (RM) proporcionan una imagen morfológica detallada y de alta resolución, que permite localizar la lesión y estadificarla de forma más certera, con la posibilidad, además, de obtener información funcional del tumor mediante secuencias ponderadas en difusión, dinámicas con contraste y espectroscopia9. Incluso la RM se utiliza cada vez más como mapa y guía para dirigir la biopsia mediante ETR, ya que, de este modo, se incrementa la precisión diagnóstica en la detección y localización del tumor y se reduce la subestadificación clínica, mejorando la selección del tratamiento.
La detección de la enfermedad a distancia suele ser valorada por TC tóraco-abdómino-pélvica y gammagrafía ósea, pero nuevos avances en los métodos de diagnóstico por imágenes están siendo evaluados con el fin de establecer con mayor precisión la localización de la enfermedad metastásica y la recurrente. La evolución de la técnica de RM permite realizar, en forma simultánea con la estadificación local, un estudio de cuerpo entero con secuencia de difusión para la valoración de la enfermedad metastásica10.
En el caso de la tomografía por emisión de positrones con fluorodesoxiglucosa (FDG-PET/TC), se ha demostrado su eficacia en la detección de la enfermedad primaria y metástasis en diversos escenarios oncológicos. Sin embargo, tiene escaso valor para la evaluación del cáncer de próstata debido a sus limitaciones (baja avidez por la FDG de los tipos histológicos del cáncer de próstata y eliminación del radio-trazador por orina, entre otras). Recientemente, algunos estudios han evaluado el valor del examen PET/TC con colina no solo para la detección del cáncer de próstata primario, sino también para la recidiva local y/o metástasis ganglionares u óseas11. Se ha demostrado que tiene baja sensibilidad y alta especificad en la estadificación inicial para la detección de pequeños ganglios linfáticos12,13, y su indicación se propone en pacientes con recaída bioquímica e imágenes convencionales negativas o no concluyentes14.
En el Consenso Argentino Intersociedades 200815 no se incluyó a la RM ni a los exámenes por PET/TC colina en la estadificación y evaluación de las recaídas locales. Sin embargo, en el 2013 se está actualizando el lineamiento en cáncer de próstata.
En 1997 la American Joint Committee on Cancer (AJCC) adoptó la clasificación TNM para la estadificación del cáncer de próstata. Luego de diversas revisiones y modificaciones, en el 2010 se consum ó la 7.a edición del TNM, estableciéndola como el sistema estándar de referencia para la estadificación de la enfermedad. Esta tiene como objetivo diferenciar las lesiones intraglandulares de las localmente invasivas o metastásicas, para así decidir el enfoque terapéutico más adecuado para cada paciente (tablas 1-4).
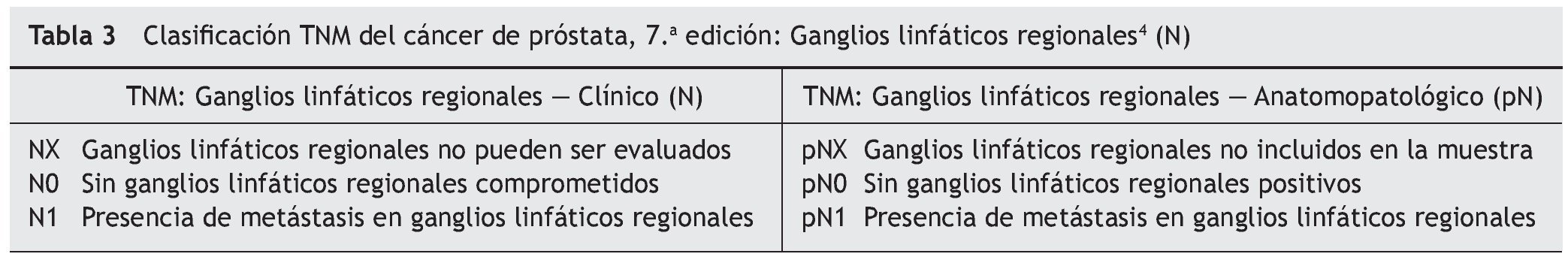
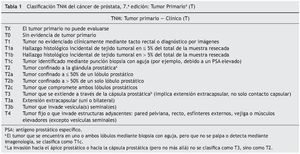
En el TNM, se define como T1 al tumor que es clínicamente no evidente, impalpable y no visible en estudios de imágenes. El cáncer detectado sin extensión extraglandular se considera T2 y cuando se extiende por fuera de la cápsula se establece como T3. Se clasifica como T4 cuando existe una invasión de órganos adyacentes distintos a las vesículas seminales. Si los ganglios linfáticos regionales están comprometidos, se considera N1; mientras que la afectación de ganglios linfáticos no regionales y/o la presencia de metástasis (en los huesos o en otras localizaciones) son clasificadas como M1.
Cambios entre la 6.a y 7.a edición del TNM de cáncer de próstata
La nueva clasificación TNM (7.a edición), publicada a fines de 2009 y vigente desde el 1.° de enero de 2010, ha introducido cambios mayores con respecto a la 6.ª edición4:
• La microinvasión del cuello vesical actualmente se considera estadio pT3a, mientras que en la 6.a edición era clasificada como estadio T4. Esto surge del análisis retrospectivo de un gran número de casos en los que se demostró que la invasión microscópica del cuello vesical no era un factor independiente de peor pronóstico, diferente a la extensión extracapsular en general.
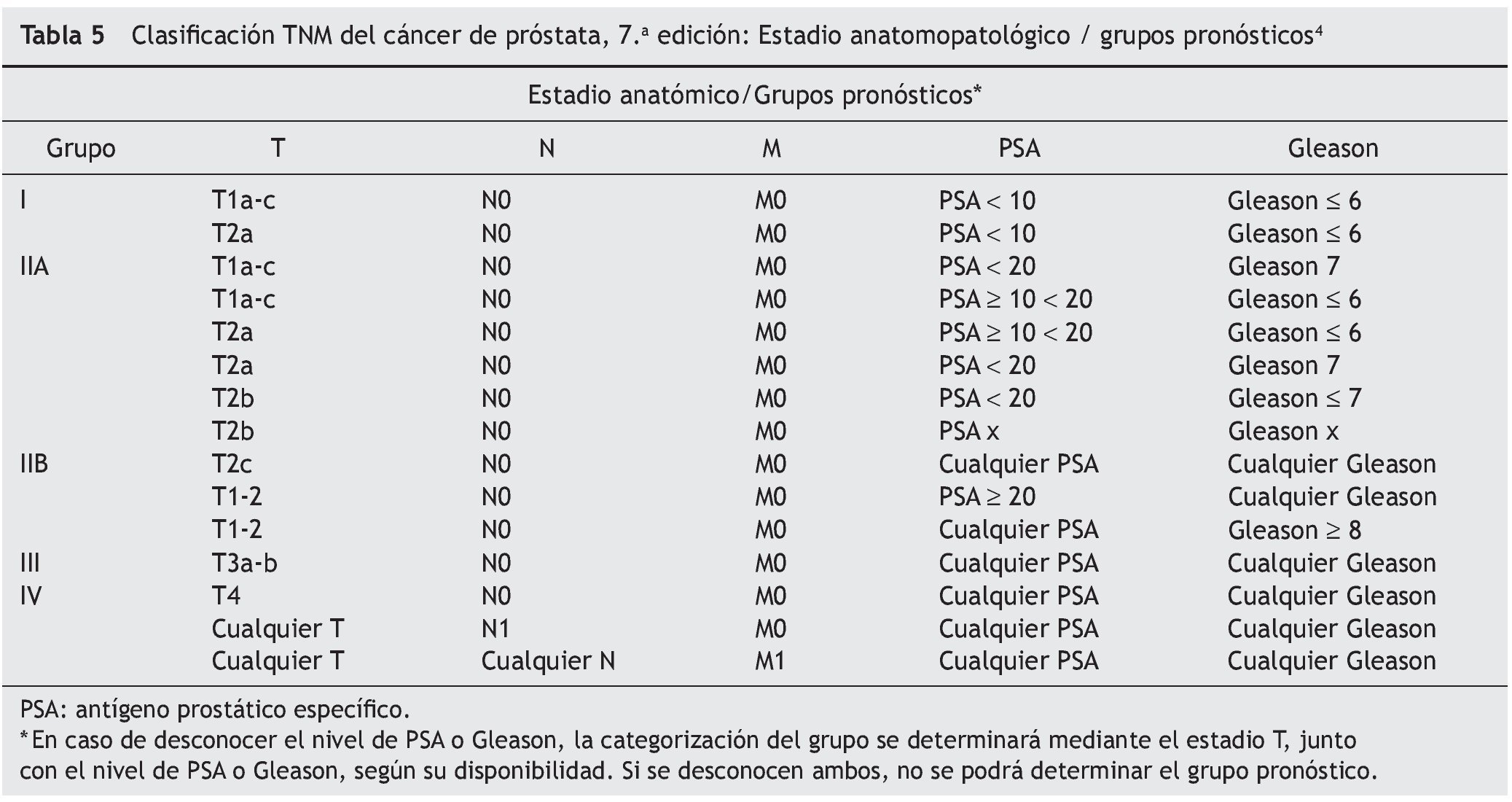
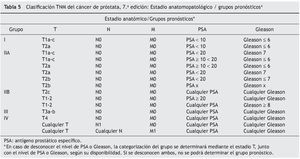
• Se han incorporado dos factores al estadio anatómico, determinando grupos de pronóstico: puntaje de Gleason y nivel sérico de PSA (tabla 5).
• El puntaje de Gleason se considera el sistema de clasificación anatomopatológico de elección, ya que toma en cuenta la heterogeneidad morfológica inherente al cáncer de próstata y tiene un valor pronóstico demostrado por numerosos estudios.
• Con respecto al estadio anatómico, se ha modificado el grupo I y II. Actualmente los estadios T1 y T2a se encuentran en el Grupo I, mientras que los estadios T2b y T2c pertenecen al Grupo II.
Criterios a considerar en el informe médico para la estadificación local del cáncer de próstata
En comparación con la TC, la ecografía y el tacto rectal, la RM ha demostrado ser la técnica más fiable para la estadificación locorregional del cáncer de próstata, por su mayor capacidad de caracterización tisular y buena resolución espacial16.
En el informe del estudio de RM para la estadificación locorregional es importante constatar la siguiente información9,10:
1. Número, tamaño y ubicación de los nódulos prostáticos.
2. Compromiso de la cápsula prostática, el ángulo recto-prostático, el haz neurovascular y los planos periprostáticos.
3. Compromiso de las estructuras adyacentes: vesículas seminales, vejiga urinaria, recto, esfínter anal externo, músculos elevadores y pared pélvica.
4. Presencia y tamaño de adenopatías regionales: se consideran ganglios linfáticos regionales a los ubicados por debajo de la bifurcación de las arterias ilíacas comunes. La lateralidad no afecta el estadio N. El compromiso de ganglios linfáticos a distancia se considera M1a e incluye a los ganglios ilíacos comunes, inguinales y paraaórticos.
La 7.a edición del TNM de cáncer de próstata clasifica el estadio anatomopatológico / grupos pronósticos (tabla 5) en 5 categorías y considera distintas opciones terapéuticas para cada uno de estos grupos.
Grupo I
En T1a-c N0 M0, PSA < 10, Gleason 6 o menos, los cilindros de biopsia son 1 o 2, ninguno con más del 50% de compromiso. En este caso y aceptadas las opciones explicadas al paciente, se puede proponer un protocolo de vigilancia activa. En cambio, el T2a, por ser palpable, debe someterse a alguna terapia incluida en los de bajo riesgo.
Grupo IIA
Representa el grupo de bajo riesgo en todas las clasificaciones citadas6-8. Deben recibir tratamiento, ya sea radioterapia (RTP intersticial, 3D conformada, intensidad modulada —IMRT) o cirugía (PR abierta, laparoscópica, robótica). En general, a los pacientes con una expectativa de vida superior a los 10 años se les propone PR y a los de menos de 10 años algún tipo de radioterapia, contemplando comorbilidades, complicaciones del tratamiento y preferencias del paciente.
Grupo IIB
Son el grupo de riesgo intermedio con enfermedad localizada, pero con un PSA alto o Gleason alto (8, 9 ó 10) que aumenta el riesgo de compromiso ganglionar locorregional. La estadificación ganglionar por imágenes puede definir la terapéutica. Como los planes de radioterapia (intersticial, 3D conformada, intensidad modulada-IMRT) incluyen solo la próstata, habría que complementar con campos ganglionares o efectuar una cirugía con linfadenectomía ampliada.
Grupo III
Se caracteriza por la presencia de compromiso extraprostático o de vesículas seminales. En este grupo no puede realizarse monoterapia. Se ha demostrado una mejor sobrevida con la RTP + deprivación androgénica17 (DA), por lo que la radioterapia sola no está aceptada como único tratamiento. Las terapias que pueden combinarse son la DA, RDT y cirugía.
El tratamiento habitual para los localmente avanzados era DA-RTP-DA, pero en la última década se ha demostrado un alto índice de sobreestadificación: el 27% de los cT3 resulta pT2 luego de la PR, con una evolución similar a los cT218. Además, se ha reportado que de 1746 pacientes tratados con PR en los que se halló enfermedad extraprostática, el 50% estaba libre de recaída a 15 años19. Como consecuencia, se está indicando PR en los casos con sospecha de extensión extracapsular (pT3a) y, según los resultados del estudio patológico, se complementa con RTP o DA en los casos pT3 y se mantiene en control a aquellos pT2.
Grupo IV
En este grupo la DA es el tratamiento de elección y solo en el T4 N0 M0 puede asociarse a radioterapia prostática.
Conclusión
La incorporación de la clasificación TNM del cáncer de próstata en la práctica diaria del especialista en Diagnóstico por Imágenes aporta información relevante para la correcta estadificación de los pacientes, permitiendo, a su vez, la colaboración en la toma de decisiones terapéuticas del equipo multidisciplinario.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses, excepto la Dra. Dieguez que declara como posible conflicto de interés formar parte de la Comisión Directiva de la SAR y el Dr. González que declara ser parte del Comité de Redacción de la RAR.
http://dx.doi.org/10.7811/rarv77n4a10
* Autor para correspondencia.
Correo electrónico:javiervallejos@diagnosticomaipu.com.ar (J. Vallejos).