Convocadas por la Academia Nacional de Medicina, por intermedio del Instituto de Estudios Oncológicos y ante la iniciativa de la Asociación Argentina de Ginecología Oncológica, las entidades autoras, miembros del Programa Argentino de Consensos de Enfermedades Oncológicas y del Programa Nacional de Consensos Intersociedades, avalan este Consenso Multidisciplinario que aúna los criterios propuestos por los profesionales que se encuentran involucrados en la prevención, diagnóstico y tratamiento de los tumores de ovario.
Las instituciones autoras se comprometen a difundir y promover el uso del contenido de este documento en todas las áreas y entidades responsables del manejo de la salud, institutos nacionales, provinciales y municipales, PAMI, colegios médicos, entidades de medicina prepaga, obras sociales, mutuales, en la Superintendencia de Seguros de Salud de la Nación, hospitales universitarios y comunales, y demás entidades relacionadas, así como su aplicación por todos los especialistas del país.
IntroducciónEl cáncer de ovario ocupa el tercer lugar en orden de frecuencia dentro de los cánceres ginecológicos, después del cáncer de cuello y endometrio. Es el que causa mayor mortalidad, dado que el 75% de los casos se detecta en estadios avanzados. Alrededor del mundo, en el año 2008 se diagnosticaron aproximadamente 225.000 casos nuevos y 140.000 mujeres fallecieron por esta causa. La incidencia actual del cáncer de ovario en países desarrollados se estima en 13 casos cada 100.000 mujeres/año. La edad media de diagnóstico en los Estados Unidos es de 63 años.
En la República Argentina, según el reporte del Registro de Tumores de Concordia, la tasa cruda de incidencia es de 7,3 casos cada 100.000 mujeres/año y la tasa de mortalidad, de 4,8 casos cada 100.000 mujeres/año, con aproximadamente 800 defunciones anuales en promedio.
El 90% de los tumores primarios de ovario corresponde a la estirpe epitelial, mientras que el resto pertenece a tumores menos frecuentes, como los derivados de las células germinales del estroma y cordones sexuales.
EtiologíaEl mecanismo patogénico que explica el vínculo entre muchos de los factores de riesgo y el desarrollo de cáncer de ovario no ha sido determinado. Existen algunas hipótesis propuestas:
*Las repetidas ovulaciones producen pequeños traumas en la corteza ovárica, lo cual conduce a la producción de clones anormales y a la transformación maligna. Lo que apoya esta hipótesis es que las mujeres con supresión periódica de la ovulación, como las usuarias de anticonceptivos orales, multíparas o con lactancia prolongada, tienen una menor incidencia de cáncer de ovario.
*La exposición persistente a gonadotrofinas y concentraciones elevadas de estradiol pueden ser carcinogénicas. Esta hipótesis se basa en la observación de tumores ováricos inducidos experimentalmente, portadores de receptores para gonadotrofina y estrógenos, en los que estas hormonas podrían estimular la proliferación celular.
*Hallazgos de pacientes sometidas a salpingo-ooforectomía profiláctica por mutaciones en el gen BRCA 1 y 2 demostraron una incidencia sorpresivamente alta de estadios iniciales de carcinoma de tipo seroso en las fimbrias de la trompa de Falopio. Por lo tanto, podría existir una analogía entre el carcinoma de ovario esporádico (90% de los casos) y las lesiones que comienzan en las trompas. De acuerdo con esta teoría, desde la trompa, de forma retrógrada, se derramarían sobre la superficie del ovario las células endometriales y tubáricas, desencadenando la secuencia de eventos para el desarrollo de cáncer de tipo epitelial seroso, endometroide y de células claras.
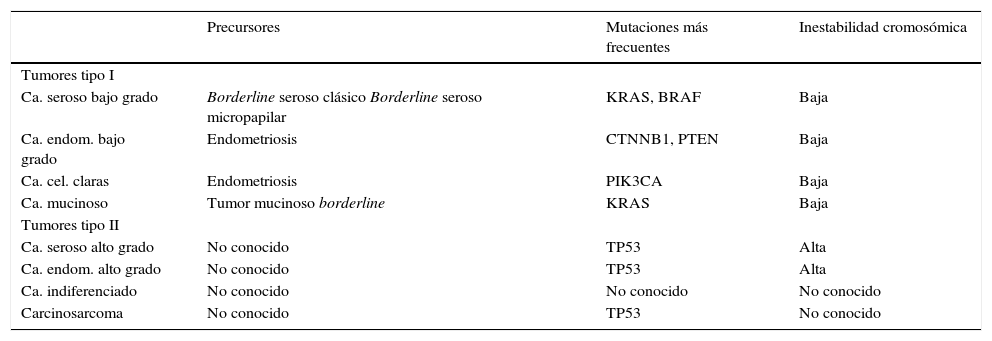
*Recientemente, basados en una extensa revisión de estudios clínico-patológicos y biomoleculares, se ha propuesto un nuevo modelo para el desarrollo de estos tumores. Según ciertos autores, se establecen dos categorías: los tumores de tipo I, que tienden a ser de bajo grado y se desarrollan paulatinamente a partir de tumores de bajo potencial de malignidad; y los tumores de tipo II, que son neoplasias de alto grado que se desarrollan de novo sin precursores identificables. Los tumores de tipo I incluyen carcinomas serosos de bajo grado, carcinomas mucinosos, endometroides, tumores de Brenner malignos y carcinomas de células claras. Los tumores de tipo II abarcan tumores serosos de alto grado, endometroides de alto grado, carcinosarcomas y carcinomas indiferenciados.
* Menarca temprana y/o menopausia tardía
* Nuligesta
* Esterilidad (los tratamientos que inducen la ovulación no parecen tener un incremento del riesgo, cuando se los compara con la población estéril no tratada)
* Endometriosis
* Síndrome de ovario poliquístico
* Terapia de reemplazo hormonal en la menopausia con estrógenos solos
* Factores genéticos (mutaciones en genes involucrados en la reparación del ADN, como BRCA, MSH-2, MLH-1 y PMS 1 y 2): se estima que entre el 10 y el 15% de los casos de cáncer epitelial de ovario (CEO) se debe a mutaciones en el gen BRCA o al síndrome de Lynch (estos casos se dan principalmente en mujeres jóvenes).
- ∘
Historia familiar de CEO: es clínicamente útil separar el riesgo genético en CEO familiar y hereditario. El familiar tiene un solo familiar con CEO y un 5% de riesgo, mientras que el hereditario tiene 2 o más familiares con CEO y una probabilidad del 25 al 50% de desarrollarlo a lo largo de la vida.
- ∘
Síndrome de cáncer de mama-ovario (mutaciones en el gen BRCA): se calcula que las mutaciones en el BCRA 1 aumentan del 35 al 46% el riesgo de desarrollar cáncer de ovario a lo largo de la vida, mientras que las mutaciones en el BRCA 2 incrementan las probabilidades entre un 13 y 15%.
- ∘
Síndrome de Lynch tipo 2 (cáncer colorrectal hereditario no asociado a poliposis HNPCC): la predisposición al cáncer se debe a mutaciones en los genes MSH-2, MLH-1, MSH-6, hPMS-2. Se asocia con otros cánceres primarios, en particular con el de endometrio, el de ovario, el urogenital y el gastrointestinal; hay un riesgo del 9 al 12% de desarrollar cáncer de ovario.
- ∘
Otros factores genéticos: anemia de Fanconi, síndrome Li-Fraumeni o síndrome de Cowden.
- ∘
Asesoramiento genético: existen actualmente profesionales dedicados al asesoramiento genético. Sirve para orientar a aquellas pacientes que lo solicitan, sobre todo en casos de mujeres judías azquenazi con antecedentes de cáncer de ovario o mama en sus familiares.
* Factores ambientales:
- ∘
Obesidad: existe una asociación estadísticamente significativa entre la obesidad y el riesgo de cáncer.
- ∘
Consumo de cigarrillo: fumadoras actuales o exfumadoras parecen tener un riesgo incrementado de cáncer de ovario mucinoso, pero no de otros tipos de CEO.
- ∘
* Uso de anticonceptivos orales durante 5 años o más
* Multiparidad
* Ligadura tubaria
* Salpingectomía
* Lactancia prolongada
* Vitamina D (su deficiencia podría estar asociada con un aumento del riesgo de cáncer)
El 75% de las pacientes con CEO son diagnosticadas cuando la enfermedad se ha extendido a través de la cavidad abdómino-pelviana o a distancia. La detección de tumores en los primeros estadios, mientras este se encuentra confinado a la pelvis, suele ser incidental durante un examen ginecológico efectuado por rutina o un estudio por imagen indicado por algún otro motivo. Menos frecuentemente se presenta con síntomas inespecíficos:
* Dolor pelviano
* Metrorragia disfuncional
* Dispareunia
* Urgencia miccional
* Síntomas gastrointestinales inespecíficos
Cabe recordar que, en las mujeres en edad fértil, solo el 5% de las masas ováricas palpables corresponde a un cáncer de ovario. En la premenarca y posmenopausia la presencia de una masa en los anexos obliga a profundizar el estudio, ya que la asociación con enfermedad maligna en estas circunstancias es mucho más frecuente.
Examen físicoEs primordial la realización de un examen físico completo y minucioso. Se debe evaluar, mediante tacto pélvico bimanual y rectal, las características de la masa pélvica, el tamaño, la solidez, la bilateralidad, la fijación a la pelvis, y descartar una masa en el recto. También se deben evaluar las regiones inguinales, el resto del abdomen y el tórax para descartar derrame pleural.
ImágenesEcografía transvaginal- •
Como fue previamente mencionado en el “Consenso de Masa Anexial”, la ecografía es el primer examen por imágenes para caracterizar una masa anexial. Cuando esta muestra características indeterminadas, se puede recurrir a la resonancia magnética (RM) por su gran caracterización tisular.
- •
Ante la sospecha de malignidad, el estudio de evaluación inicial prequirúrgica es la tomografía computada (TC).
- •
La TC es la modalidad diagnóstica de elección para la evaluación inicial prequirúrgica y seguimiento del cáncer de ovario. Permite al cirujano una mejor planificación quirúrgica, al poder identificar los sitios comprometidos y diferenciar la enfermedad resecable de la no resecable.
- •
Debe solicitarse TC de tórax, abdomen y pelvis con contraste oral y endovenoso, de no mediar contraindicaciones (los contrastes son yodados). Los equipos de última generación de múltiples detectores (multicorte) permiten realizar reconstrucciones volumétricas y multiplanares con una resolución óptima, y son preferibles a los equipos helicoidales simples cuando están disponibles.
- •
No es superior a la TC en la evaluación inicial prequirúrgica y, por lo tanto, no está indicada en esta instancia.
- •
Por su gran caracterización tisular es una excelente modalidad diagnóstica para evaluar la relación del tumor con los órganos adyacentes y la pared pelviana. Puede solicitarse con el objetivo de responder preguntas puntuales para una mejor planificación quirúrgica.
- •
Evaluación gastrointestinal: se debería solicitar una videocolonoscopia o una endoscopia digestiva alta ante la sospecha de cáncer de origen intestinal o gástrico (tumor de Krukenberg), ya que el ovario es un sitio de metástasis frecuente de estos tumores.
- •
Mamografía bilateral: los ovarios también pueden ser sitios de metástasis del cáncer de mama, o existe la posibilidad de estar ante la presencia de un síndrome de cáncer de mama-ovario.
- ∘
CA 125: se encuentra elevado (> 35 UI/ml) en la mayoría de las mujeres con CEO avanzado. La sensibilidad de este marcador es baja para el estadio I (50%), pero para estadios II o mayores es del 90%. La sensibilidad es alta para tumores epiteliales de tipo seroso y baja para los mucinosos. El CA 125 posee baja especificidad, debido a que puede estar elevado en otras patologías malignas, benignas o situaciones fisiológicas. Entre las malignas, se mencionan el cáncer de endometrio o páncreas, mientras que dentro de las benignas se encuentran la endometriosis, la miomatosis y la enfermedad pélvica inflamatoria (a la vez que los valores no superan los 100 a 200 UI/ml). La menstruación y el embarazo son condiciones que pueden elevar este marcador, al igual que en el 1% de las mujeres sanas.
- ∘
El marcador HE4 (Human Epididymis Protein), de mayor sensibilidad y especificidad para CEO, no asciende en procesos tumorales benignos o infecciosos, ni en situaciones fisiológicas (embarazo, menstruación). Es positivo en estadios iniciales (I-II), en tumores serosos, endometroides y de células claras. Su nivel normal es de 90 a 150pmol/l. En poco tiempo estará disponible para su uso en nuestro país. Su resultado es falso positivo en pacientes con insuficiencia renal y valores de creatinina mayores de 1,5mg/dl
La clasificación utilizada actualmente es la de la Organización Mundial de la Salud (WHO) del año 2002, que divide a los tumores del ovario en siete grandes grupos:
- 1.
Tumores superficiales epitelio-estromales
- 2.
Tumores del estroma gonadal-cordón sexual
- 3.
Tumores germinales
- 4.
Tumores de la rete ovarii
- 5.
Tumores misceláneos
- 6.
Tumores linfoides
- 7.
Tumores secundarios
El grupo de tumores superficiales epitelio-estromales comprende los siguientes tumores:
- 1.
Tumores serosos
- 2.
Tumores mucinosos
- 3.
Tumores endometroides
- 4.
Tumores de células claras
- 5.
Tumores de células transicionales
- 6.
Tumores epiteliales mixtos
- 7.
Tumores indiferenciados o inclasificados
Todos los tumores epiteliales pueden presentarse macroscópicamente como quísticos, sólido–quísticos (cistoadenofibromas) o con proliferaciones en la superficie del ovario.
Tumores serosos malignosActualmente se los divide en dos categorías: la primera incluye tumores serosos borderline (clásico y micropapilar), carcinomas serosos con microinvasión y carcinomas serosos de bajo grado; mientras que la segunda corresponde a los carcinomas serosos de alto grado. Esta división se debe a que son dos tipos de enfermedades diferentes, con distinta evolución, tratamiento y pronóstico.
*Tumores serosos borderline
Macroscopía: son tumores quísticos con número variable de excrecencias papilares en la superficie o intraquísticas; también pueden formar una proliferación papilar exclusivamente en la superficie externa del ovario. No se observa necrosis o hemorragia.
Histopatología: proliferación epitelial que forma papilas ramificadas (con eje estromal edematoso) y micropapilas asociadas con grupos celulares “desprendidos” hacia la luz del quiste. Atipia citológica de leve a moderada. Índice mitótico variable. Puede haber cuerpos de psammoma.
-Variantes:
- ∘
Tipo clásico (90% de los casos)
- ∘
Tipo micropapilar o cribiforme (5-14% de los casos): proliferación focal de micropapilas elongadas (longitud 5 veces mayor que el diámetro) que nacen directamente del revestimiento de la pared del quiste, o de grandes papilas. Para denominarlo de este modo debe tener un tamaño de 5mm o más, o corresponder al 10% de la proliferación como mínimo. Esta variante se asocia con mayor frecuencia a implantes especialmente invasores, de pobre respuesta a la quimioterapia y peor pronóstico que los clásicos. Cuando se presenta en estadio I tiene 100% de sobrevida, pero cuando se presenta en estadio II esta es de 75-85% a los 5 años y de 40-60% a los 10 años, considerándolos carcinomas serosos de bajo grado. Ambos tipos histológicos se unifican al evaluar comportamiento y tratamiento porque se caracterizan por crecimiento indolente, resistencia a la quimioterapia y recurrencias que pueden presentarse luego de varias décadas del diagnóstico inicial. Existen raras excepciones donde se ha demostrado transformación hacia carcinoma seroso de alto grado.
*Tumores borderline e implantes:
- •
No invasivos:
- ∘
Epiteliales
- ∘
Desmoplásicos
- ∘
- •
Invasivos
Para la correcta evaluación del tipo de implante es imprescindible que la muestra incluya tejido subyacente.
La clasificación de un tumor seroso ovárico como borderline depende de las características del tumor en el ovario y es independiente de la presencia y tipo de implantes.
En los estadios II al IV, el tipo de implante (invasor – no invasor) es el factor pronóstico más importante. Se considera a los implantes invasores, morfológica y biológicamente, focos de carcinoma invasor de bajo grado de localización extraovárica.
*Tumor seroso borderline con microinvasión
Definición: presencia en el estroma de uno o más focos de microinvasión que no exceden los 5mm lineales o los 10 mm2 por área. La microinvasión suele encontrarse en el 10% de los casos. Histológicamente existen 3 formas de microinvasión:
- ∘
Infiltración por pequeños grupos de células o células aisladas
- ∘
Infiltración por grupos celulares con un espacio claro alrededor (micropapilar)
- ∘
Papilas con eje conectivo vascular, revestidas por células epiteliales y espacio claro alrededor (macropapilar)
Si bien la microinvasión se asocia con un incremento de las recidivas a largo plazo, esto no habilita considerarlos carcinomas.
*Carcinomas serosos
Se recomienda dividirlos en carcinomas serosos de bajo y alto grado, correspondiendo a dos entidades distintas. Solo el 10% de los carcinomas serosos corresponde a tumores de bajo grado, siendo la mayoría (90%) carcinomas de alto grado.
- ∘
Carcinoma seroso de bajo grado:
Se caracteriza por la presencia de células uniformes de leve a moderada atipia nuclear y menos de 12 mitosis por 10 campos de alto poder.
Macroscopía: son semejantes al tumor seroso borderline, con áreas más sólidas y a veces áreas calcificadas. Cuando las microcalcificaciones son muy abundantes debe considerarse el diagnóstico de psammocarcinoma. Se caracterizan por proliferación epitelial en forma de nidos pequeños con formación masiva de cuerpos de psammoma (> 75%) y caracteres citológicos de bajo grado (grado nuclear 1 -GN1-).
Microscopía: se diferencia del tumor seroso borderline por la invasión destructiva del estroma. La clasificación de los implantes no se usa para los carcinomas serosos de bajo grado.
Relación de los carcinomas serosos de bajo grado con los tumores serosos borderline: se cree que los carcinomas serosos de bajo grado provienen de tumores serosos borderline, ya que estos son observados en el mismo tumor y en las recidivas.
- ∘
Carcinomas serosos de alto grado:
Se caracterizan por la presencia de células pleomórficas con marcada atipia nuclear y más de 12 mitosis por campo de alto poder.
Los precursores del carcinoma seroso de alto grado no han sido bien identificados. Se ha propuesto que se desarrollarían de novo a partir del epitelio superficial ovárico o de quistes de inclusión.
Macroscopía: tamaño variable; bilateralidad (2/3 de los casos); diferente proporción de áreas quísticas y sólidas, con papilas blandas y confluentes; puede haber necrosis y hemorragia; raramente están confinados a la superficie ovárica (adenocarcinoma papilar superficial).
Histopatología: presencia y proporción variable de áreas papilares, glandulares y sólidas; glándulas irregulares o tipo hendidura; papilas irregularmente ramificadas y ricamente celulares, y cuerpos de psammoma presentes en proporción variable. Estroma escaso a desmoplásico; ocasionalmente áreas mixoides. Puede haber otros tipos celulares que no modifican el diagnóstico si no superan el 10%. Son siempre de alto grado nuclear (GN3).
Corresponde al 10% de las proliferaciones serosas. Se presenta en estadios avanzados, con ovarios de tamaño normal o con compromiso superficial. Los criterios para distinguir esta entidad fueron propuestos por el GOG, siendo principalmente un compromiso del ovario no mayor de 5 x 5mm.
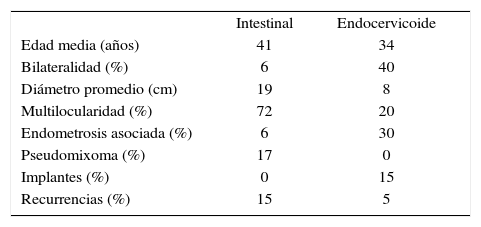
Tumores mucinososRepresentan del 12 al 15% de todos los tumores ováricos. El 75% de ellos es benigno, el 10% borderline y el 15% malignos. Aparecen entre la 3.a y la 6.a década de vida.
*Tumor mucinoso borderline
En esta categoría es fundamental dividirlos en los subtipos endocervicoide o mulleriano (15%) e intestinal (85%). Son dos entidades con distinta forma de presentación y distinto pronóstico.
Cuando un tumor presenta características de borderline hasta en un 10% del volumen tumoral se los llama proliferante focal y el pronóstico es igual al benigno.
Microscopía:
- -
Tipo endocervicoide: estratificación celular (no interesa el número de hileras celulares), atipia citológica de leve a moderada, aisladas mitosis.
- -
Tipo intestinal: quistes revestidos por epitelio mucinoso estratificado (hasta 4 hileras celulares), papilas con penachos epiteliales sueltos y ocasionales cribas.
El criterio histológico fundamental para hacer el diagnóstico diferencial con el tumor mucinoso maligno es la ausencia de invasión estromal destructiva.
*Carcinoma mucinoso intraepitelial
En los tumores mucinosos borderline de tipo intestinal, la presencia de atipia citológica severa (grado 3) es considerada como criterio de carcinoma intraepitelial. Algunos autores sostienen que un patrón arquitectural intraglandular complejo también es criterio suficiente para el diagnóstico de esta lesión, independientemente de la atipia citológica.
*Tumor mucinoso borderline con microinvasión
Un bajo porcentaje de los tumores mucinosos borderline de tipo intestinal pueden contener uno o más focos de microinvasión (3 x 3mm o menos de 10 mm2). Su presencia no modifica el pronóstico.
* Carcinomas mucinosos
Son menos del 10% de todos los tumores epiteliales ováricos. Predominan en la edad reproductiva (45 años). Ante la presencia de un carcinoma mucinoso, pierde relevancia la diferenciación entre los subtipos endocervicoide e intestinal.
Macroscopía: habitualmente voluminosos, multiquísticos, con abundante contenido de aspecto gelatinoso. Un muestreo adecuado en este tipo tumoral (1 a 2 tacos por cm de diámetro tumoral) es mandatorio, debido a la frecuente coexistencia en un mismo tumor de áreas benignas, borderline y malignas. Este hallazgo favorece el origen primario de esta estirpe tumoral.
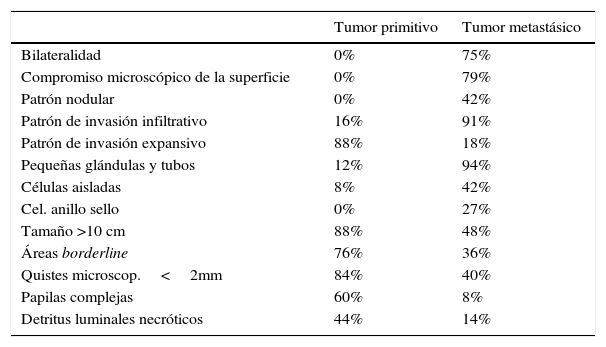
Microscopía: los tumores mucinosos malignos son muy poco frecuentes y en general unilaterales. Se reconocen áreas borderline y otras francamente carcinomatosas. En estas áreas carcinomatosas es muy importante el tipo de invasión, que puede ser confluente o expansiva (mejor pronóstico) o destructiva, que es menos frecuente con mayor atipia citológica y peor pronóstico, siendo discutible el valor pronóstico del grado de diferenciación. Es conveniente en estos casos descartar un tumor metastásico, especialmente si hay compromiso bilateral. Ante un tumor mucinoso ovárico asociado con pseudomixoma ovárico o peritoneal, es importante descartar un tumor mucinoso en otra localización (apéndice cecal, tracto gastrointestinal).
El pseudomixoma peritoneal es una ascitis mucinosa, copiosa con o sin distensión abdominal. Empeora el pronóstico y lleva al óbito a largo plazo. Siempre debe extirparse el apéndice independientemente de su aspecto macroscópico. Cuando se encuentra pseudomixoma peritoneal, se considera que el compromiso ovárico es secundario.
Criterios macro y microscópicos para el diagnóstico diferencial entre tumor mucinoso primitivo y metastásico
| Tumor primitivo | Tumor metastásico | |
|---|---|---|
| Bilateralidad | 0% | 75% |
| Compromiso microscópico de la superficie | 0% | 79% |
| Patrón nodular | 0% | 42% |
| Patrón de invasión infiltrativo | 16% | 91% |
| Patrón de invasión expansivo | 88% | 18% |
| Pequeñas glándulas y tubos | 12% | 94% |
| Células aisladas | 8% | 42% |
| Cel. anillo sello | 0% | 27% |
| Tamaño >10 cm | 88% | 48% |
| Áreas borderline | 76% | 36% |
| Quistes microscop.<2mm | 84% | 40% |
| Papilas complejas | 60% | 8% |
| Detritus luminales necróticos | 44% | 14% |
Representan el 10% de los carcinomas ováricos, su variante borderline es muy poco frecuente e histológicamente remeda a la hiperplasia atípica endometrial.
*Tumor endometrioide borderline
Se halla constituido por glándulas o quistes de tipo endometrioide maligno, en un estroma fibromatoso sin invasión del estroma. Histológicamente recuerdan una hiperplasia endometrial atípica o carcinoma de bajo grado. También se refiere a un patrón papilar o cribiforme en un área > 5mm no interrumpida por estroma.
*Tumor endometrioide maligno
Se presenta con mayor frecuencia en estadio I (50%). Se postula que estos tumores malignos presentarían una progresión, desde la endometriosis, pasando por la endometriosis atípica y los tumores borderline hasta llegar a los carcinomas, a través de una mutación temprana del gen KRAS.
El carcinoma endometrioide suele acompañarse de componente adenofibromatoso o endometriosis. Remeda al carcinoma endometrial usual. La presencia de diferenciación escamosa apoya el diagnóstico. El grado se determina en forma similar a los grados de la FIGO, utilizados para el carcinoma endometrial de tipo endometrioide.
Están descritas variantes inusuales que remedan los tumores del cordón sexual, tipo basaloide, secretorio, oxifílico, ciliado y rico en mucina.
Las alteraciones genéticas encontradas en estos tumores son: genes supresores de tumores (PTEN, p53), genes que reparan el ADN (MSH2, MSH6, MLH1, MLH3) y oncogenes (K-RAS, CTNNB1/β-catenina).
Tumores de células claras*Tumores de células claras borderline
Son muy poco frecuentes (0,2% de los tumores epiteliales del ovario) y similares a los adenofibromas con glándulas más ramificadas que presentan proliferación y atipia epitelial.
*Carcinoma de células claras
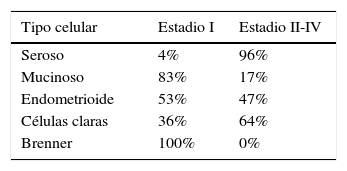
Corresponden al 5% de los carcinomas ováricos. La mayoría se presenta en estadios I y II. El 25% de todos los CEO en estadio I y II es de células claras. La importancia del diagnóstico diferencial con los carcinomas serosos radica en su diferente respuesta al platino.
Tienen alta asociación con endometriosis y su génesis sería similar a la de los carcinomas endometrioides ováricos. Presentan numerosos patrones de crecimiento: tubuloquístico, revestido por células claras ricas en glucógeno; papilar con células en tachuela; difuso, con células planas o cuboidales; trabecular, con células oxifílicas; y reticular, con células en anillo de sello.
El estudio del genotipo ha demostrado mutación de los genes PTEN y K-RAS e inestabilidad microsatelital (alteración de genes reparadores del ADN).
Tumores de células transicionalesPor convención el tumor de células transicionales maligno difiere del tumor de Brenner maligno porque en este último se reconocen elementos benignos y borderline.
*Tumores de Brenner borderline
Habitualmente son sólido-quísticos y casi invariablemente unilaterales. Histológicamente tienen componente de tumor de Brenner benigno, con componente proliferativo a manera de grandes papilas revestidas por epitelio transicional atípico, en general como el carcinoma transicional de bajo grado de vejiga.
*Tumores de Brenner maligno
También son sólidos y quísticos, y hasta en un 12% bilaterales. El componente invasor en general corresponde a un carcinoma transicional grado 2 o de alto grado.
*Carcinomas de células transicionales
Pueden ser bilaterales en un 15%. Histológicamente no hay componente de tumor de Brenner benigno o borderline. Se constituyen por anchas papilas con bordes luminales lisos, que rellenan espacios quísticos (tipo papilar). A veces se disponen en nidos transicionales en un estroma fibromatoso (tipo fibroepitelial). El tipo papilar es más frecuente. Habitualmente presentan marcada atipia citológica, nucléolos prominentes (69%), hendiduras nucleares (48%) y presencia de células gigantes bizarras. Suelen asociarse con carcinoma seroso o endometrioide.
Carcinomas indiferenciadosPor definición son carcinomas de alto grado. La sobrevida a 5 años de las pacientes con carcinomas indiferenciados es peor que con carcinomas serosos o transicionales.
Precursores y patrones moleculares de los tumores epiteliales ováricos
| Precursores | Mutaciones más frecuentes | Inestabilidad cromosómica | |
|---|---|---|---|
| Tumores tipo I | |||
| Ca. seroso bajo grado | Borderline seroso clásico Borderline seroso micropapilar | KRAS, BRAF | Baja |
| Ca. endom. bajo grado | Endometriosis | CTNNB1, PTEN | Baja |
| Ca. cel. claras | Endometriosis | PIK3CA | Baja |
| Ca. mucinoso | Tumor mucinoso borderline | KRAS | Baja |
| Tumores tipo II | |||
| Ca. seroso alto grado | No conocido | TP53 | Alta |
| Ca. endom. alto grado | No conocido | TP53 | Alta |
| Ca. indiferenciado | No conocido | No conocido | No conocido |
| Carcinosarcoma | No conocido | TP53 | No conocido |
Fuente: Kurman RJ, Shih leM. The origin and pathogenesis of epithelial ovarian cancer: a proposed unifying theory. Am J Surg Pathol. 2010;34:433-43.
Cuando estamos frente a un tumor de ovario, primero debemos definir si es primitivo o metastásico. En ocasiones se hace muy dificultosa dicha tarea. Si es primitivo, debemos tratar de determinar el tipo histológico: epitelial o no epitelial, y dentro del epitelial si es borderline o maligno. La macroscopía es fundamental.
Si es un tumor bilateral de tamaño mediano y con superficies lobuladas, hay que descartar un origen metastásico, ya sea ginecológico (endometrial, trompa, cérvix) o no ginecológico (intestinal, Krukenberg, mama y linfoma).
Biopsia intraoperatoria de los tumores epiteliales de bajo potencial (borderline)Sensibilidad global: 44-65%. Los tumores voluminosos (más de 10cm) de tipo mucinoso tienen mayores errores diagnósticos.
Sensibilidad: serosos 64,3% vs. mucinosos 30,8% (debido a mayor tamaño y mezcla de áreas benignas, borderline y malignas en estos últimos). Del 20 al 30% puede presentar invasión en el estudio diferido.
Informe de la biopsia intraoperatoria: posibles diagnósticos
- ∘
Maligno
- ∘
Benigno, no se descarta borderline
- ∘
Borderline
- ∘
Borderline, no se descarta maligno
- ∘
Diferido
El estudio intraoperatorio con cortes por congelación puede confirmar enfermedad maligna, pero no siempre permite definir proliferación borderline. El cirujano debe estar al tanto de estas limitaciones. No hay evidencia de que se pueda establecer el grado histológico de una lesión en cortes por congelación.
Tratamiento. EstadificaciónCirugía primariaEs la que se realiza en una paciente virgen de tratamiento. Tiene tres objetivos fundamentales:
- -
Confirmar el diagnóstico de sospecha de cáncer.
- -
Efectuar una correcta estadificación.
- -
Dejar la menor cantidad posible de enfermedad residual (citorreducción).
Concepto de enfermedad residual:
- -
Citorreducción completa: ausencia de tumor macroscópico, luego de la cirugía primaria.
- -
Citorreducción óptima: enfermedad residual menor de 1cm.
- -
Citorreducción subóptima: enfermedad residual mayor de 1cm.
Antes de realizar la cirugía, se efectuará una evaluación completa del riesgo quirúrgico, cobertura antibiótica, preparación intestinal por eventual resección y heparinización profiláctica.
Incisión mediana infraumbilical. Abierto el peritoneo, de encontrarse líquido ascítico se extrae para estudio citológico; y si no hay, se procede con el mismo fin al lavado peritoneal. Esto se realiza lavando con solución fisiológica la pelvis, las goteras paracólicas derecha e izquierda y las zonas subdiafragmáticas derecha e izquierda. El líquido obtenido luego del lavado se extrae para ser remitido inmediatamente para su estudio citológico o se refrigera hasta su envío. De no ser posible ninguna de las opciones anteriores, debe mezclarse con igual cantidad de alcohol (al 96%) para su estudio ulterior.
A continuación, se procede a la exéresis del tumor (quistectomía, ooforectomía o anexectomía, según el hallazgo macroscópico). Si la biopsia por congelación confirma la malignidad, la incisión debe transformarse en xifopubiana.
Se procede a inspeccionar la pelvis, el abdomen en forma completa, incluyendo las cúpulas diafragmáticas, la cara superior del hígado, las masas anexiales, la superficie peritoneal en su totalidad, en busca de tejido neoplásico sobre las adherencias y/o la superficie intestinal. Se debe realizar biopsia de todo tejido sospechoso. En los casos que haya aparentes estadios iniciales, además se deberá efectuar biopsias al azar, tomadas del fondo de saco de Douglas, la serosa vesical y rectal, la serosa de las paredes pelvianas izquierda y derecha, y en ambas goteras paracólicas.
El objetivo final, de ser posible, es extirpar las masas tumorales en forma completa. Esto incluye la histerectomía total con la salpingo-ooforectomía bilateral, la omentectomía infra y/o supracolónica, la resección completa de nódulos metastásicos peritoneales pelvianos y la linfadenectomía pelviana y paraaórtica bilateral sistemática extendida hasta las venas renales.Los territorios ganglionares involucrados en la linfadenectomía sistemática son:
- -
Pelvianos: ilíacos primitivos, ilíacos externos y obturatrices.
- -
Paraaórticos: laterocavos, intercavoaórticos, precavos, preaórticos, lateroaórticos hasta las venas renales, especialmente del lado izquierdo.
La resección del apéndice debe realizarse en los tumores mucinosos y es discutida en el resto.
Estadificación FIGO| Estadio I | a: Tumor limitado a un ovario, cápsula íntegra, sin crecimiento superficial, lavado peritoneal/ascitis negativos. |
| b: Tumor de los dos ovarios, con cápsula integra, sin crecimiento superficial y lavado peritoneal/ascitis negativos | |
| c: Tumor Ia o Ib con cápsula rota, o con crecimiento superficial en uno o ambos ovarios, o con lavado peritoneal/ascitis positivos | |
| Estadio II | a: Extensión tumoral y/o implantes en útero y/o trompas, y lavado peritoneal/ascitis negativos |
| b: Extensión a otros tejidos pelvianos, y lavado peritoneal/ascitis negativos | |
| c: Tumor IIa o IIb con ascitis/lavado peritoneal positivos |
Cuando se obtiene el diagnóstico de malignidad en el posoperatorio a través del informe de la anatomía patológica diferida, se debe reintervenir a la paciente para efectuar una correcta y completa estadificación y tratamiento.
Cirugía conservadora para preservar la fertilidad
En mujeres jóvenes (hasta 40 años) con deseo de procrear puede efectuarse una cirugía conservadora, que deberá ser llevada a cabo por un cirujano entrenado en ginecología oncológica, siempre que se cumplan las siguientes condiciones:
- 1.
Consentimiento informado, solicitando la cirugía conservadora
- 2.
Evaluación endometrial
- 3.
Debe existir compromiso ovárico unilateral en tumores bien diferenciados. Otros casos, deberán analizarse en forma individualizada.
- 1.
Lavado peritoneal
- 2.
Anexectomía y exéresis de 5cm de pedículo infundíbulo-pelviano.
- 3.
Evaluación palpatoria y visual del ovario contralateral
- 4.
Estadificación completa
No se recomienda la biopsia contralateral del ovario, ya que de por sí se la considera causa de esterilidad.
Tumor borderlineLa cirugía es el principal tratamiento en cualquier estadio. Se debe realizar una cirugía de estadificación quirúrgica, igual que en los tumores invasores con citorreducción completa, excepto la linfadectomía sistemática. Esta última se reserva solo para aquellos casos en que la biopsia por congelación no descarta mayor patología. Dado que suelen aparecer en mujeres más jóvenes, se recomienda considerar un tratamiento conservador de la fertilidad. No hay evidencia de que la cirugía conservadora (anexectomía) en estadio I tenga un efecto perjudicial en la supervivencia; sin embargo, tendrán mayor índice de recidiva que aquellas pacientes tratadas con anexohisterectomía total. En casos muy especiales (por ejemplo: ausencia de ovario contralateral), se puede considerar la realización de una quistectomía como tratamiento conservador. En la variedad mucinosa, al igual que en los tumores invasores, se debe completar la cirugía con la realización de una apendicectomía.
Tratamiento adyuvanteQuimioterapia en estadios iniciales de cáncer de ovario (estadios I y II)Pacientes con cáncer de ovario de bajo riesgo:
Son aquellas pacientes con enfermedad confinada a uno o ambos ovarios, con histología bien o moderadamente diferenciada (G1-G2), cápsula intacta, sin tumor extracapsular ni ascitis, y con lavado peritoneal negativo. Estos casos son catalogados como estadios Ia–b, G1-2. En este grupo, la sobrevida es mayor al 90%. Estas pacientes deberán ser observadas sin tratamiento adyuvante.
Pacientes con cáncer de ovario de alto riesgo:
Son las que presentan cualquiera de los siguientes factores de riesgo:
- 1.
G3
- 2.
Estadios Ic o II
- 3.
Histología de células claras
En ellas el riesgo de recidiva está en el orden del 30-40% y el riesgo de muerte entre 25-30%. Estas pacientes deben recibir quimioterapia adyuvante, siendo el esquema a utilizar 6 ciclos de paclitaxel - cisplatino o paclitaxel - carboplatino.
SeguimientoLas pacientes tratadas por un carcinoma de ovario serán controladas cada 3 meses, durante los dos primeros años después de su terapéutica inicial. Luego, el período se extenderá a 6 meses hasta los 5 años, para finalmente pasar a ser anual. En cada control se efectuará examen físico, examen ginecológico completo, análisis de rutina y dosaje del marcador específico (optativo). Los estudios por imágenes de mayor complejidad (TC) se solicitarán anualmente o ante la sospecha de recurrencia. Se realizará examen mamario cada 6 meses con mamografía anual.
El seguimiento intensivo no ha mostrado utilidad para mejorar la supervivencia global. Es de indicación precisa en aquellos casos de cirugía conservadora de la fertilidad.
Rol del estudio PET/TC con FDG: se ha sugerido su utilidad en aquellas pacientes asintomáticas con aumento del marcador y sin evidencia de hallazgos patológicos en estudios convencionales y en la evaluación de la estrategia quirúrgica para la citorreducción de la recurrencia.
Sección general
Anchezar JP, Sardi J, Soderini A. Long-term follow-up results of fertility sparing surgery in patients with epithelial ovarian cancer. J Surg Oncol. 2009;100:55-8.
Ayhan A, Celik H, Taskiran C, Bozdag G, Aksu T. Oncologic and reproductive outcome after fertility-saving surgery in ovarian cancer. Eur J Gynecol Oncol. 2003;24:223-32.
Barakat RR, Markman M, Randall ME, eds. Principles and Practice of Gynecologic Oncology. Philadelphia: Lippincott Williams & Wilkins; 2009:763-836.
Barnhill DR, Kurman RJ, Brady MF, Omura GA, Yordan E, Given FT, et al. Preliminary analysis of the behavior of stage I ovarian serous tumors of low malignant potential: a Gynecologic Oncology Group study. J Clin Oncol. 1995;13:2752-6.
Berek J, Hacker NF. Ginecología oncológica práctica. México DF: McGraw Hill; 2006:220-310.
30. Berek JS. Epithelial ovarian cancer. En: Berek JS, Hacker NF, eds. Practical Gynecologic Oncology. Philadelphia: Lippincott Williams & Wilkins; 2005:443.
Boyd J. Specific keynote: hereditary ovarian cancer: what we know. Gynecol Oncol. 2003;88:S8-10.
Brown AK, Miller C, Robison K, Somers E, Allard J, Granai CO, et al. Differential expression of CA125 and a novel serum tumor marker HE4 in epithelial ovarian cancer (abstract 5533). J Clin Oncol. 2008;26:301s.
Cannistra SA. Cancer of the ovary. N Engl J Med. 2004;351:2519-29.
Casagrande JT, Louie EW, Pike MC, Roy S, Ross RK, Henderson BE. “Incessant ovulation” and ovarian cancer. Lancet. 1979;2:170-3.
FIGO Committee on Gynecologic Oncology. Current FIGO staging for cancer of the vagina, fallopian tube, ovary, and gestational trophoblastic neoplasia. Int J Gynaecol Obstet. 2009;105:3-4.
Gallup DG, Talledo OE. Management of the adnexal mass in 1990s. South Med J. 1997;90:972-81.
Giede KC, Kieser K, Dodge J, Rosen B. Who should operate on patients with ovarian cancer? An evidence-based review. Gynecol Oncol. 2005; 99:447-61.
Gilliland R, Gill PJ. Incidence and prognosis of Krukenberg tumour in Northern Ireland. Br J Surg. 1992;79:1364-6.
Goff BA, Mandel L, Muntz HG, Melancon CH. Ovarian cancer diagnosis. Cancer. 2000;89:2068-75.
Havrilesky LJ, Whitehead CM, Rubatt JM, Cheek RL, Groelke J, He Q, et al. Evaluation of biomarker panels for early stage ovarian cancer detection and monitoring for disease recurrence.
Gynecol Oncol. 2008; 110:374-82.
Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90.
Koonings PP, Campbell K, Mishell DR Jr, Grimes DA. Relative frequency of primary ovarian neoplasms: a 10-year review. Obstet Gynecol. 1989;74:921-6.
Kurman RJ, Shih leM. The origin and pathogenesis of epithelial ovarian cancer: a proposed unifying theory. Am J Surg Pathol. 2010;34:433-43.
Leake JF, Currie JL, Rosenshein NB, Woodruff JD. Long-term follow-up of serous ovarian tumors of low malignant potential. Gynecol Oncol. 1992;47:150-8.
Levanon K, Crum C, Drapkin R. New insights into the pathogenesis of serous ovarian cancer and its clinical impact. J Clin Oncol. 2008;26:5284-93.
Lurie G, Thompson P, McDuffie KE, Carney ME, Terada KY, Goodman MT. Association of estrogen and progestin potency of oral contraceptives with ovarian carcinoma risk. Obstet Gynecol. 2007;109:597-607.
Markman M. Management of ovarian cancer. An impressive history of improvement in survival and quality of life. Oncology (Williston Park). 2006;20:347-54;discussion 354, 357-8, 364 passim.
Medeiros F, Muto MG, Lee Y, Elvin JA, Callahan MJ, Feltmate C, et al. The tubal fimbria is a preferred site for early adenocarcinoma in women with familial ovarian cancer syndrome. Am J Surg Pathol. 2006;30:230-6.
Morgan RJ Jr, Alvarez RD, Armstrong DK, Burger RA, Castells M, Chen LM, et al. Clinical. Ovarian cancer. Version 3. 2012. J Natl Compr Canc Netw. 2012;10:1339-49.
Musto A, Rampin L, Nanni C, Marzola MC, Fanti S, Rubello D. Present and future of PET and PET/CT in gynaecologic malignancies. Eur J Radiol. 2011;78:12-20.
Ness RB, Cramer DW, Goodman MT, Kjaer SK, Mallin K, Mosgaard BJ, et al. Infertility, fertility drugs, and ovarian cancer: a pooled analysis of case-control studies. Am J Epidemiol. 2002;155:217-24.
Ozols RF, Rubin SC, Thomas G. Chapter 32. En: Hoskins WK, ed. Principles and practice of gynecologic oncology. Philadelphia: Lippincott Williams & Wilkins;1997:939-41.
Pal T, Permuth-Wey J, Betts JA, Krischer JP, Fiorica J, Arango H, et al. BRCA1 and BRCA2 mutations account for a large proportion of ovarian carcinoma cases. Cancer. 2005;104:2807-16.
Park JY, Kim DY, Suh DS, Kim JH, Kim YM, Kim YT, et al. Comparison of laparoscopy and laparotomy in surgical staging of early-stage ovarian and fallopian tubal cancer. Ann Surg Oncol. 2008; 15:2012-9.
Piek JM, van Diest PJ, Zweemer RP, Jansen JW, Poort-Keesom RJ, Menko FH, et al. Displastic changes en proprophylactically removed Fallopian tubes of women predisposed to developing ovarian cancer. J Pathol. 2001;195:451-6.
Risch HA. Hormonal etiology of epithelial ovarian cancer, with a hypothesis concerning the role of androgens and progesterone. J Natl Cancer Inst. 1998; 90:1774-86.
Rustin G, Vergote I, Eisenhauer E, Pujade-Lauraine E, Quinn M, Thigpen T, et al. Definitions for response and progression in ovarian cancer clinical trials incorporating RECIST 1.1 and CA 125 agreed by the Gynecological Cancer Intergroup (GCIG). Int J Gynecol Cancer. 2011;21:419-23.
Sardi J y col. Cáncer de ovario. En: Asociación Argentina de Ginecología Oncológica. Guías clínicas para el diagnóstico, tratamiento y seguimiento del cáncer genital femenino. Buenos Aires: Ascune; 2007.
Schutter EM, Sohn C, Kristen P, Möbus V, Crombach G, Kaufmann M, et al. Estimation of probability of malignancy using a logistic model combining physical examination, ultrasound, serum CA 125, and serum CA 72-4 in postmenopausal women with a pelvic mass: an international multicenter study. Gynecol Oncol. 1998;69:56-63.
Storey DJ, Rush R, Stewart M, Rye T, Al-Nafussi A, Williams AR, et al. Endometrioid epithelial ovarian cancer: 20 years of prospectively collected data from a single center. Cancer, 2008;112:2211-20.
Stuart GC, Kitchener H, Bacon M, duBois A, Friedlander M, Ledermann J, Marth C, et al., 2010 Gynecologic Cancer InterGroup (GCIG) consensus statement on clinical trials in ovarian cancer: report from the Fourth Ovarian Cancer Consensus Conference. Int J Gynecol Cancer. 2011;21:750-5.
Tropé C, Kaern J, Vergote IB, Kristensen G, Abeler V. Are borderline tumors of the ovary overtreated both surgically and systemically? A review of four prospective randomized trials including 253 patients with borderline tumors. Gynecol Oncol. 1993;51:236-43.
Tserkezoglou A, Kontou S, Hadjieleftheriou G, Apostolikas N, Vassilomanolakis M, Sikiotis K, et al. Primary and metastatic ovarian cancer in patients with prior breast carcinoma. Pre-operative markers and treatment results. Anticancer Res. 2006;26:2339-44.
van Nagell JR, Gershenson DM. Cáncer de ovario: etiología, screening y cirugía. En: Rock JA, Jones III HW, editores. Te Linde Ginecología Quirúrgica. Buenos Aires, Editorial Médica Panamericana; 2006:160139.
Vermorken JB, Parmar MK, Brady MF, Eisenhauer EA, Hogberg T, Ozols RF, et al. Clinical trials in ovarian carcinoma: study methodology. Ann Oncol. 2005;16 Suppl 8:viii20-viii29.
Wenzel LB, Huang HQ, Armstrong DK, Walker JL, Cella D; Gynecologic Oncology Group. Health-related quality of life during and after intraperitoneal versus intravenous chemotherapy for optimally debulked ovarian cancer: a Gynecologic Oncology Group Study. J Clin Oncol. 2007;25:437-43.
Whittemore AS, Harris R, Intyre J. Characteristics relating to ovarian cancer risk: collaborative analysis of 12 US case-control studies. II. Invasive epithelial ovarian cancers in white women. Collaborative Ovarian Cancer Group. Am J Epidemiol. 1992;136:1184-203.
Zanetta G, Bonazzi C, Cantú M Binidagger S, Locatelli A, Bratina G, et al. Survival and reproductive function after treatment of malignant germ cell ovarian tumors. J Clin Oncol. 2001;19:1015-20.
Imágenes
Morgan RJ Jr, Alvarez RD, Armstrong DK, Burger RA, Castells M, Chen LM, et al. Ovarian cancer, version 3.2012. J Natl Compr Canc Netw. 2012;10:1339-49.
Mohaghegh P, Rockall AG. Imaging: Strategy for early ovarian cancer: characterization of adnexal masses with conventional and advanced imaging techniques. Radiographics. 2012;32: 1751-73.
Patología
Bell KA, Smith Sehdev AE, Kurman RJ. Refined diagnostic criteria for implants associated with ovarian atypical proliferative serous tumors (borderline) and micropapillary serous carcinomas. Am J Surg Pathol. 2001;25:419-32
Bloss JD, Bradey MF, Liao SY, Rocereto T, Partridge EE, Clarke-Pearson DL, et al. Extraovarian peritoneal serous papillary carcinoma: a phase II trial of cisplatin and cyclophosphamide with comparation to a cohort with papillary serous ovarian carcinoma – a Gynecologic Oncology Group Study. Gynecol Oncol. 2003;89:148-54.
Deavers MT, Gershenson DM, Tortolero-Luna G, lpica A, Lu KH, Silva EG. Micropapillary and cribriform patters in ovarian serous tumors of low malignant potential: a study of 99 advanced stage cases. Am J Surg Pathol. 2002;26:1129-41.
Gilks CB, McKenney JK, Kalloger S et al. Interobserver variation in the assessment of extra-ovarian implants of serous borderline tumors (serous tumors of low malignant potential). Modern Pathol. 2005;8 (supplement1):184A (abstract).
Ji H, Isaacson C, Seidman JD, Kurman RJ, Ronnett BM. Cytokeratins 7 and 20, Dpc4, and MUC5AC in the distinction of metastatic mucinous carcinomas in the ovary from primary ovarian mucinous tumors: Dpc4 assists in identifying metastatic pancreatic carcinomas. Int J Gynecol Pathol. 2002;21:391-400.
Kurman RJ, Hedrick Ellenson L, Ronnet BM, eds. Blaustein's Pathology of the female genital tract. New York: Springer;2011.
Lee KR, Scully RE. Mucinous tumors of the ovary: a clinicopathologic study of 196 borderline tumors (of intestinal type) and carcinomas, including an evaluation of 11 cases with pseudomixoma peritonei. Am J Surg Pathol. 2000;24:1447-64.
Lee KR, Young RH. The distinction between primary and metastatic mucinous carcinomas of the ovary: gross and histologic findings in 50 cases. Am J Surg Pathol. 2003;27:281-92.
Malpica, Deavers MT, Lu K, Bodurka DC, Atkinson EN, Gershenson DM, et al. Grading ovarian serous carcinoma using a two-tier system. Am J Surg Pathol. 2004;28:496-504.
McCluggage WG. Immunohistochemical and functional biomarkers of value in female genital tract lesions. Int J Gynecol Pathol. 2006;25:101-20.
McKenney JK, Gilks CB, Longacre TA. Classification of extra-ovarian implants associated with ovarian serous tumors of low malignant potential (S-LMP): Clinicopathologic study of 181 cases. Modern Pathol. 2005;8 (suppl 1):195A.
Mittal K, Soslow R, McCluggage WG. Application of immunohistochemistry to gynaecologic pathology. Arch Pathol Lab Med. 2008;132:402-23.
Nucci MR, Oliva E, eds. Gynecologic pathology. Philadelphia: Churchill Livingstone Elsevier; 2009.
Prat J, De Nictolis M. Serous borderline tumors of th ovary: a long-term follow-up study of 137 cases, including 18 with a micropapillary pattern and 20 with microinvasion. Am J Surg Pathol. 2002;26:1111-28.
Seidman JD, Kurman RJ, Ronnett BM. Primary and metastatic mucinous adenocarcinomas in the ovaries: incidence in routine practice with a new approach to improve intraoperative diagnosis. Am J Surg Pathol. 2003;27:985-93.
Tavassoli FA, Devilee P, eds. World Health Organization classification of Tumours: Pathology and genetics, Tumours of the breast and female genital organs. Lyon, France: IARC Press; 2003.
Tratamiento adyuvante
Colombo N, Guthrie D, Chiari S, Parmar M, Qian W, Swart AM, et al. International Collaborative Ovarian Neoplasm trial 1: a randomized trial of adjuvant chemotherapy in women with early-stage ovarian cancer. J Natl Cancer Inst. 2003;95:125-32.
Morgan RJ Jr, Alvarez RD, Armstrong DK, Burger RA, Castells M, Chen LM, et al. Ovarian cancer, version 3.2012. J Natl Compr Canc Netw. 2012;10:1339-49.
Katsumata N, Yasuda M, Takahashi F, Isonishi S, Jobo T, Aoki D, et al. Dose-dense paclitaxel once a week in combination with carboplatin every 3 weeks for advanced ovarian cancer: a phase 3, open-label, randomised controlled trial.Lancet. 2009;374:1331-8.
Stuart GC, Kitchener H, Bacon M, duBois A, Friedlander M, Ledermann J et al., 2010 Gynecologic Cancer InterGroup (GCIG) consensus statement on clinical trials in ovarian cancer: report from the Fourth Ovarian Cancer Consensus Conference. Int J Gynecol Cancer. 2011;21:750-5
Trimbos JB, Vergote I, Bolis G, Vermorken JB, Mangioni C, Madronal C, et al. Impact of adyuvant chemotherapy and surgical staging in early stage ovarian carcinoma: European Organisation for Research and Treatment of Cancer – Adjuvant Chemotherapy in Ovarian Neoplasm trial. J Natl Cancer Inst. 2003;95:113-25.
Vasey PA, Jayson GC, Gordon A, Gabra H, Coleman R, Atkinson R, et el. Phase III randomized trial of docetaxel-carboplatin versus paclitaxel- carboplatin as first –line chemotherapy for ovarian cancer. J Natl Cancer Inst. 2004;96:1682-91.
Vergote I, De Brabanter J, Fyles A, Bertelsen K, Einhorn N, Sevelda P, et al. Prognostic importance of degree of differentiation and cyst rupture in stage I invasive epithelial ovarian carcinoma. Lancet. 2001;357:176-82.
Young RC. Early-stage ovarian cancer: to treat or not to treat. J Natl Cancer Inst. 2003;95:94-5.
Young RC, Walton LA, Ellenberg SS, Homesley HD, Wilbanks GD, Decker DG, et al. Adyuvant therapy in stage I and stage II epithelial ovarian cancer. Results of two prospective randomized trials. N Engl J Med. 1990;322:1021.