Convocadas por la Academia Nacional de Medicina, por intermedio del Instituto de Estudios Oncológicos, y ante la iniciativa de la Asociación Argentina de Ginecología Oncológica, las entidades autoras, miembros del Programa Argentino de Consensos de Enfermedades Oncológicas y del Programa Nacional de Consensos Intersociedades, avalan este consenso multidisciplinario que aúna los criterios propuestos por los profesionales que se encuentran involucrados en la prevención, diagnóstico y tratamiento de los tumores de cuello uterino.
Las instituciones autoras se comprometen a difundir y promover el uso del contenido de este documento en todas las áreas y entidades responsables del manejo de la salud, institutos nacionales, provinciales, municipales, PAMI, colegios médicos, entidades de medicina prepaga, obras sociales, mutuales, Superintendencia de Seguros de Salud de la Nación, hospitales comunitarios y universitarios, además de las entidades relacionadas, así como su aplicación por todos los especialistas del país.
Metodología diagnóstica de las lesiones preinvasorasIntroducciónLa irrupción del virus del papiloma humano (HPV) como “factor necesario” para la génesis del cáncer cervical a partir de lesiones preinvasoras, presente en el 99,7%, motivó un cambio en la concepción global de la enfermedad. Las constantes investigaciones desplazaron la mirada futura de la problemática desde una visión morfológica hacia una concepción molecular en pleno avance.
Los países en vías de desarrollo (y, dentro de estos, las regiones más desiguales) son los más castigados por la enfermedad, considerándose al cáncer de cuello uterino (CCU) un marcador de pobreza estructural. Las condiciones económicas desfavorables hacen que la metodología morfológica tenga aún plena vigencia en esas zonas.
La ausencia de planes de tamizaje poblacional que abarquen a la mayoría de las mujeres de estas regiones en un período de tiempo genera que, aun en la actualidad, se continúe con técnicas de tamizaje individual y oportunístico, con una efectividad relativa en lo referente a la mejoría en los índices de mortalidad.
En nuestro país, desde junio de 2008 se encuentra en marcha el Programa Nacional de Prevención del Cáncer Cervicouterino, dependiente del Ministerio de Salud. Este fue iniciado en “provincias prioritarias” (Chaco, Jujuy, Misiones, Salta y Formosa) y, a pesar de las dificultades, aspira a abarcar la totalidad del extenso territorio argentino. El programa se centra en el tamizaje mediante técnicas moleculares, junto con la citología. Mientras tanto, el tamizaje individual continúa siendo el arma prioritaria con la que contamos para la detección de la patología preinvasora.
PremisaLa lesión considerada premaligna o preinvasora corresponde a lesión intraepitelial escamosa (SIL) de alto grado-CIN3. El SIL de alto grado-CIN2 tiene características particulares, por lo que actualmente se encuentra en revisión.
Métodos disponiblesLa citología exfoliativa cervicovaginal complementada con la colposcopia y la biopsia dirigida son consideradas el trípode diagnóstico clásico para la detección de la patología preinvasora. Sin embargo, en los últimos años se ha agregado la posibilidad de realizar estudios moleculares para la detección del HPV y estudios complementarios mediante inmunohistoquímica.
OportunidadSe recomienda la realización de estudios de detección a partir de los 21 años y hasta los 65 o a partir de los 3 años posteriores al inicio de las relaciones sexuales. El profesional debe evaluar situaciones especiales, como la existencia de condiciones de riesgo de contacto anterior con el HPV (abuso o violación, concomitante o no con episodios de adicciones) para modificar la fecha de inicio de los estudios.
PeriodicidadLa baja sensibilidad de la citología exfoliativa como único estudio, que conlleva una considerable cantidad de falsos negativos, se reduce con su repetición periódica. La extensión de los plazos de cada control podría prolongarse de 3 a 5 años, cuando se disponga del cotest molecular asociado a la citología exfoliativa y no se asocien otros factores de riesgo, como el recontagio con HPV (cambios de pareja, nuevos parteners con condilomas, sexo ocasional sin protección, aparición de condilomas, etc.), presencia o aparición de cofactores relacionados (infecciones de transmisión sexual -ITS-, inmunodeficiencia, promiscuidad, etc.) o signo-sintomatología de alteración genital (ulceraciones, sinusorragia, flujo patológico, etc.).
En nuestro medio, el tamizaje individual asocia clásicamente la citología exfoliativa con la colposcopia para disminuir los falsos negativos con razonable eficacia. La periodicidad podría acortarse con el mismo objetivo, dependiendo del criterio profesional y de las características de cada paciente, recomendándose realizar una citología anual.
Metodología- 1
Citología exfoliativa: idealmente debe ser realizada mediante toma exo y endocervical, dado que las lesiones glandulares se han incrementado y representan hasta el 20% del total.
- 2
Colposcopia: así como la citología “detecta”, la colposcopia “localiza” la lesión y dirige la biopsia a los sectores más sospechosos. Se utiliza ácido acético al 5% y, eventualmente, solución de Lugol.
Para mayor información sobre los tipos de lesiones y su gradiente de sospecha, especialmente en lesiones premalignas o invasoras, se adjunta la última clasificación y nomenclatura de The International Federation of Cervical Pathology and Colposcopy (IFCPC – Río, 2011). Al respecto, se puede ver tabla 1 o ingresar en: http://www.ifcpc.org/en/healthcare-professionals/resource-material/2011-ifcpc-nomenclature; o bien en www.colpoweb.org
Tabla 1.Terminología colposcópica del cuello uterino de IFCPC (2011)
Evaluación general - Adecuada/inadecuada a causa de...(p. ej.: cuello uterino no claro por inflamación, sangrado, cicatriz)
-Visibilidad de la unión escamocolumnar: completamente visible, parcialmente visible, no visible
Tipos de zona de transformación 1,2,3Hallazgos colposcópicos normales Epitelio escamoso original
-Maduro
-Atrófico
Epitelio columnar
-Ectopia
Epitelio escamoso metaplásico
-Quistes de Naboth
-Aberturas glandulares y/o criptas glandulares
Deciduosis en el embarazoHallazgos colposcópicos anormales
Principios generalesUbicación de la lesión: dentro o fuera de la zona de transformación, ubicación de la lesión según las agujas del reloj.
Tamaño de la lesión: número de cuadrantes del cuello uterino que cubre la lesión, tamaño de la lesión en porcentajes del cuello uterino.Grado 1 (menor) Epitelio acetoblanco delgado
Borde irregularMosaico fino, puntillado fino Grado 2 (mayor) Epitelio acetoblanco denso, aparición rápida de epitelio acetoblanco
Orificios glandulares abiertos con bordes engrosadosMosaico grueso, puntillado grueso
Bordes delimitados, signo del límite del borde interno, signo de cresta o sobreelevado.No específicos Leucoplasia (queratosis, hiperqueratosis), erosión
Solución de Lugol (test de Schiller): positivo/negativoSospecha de invasión Vasos atípicos
Signos adicionales: vasos delgados, superficie irregular, lesión exofítica, necrosis, ulceración (necrótica), tumoración nodular.Hallazgos varios Zona de transformación congénita, condiloma, pólipo (exocervical /endocervical), inflamación Estenosis, anomalía congénita, anomalías postratamiento, endometriosis Para el caso del diagnóstico de las lesiones intraepiteliales que nos ocupa, corresponde a los “hallazgos colposcópicos anormales – grado 2 (mayor)”. Cuando las imágenes sospechosas corresponden a lesiones intraepiteliales y se encuentran contactando con el orificio cervical externo (OCE) o se introducen en el conducto endocervical, la utilización de una pinza de apertura endocervical (endoespéculo) es necesaria, muy especialmente como evaluación preterapéutica y consideración de la estrategia terapéutica.
- 3
Biopsia dirigida: provee certeza diagnóstica, considerándose el gold standard para encarar cualquier tipo de tratamiento. Ante una citología anormal y una colposcopia grado 2 (con alteraciones mayores), se impone la realización de una biopsia para obtener la certeza de lesiones preinvasoras (CIN2-3 / H-SIL). La obtención de más de una toma de biopsia mejora la certeza diagnóstica.
En lesiones amplias, debe considerarse la realización del mapeo biópsico (varias tomas pequeñas). Para los casos en que fuera necesario (lesiones glandulares, pavimentosas que se introducen en el endocérvix o mixtas), el curetaje del endocérvix provee material histológico.
- 4
Estudios moleculares: son utilizados en cribados poblacionales como tamizaje primario asociados a la citología. En nuestro medio se utilizan como complemento diagnóstico en citologías ASCUS, SIL de bajo grado persistente en posmenopaúsicas y control postratamiento de pacientes con SIL de alto grado tratadas. No se recomienda su uso en pacientes menores de 30 años.
La biopsia ampliada, tanto a bisturí como mediante radiofrecuencia utilizando asa (gran escisión con asa de la zona de transformación [LLETZ] o cono escisión electroquirúrgica en asa [LEEP]), tiene finalidad diagnóstica (para confirmar o descartar microinvasión) y/o terapéutica para el caso de lesiones intraepiteliales de alto grado.
La biopsia ampliada como eventual tratamiento del estadio 1A es abordada en el capítulo de terapéuticas.
Discordancia cito-colpo-histológicaArribar a un diagnóstico de certeza puede ser muy dificultoso en lesiones premalignas, cuando existe una discordancia entre la citología exfoliativa exo-endocervical, la colposcopia y el resultado de las biopsias. En estos casos, si se confirma la discordancia, a pesar de las interconsultas con especialistas y las revisiones de los preparados histopatológicos, es menester la realización de una biopsia ampliada diagnóstica.
Bibliografía recomendada- -
Walboomers JM, Jacobs MV, Manos MM, Bosch FX, Kummer JA, Shah KV, et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol. 1999;189:12-9.
- -
Bornstein J, Bentley J, Bösze P, Girardi F, Haefner H, Menton M, et al., 2011 colposcopic terminology of the International Federation for Cervical Pathology and Colposcopy. Obstet Gynecol. 2012;120:166-72.
- -
Moscicki AB. HPV infections in adolescents. Dis Markers. 2007;23:229-34.
- -
IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Human papillomaviruses. IARC Monogr Eval Carcinog Risks Hum. 2007;90:1-636.
- -
IARC. Hanbooks of Cancer Prevention, Volume 10. Cervix Cancer Screening. Lyon: IARC Press; 2005.
- -
Instituto Nacional del Cáncer. Prevención del Cáncer Cérvico-uterino. Buenos Aires: Ministerio de Salud de la Argentina; 2011. Disponible en: http://www.msal.gob.ar/inc/images/stories/downloads/publicaciones/equipo_medico/Cancer_Cervico_Uterino/Guia_para_la_utilizacin_de_la_prueba_de_VPH.pdf
- -
Ivanov S. Cytological screening--the technique of cytological specimen taking and its influence on the quality of the method. Akush Ginekol (Sofiia). 2007;46:26-7.
- -
Lee SH, Vigliotti JS, Vigliotti VS, Jones W. From Human Papillomavirus (HPV) detection to cervical cancer prevention in clinical practice. Cancers (Basel). 2014;6:2072-99.
- -
Tota JE, Ramana-Kumar AV, El-Khatib Z, Franco EL. The road ahead for cervical cancer prevention and control. Curr Oncol. 2014;21:e255-64.
- -
Karimi-Zarchi M, Peighmbari F, Karimi N, Rohi M, Chiti Z. A comparison of 3 ways of conventional pap smear, liquid-based cytology and colposcopy vs cervical biopsy for early diagnosis of premalignant lesions or cervical cancer in women with abnormal conventional pap test. Int J Biomed Sci. 2013;9:205-10.
- -
Seifert U, Klug SJ. Early detection of cervical cancer in Germany: evidence and implementation. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2014;57:294-301.
- -
Cernescu EC, Anton G, Ruţă S, Cernescu C. The effectiveness of cytological rescreening in the reduction of false negative/positive Pap reports. Roum Arch Microbiol Immunol. 2013;72:93-104.
- -
Almeida CM, Rodriguez MA, Skootsky S, Pregler J, Steers N, Wenger NS. Cervical cancer screening overuse and underuse: patient and physician factors. Am J Manag Care. 2013;19:482-9.
- -
Kim JH, Kim IW, Kim YW, Park DC, Kim YW, Lee KH, et al. Comparison of single, double- and triple-combined testing, including Pap test, HPV DNA test and cervicography, as screening methods for the detection of uterine cervical cancer. Oncol Rep. 2013;29:1645-51.
- -
Sigurdsson K. Is a liquid-based cytology more sensitive than a conventional Pap smear? Cytopathology. 2013;24:254-63.
- -
McCrory DC, Matchar DB, Bastian L, Datta S, Hasselblad V, Hickey J, et al. Evaluation of cervical cytology. Summary. Evidence Report/Technology Assessment: Number 5, January 1999. Agency for Health Care Policy and Research, Rockville, MD. http://text.nlm.nih.gov/ftrs/directBrowse.pl?collect=epc&dbName=cersum
- -
ACCP. Pap smears: An important but imperfect method. Cervical Cancer Prevention Fact Sheet. October, 2002. Disponible en: http://screening.iarc.fr/doc/RH_pap_smears.pdf
- -
Zamudio Andrade A, Zepeda Zaragoza J, Rodríguez Blanco B, Tenorio Marañón FR. Evaluación del Papanicolaou y la colposcopia en el diagnóstico de la infección por el virus del papiloma humano. Rev Fac Med UNAM. 2001;44:5-7.
- -
Mauro J, Santomé Osuna A, Capresi M, Cohen E, Morín A, Shayo S. Evaluación del rendimiento de captura de híbridos, citología y colposcopia para predecir lesiones de alto grado y cáncer de cuello uterino en un hospital público de la Ciudad de Buenos Aires. Colposcopia. 2014;25:96-105.
- -
International Federation of Gynecology and Obstetrics. Cervical cancer screening age ‘may not be high enough. FIGO website, 14-5-2014. Disponible en: http://www.figo.org/news/cervical-cancer-screening-age-%E2%80%98may-not-be-high-enough%E2%80%99-0014007
- -
Cain J, Goltz S. Global Guidance for Cervical Cancer Prevention and Control. International Federation of Gynecology and Obstetrics; 2009. Disponible en: http://www.figo.org/sites/default/files/uploads/wg-publications/gynec-cancer/English_version.pdf
Se denominan lesiones intraepiteliales escamosas al espectro de anomalías escamosas no invasoras del epitelio cervical asociada al virus del papiloma humano. Desde un punto de vista práctico y con aplicación clínica, las SIL se dividen en dos grandes grupos: lesiones de bajo grado y alto grado. Todas son producidas por HPV de bajo y alto riesgo.
SIL de bajo gradoRepresenta la manifestación clínica y morfológica de la infección producida por el HPV. Estas lesiones tienen un bajo riesgo de progresión a carcinoma (OMS, 2014).
La categoría incluye a las lesiones virales puras, ya sean planas y/o acuminadas, y a las neoplasias intraepiteliales de tipo 1 (CIN1), también llamadas displasias leves.
Criterios citológicosLos cambios se producen principalmente en las células superficiales o en las que tienen citoplasma “maduro”. El elemento patognomónico diagnóstico es el coilocito, que afecta células superficiales o intermedias. Estas células tienen núcleos agrandados tres o más veces con respecto a una célula intermedia normal, usualmente hipercromáticos. El tamaño y número de los núcleos es variable y constituye células bi o multinucleadas con anisocariosis. Los cambios citoplasmáticos corresponden a un halo con borde denso y desigual, que rodean al núcleo, otorgándole el clásico aspecto vacío que le da nombre.
Si además de los coilocitos clásicos previamente descritos, se observan células con alteraciones nucleares similares a las del coilocito, pero que carecen de la cavitación perinuclear, se informa SIL de bajo grado (CIN1 – HPV).
Criterios histológicosEl elemento diagnóstico fundamental del condiloma es el coilocito. Este siempre debe estar presente y ubicarse en los estratos superiores. Toda célula vacuolizada y con núcleo algo más voluminoso próximo a la basal, no es un coilocito.
El efecto citopático viral también produce bi y multinucleación, alteraciones de la queratinización (disqueratosis, paraqueratosis o hiperqueratosis), con aumento del espesor epitelial que se traduce principalmente como hiperplasia de estratos basales. Este aumento del espesor epitelial conlleva, para nutrirlo, un aumento de la vascularización. El tejido conectivo que rodea los vasos se introduce en el espesor epitelial adoptando distintas morfologías, que son las que ayudan a definir las imágenes colposcópicas. Es así que los ejes conectivo-vasculares pueden ser cortos, alcanzar la superficie del epitelio o acompañar la elevación del mismo, conformando espículas o proyecciones papilares (condiloma viral plano, espiculado o acuminado).
La capa basal debe estar ordenada con escasa superposición nuclear, siendo muy útil observar con el objetivo de campo en su unión epitelio-estromal, donde constituye una línea continua, suave u ondulada, como siguiendo el contorno geográfico de un mapa. La presencia de figuras mitóticas no es infrecuente, ya que es un epitelio que está proliferando. Sin embargo, estas deben ser mitosis normales. La existencia de mitosis anómalas es sugerente de displasia y aquí comienza a considerarse el diagnóstico de CIN1.
Condiloma viral puro:
- -
Coilocitos en estratos superiores
- -
Binucleación y multinucleación
- -
Disqueratosis
- -
Papilomatosis
- -
Hiperplasia de estratos basales
- -
Hiper o paraqueratosis
- -
Elongación de ejes conectivo-vasculares
- -
Crecimiento plano - espiculado - acuminado - invertido
- -
Ausencia de mitosis anómalas
El diagnóstico de CIN1 (displasia leve) debe considerarse cuando, a los hallazgos anteriormente descritos, se suma la desorganización de la capa basal con aumento del número de células. Estas presentan atipia nuclear verdadera, que se manifiesta con núcleos voluminosos hipercromáticos, irregulares y distintos entre sí. Además, hay figuras mitóticas anómalas (tripolares o multipolares, estalladas o dispersas). Esta alteración morfológica se reconoce con el objetivo de campo, al observar la capa basal.
CIN1 (displasia leve):
- -
Hallazgos del condiloma viral puro
- -
Hiperplasia y desorganización de la capa basal
- -
Atipia citológica en células basales
- -
Mitosis anómalas (tripolares, multipolares, estalladas o dispersas)
Es una lesión intraepitelial escamosa con un significativo riesgo de desarrollar cáncer cervical, si no es tratada (OMS, 2014). En esta categoría se incluyen las neoplasias intraepiteliales de tipo 2 (CIN2), también llamadas displasias moderadas, y las neoplasias intraepiteliales de tipo 3 (CIN3) o displasias severas y/o carcinoma in situ.
Criterios citológicosLas alteraciones citológicas se expresan en las células intermedias y parabasales, asociadas a distintos grados de efecto citopático viral. Estas células pueden estar aisladas, en hileras o láminas, o en agregados pseudosinciciales.
Los núcleos son hipercromáticos con la membrana nuclear irregular, que comúnmente presenta indentaciones o escotaduras. La cromatina puede ser laxa o granular en grumos gruesos.
En ciertas ocasiones el diagnóstico entre lesiones de bajo y de alto grado es difícil. Estos casos suelen corresponder histológicamente a lesiones de grado intermedio (CIN2), cuya interpretación histológica es también conflictiva, en tanto existe en esta categoría poca reproducibilidad diagnóstica entre distintos citopatólogos.
- -
Células aisladas, en colgajos o en sincicios
- -
Anormalidades nucleares en células con escasa maduración citoplasmática
- -
Agrandamiento nuclear con marcada alteración de la relación N/C a expensas de la disminución del área citoplasmática
- -
Hipercromasia con cromatina fina o gruesa granular
- -
Contorno nuclear irregular
Las neoplasias intraepiteliales de alto grado están compuestas por proliferación de células escamosas o metaplásicas, con anormalidades nucleares que incluyen incremento del tamaño nuclear, irregularidad de la membrana nuclear con cromatina granular y aumento de la relación núcleo-citoplasmática.
Los núcleos pierden su polaridad, adoptando un aspecto desordenado y a veces arremolinado. El citoplasma de estas células neoplásicas no muestra diferenciación en los estratos medios y superiores del epitelio. Las figuras mitóticas normales y anómalas alcanzan el tercio medio y superior epitelial.
Las lesiones de alto grado pueden encontrarse a nivel exocervical del epitelio escamoso metaplásico superficial, comprometiendo el epitelio metaplásico de las glándulas endocervicales.
SIL de alto grado (CIN2-3):
- -
Compromiso de más de 1/3 epitelial
- -
Pérdida de polaridad nuclear
- -
Núcleos agrandados, hipercromáticos, cromatina granular
- -
Mitosis normales y atípicas
- -
Citoplasma escaso
- -
Efecto citopático viral variable (HPV)
Desde el punto de vista histológico existen diferentes tipos morfológicos de SIL de alto grado:
- -
SIL de alto grado queratinizante: se caracteriza por la gran queratinización presente en todas las capas celulares, con citoplasmas más abundantes y eosinófilos.
- -
SIL de alto grado papilar: está constituido por un epitelio de tipo transicional con un marcado crecimiento exofítico. Son necesarias biopsias amplias para descartar invasión.
- -
SIL de alto grado con fenotipo de metaplasia inmadura: este tipo es difícil de reconocer porque se confunde con cambios metaplásicos reactivos y suele tener un epitelio columnar indemne en la superficie.
- -
SIL de alto grado delgado (thin SIL): sus lesiones están constituidas por células inmaduras en capas con menos de 10 células de espesor.
La inmunohistoquímica puede utilizarse como una herramienta diagnóstica en la patología cervical. Los inmunomarcadores más utilizados son la proteína 16 INK4A (p16) y el Mib1 o Ki67 en parafina.
El p16 es un marcador de integración del HPV de alto riesgo. Se considera marcación positiva para p16 aquella marcación fuerte y difusa, nuclear y citoplasmática en los tercios basal y medio del epitelio. Esta marcación positiva es característica de la lesión intraepitelial de alto grado. Por su parte, el Ki67 es un marcador de proliferación celular. Su marcación es nuclear y compromete distintas alturas del epitelio, de acuerdo con el grado de la lesión intraepitelial.
Estos marcadores mejoran la reproducibilidad diagnóstica de las lesiones intraepiteliales y disminuyen los errores diagnósticos. Sin duda, el punto de mayor discordia está representado por los CIN2, donde se observa una marcada diferencia diagnóstica interobservador.
Utilidad de la inmunohistoquímica en patología cervical:
- -
Diagnóstico diferencial SIL de alto grado / simuladores (epitelio atrófico, metaplasia inmadura, epitelio reactivo)
- -
Lesiones delgadas (displasia delgada, metaplasia)
- -
Lesiones pequeñas
- -
Corte tangencial
- -
CIN2
También denominada lesión intraepitelial glandular de alto grado (HG-CGIN), el adenocarcinoma in situ (AIS) contiene un epitelio glandular de apariencia maligna y conlleva un riesgo significativo de desarrollar un adenocarcinoma si no es tratado. No se reconocen otras lesiones precursoras del adenocarcinoma invasor del cuello uterino.
Criterios citológicos- -
Disposición en láminas con bordes desflecados
- -
Formación de rosetas
- -
Núcleos agrandados, elongados y estratificados
- -
Variación en tamaño y forma nuclear
- -
Hipercromasia, cromatina finamente granular
- -
Nucléolo pequeño o ausente
El adenocarcinoma in situ muestra reemplazo del epitelio glandular normal, tanto de la superficie de la mucosa endocervical como de las glándulas endocervicales, por epitelio neoplásico. Este muestra pseudoestratificación, disminución o pérdida completa de la mucina intracitoplasmática, atipia nuclear, con macrocariosis, hipercromasia, cromatina irregular y en grumos gruesos, y nucléolos prominentes. Son frecuentes las figuras de mitosis y los cuerpos apoptóticos.
El epitelio neoplásico descrito compromete las estructuras glandulares preexistentes, por lo que la lesión conserva la arquitectura lobular. El compromiso parcial de las glándulas es un elemento morfológico de gran ayuda para el patólogo en el diagnóstico de esta lesión.
El adenocarcinoma in situ puede presentar diferenciación intestinal, con células caliciformes o endometroides.
Criterios morfológicos- -
Pérdida de la secreción mucinosa
- -
Presencia de glándulas irregulares o con formaciones glandulares adyacentes pequeñas
- -
Epitelio pseudoestratificado, atipia celular, células con núcleos hipercromáticos, frecuentes mitosis y cuerpos apoptóticos
- -
Compromiso de parte de las glándulas
Inmunofenotipo:
- -
Positividad fuerte y difusa para p16
- -
Alto índice de proliferación (Ki67)
- -
Pérdida de la expresión de receptores de estrógeno y progesterona
El HPV puede infectar células pluripotenciales de la zona de transformación que se diferencian del epitelio escamoso o glandular. Esta mezcla de ambos tipos celulares afectados produce este SIL especial de alto grado, donde conviven células productoras de moco con células escamosas atípicas.
Bibliografía recomendada- -
Salomon D, Nayar R. El Sistema Bethesda para informar la citología cervical. Definiciones, criterios y notas aclaratorias. Buenos Aires: Journal; 2005.
- -
Koss LG, Relamed MR. Koss¿ diagnostic cytology and its histopathologic bases. Philadelphia: Lippincot Williams and Williams; 2006.
- -
Kurman RJ, Ellenson LH, Ronnett BM. Blaustein's pathology of the female genital tract. New York: Springer; 2011.
- -
Crum CP, Lee KR. Diagnostic Gynecologic and Obstetric Pathology. Philadelphia: Elsevier Saunders; 2006.
- -
Nucci MR, Oliva E. Gynecologic pathology. London: Churchill Livingstone Elsevier; 2009.
- -
Tatti S. Colposcopia y patologías del tracto genital inferior. En la era de la vacunación. Buenos Aires: Panamericana; 2008.
- -
Yang B. Thinner CIN 2-3 associates with low sensitivity of colposcopic-directed biopsy. Mod Pathol. 2008;21 (suppl 1):229a.
- -
Díaz LB, Cardinal LH. Simuladores de bajo y alto grado en citología cérvico-vaginal. En: Temas de actualización en citopatología. Citopatología ginecológica. Fascículo 1. Buenos Aires: Azcune; 2012:13-25.
- -
van Aspert-van Erp AJ, Smedts FM, Vooijs GP. Severe cervical glandular cell lesions and severe cervical combined lesions: predictive value of the papanicolaou smear. Cancer. 2004;102:210-7.
- -
van Aspert-van Erp AJ, Smedts FM, Vooijs GP. Severe cervical glandular cell lesions with coexisting squamous cell lesions. A reevaluation of cytologic (and histologic) specimens. Cancer. 2004;102:218-27.
- -
Darragh TM, Colgan TJ, Cox JT, Heller DS, Henry MR, Luff RD, et al. The Lower Anogenital Squamous Terminology Standardization Project for HPV-Associated Lesions: background and consensus recommendations from the College of American Pathologists and the American Society for Colposcopy and Cervical Pathology. J Low Genit Tract Dis. Guidelines. 2012;16:205-42.
- -
Kurman RJ, Carcangiu ML, Herrington CS, Young RH. WHO classification of tumours of female reproductive organs. IARC: Lyon; 2014.
El 60-70% retrograda (el 91% en adolescentes) y el 13% progresa a SIL de alto grado. El HPV 16 es el genotipo más frecuentemente asociado. En gestantes con SIL de bajo grado (26,3%) se aconseja control sin tratamiento.
° Con correlación colpo-cito-histológica
Dos opciones:
*Control cada 6 meses con citología y colposcopia. Si persiste la lesión luego de 2 años, se considera persistente. Se recomienda seguimiento y eventual tratamiento.
*Tratamiento ante la presencia de factores de riesgo
-Imposibilidad de seguimiento
-Pacientes mayores de 35 años
-Tabaquismo
-Compromiso inmunológico: trasplantadas, virus de inmunodeficiencia humana positivo (HIV+), corticoterapia, etc.
El tratamiento será destructivo y local con cauterización química, criocoagulación o electrofulguración con radiofrecuencia. En caso de pacientes añosas con colposcopia inadecuada, se prefiere un procedimiento ablativo con LEEP.
° Sin correlación cito-colpo-histológica y con sospecha de mayor lesión
Deberá efectuarse una revisión de todos los hallazgos y luego optar por un procedimiento escisional para asegurar el diagnóstico histológico, excepto en adolescentes o menores de 21 años en las que se prefiere el seguimiento estricto cada 6 meses por la alta tasa de regresión.
SIL de alto grado (diagnóstico histológico)Las posibilidades evolutivas son:
-CIN2: regresión en el 43%, persistencia en el 35% y progresión en el 22%.
-CIN3: regresión en el 32%, persistencia en el 56% y progresión en el 14%.
En un 75% de las lesiones se comprueba asociación con tipos virales de HPV 16, 18, 31, 33 y 58.
° Con colposcopia adecuada y evaluación normal del conducto endocervical (LEC o cepillado)
*Se recomienda un procedimiento diagnóstico escisional de la Z de T (LLETZ).
° Con colposcopia inadecuada y/o penetración de la lesión en el conducto endocervical y/o evaluación endocervical positiva y/o SIL de alto grado recurrente
*Se efectuará un procedimiento diagnóstico escisional con un cono LEEP o cono a bisturí frío y posterior LEC en el mismo acto quirúrgico.
*En el 7% de los casos puede existir un cáncer infiltrante oculto en el cono.
*El compromiso de los márgenes se considera un factor de riesgo de persistencia/ recurrencia que se constata en el 10-33% de los casos. Con márgenes comprometidos con SIL de alto grado en las secciones laterales o en el vértice del cono o con legrado endocervical positivo (LEC+), se contemplan dos opciones:
- -
seguimiento con citología + colposcopia + LEC o cepillado cada 6 meses, o en caso de disponerlo, prueba de HPV.
- -
nuevo procedimiento escisional (reconización con LEEP, bisturí frío o histerectomía total).
La histerectomía no es aceptada como primera elección de tratamiento del SIL de alto grado. Se indica luego de una conización diagnóstica en casos seleccionados: recurrencia, persistencia con reconización no factible, imposibilidad de seguimiento, patología asociada o por demanda especial de la paciente. Hay que tener presente que en un 60-90% de las histerectomías poscono por compromiso de márgenes no se halla enfermedad residual en la pieza.
En embarazadas con SIL de alto grado no se requiere tratamiento específico durante la gestación, sino solo evaluación con citología y colposcopia cada 12 semanas. Se debe reevaluar con citología y colposcopia no antes de las 6 semanas posteriores al parto/cesárea.
En adolescentes con SIL de alto grado (CIN2), colposcopia adecuada y posibilidad de seguimiento estricto, puede optarse por la observación, dada la alta tasa de regresión. De ser factible, la determinación de p16 por inmunohistoquímica es un método útil para la confirmación de SIL de alto grado. Con factores de riesgo y en caso de persistencia se efectúa la ablación con LEEP. En los casos con SIL de alto grado (CIN2/3), colposcopia inadecuada o difícil seguimiento, se recomienda procedimiento escisional diagnóstico.
Adenocarcinoma in situSu incidencia es de 1,25/100.000 mujeres por año, con un incremento de casi 6 veces entre los 70 y 90 años (comparativamente el CIN3 tiene una incidencia de 41,4/100.000). Por lo general, la colposcopia muestra cambios mínimos.
Frecuentemente es multifocal y hay presencia de skip lesions, por lo que los márgenes negativos de la escisión no indican necesariamente su exéresis completa.
Ante una citología de AIS, debe realizarse una confirmación histológica con biopsia guiada por colposcopia y legrado endocervical. De no haber imagen colposcópica, se realizará el legrado endocervical.
El procedimiento escisional indicado es la conización cervical, seguido de un legrado endocervical del muñón.
El riesgo de enfermedad residual depende del estatus de los márgenes del cono y el resultado del LEC poscono. Si ambos son negativos, se relaciona con una persistencia de lesión en el 11-14%. Si el LEC es positivo con cualquier estado de márgenes, la lesión residual está presente en el 100% de los casos (Lea et al.).
El manejo del AIS posconización es controvertido:
*En mujeres con paridad cumplida c/s márgenes libres en la conización y cualquier LEC, se recomienda la histerectomía total.
*En mujeres con deseos de fertilidad puede considerarse un manejo conservador, dejando la conización como procedimiento terapéutico:
- -
Con márgenes y LEC negativos hay que asegurar un seguimiento a largo plazo.
- -
Con márgenes comprometidos o LEC positivo se recomienda la reescisión con bisturí frío o la evaluación cada 6 meses con citología, colposcopia y LEC.
Se aconseja completar el tratamiento con histerectomía total una vez cumplida la paridad.
Bibliografía recomendada- -
Sociedad Argentina de Patología del Tracto Genital Inferior y Colposcopia y Sociedad de Ginecología y Obstetricia de Buenos Aires. Manejo de las citologías anormales. Manejo de la neoplasia intraepitelial cervical y del adenocarcinoma in situ: guías de manejo 2009. Disponible en: http://www.sogiba.org.ar/documentos/GuiasdeManejoConsenso2009.pdf
- -
Massad LS, Einstein MH, Huh WK, Katki HA, Kinney WK, Schiffman M et al., 2012 updated consensus guidelines for the management of abnormal cervical cancer screening tests and cancer precursors. Obstet Gynecol. 2013;121:829-46.
- -
de Bie RP, Massuger LF, van Dongen RA, Snijders MP, Bulten J, Melchers WJ, et al. To treat or not to treat; the clinical dilemma of atypical squamous cells of undetermined significance (ASC-US). Acta Obstet Gynecol Scand. 2011;90:313-8.
- -
Chumworathayi B, Thinkhamrop J, Blumenthal PD, Thinkhamrop B, Pientong C, Ekalaksananan T. Cryotherapy for HPV clearance in women with biopsy-confirmed cervical low-grade squamous intraepithelial lesions. Int J Gynaecol Obstet. 2010;108:119-22.
- -
Ayhan A, Boynukalin FK, Guven S, Dogan NU, Esinler I, Usubutun A. Repeat LEEP conization in patients with cervical intraepithelial neoplasia grade 3 and positive ectocervical margins. Int J Gynaecol Obstet. 2009;105:14-7.
- -
Tombola Group. Biopsy and selective recall compared with immediate large loop excision in management of women with low grade abnormal cervical cytology referred for colposcopy: multicentre randomised controlled trial. BMJ. 2009;339:b2548.
- -
Moscicki AB. Management of adolescents who have abnormal cytology and histology. Obstet Gynecol Clin North Am. 2008;35:633-43.
- -
American College of Obstetricians and Gynecologists. ACOG Committee Opinion No. 463: Cervical cancer in adolescents: screening, evaluation, and management. Obstet Gynecol. 2010;116 (2 Pt 1):469-72.
- -
Latif NA, Neubauer NL, Helenowski IB, Lurain JR. Management of adenocarcinoma in situ of the uterine cervix: a comparison of loop electrosurgical excision procedure and cold knife conization. J Low Genit Tract Dis. 2015;19:97-102.
- -
Lea JS, Shin CH, Sheets EE, Coleman RL, Gehrig PA, Duska LR, et al. Endocervical curettage at conization to predict residual cervical adenocarcinoma in situ. Gynecol Oncol. 2002;87:129-32.
- -
Tierney KE, Lin PS, Amezcua C, Matsuo K, Ye W, Felix JC, et al. Cervical conization of adenocarcinoma in situ: a predicting model of residual disease. Am J Obstet Gynecol. 2014;210:366.
- -
Martin-Hirsch PP, Paraskevaidis E, Bryant A, Dickinson HO. Surgery for cervical intraepithelial neoplasia. Cochrane Database Syst Rev. 2013;12:CD001318.
- -
Baloglu A, Uysal D, Bezircioglu I, Bicer M, Inci A. Residual and recurrent disease rates following LEEP treatment in high-grade cervical intraepithelial lesions. Arch Gynecol Obstet. 2010;282:69-73.
- -
Duesing N, Schwarz J, Choschzick M, Jaenicke F, Gieseking F, Issa R, et al. Assessment of cervical intraepithelial neoplasia (CIN) with colposcopic biopsy and efficacy of loop electrosurgical excision procedure (LEEP). Arch Gynecol Obstet. 2012;286:1549-54.
El CCU es la quinta neoplasia en frecuencia en el mundo y la segunda en nuestro país, luego del cáncer de mama. La OMS reporta 500.000 casos nuevos por año, de los cuales el 90% ocurre en países en vías de desarrollo, como Argentina donde la mitad de las mujeres diagnosticadas anualmente mueren por la enfermedad.
La incidencia depende de la provincia que evaluemos, pasando desde la Ciudad de Buenos Aires con una incidencia de 7,8 por 100.000 mujeres/ año (similar a la de los países desarrollados) a 23,2 en Formosa, similar a la de los países en vías de desarrollo.
La edad de aparición asciende desde los 25 años, haciendo su pico alrededor de la cuarta década. Los factores de riesgo son: inicio precoz de la actividad sexual, embarazos en la adolescencia, múltiples parejas, promiscuidad sexual, sucesivas infecciones ginecológicas (fundamentalmente por HPV), multiparidad, condición socio-económica baja, poca accesibilidad a la medicina preventiva, bajo nivel cultural, tabaquismo, pobre alimentación, inmunosupresión, etc.
SintomatologíaLos síntomas más frecuentes son la sinusorragia, el sangrado vaginal anormal y espontáneo, el flujo serosanguinolento, fétido y persistente, y en estadios avanzados el dolor. Con respecto a los tumores con crecimiento rápido y mucha necrosis, el flujo se transforma en icoroso, con gran fetidez y trozos de tejido necrótico, sangre y pus. En relación con el dolor, la invasión de los linfáticos perineurales produce dolor urente hacia la parte interna de los muslos y en la zona lumbar y pelviana siguiendo el trayecto ciático, siendo siempre señal de enfermedad avanzada, al igual que el edema linfático de uno o los dos miembros inferiores. La uropatía obstructiva por la invasión parametral puede llevar, en el caso de bilateralidad, a la muerte por anuria. Finalmente en las situaciones de invasión de la vejiga o el recto, la aparición de fístulas puede producir eliminación de orina o de materia fecal por vagina o transformarla en una cloaca.
El CCU tiene un comportamiento locorregional durante la mayor parte de su evolución. En etapas muy tardías se propaga a distancia y los síntomas son órgano-dependientes, siendo el hígado, el pulmón, los huesos y los ganglios extrapelvianos (inguinales, supraclaviculares, etc.) los más posiblemente invadidos.
Diagnóstico y estadificaciónEn un tumor clínicamente visible, y una biopsia simple define el diagnóstico. En algunos casos, la colposcopia puede dirigir la biopsia a zonas de menor necrosis para un mejor diagnóstico histológico, al igual que puede precisar otras zonas de invasión, como la vagina. En lesiones no macroscópicas, la biopsia ampliada proporcionará el diagnóstico definitivo.
La Federación Internacional de Ginecología y Obstetricia (FIGO) basa su estadificación en la clínica (inspección, tacto vaginal y rectal, y eventualmente examen bajo anestesia) y en algunos estudios complementarios de disponibilidad universal, como son un laboratorio de rutina, radiografía de tórax, urograma excretor, cistoscopia y rectoscopia.
El tacto vaginal bajo anestesia tiene como propósito obtener mayor relajación por la ausencia del dolor, permitiendo un examen más correcto. No obstante, se recomienda que la prueba sea efectuada por dos operadores con experiencia y, si hay discrepancia entre ellos, se asigna el menor estadio.
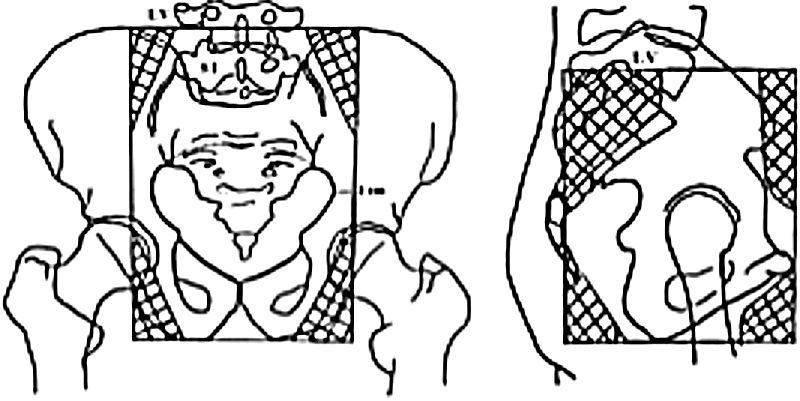
Con estos elementos se estadifica a la paciente, pero para ajustar la terapéutica se puede recurrir a otros métodos de diagnóstico por imágenes (aunque estos no cambian la estadificación clínica ya efectuada):
Resonancia magnética con gadolinioSi bien la estadificación es clínica, la discordancia entre esta y los hallazgos quirúrgicos es significativa, más aún en estadios avanzados. El acceso a estudios imagenológicos, como la resonancia magnética (RM), suele ser limitado en países o áreas de bajos recursos. De todos modos, la última clasificación FIGO revisada reconoce la importancia de considerarla y estimula el uso de la RM cuando se esté disponible como un estudio adicional a la evaluación clínica sin reemplazarla (en estadios IB1 o mayores), ya que aporta información en relación con factores pronósticos importantes.
En la actualidad, la RM es considerada el método de elección para la evaluación de la extensión de la enfermedad, en tanto permite una adecuada valoración de la localización y tamaño tumoral, invasión de los parametrios y pared pelviana, y compromiso de órganos adyacentes y de ganglios linfáticos. También es de extrema utilidad en candidatas a traquelectomía, definiendo la relación del tumor con el orificio cervical interno (OCI), la longitud del cérvix y el tamaño del tumor.
Para que los resultados del estudio sean óptimos, es esencial una adecuada preparación de la paciente, la realización de secuencias apropiadas y la interpretación realizada por un radiólogo entrenado.
*Protocolo de estudio RM
-Preparación de la paciente: vejiga en semirepleción, colocación de gel endovaginal e inyección intramuscular de antiperistáltico.
-Secuencias recomendadas: en ponderación T2 en corte axial de la pelvis hasta los hilios renales, en ponderación T2 en corte sagital de la pelvis (siguiendo el eje longitudinal del cuello), en ponderación T2 en corte axial oblicuo o coronal oblicuo (perpendicular al eje del cuello uterino), en ponderación T1 con supresión grasa con gadolinio (dinámico) o difusión.
-El reporte del estudio debe informar: tamaño tumoral; compromiso de parametrios, pared pelviana, espacios vésico y recto-uterinos, pared vesical y rectal, y vagina; presencia o ausencia de adenomegalias o ganglios de aspecto patológico. En pacientes candidatas a traquelectomía hay que agregar longitud cervical y distancia del tumor al OCI.
Tomografía computada (TC) con contraste oral y endovenosoDada la menor diferenciación tisular de la TC con respecto a la RM a nivel pelviano, su rendimiento a nivel local es inferior a esta última (tamaño tumoral, compromiso parametrial y de órganos vecinos). La eficacia diagnóstica de ambos métodos es similar para valorar enfermedad ganglionar y a distancia.
Tomografía computada por emisión de positrones (PET/TC)Debido a su alta sensibilidad para evaluación de ganglios linfáticos infracentimétricos, se recomienda realizar PET/TC en estadios localmente avanzados sin evidencia de adenopatías en abdomen y pelvis en TC o RM.
Estadios evolutivos según la clasificación de la FIGO 2009 (estadificación clínica)Estadio I: confinado al cuello
IA: tumor microscópico
IA1: tumor con hasta 3mm de invasión en profundidad en el estroma y hasta 7mm de extensión en superficie
IA2: tumor con más de 3mm en profundidad y hasta 5mm. Con hasta 7mm de extensión superficial
IB: tumor macroscópico limitado al cuello uterino ó lesiones preclínicas mayores del estadio IA2
IB1: tumor cervical de hasta 4cm en su mayor dimensión
IB2: tumor cervical mayor de 4cm en su mayor dimensión
Estadio II: el tumor cervical se propaga más allá del cuello, pero sin llegar al tercio inferior de la vagina o a la pared pelviana
IIA: invasión vaginal, sin invasión parametral
IIA1: tumor cervical uterino cuyo diámetro mayor, no superior a 4cm
IIA2: tumor cervical uterino con diámetro mayor, superior a 4cm
IIB: con invasión parametral
Estadio III: el tumor invade el tercio inferior de la vagina o llega a pared pelviana o produce hidronefrosis o riñón no funcionante
IIIA: involucra el tercio inferior de la vagina sin extenderse a la pared pelviana
IIIB: extensión a pared pelviana o hidronefrosis o riñón no funcionante
Estadio IV: el tumor se extiende más allá de la pelvis o invade la vejiga o el recto, corroborado por biopsia (el edema bulloso no significa estadio IV)
IVA: diseminación a órganos adyacentes
IVB: diseminación a órganos distantes
Citopatología del carcinoma del cuello uterinoTumores epiteliales (OMS, 2014)
- •
Tumor de células escamosas y sus precursores
- ∘
Carcinoma de células escamosas, NOS
- -
Queratinizante
- -
No queratinizante
- -
Papilar
- -
Basaloide
- -
Warty
- -
Verrugoso
- -
Escamotransicional
- -
Tipo linfoepitelioma
- -
- ∘
- •
Tumores glandulares y sus precursores
- ∘
Adenocarcinoma
- -
Adenocarcinoma endocervical, tipo usual
- -
Carcinoma mucinoso
- ✓
Tipo gástrico
- ✓
Tipo intestinal
- ✓
Tipo células en anillo de sello
- ✓
- -
Carcinoma velloglandular
- -
Carcinoma endometrioide
- -
Carcinoma de células claras
- -
Carcinoma seroso
- -
Carcinoma mesonéfrico
- -
Adenocarcinoma con carcinoma neuroendocrino
- -
- ∘
- •
Otros tumores epiteliales
- ∘
Carcinoma adenoescamoso
- -
Carcinoma de células vidriadas
- -
- ∘
Carcinoma adenoide basal
- ∘
Carcinoma adenoide quístico
- ∘
Carcinoma indiferenciado
- ∘
- •
Tumores neuroendocrinos
- ∘
Carcinoma neuroendocrino de alto grado
- -
Carcinoma neuroendocrino de células pequeñas
- -
Carcinoma neuroendocrino de células grandes
- -
- ∘
Los carcinomas del cuello uterino suele presentarse como:
- 1.
Masas exofíticas, friables, polipoides o papilares (exocervicales).
- 2.
Nódulos ulcerados y endofíticos que involucran con mayor frecuencia el endocérvix, en ocasiones con una configuración en barril.
- 3.
Lesiones ulceradas.
Es sumamente importante consignar: el tamaño tumoral, la ubicación (uno o ambos labios), la distancia a adventicia y serosa posterior, el compromiso de fondos de saco y/o mangos vaginales, la distancia al límite de resección vaginal en cm el compromiso del istmo y/o cavidad endometrial, el estado de los parametrios, su compromiso y distancia de la sección en cm, y la descripción del resto de los órganos.
CitologíaLas características principales de los extendidos citológicos obtenidos de los carcinomas cervicales dependen de su tipo histológico.
En los carcinomas escamosos hay marcada anisocariosis, los citoplasmas pueden tener una fuerte tinción naranja otorgada por el grado de queratinización del tumor. Los núcleos son hipercromáticos con bordes irregulares, cromatina gruesa granular y, frecuentemente, son picnóticos con apariencia en “gota de tinta china”. El tamaño nuclear es variable. Es frecuente observar, también, células en renacuajo, características de los carcinomas invasores, aunque ocasionalmente pueden verse en las lesiones de alto grado. Las perlas córneas -nidos dispuestos en forma concéntrica de células escamosas atípicas- también pueden observarse en estos extendidos.
En los adenocarcinomas las células son de configuración columnar con ocasionales vacuolas citoplasmáticas, los colgajos son densos, tridimensionales con bordes desflecados y núcleos orientados hacia la parte externa de los colgajos. Los núcleos son grandes, hipercromáticos y, frecuentemente, presentan nucléolos.
Es importante remarcar que por características propias de las lesiones invasoras no es infrecuente que el fondo de los extendidos sea sucio, hemorrágico o inflamatorio, con escasas o ausentes células neoplásicas. Este fenómeno explica la gran cantidad de falsos negativos.
HistologíaEl carcinoma cervical tempranamente invasor ha sido definido por la FIGO y el proyecto LAST como carcinomas microscópicos con una invasión del estroma hasta 5mm y extensión lateral no mayor de 7mm.
El término carcinoma de células escamosas superficialmente invasor (SISCCA) ha sido acuñado por el proyecto LAST para carcinomas escamosos mínimamente invasores que han sido completamente extirpados y son pasibles de tratamientos conservadores.
El SISCCA de cuello se define como aquel que no se ve macroscópicamente, tiene una profundidad de invasión menor o igual a 3mm desde la basal del punto de origen, la extensión horizontal es menor o igual a 7mm y ha sido completamente extirpado.
En casos con márgenes positivos debería informarse con las siguientes notas: “el tumor excede la dimensión del SISCCA” o “el tumor es al menos un SISCCA”. A su vez, el informe de SISCCA debe incluir si hay invasión linfovascular (presencia / ausencia) y la existencia, número y tamaño de cada foco de invasión (excluir carcinoma único).
Se recomienda el término SISCCA porque identifica un grupo de pacientes que pueden tratarse en forma conservadora, es equivalente a FIGO IA1 y porque el SIL de alto grado en el margen no invalida el diagnóstico. Puede efectuarse seguimiento o resecarse inmediatamente.
Para determinar la microinvasión en lesiones glandulares se siguen los criterios de la FIGO.
Carcinoma escamosoSon tumores con un patrón de crecimiento heterogéneo, con distintos grados de diferenciación. Crecen a manera de nidos, cordones, islotes o células individuales con citoplasmas poligonales y eosinófilos, con puentes intercelulares y grado variable de pleomorfismo nuclear. La queratinización puede ser individual o formar perlas córneas. Dependiendo de la cantidad de queratina, los carcinomas se clasifican en queratinizante y no queratinizante. El estroma circundante presenta desmoplasia e infiltrados inflamatorios y áreas de necrosis. Con relativa frecuencia es acompañado de lesión intraepitelial de alto grado.
Es importante determinar el grado tumoral basado en el grado de diferenciación, el pleomorfismo nuclear y el índice mitótico, obteniéndose 3 grados. Al igual que el SIL de alto grado, estos tumores están fuertemente asociados a HPV de alto riesgo, por lo que demuestran positividad con p16 e índice de proliferación elevado medido con Ki67. Existen variantes infrecuentes de los carcinomas escamosos que pueden combinarse entre sí.
AdenocarcinomaSon un grupo heterogéneo de neoplasias con diferentes patrones histológicos. Las formas mixtas son sumamente frecuentes y los autores recomiendan clasificar la lesión de acuerdo con el componente predominante, listando en la descripción los demás hallazgos.
Se denominan adenocarcinomas tempranamente invasores a las lesiones con mínima invasión estromal. El tipo histológico más frecuente es el denominado de tipo usual en la actual clasificación de la OMS y corresponde al adenocarcinoma endocervicoide. Este se compone de células que se disponen formando glándulas, papilas o en forma sólida adoptando diferentes patrones histoarquitecturales. Son, en general, bien o semidiferenciados con depleción de mucinas. Las mitosis se disponen en el sector apical celular (mitosis flotantes) y son frecuentes los cuerpos apoptóticos.
Estos tumores también están fuertemente asociados a HPV de alto riesgo, por lo que demuestran positividad con p16 e índice de proliferación elevado medido con Ki67. Al igual que en los carcinomas escamosos, existen múltiples variantes histológicas de los adenocarcinomas, pero ante un patrón inusual de crecimiento (endometrioide, células en anillo de sello), siempre conviene descartar un origen secundario.
Informe histopatológicoMacroscopia- •
Tamaño de la pieza y del tumor
- •
Ubicación del tumor: labio ant/post/ambos, exocérvix, endocérvix
- •
Profundidad de invasión: anterior y posterior distancia a la serosa y adventicia en cm (relación tumor/ cuello), compromiso vaginal y su extensión
- •
Sección quirúrgica vaginal en cm
- •
Tamaño de los parametrios, diferenciar de paracolpios
- •
Compromiso del parametrio y distancia de la sección en cm
- •
Descripción del resto de los órganos
- •
Tipo histológico: escamoso, adenocarcinoma, otros, mixto
- •
Grado histológico: bien, semi o poco diferenciado
- •
Grado nuclear y mitótico
- •
Extensión histológica en el cuello, vagina, útero y otros (recto, vejiga)
- •
Presencia de embolias linfáticas y vasculares
- •
Propagación parametral, embolias, compromiso ganglios parametrales, margen de sección quirúrgica
- •
Otros órganos extirpados
- •
Técnicas especiales que influyan en el diagnóstico final
Localización de los ganglios
- •
Tamaño
- •
Presencia de metástasis
- •
Tamaño de la metástasis
- •
Perforación de la cápsula ganglionar
- •
Número de ganglios totales resecados/ número de ganglios metastásicos, por grupo y en total
Estadios I-IIA:
Estadio IA1: el tratamiento quirúrgico dependerá de la edad, posibilidad de seguimiento, deseos de paridad y factores de riesgo. En la mujer joven sin factores de riesgo y deseo de paridad, podrá admitirse la conización diagnóstica como tratamiento definitivo en los casos de tumores escamosos con márgenes de tejido sano no menor de 5mm. En las mujeres con paridad cumplida, la histerectomía total extrafacial simple (tipo A), con o sin manguito, será el tratamiento. En pacientes con contraindicaciones quirúrgicas puede ser utilizada la braquiterapia.
Estadio IA2: el tratamiento clásico es la histerectomía radical tipo Piver III (tipo C). No obstante, se considera una opción válida efectuar una histerectomía radical modificada de Piver II (tipo B) o la operación de Shauta con linfadenectomía pelviana bilateral laparoscópica. En mujeres con deseos de paridad se indica la traquelectomía radical+linfanedectomía pelviana. En ciertos casos puntuales (edad avanzada, contraindicación quirúrgica o negativa de la paciente a la cirugía), es posible realizar braquiterapia (70-80Gy al punto A). En casos especiales se puede agregar radioterapia externa (45Gy a la pelvis). En este estadio actualmente se están investigando técnicas quirúrgicas en menos.
Estadios IB1 y IIA1: existen dos modalidades de tratamiento radical del CCU clínico temprano, la quirúrgica y la radiante.
1. Cirugía. Histerectomía radical Piver III con linfadenectomía pelviana bilateral: operación de Werthein-Meigs o Shauta. Esta última con la linfadenectomía pelviana laparoscópica.
2. Radioterapia. Radioterapia externa+braquiterapia (70-85Gy al punto A) con quimioterapia concurrente con cisplatino.
Ambas terapéuticas ofrecen la misma tasa de sobrevida, como lo demuestra el clásico trabajo prospectivo randomizado de Landoni de 1997 y la revisión actualizada del 2013 de la base de datos Cochrane. La modalidad elegida debe adecuarse a:
- -
condiciones de la paciente: se prefiere la cirugía, excepto en pacientes añosas y/o con contraindicaciones quirúrgicas, comorbilidades u obesidad.
- -
condiciones de la enfermedad: ante la existencia de factores tumorales de mal pronóstico asociados al compromiso ganglionar o evidencia del mismo en estudios por imágenes, se prefiere la quimioradioterapia, ya que en esos casos el indispensable tratamiento radiante complementario posquirúrgico duplicaría el riesgo de complicaciones propio de cada modalidad de tratamiento.
- -
condiciones del centro tratante: disponibilidad de equipamiento y experiencia en cirugía radical.
Los estadios IA2, IB1 y IIA con tamaño tumoral de hasta 2cm son pasibles de tratamiento conservador de fertilidad, siempre y cuando el tumor cervical sea exofítico, los ganglios linfáticos sean informados histológicamente negativos en la congelación y exista un consentimiento informado con solicitud de la paciente para efectuar este tipo de operación. Debe hacerse, además, una evaluación histeroscópica del canal endocervical para verificar su indemnidad.
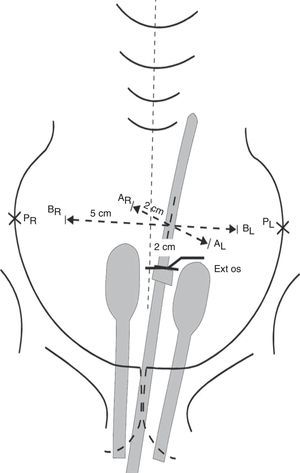
La operación es la traquelectomía radical, que consiste en la extirpación del cuello uterino con o sin conservación de la arteria uterina (TRAPAU o UNGAR, respectivamente), con extirpación de los parametrios y linfadenectomía pelviana bilateral, laparoscópica en el caso de traquelectomía por vía vaginal o abdominal si se elige la vía abdominal
El margen superior de la resección del cuello uterino debe ser examinado microscópicamente por congelación en el acto quirúrgico, dado que si resulta positivo, se suspende el tratamiento conservador y se procede a la cirugía radical convencional.
Conservación ováricaEn mujeres jóvenes tratadas quirúrgicamente se puede considerar, en caso de ovarios sanos, la posibilidad de conservación. Estos se fijan y marcan con clips radioopacos en situación extrapelviana supraumbilical (translocación ovárica) para su preservación funcional en caso de ser necesaria la irradiación pelviana posquirúrgica.
Preservación del plexo autonómico pelvianoEs recomendable la preservación del plexo autonómico pelviano (PPAP) en forma bilateral al efectuar la cirugía radical con el propósito de disminuir la morbilidad de la función vesical, rectal y sexual.
En los estadios IB2 y IIA2, el tratamiento de elección es la quimiorradiación concurrente. Cuando no existen las condiciones para garantizar una adecuada quimiorradiación concurrente, las opciones terapéuticas incluyen:
-quimioterapia neoadyuvante seguida de cirugía radical (operación de Wertheim-Meigs). Actualmente a la espera del resultado de protocolos prospectivos internacionales en curso para su validación, pero de uso tradicional en muchos centros del país (Hospital de Clínicas, Hospital Piñero, Hospital Fernández, Hospital Marie Curie, Hospital Penna, Hospital Bocalandro, Hospital Español, Hospital Provincial de Formosa).
- -
radioterapia externa+braquiterapia.
- -
cirugía: histerectomía radical con linfadenectomía pelviana bilateral.
Ante la presencia de un único factor anatomopatológico posquirúrgico de alto riesgo (ganglios positivos, parametrios con infiltración microscópica, sección de corte vaginal o parametrial positivo) o dos o más factores de riesgo intermedio (tamaño tumoral mayor de 4cm, compromiso mayor de 2/3 del miocérvix, invasión del espacio linfovascular), debe completarse el tratamiento quirúrgico con tratamiento radiante adyuvante.
Si hay margen vaginal positivo, se realiza braquiterapia. Todos los otros factores presentes requerirán tratamiento radiante externo con sensibilización con platino en los casos de alto riesgo.
La invasión profunda del miocérvix y la invasión linfovascular son factores independientes para la indicación de radioterapia posoperatoria, pero aún es controvertida.
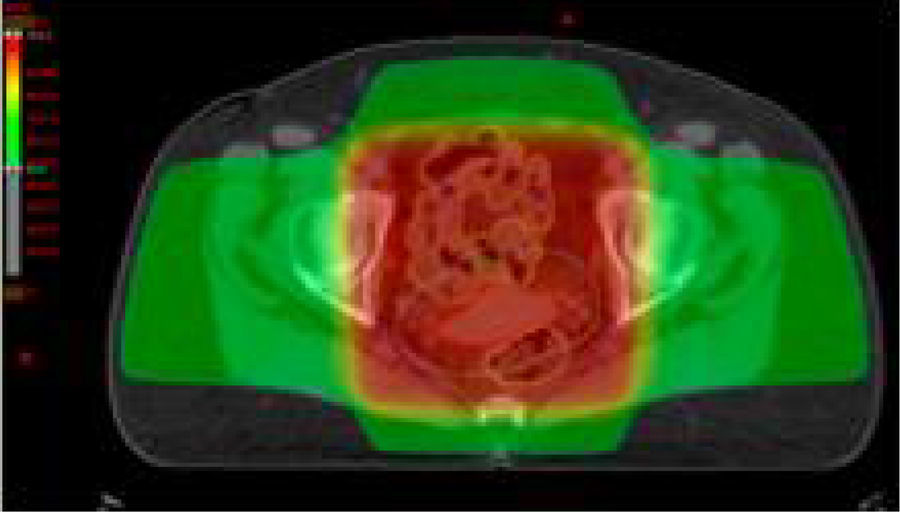
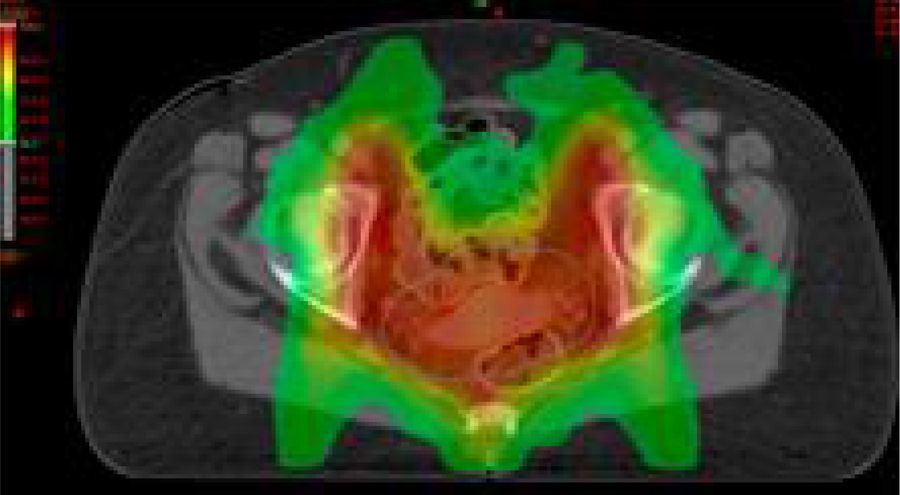
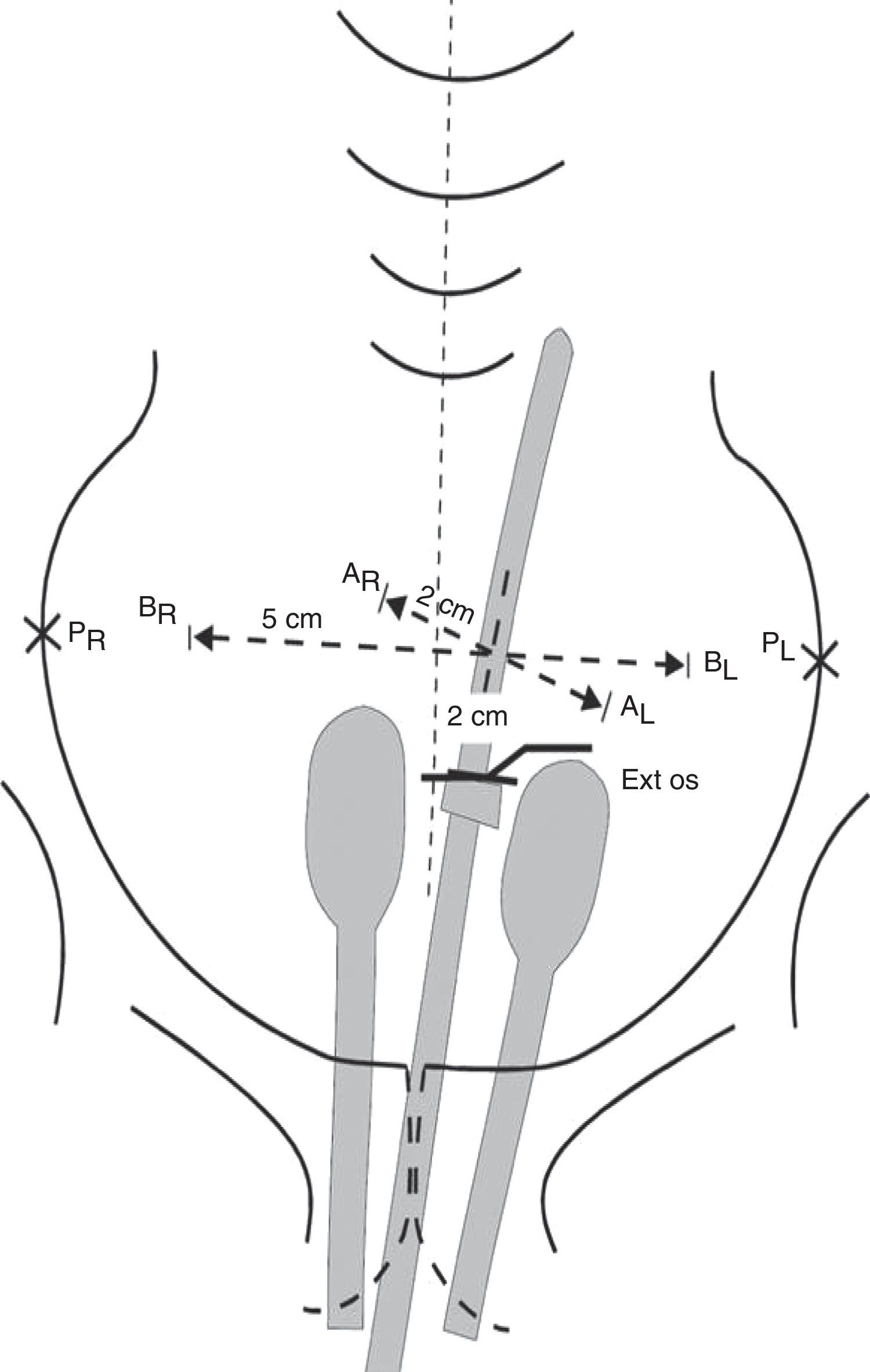
Estadios avanzados de cáncer de cuello uterinoEstadios IIB, IIIA, IIIB y IVAEn este grupo de pacientes la enfermedad está localmente avanzada, por lo que no son candidatas para la cirugía. El tratamiento estándar es la radioterapia externa más braquiterapia con quimioterapia concomitante. Es importante completar la radioterapia pelviana (45-50Gy) idealmente con 5-6 ciclos de cisplatino más braquiterapia (baja o alta tasa de dosis).
El agregado de cisplatino a la radioterapia ha demostrado que reduce la recurrencia local y mejora la sobrevida global en cinco ensayos aleatorizados. Se indica cisplatino concurrente en pacientes con adecuada función renal; en caso contrario, hay que considerar otros agentes radiosensibilizantes, como carboplatino, paclitaxel, fluorouracilo o gemcitabina semanal.
Se aconseja hemograma completo semanal, particularmente en pacientes que realizan el campo extendido, porque conlleva un volumen mayor de médula ósea expuesta.
En relación con el uso de quimioterapia y braquiterapia de alta tasa, se considera que las dosis del quinto y sexto ciclos de quimioterapia pueden coincidir con el inicio de la braquiterapia. Se recomienda no administrar quimioterapia en el mismo día de la braquiterapia, pero sí se puede administrar en el día de la radioterapia externa. No debe haber interrupción entre la radioterapia externa y la braquiterapia, ya que se compromete el control local y la sobrevida.
El tiempo total de radioterapia externa y braquiterapia no debe exceder las 8 semanas. La prolongación del tratamiento reduce el control local y la sobrevida en aproximadamente un 1% por cada día de demora en todos los estadios.
La anemia es una característica principal en pacientes con cáncer de cuello uterino. Esta disminuye la efectividad y resultado de la radioterapia debido a la radioresistencia de las células tumorales hipóxicas. Se acepta como valor óptimo 12g/dL de hemoglobina y se recomienda la transfusión con niveles por debajo de 10g/dL.
La evidencia actual no soporta aún el uso de la quimioterapia adyuvante. En el presente hay estudios en curso en estadios IIB que evalúan el rol de la neoadyuvancia seguida de cirugía.
Estadios IVBEste subgrupo se divide en pacientes con enfermedad lumboaórtica exclusiva o con diseminación a distancia (compromiso peritoneal, supraclavicular, mediastinal, pulmonar, hepático, óseo).
Estadio IVB (con compromiso de los ganglios paraaórticos)Las pacientes con enfermedad paraaórtica grosera por imágenes tienen un peor pronóstico. Los porcentajes de cura oscilan entre un 10 y un 30% con radioterapia de campo extendido y quimioterapia. Sin embargo, cabe reconocer que este tratamiento está asociado a una toxicidad grado 3 o mayor en aproximadamente el 30% de los casos. En presencia de enfermedad pelviana avanzada, dadas las bajas tasas de control local, se considera válido tratar solo la pelvis, y de acuerdo a la respuesta, evaluar el agregado de la región paraaórtica.
Los factores pronóstico más significativos incluyen: el tamaño de los ganglios, la extensión de la enfermedad pelviana y el performance status.
Estadio IVB (con metástasis a distancia) o recaídas a distanciaAnte la presencia de enfermedad metastásica, la cura no es posible y el tratamiento siempre es paliativo. En pacientes con adecuado performance status y adecuadas funciones orgánicas, se debe considerar la quimioterapia. Los esquemas a considerar son (*):
- 1
cisplatino/carboplatino+paclitaxel (el más recomendado).
- 2
cisplatino (o carboplatino)+paclitaxel+bevacizumab (recientemente aprobado por la ANMAT).
Otras drogas útiles son: docetaxel, gemcitabina, topotecan, ifosfamida, pemetrexed, vinorelbine, etc.
No hay un esquema estándar de segunda línea. Se sugiere usar monodrogas sobre combinaciones, ya que ninguna combinación demostró mejoría en la sobrevida o la participación en estudios de investigación.
Las pacientes con estadio IVB deben recibir tratamiento locorregional, previo o posterior al tratamiento sistémico, en función del caso clínico. Aquellas altamente seleccionadas con una sola metástasis o con enfermedad oligometastásica (de 1 a 5 metástasis) pueden beneficiarse de terapia local agresiva (cirugía, terapias ablativas, SBRT radioterapia estereotáctica corporal).
Recaída posradioterapia/quimioterapia local o a distancia y persistencia de enfermedad luego de tratamiento localHay que considerar el rol de la cirugía (exenteración pelviana) en casos seleccionados. Las recaídas locales centrales limitadas podrán recibir nuevamente irradiación y/o se debe considerar la exenteración pelviana en pacientes jóvenes en muy buen estado general.
En la enfermedad recurrente pelviana poscirugía, se debe tener en cuenta la quimioterapia/radioterapia como en la enfermedad localmente avanzada.
Acá también mantienen validez las recomendaciones de quimioterapia +/- bevacizumab consideradas en el apartado anterior (*).
La radioterapia puede ser útil en la paliación de síntomas específicos, como sangrado, compresión o dolor en pacientes con enfermedad metastásica.
SeguimientoEl seguimiento de las pacientes tratadas se hará mediante un control cada tres meses durante los dos primeros años y cada seis meses hasta los cinco años, para luego pasar a ser anual. Durante cada entrevista se efectuará un examen físico y pelviano completo (especuloscopia, tacto vaginal y rectal) con palpación de territorios ganglionares inguinales y supraclaviculares.
En los casos tratados con cirugía exclusiva hay que sumar en cada instancia una citología vaginal con colposcopia, mientras que en las pacientes sometidas a tratamiento radiante exclusivo o adyuvante, se aconseja realizar la citología vaginal en forma anual, sin colposcopia, por su baja sensibilidad y especificidad en el diagnóstico de recurrencias asintomáticas.
Los estudios por imágenes y endoscopias se indicarán a demanda ante la sospecha de progresión de la enfermedad.
Bibliografía recomendada- -
Choi CH, Lee JW, Kim TJ, Kim WY, Nam HR, Kim BG, et al. Phase II study of consolidation chemotherapy after concurrent chemoradiation in cervical cancer: preliminary results. Int J Radiat Oncol Biol Phys. 2007;68:817-22.
- -
Chemoradiotherapy for Cervical Cancer Meta-Analysis Collaboration. Reducing uncertainties about the effects of chemoradiotherapy for cervical cancer: a systematic review and meta-analysis of individual patient data from 18 randomized trials. J Clin Oncol. 2008;26:5802-12.
- -
Dueñas-González A, Zarbá JJ, Patel F, Alcedo JC, Beslija S, Casanova L, et al. Phase III, open-label, randomized study comparing concurrent gemcitabine plus cisplatin and radiation followed by adjuvant gemcitabine and cisplatin versus concurrent cisplatin and radiation in patients with stage IIB to IVA carcinoma of the cervix. J Clin Oncol. 2011;29:1678-85.
- -
Eifel PJ, Winter K, Morris M, Levenback C, Grigsby PW, Cooper J, et al. Pelvic irradiation with concurrent chemotherapy versus pelvic and para-aortic irradiation for high-risk cervical cancer: an update of Radiation Therapy Oncology Group trial (RTOG) 90-01. J Clin Oncol. 2004;22:872-80.
- -
Green J, Kirwan J, Tierney J, Vale C, Symonds P, Fresco L, et al. Concomitant chemotherapy and radiation therapy for cancer of the uterine cervix. Cochrane Database Syst Rev. 2005; (3):CD002225.
- -
Pearcey R, Brundage M, Drouin P, Jeffrey J, Johnston D, Lukka D, et al. Phase III trial comparing radical radiotherapy with and without cisplatin chemotherapy in patients with advanced squamous cell cancer of the cervix. J Clin Oncol. 2002;20:966-72.
- -
Pearcey R, Miao Q, Kong W, Zhang-Salomons J, Mackillop WJ. Impact of adoption of chemoradiotherapy on the outcome of cervical cancer in Ontario: results of a population-based cohort study. J Clin Oncol. 2007;25:2383-8.
- -
Peters WA, Liu PY, Barrett RGW, Stock RJ, Monk BJ, Berek JS, et al. Cisplatin, 5-Fluorouracil plus radiation therapy are superior to radiation therapy as adjunctive therapy in high risk, early stage carcinoma of the cervix after radical hysterectomy andpelvic lymphadenectomy: report of a Phase III inter group study. J Clin Oncol. 2000;18:1606-13.
- -
Rose PG, Bundy BN, Watkins EB, Thigpen JT, Deppe G, Maiman MA, et al. Concurrent cisplatin-based radiotherapy and chemotherapy for locally advanced cervical cancer. N Engl J Med. 1999;340:1144-53.
- -
Whitney CW, Sause W, Bundy BN, Malfetano JH, Hannigan EV, Fowler WC Jr, et al. Randomised comparison of fluorouracil plus cisplatin versus hydroxyurea in stage IIB/IVA in carcinoma of the cervix. J Clin Oncol. 1999;17:1339-48.
- -
Keys HM, Bundy BN, Stehman FB, Muderspach LI, Chafe WE, Suggs CL 3rd, et al. Cisplatin, radiation and adjuvant hysterectomy compared with radiation and adjuvant hysterectomy for bulky stage IB cervical carcinoma. N Engl J Med.1999;340:1154-61.
- -
Morris M, Eifel PJ, Lu J, Grigsby PW, Levenback C, Stevens RE, et al. Pelvic radiation with concurrent chemotherapy compared with pelvic and para-aortic radiation for high-risk cervical cancer. N Engl J Med. 1999;340:1137-43.
- -
Cancer Network. Chemotherapy plus radiation improves survival in patients with cervical cáncer. Oncology, 1999. Disponible en: http://www.cancernetwork.com/articles/chemotherapy-plus-radiation-improves-survival-patients-cervical-cancer (consultado Sept 2016)
- -
Asociación Argentina de Ginecología Oncológica. Guías clínicas para el diagnóstico, tratamiento y seguimiento del cáncer genital femenino. Buenos Aires: Ascune; 2013:47-63.
- -
National Comprehensive Cancer Network. Clinical practice guidelines in oncology: cervical cancer. Version 1.2014. Disponible en: https://www.nccn.org/professionals/physician_gls/f_guidelines.asp
- -
Sardi J, Sananes C, Giaroli A, Bayo J, Rueda NG, Vighi S, et al. Results of prospective randomized trials with neoadjuvant chemotherapy in stage IB, bulky, squamous carcinoma of the cervix. Ginecol Oncol. 1993;49:156-65.
- -
Benedetti-Panici P, Greggi S, Scambia G, Amoroso M, Salerno MG, Maneschi F, et al. Long-term survival following neoadjuvant chemotherapy and radical surgery in locally advanced cervical cancer. Eur J Cancer. 1998;34:341-6.
- -
Kim HS, Kim JY, Park NH, Kim K, Chung HH, Kim YB, et al. Matched-case comparison for the efficacy of neoadjuvant chemotherapy before surgery in FIGO stage IB1-IIA cervical cancer. Gynecol Oncol. 2010;119:217-24.
- -
Rydzewska L, Tierney J, Valw CL, Symonds PR. Neoadyuvant chemotherapy plus surgery for cervical cancer. Cochrane Database Syst Rev. 2012;12:CD007406.
- -
Shoji T, Takatori E, Saitoi T, Omi H, Kagabu M, Miura F, et al. Neoadjuvant chemotherapy using platinum-taxane regimens for bulky stage IB2 to IIB non-squamous cell carcinoma of the uterine cervix. Cancer Chemother Pharmacol. 2013;71:657-63.
- -
Uegaki K, Shimada M, Sato S, Deura I, Naniwa J, Sato S, et al. Outcome of stage IB2-IIB patients with bulky uterine cervical cancer who underwent neoadjuvant chemotherapy followed by radical hysterectomy. Int J Clin Oncol. 2014;19:348-53.
- -
Neoadjuvant Chemotherapy for Locally Advanced Cervical Cancer Meta-analysis Collaboration. Neoadjuvant chemotherapy for locally advanced cervical cancer: a systematic review and meta-analysis of individual patient data fron21 randomised trials. Eur J Cancer. 2003;39:2470-86.
- -
Lorusso D, Petrelli F, Coinu A, Raspagliesi F, Barni S. A systematic review comparing cisplatin and carboplatin plus paclitaxel-based chemotherapy for recurrent or metastatic cervical cancer. Gynecol Oncol. 2014;133:117-23.
- -
Cibula D, Abu-Rustum N, Benedetti-Panici P, Kohler C, Rapagliese F, Querleu D, et al. New classification system of radical hysterectomy: emphasis on a three-dimensional anatomic template for parametrial resection. Gynecol Oncol. 2011;122:264-8.
- -
Neoadjuvant Chemotherapy for Cervical Cancer Meta-Analysis Collaboration (NACCCMA) Collaboration. Neoadjuvant chemotherapy for locally advanced cervix cancer.Cochrane Database Syst Rev. 2004;(2):CD001774.
- -
Tang J, Tang Y, Yang J, Huang S. Chemoradiation and adjuvant chemotherapy in advanced cervical adenocarcinoma. Gynecol Oncol. 2012;125:297-302.
- -
Hu T, Li S, Chen Y, Shen J, Li X, Huang K, et al. Matched-case comparison of neoadjuvant chemotherapy in patients with FIGO stage IB1–IIB cervical cancer to establish selection criteria. Eur J Cancer. 2012;48:2353-60.
- -
Singh RB, Chander S, Mohanti BK, Pathy S, Kumar S, Bhatla N, et al. Neoadjuvant chemotherapy with weekly paclitaxel and carboplatin followed by chemoradiation in locally advanced cervical carcinoma: a pilot study. Gynecol Oncol. 2013;129:124–8.
- -
Chen H, Liang C, Zhang L, Huang S, Wu X. Clinical efficacy of modified preoperative neoadjuvant chemotherapy in the treatment of locally advanced (stage IB2 to IIB) cervical cancer: randomized study. Gynecol Oncol. 2008;110:308-15.
- -
Gong L, Lou JY, Wang P, Zhang JW, Liu H, Peng ZL. Clinical evaluation of neoadjuvant chemotherapy followed by radical surgery in the management of stage IB2-IIB cervical cancer. Int J Gynaecol Obstet. 2012;117:23-6.
- -
Ren Y, Li Y, Liu J. A modified shortened administration schedule for neoadjuvant chemotherapy with irinotecan and cisplatin in locally advanced cervical cancer. Int J Gynecol Cancer. 2011;21:685-9.
- -
Rogers L, Siu SS, Luesley D, Bryant A, Dickinson HO. Radiotherapy and chemoradiation after surgery for early cervical cancer. Cochrane Database Syst Rev. 2012;5:CD007583.
- -
Koh WJ, Greer BE, Abu-Rustum NR, Apte SM, Campos SM, Chan J, et al. Cervical cancer. J Natl Compr Canc Netw. 2013;11:320-43.
- -
Wen H, Wu X, Li Z, Wang H, Zang R, Sun M, et al. A prospective randomized controlled study on multiple neoadjuvant treatments for patients with stage IB2 to IIA cervical cancer. Int J Gynecol Cancer. 2012;22:296-302.
- -
Kim HS, Sardi JE, Katsumata N, Ryu HS, Nam JH, Chung HH, et al. Efficacy of neoadjuvant chemotherapy in patients with FIGO stage IB1 to IIA cervical cancer: an international collaborative meta-analysis. Eur J Surg Oncol. 2013;39:115-24.
- -
González-Martín A, González-Cortijo L, Carballo N, García JF, Lapuente F, Rojo A, et al. The current role of neoadjuvant chemotherapy in the management of cervical carcinoma. Gynecol Oncol. 2008;110:S36-40.
- -
Tewari KS, Sill MW, Long HJ 3rd, Penson RT, Huang H, Ramondetta LMet al. Improved survival with bevacizumab in advanced cervical cancer. N Engl J Med. 2014:370;734-43.
- -
Monk BJ, Sill MW, McMeekin DS, Cohn DE, Ramondetta LM, Boardman CH, et al. Phase III trial of four cisplatin-containing recurrent, or persistent cervical carcinoma: a Gynecologic Oncology Group study. J Clin Oncol. 2009;27:4649-55.
- -
Tewari KS. A critical need for reappraisal of therapeutic options for women with metastatic and recurrent cervical carcinoma: commentary on Gynecologic Oncology Group protocol 204. Am J Hematol Oncol. 2010;9:31-4.
- -
Tewari KS, Monk BJ. The rationale for the use of non-platinum chemotherapy doublets for metastatic and recurrent cervical carcinoma. Clin Adv Hematol Oncol 2010;8:108-15.
- -
Moore DH, Blessing JA, McQuellon RP, Thaler HT, Cella D, Benda J, et al. Phase III study of cisplatin with or without paclitaxel in stage IVB, recurrent, or persistent squamous cell carcinoma of the cervix: a gynecologic oncology group study. J Clin Oncol. 2004;22:3113-9.
- -
Long HJ 3rd, Bundy BN, Grendys EC Jr, Benda JA, McMeekin DS, Sorosky J, et al. Randomized phase III trial of cisplatin with or without topotecan in carcinoma of the uterine cervix: a Gynecologic Oncology Group study. J Clin Oncol. 2005; 23:4626-33.
- -
Moore DH, Tian C, Monk BJ, Long HJ, Omura GA, Bloss JD. Prognostic factors for response to cisplatin-based chemotherapy in advanced cervical carcinoma: a Gynecologic Oncology Group study. Gynecol Oncol. 2010;116:44-9.
- -
Leung DW, Cachianes G, Kuang WJ, Goeddel DV, Ferrara N. Vascular endothelial growth factor is a secreted angiogenic mitogen. Science. 1989;246:1306-9.
- -
Monk BJ, Sill MW, Burger RA, Gray HJ, Buekers TE, Roman LD. Phase II trial of bevacizumab in the treatment of persistent or recurrent squamous cell carcinoma of the cervix: a Gynecologic Oncology Oncology Group study. J Clin Oncol. 2009;27:1069-74.
- -
Tiersten AD, Selleck MJ, Hershman DL, Smith D, Resnik EE, Troxel AB, et al. Phase II study of topotecan and paclitaxel for recurrent, persistent, or metastatic cervical carcinoma. Gynecol Oncol. 2004;92:635-8.
- -
Bodily JM, Mehta KP, Laimins LA. Human papillomavirus E7 enhances hypoxia-inducible factor 1-mediated transcription by inhibiting binding of histone deacetylases. Cancer Res. 2011;71:1187-95.
- -
Ferrara N, Hillan KJ, Gerber HP, Novotny W. Discovery and development of bevacizumab, an anti-VEGF antibody for treating cancer. Nat Rev Drug Discov. 2004;3:391-400.
- -
Cadron I, Van Gorp T, Amant F, Leunen K, Neven P, Vergote I. Chemotherapy for recurrent cervical cancer. Gynecol Oncol. 2007;107(1 Suppl 1):S113-8.
- -
Choi CH, Kim TJ, Lee SJ, Lee JW, Kim BG, Lee JH, et al. Salvage chemotherapy with a combination of paclitaxel, ifosfamide, and cisplatin for the patients with recurrent carcinoma of the uterine cervix. Int J Gynecol Cancer. 2006;16:1157-64.
- -
Dimopoulos MA, Papadimitriou CA, Sarris K, Aravantinos G, Kalofonos C, Gika D, et al. Combination of ifosfamide, paclitaxel, and cisplatin for the treatment of metastatic and recurrent carcinoma of the uterine cervix: a phase II study of the Hellenic Cooperative Oncology Group. Gynecol Oncol. 2002;85:476-82.
- -
Kosmas C, Mylonakis N, Tsakonas G, Vorgias G, Karvounis N, Tsavaris N, et al. Evaluation of the paclitaxel–ifosfamide–cisplatin (TIP) combination in relapsed and/or metastatic cervical cancer. Br J Cancer. 2009;101:1059-65.
- -
Mountzios G, Dimopoulos MA, Bamias A, Vourli G, Kalofonos H, Aravantinos G, et al. Randomized multicenter phase II trial of cisplatin and ifosfamide with or without paclitaxel in recurrent or metastatic carcinoma of the uterine cervix: a Hellenic Cooperative Oncology Group (HeCOG) study. Ann Oncol. 2009;20:1362-8.
- -
Zanetta G, Fei F, Parma G, Balestrino M, Lissoni A, Gabriele A, et al. Paclitaxel, ifosfamide and cisplatin (TIP) chemotherapy for recurrent or persistent squamous-cell cervical cancer. Ann Oncol. 1999;10:1171-4.
- -
Downs LS Jr, Chura JC, Argenta PA, Judson PL, Ghebre R, Geller MA, et al. Ifosfamide, paclitaxel, and carboplatin, a novel triplet regimen for advanced, recurrent, or persistent carcinoma of the cervix: a phase II trial. Gynecol Oncol. 2011;120:265-9.
- -
-Mabuchi S, Morishige K, Fujita M, Tsutsui T, Sakata M, Enomoto T, et al. The activity of carboplatin and paclitaxel for recurrent cervical cancer after definitive radiotherapy. Gynecol Oncol. 2009;113:200-4.
- -
Torfs S, Cadron I, Amant F, Leunen K, Berteloot P, Vergote I. Evaluation of paclitaxel/ carboplatin in a dose dense or weekly regimen in 66 patients with recurrent or primary metastatic cervical cancer. Eur J Cancer. 2012;48:1332-40.
- -
Garces AH, Mora PA, Alves FV, do Carmo CC, Grazziotin R, Fernandes AC, et al. First-line paclitaxel and carboplatin in persistent/recurrent or advanced cervical cancer: a retrospective analysis of patients treated at Brazilian National Cancer Institute. Int J Gynecol Cancer. 2013; 23:743-8.
- -
Elit L, Fyles AW, Oliver TK, Devries-Aboud MC, Fung-Kee-Fung M; members of the Gynecology Cancer Disease Site Group of Cancer Care Ontario's Program in Evidence-Based Care. Follow-up for women after treatment for cervical cancer. Curr Oncol. 2010;17:65-9.
- -
Salani R, Backes FJ, Fung MF, Holschneider CH, Parker LP, Bristow RE, et al. Posttreatment surveillance and diagnosis of recurrence in women with gynecologic malignancies: Society of Gynecologic Oncologists recommendations. Am J Obstet Gynecol. 2011;204:466-78.
- -
Li Z, Barron S, Hong W, Karunamurthy A, Zhao C. Surveillance for recurrent cancers and vaginal epithelial lesions in patients with invasive cervical cancer after hysterectomy: are vaginal cytology and high-risk human Papillomavirus testing useful? Am J Clin Pathol. 2013;140:708-14.
- -
-National Comprehensive Cancer Network. Clinical practice guidelines in oncology: cervical cancer. Version 2.2015. Disponible en: https://www.nccn.org/professionals/physician_gls/f_guidelines.asp
Desde principios de 1900, la radiación se ha utilizado en el manejo curativo del cáncer de cuello de útero, con una combinación de radioterapia externa (RTE) y braquiterapia. Durante los siguientes 100 años, las técnicas y los equipos utilizados han evolucionado, debiendo ser hoy en día la radioterapia tridimensional conformada (RT3DC) el estándar de tratamiento radiante externo.
TécnicasEnergíasEl equipamiento mínimo recomendado es el equipo de telecobalto isocéntrico con distancia fuente piel por lo menos de 80cm. Se prefieren altas dosis de fotones, generadas por aceleradores lineales, especialmente en pacientes cuyo diámetro anteroposterior pelviano es mayor de 20cm y en pacientes con campos extendidos.
-Radioterapia convencional o 2D: la técnica 2D utiliza el simulador convencional, donde se obtienen imágenes radiográficas ortogonales del paciente, para el diseño del campo de tratamiento según referencias óseas (fig. 1). Los típicos límites de campo para el tratamiento se encuentran la tabla 2.
Límites típicos de campo para el tratamiento
| Nombre del campo | Límite | Reparos óseos |
|---|---|---|
| AP-PA | Superior | L4-L5 o L5-S1 (espacio intervertebral) |
| Inferior | Borde inferior del agujero obturador, en caso de extensión vaginal el margen distal debería estar a 3cm del compromiso tumoral más caudal | |
| Lateral | 2cm lateral al borde del agujero pelviano (para cubrir ilíacos externos y obturadores) | |
| Laterales | Superior | L4-L5 o L5-S1 (espacio intervertebral) |
| Inferior | Borde inferior del agujero obturador, en caso de extensión vaginal el margen distal debería estar a 3cm del compromiso tumoral más caudal | |
| Anterior | Cara anterior de la sínfisis pubiana | |
| Posterior | Incluir todo el agujero sacro con margen de 1 a 1,5cm | |
| Boost parametrial | Superior | Borde inferior de la articulación sacroilíaca |
| Inferior | Borde inferior del agujero obturador, en caso de extensión vaginal el margen distal debería estar a 3cm del compromiso tumoral más caudal | |
| Medial | Si es unilateral, el bloque central que protege la vejiga, el recto y el intestino delgado, si es bilateral es un campo dividido en el centro por dicho bloque | |
| Lateral | 2cm lateral al borde del agujero pelviano (para cubrir ilíacos externos y obturadores) | |
| Lumboaórticos | Superior | Límite superior de T12 |
| Inferior | L4-L5 o L5-S1 (espacio intervertebral) | |
| Campo extendido | Pelvis+lumboaórticos |
-Radioterapia 3D conformada (RT3DC): con la técnica de RT3DC con planificación virtual se incorporan al planificador cortes tomográficos cada 3 a 5mm, que reproducen una imagen tridimensional del tumor en la computadora, con la consiguiente reconstrucción espacial de los órganos vecinos de interés (cabezas femorales, vejiga, recto, intestinos delgado y grueso). De este modo, la radiación, conforme el contorno del área de tratamiento, asegura la óptima cobertura del blanco y logra distribuciones de dosis volumétricas, producto de los diversos campos de radiación empleados, permitiendo concentrar altas dosis terapéuticas en el tumor con mínimo compromiso del tejido sano (fig. 2).
-Intensidad modulada (IMRT): modula la intensidad del haz para reducir dosis en los órganos de riesgo, lo cual es particularmente beneficioso en pacientes pos-histerectomía. También es útil para escalar dosis en ganglios identificados por métodos diagnósticos (fig. 3).
-Radioterapia guiada por imágenes: es una IMRT que permite localizar y corregir la posición del volumen blanco en forma diaria para garantizar la precisión.
Radioterapia externa como tratamiento primarioEl objetivo de la RTE es reducir el tumor primario voluminoso y mejorar su geometría para una posterior braquiterapia óptima. La dosis en pelvis recomendada es: 45Gy en 25 fracciones de 1,8Gy o 46Gy en 23 fracciones de 2,0Gy. La dosis de 50,4 en 28 fracciones se usa comúnmente en pacientes con estadios avanzados. Se recomienda que la dosis prescripta que engloba el PTV (planning target volume) sea al menos del 98%, según recomendaciones de la Comisión Internacional de Unidades y Medidas (ICRU, reporte 50).
La RTE debe ser planificada para tratar el volumen target clínico (CTV) que comprende:
- 1.
Tumor primario y su extensión local (gross tumor volume GTV)
- 2.
Cuello uterino y útero completos
- 3.
Vagina superior o 3-4cm por debajo del límite inferior del tumor
- 4.
Ligamentos parametriales y útero-sacros
- 5.
Cadenas ganglionares linfáticas pelvianas incluyendo obturadores, ilíacas externa e interna, ilíaca común y ganglios presacros
El volumen target de planificación o PTV proporciona un margen de 0,5, 0,7 o 1cm alrededor del CTV para compensar variables del posicionamiento y movimiento de los órganos internos.
Radioterapia adyuvanteEl GTV se ha resecado en la cirugía, por lo que el volumen blanco comprende el lecho tumoral quirúrgico, el cual está delineado mediante tomografía y/o resonancia magnética preoperatoria, protocolo quirúrgico y hallazgos histológicos para incluir sitios con alto riesgo de recurrencia.
Radioterapia lumboaórtica o campo extendidoDebe abarcar la totalidad de los ganglios pélvicos y paraaórticos en un solo campo continuo o con un campo pelviano y otro paraaórtico separado. Se recomienda proteger ambos riñones y mantener la dosis de la médula espinal por debajo de los 45Gy.
Se aconseja una dosis de 45 y si hay compromiso ganglionar, se puede realizar un boost sobre adenomegalias de 5-10Gy. Si se dispone de IMRT, es posible escalonar la dosis en el área de boost con mayor protección.
Radioterapia paliativaLos síntomas de sangrado o dolor por cáncer de cuello uterino localmente avanzado se pueden aliviar con radioterapia de corta duración y en pequeño volumen, inclusive en casos de reirradiación. Se sugiere generar un plan de varios haces localizado al tumor grosero (GTV) para reducir la toxicidad y asegurar la paliación.
BraquiterapiaLa braquiterapia es un importante componente en el manejo curativo del cáncer de cérvix y mejora significativamente la sobrevida. La de alta tasa (velocidad de dosis ≥ 12Gy/h) y la de baja tasa (velocidad de dosis 0,4 a 2Gy/h) parecen ser tratamientos relativamente equivalentes en términos de sobrevida y resultados, en base a estudios retrospectivos y prospectivos.
La braquiterapia permite la entrega de dosis altas al volumen tumoral central para obtener control local máximo, sin exceder la tolerancia de los tejidos normales circundantes. Usualmente se realiza con dispositivos intracavitarios (tándem intrauterino, colpostatos, ovoides, anillos o cilindros vaginales).
En estadios avanzados se recomienda realizarla hacia el final o después de completar la RT externa, una vez obtenida una adecuada geometría tumoral, que permita la correcta colocación del dispositivo ginecológico intracavitario y una óptima distribución de dosis.
En pacientes que reciben cisplatino semanal, se aconseja que la QT no se administre el mismo día de la braquiterapia.
Una opción razonable para tumores menores de 4cm puede ser administrar la braquiterapia de alta tasa semanalmente de forma concomitante con la RT externa. No se debe administrar BT el mismo día de la RT externa.
En pacientes seleccionadas poshisterectomía (especialmente aquellas con margen vaginal cercano, invasión vasculolinfática o extensión vaginal), la braquiterapia en cúpula puede ser usada como boost después de la RT externa.
La planificación histórica se basa en un sistema que consiste en dosis prescriptas a puntos de referencia definidos. El punto A se define como un punto 2cm lateral a la cavidad uterina central y 2cm superior al fórnix lateral en el plano del útero. Se encuentra dentro de los tejidos paracervicales cerca de la arteria uterina y el uréter, y fue elegido para tener en cuenta la tolerancia de las estructuras normales adyacentes limitantes de la dosis. El punto B se define 3cm laterales al punto A, y se utiliza para proporcionar una indicación de la dosis al parametrio distal (fig. 4).
Braquiterapia 3D: Este método se basa en la TC y/o RM en vez de radiografías ortogonales 2D. Las dosis se prescriben a volúmenes en lugar de hacer puntos de referencia. El grupo GEC-ESTRO ha publicado recomendaciones sobre conceptos de volumen y evaluación del plan, utilizando histogramas de dosis volumen. (tabla 3)
| Intención del tratamiento | Estadio | Radioterapia externa | Braquiterapia | |||
|---|---|---|---|---|---|---|
| Radical (cuello intacto) | Pelvis total (Gy) | Boost parametrios (Gy) | Dosis total punto A (Gy) | |||
| (*Se tratan lesiones in situ o multifocales y estadios IA1 y IA2 en pacientes en las que se haya descartado la posibilidad quirúrgica) | Lesiones in situ o multifocal* | +/-45 | - | 45 | ||
| IA1-IA2* | - | - | 70-80 | |||
| IB1 | 45 | - | 80-85 | |||
| IB2-IIA | 45 | - | 85 | |||
| IIB | 45 | 9-15 | 85 | |||
| III | 45-50 | 9-15 | 85-90 | |||
| IIB,IIIB,IVA/IVB | 45-50 boost tumor: 10,8 | 0-15 | 75-85 | |||
| Adyuvante (poshisterectomía) Riesgo intermedio (Sedis GOG 92) | IVL | Profundidad | Tamaño | 45-50 | 0 | 50-60 Boost con BT si hay LVSI +extensión vahginal o márgenes (≤ 1 cm) Grado de recomendación C |
| + | Profunda | Cualquiera | ||||
| + | Media | ≥ 2 cm | ||||
| + | Superficial | ≥ 5 cm | ||||
| - | Media o Profunda | ≥ 4 cm | ||||
| Alto riesgo (Peters RTOG 91-12) | 1. Compromiso parametrial | 45-50 | 0 | 50-60 Boost con BT en caso de márgenes positivos y/o parametrios positivos | ||
| 2. Ganglios positivos | ||||||
| 3. Márgenes positivos | ||||||
| Lumboaórticos | Cualquier estadio con compromiso LAO (+) (no se aconseja la RT en LAO profiláctica) | 45Gy en 25 fracciones | Boost ganglionar 5-10 Gy | |||
| Paliativos | Localizar el tumor grosero | 30 en 10 | - | Individualizar | ||
| 20 en 5 | ||||||
| 3,7 BID c/3-4 semanas y 8-10 | ||||||
| única dosis | ||||||
- -
International Atomic Energy Agency. Management of cervical cancer strategies for limited-resource centres. A guide for radiation oncologists. Human Health Reports N.° 6. Vienna: IAEA; 2014.
- -
Berek JS, Hacker NF. Ginecología oncológica práctica. Filadelfia: Lippincott Williams and Wilkins; 2010:119-61.
- -
Berek JS, Hacker NF. Ginecología oncológica práctica. Filadelfia: Lippincott Williams and Wilkins; 2010:337-95.
- -
National Comprehensive Cancer Network. Clinical practice guidelines in oncology: cervical cancer. Version 2, 2015. Disponible en: https://www.nccn.org/professionals/physician_gls/f_guidelines.asp
- -
Perez C, Brady L, Halperin E, Wazer D, eds. Principles and practice of radiation oncology. Filadelfia: Lippincott Williams and Wilkins; 2013:1355.
- -
Bermudez RL. Cervical cancer. En: Hansen E, Roach M, eds. Handbook of evidence-based radiation oncology. Nueva York: Springer-Verlag; 2006:499.
- -
Viswanathan AN, Erickson BA. Three-dimensional imaging in gynecologyc brachytherapy: a survey of the American Brachyterapy Society. Int J Radiation Biol Phys. 2010;76:104-9.
- -
International Commission On Radiation Units and Measurements. Dose and volume specification for reporting intracavitary therapy in gynecology (report 38). Bethesda, USA: ICRU;1985.
- -
Landoni F, Maneo A, Colombo A, Placa F, Milani R, Perego P, et al. Randomised study of radical surgery versus radiotherapy for stage Ib-IIa cervical cancer. Lancet. 1997;350:535-40.
- -
Lim K, Small W Jr, Portelance L, Creutzberg C, Jürgenliemk-Schulz IM, Mundt A, et al. Consensus guidelines for delineation of clinical target volume for intensity-modulated pelvic radiotherapy for the definitive treatment of cervix cancer. Int J Radiat Oncol Biol Phys. 2011;79:348-55.
- -
Keys HM, Bundy BN, Stehman FB, Muderspach LI, Chafe WE, Suggs CL 3rd, et al. Cisplatin, radiation, and adjuvant hysterectomy compared with radiation and adjuvant hysterectomy for bulky stage IB cervical carcinoma. N Engl J Med. 1999;340:1154-61.
- -
Eifel PJ, Winter K, Morris M, Levenback C, Grigsby PW, Cooper J, et al. Pelvic irradiation with concurrent chemotherapy versus pelvic and para-aortic irradiation for high-risk cervical cancer: an update of radiation therapy oncology group trial (RTOG) 90-01. J Clin Oncol. 2004;22:872-80.
- -
Rotman M, Sedlis A, Piedmonte MR, Bundy B, Lentz SS, Muderspach LI, et al. A phase III randomized trial of postoperative pelvic irradiation in Stage IB cervical carcinoma with poor prognostic features: follow-up of a gynecologic oncology group study. Int J Radiat Oncol Biol Phys. 2006;65:169-76.
- -
Loiselle C, Koh WJ. The emerging use of IMRT for treatment of cervical cancer. J Natl Compr Canc Netw. 2010;8:1425-34.
La verdadera incidencia del cáncer de cuello uterino y embarazo se desconoce, pero se estima que es el 0,05 de todos los embarazos, con una incidencia de 1 CCU cada 1000 a 100.000 embarazadas. Constituye el cáncer más común en la mujer embarazada, luego de los linfomas y los melanomas.
Todavía no se ha demostrado que la sobrevida sea diferente, cuando se compara con las mujeres no embarazadas con el mismo estadio y tipo histológico. Las causas del empeoramiento de la sobrevida se deben generalmente a la demora en el diagnóstico y, una vez efectuado, a las dificultades que sobrevienen para una correcta derivación a una institución donde exista la posibilidad de efectuar un tratamiento integral del CCU y el embarazo.
Las embarazadas tienen mayor posibilidad de acceder a una citología del cuello uterino. Tal es así, que el 50% de los CCU y embarazo se diagnostican en el estadio I. En países en vías de desarrollo el diagnóstico es más tardío y la derivación más dificultosa, agravándose por la falta de normatizaciones, lo que acarrea menores posibilidades de sobrevida para la madre y el recién nacido.
Recursos diagnósticosSon la citología, la colposcopia y la biopsia. Esta última da el diagnóstico de certeza. Respecto a la citología, en un gran número de casos puede estar alterada y requerir repetición, debido a tomas incorrectas, infecciones agregadas, etc.
Una vez confirmada la citología, se hacen la colposcopia y la biopsia, la cual debe efectuarse con una pinza adecuada (de mordida pequeña) para evitar la posibilidad de una hemorragia.
El raspado endocervical (LEC) correcto no aumenta el número de abortos, pero un buen cepillado endocervical puede reemplazar al LEC.
Si bien la conización puede realizarse, no es aconsejable dado las múltiples complicaciones que puede producir, como: hemorragias (5-14%), abortos en el primer trimestre (18-25%) y partos prematuros en menores de 35 semanas (12%). En casos muy puntuales se puede hacer conización con Leep.
EstadificaciónNo hay uniformidad de criterios sobre la mayor facilidad o dificultad para el examen ginecológico. Los tejidos durante la gestación están más flácidos, por lo que los parametrios no siempre se individualizan como infiltrados, a pesar de estarlo. Lo mismo ocurre con el cuello uterino, dado que no siempre se puede evaluar su tamaño y textura. Por otra parte, el útero gestante impide una correcta evaluación de los fondos de los sacos y los parametrios anterior y posterior.
Métodos auxiliares aceptados por FIGO para el diagnóstico de estadificaciónDentro de los estudios para la estadificación, la cistoscopia y la rectoscopia se pueden realizar. El urograma excretor es reemplazado por la urorresonancia.
La FIGO considera que la RM en el CCU y el embarazo da datos seguros sobre el tamaño tumoral, el compromiso de los fondos de los sacos, la infiltración de los parametrios y la existencia de ganglios pelvianos y/o lumboaórticos sospechosos. Es un método seguro para una estadificación correcta.
Consideraciones respecto a las propuestas terapéuticasVan a depender de varios puntos, como:
- 1
Deseo de la mujer de preservar o no el embarazo
- 2
Estadio de la enfermedad y tamaño tumoral
- 3
Estadio ganglionar
- 4
Tipo histológico
Evidentemente la decisión terapéutica es más sencilla cuando el embarazo no es deseado y el feto no es viable, pero es más difícil cuando el embarazo es deseado y el feto aún no es viable o no está maduro.
Habitualmente se decía que en el primer trimestre se trataba a la madre, no importando el feto, que en el tercer trimestre se esperaba la viabilidad y luego se trataba, y que en el segundo trimestre se consensuaba con la madre según el estadio, pero actualmente se considera que la opinión de la madre es condicionante, aun en el primer trimestre.
Decisiones terapéuticas1- Tercer trimestre de la gestación con feto maduro o madurable
En pacientes con estadios quirúrgicos se efectúa una cesárea (tipo Opitz) en un centro que, además de tener ginecólogos oncólogos, cubra las necesidades neonatológicas. El parto indudablemente debe ser siempre por cesárea, dado que las recurrencias poscesárea son del 14%, mientras que, en las mismas condiciones clínicas, si el parto ha sido por vía vaginal, las recurrencias ascienden al 59%. El parto vaginal es más grave que el estadio en la evolución de la paciente.
2-Tercer trimestre con paciente en estadio avanzado y feto maduro o madurable
El obstetra estará de acuerdo con el ginecólogo oncólogo para aprovechar el acto quirúrgico de la cesárea para luego efectuar la estadificación quirúrgica. Se investiga el estado ganglionar pelviano y lumboaórtico, para indicar radioterapia extendida en el caso de positividad de estos últimos. Se evalúan los espacios, el estado del peritoneo y eventualmente se efectúa una linfadenectomía. A continuación se realiza el tratamiento de quimiorradiación concurrentes.
Decisiones terapéuticas donde no hay deseo de conservar el embarazo:
*Primer trimestre con estadio inicial (IB1): operación de Werthein-Meigs con embarazo in situ o microcesárea seguida de operación de Werthein-Meigs.
*Primer trimestre con estadio IIB y IIIB: quimiorradiación concurrente con o sin evacuación uterina previa.
En una gestación menor de 22 semanas y estadio IB2 - IIA, con deseo de conservar el embarazo, se debe realizar una RM. Si hay ganglios positivos, a pesar del deseo de la conservación del embarazo, se debe volver a plantear con la paciente la necesidad de efectuar tratamiento. Por el contrario, si los ganglios son negativos, se puede proponer quimioterapia neoadyuvante y, con la madurez fetal, una cesárea seguida en el mismo acto de una operación de Werthein-Meigs. Si se decide esta conducta, entre la última serie de quimioterapia y la cesárea debe haber un intervalo de 25 a 30 días para evitar la mielosupresión del recién nacido.
Conceptos generales sobre el uso de la quimioterapia durante el embarazoDurante el embarazo se producen cambios fisiológicos que afectan a los principales procesos farmacocinéticos, incluyendo la absorción, distribución, metabolismo y excreción.
La información reciente apoya la evidencia previa de que la quimioterapia después de las 14 semanas no se asocia con mayores tasas de defectos al nacimiento (ni a largo plazo), en relación con la tasa en la población general (3%), en tanto antes de esa edad gestacional asciende hasta un 20%. Sin embargo, es importante señalar que no todos los agentes quimioterapéuticos deben considerarse como “igualmente seguros”, incluso cuando se administran después de las 14 semanas.
El cálculo de la dosis debe seguir los procedimientos estándares, fuera del entorno del embarazo, reconociendo que la farmacocinética de algunos fármacos citotóxicos puede ser alterada durante el embarazo.
La quimioterapia no debe ser administrada después de la semana 33 de la gestación.
*Esquemas de QT neoadyuvante a considerar: cisplatino (75mg/m2 cada 3 semanas) o carboplatino±paclitaxel cada 3 semanas o semanal.
*Radioterapia: en caso de estar indicada la RT, esta debe diferirse hasta completar la involución uterina, que típicamente ocurre al mes.
Bibliografía recomendada- -
Azim HA Jr, Peccatori FA, Pavlidis N. Treatment of the pregnant mother with cancer: a systematic review on the use of cytotoxic, endocrine, targeted agents and immunotherapy during pregnancy. Part I: solid tumors. Cancer Treat Rev. 2010;36: 101-9.
- -
Azim HA Jr, Pavlidis N, Peccatori FA. Treatment of the pregnant mother with cancer: a systematic review on the use of cytotoxic, endocrine, targeted agents and immunotherapy during pregnancy. Part II: hematological tumors. Cancer Treat Rev. 2010;36:110-21.
- -
Van Calsteren K, Verbesselt R, Ottevanger N, Halaska M, Heyns L, Van Bree R, et al. Pharmacokinetics of chemotherapeutic agents in pregnancy: a preclinical and clinical study. Acta Obstet Gynecol Scand. 2010; 89: 1338-45.
- -
Peccatori FA, Azim HA Jr, Orecchia R, Hoekstra HJ, Pavlidis N, Kesic V, et al. Cancer, pregnancy and fertility: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2013;24 Suppl 6:vi160-70.
- -
Amant F, Van Calsteren K, Halaska MJ, Beijnen J, Lagae L, Hanssens M, et al. Gynecologic cancers in pregnancy: guidelines of an international consensus meeting. Int J Gynecol Cancer. 2009;19:S1-12.
- -
Amant F, Halaska0MJ, Fumagalli M, Dahl Steffensen K, Lok C, Van Calsteren K, et al. Gynecologic cancers in pregnancy: guidelines of a second international consensus meeting. Int J Gynecol Cancer. 2014;24: 394-304.
- -
Amant F, von Minckwitz G, Han SN, Bontenbal M, Ring AE, Giermek J, et al. Prognosis of women with primary breast cancer diagnosed during pregnancy: results from an international collaborative study. J Clin Oncol. 2013;31:2532-9.
- -
Amant F, Van Calsteren K, Halaska MJ, Gziri MM, Hui W, Lagae L, et al. Long-term cognitive and cardiac outcomes after prenatal exposure to chemotherapy in children aged 18 months or older: an observational study. Lancet Oncol. 2012;13:256-64.