La displasia cortical focal (DCF) es una anomalía del desarrollo cortical. Representa una de las causas más frecuentes de epilepsia refractaria, siendo fundamental la resonancia magnética (RM) para su diagnóstico. Dada la importancia que ha cobrado la secuencia de tensor de difusión (DTI), el objetivo de este trabajo fue evaluar retrospectivamente los hallazgos en el mapa de fracción de anisotropía del DTI en pacientes con DCF.
ObservacionesSe buscó retrospectivamente a pacientes con diagnóstico anatomopatológico de DCF en la base de datos de nuestro hospital. De un total de 74, se seleccionaron 8 casos con diagnóstico aislado de DCF y estudio de RM prequirúrgico con DTI. El foco de displasia se identificó en las imágenes anatómicas convencionales de la RM. Se evaluó el mapa de fracción de anisotropía (FA) y se definieron las alteraciones en la región de la DCF. Se observó una disminución de la FA en la sustancia blanca adyacente a la DCF en 7 de los 8 pacientes (87,5%).
DiscusiónLos hallazgos con el DTI brindan información complementaria en relación con la RM. En la mayoría de nuestros pacientes no hubo cambios de señal en la sustancia blanca en las imágenes convencionales, pero sí se identificó una disminución de la FA en el DTI. Se desconoce si esto refleja cambios estructurales o únicamente funcionales, secundarios a la lesión primaria. Creemos que el DTI puede agregar información complementaria de valor para el diagnóstico y valoración de la extensión de esta patología.
Focal cortical dysplasia (DCF) in an anomaly of cortical development. It represents one of the most frequent causes of drug resistant epilepsy and the magnetic resonance imaging (MRI) is trivial for its diagnosis. In the last years the use of diffusion tensor imaging (DTI) has increased in this kind of pathology. The purpose of this work was to evaluate retrospectively DTI findings on fractional anisotropy maps in patients with FCD.
ObservationsWe retrospectively searched patients with confirmed anatomo-pathological diagnosis of FCD in our hospital database. From a total of 74, 8 patients, with isolated diagnosis of FCD and preoperative MRI with DTI, were selected. The FCD was identified in conventional anatomical MRI in all patients. Fractional anisotropy (FA) maps were evaluated and changes in the region of FCD were defined. Decreased FA was observed in white matter adjacent to the FCD, in 7 of 8 patients (87.5%).
DiscussionFindings of DTI gives us complementary information to those of conventional MRI. Most of our patients showed no signal changes of white matter in conventional sequences and they presented decreased FA in DTI. We don’t actually know if these DTI findings represent structural changes in white matter or just functional changes secondary to the adjacent FCD. We think DTI can give valuable complementary information for the diagnosis and determination of the extension of this pathology.
La displasia cortical focal (DCF) es una malformación del desarrollo cortical, que se origina en el período pre, peri o posnatal temprano. Fue descrita por primera vez por Taylor et al.1 en 1971 y se categorizó en distintos grupos según sus hallazgos histológicos.
La tipificación utilizada actualmente fue definida por un grupo de especialistas de la International League Against Epilepsy (ILAE) en 2011, con el propósito de refinar y hacer objetiva y reproducible la clasificación del espectro clínico-patológico de las DCF2. Estas se dividen en anomalías de la organización cortical radial y/o tangencial: sin neuronas dismórficas (tipo I), con neuronas dismórficas (tipo II) y asociadas a otra lesión primaria (tipo III).
En los pacientes con DCF existe una alteración en el proceso de proliferación y apoptosis glioneuronal durante la migración y organización neuronal. De acuerdo con estas alteraciones, la entidad presenta un amplio espectro de severidad que depende del grado de afección, localización y extensión. Las DCF representan una de las causas más frecuentes de epilepsia refractaria en niños y adultos, y su tratamiento suele ser la resección quirúrgica3.
La RM cumple un rol fundamental en el diagnóstico y la valoración pre y posquirúrgica. En las secuencias anatómicas convencionales se pueden observar cambios en el espesor cortical, borramiento de la interfaz sustancia gris – sustancia blanca, hiperintensidad de señal córtico-subcortical en secuencias en recuperación de inversión atenuada de fluido (FLAIR) y ponderadas en T2, e hipointensidad en ponderación T1, así como asimetría en el patrón de surcos cuando se compara con la región homóloga contralateral. El signo de la displasia transmanto, descrito por primer vez por Barkovich et al.4 en 1997, consiste en un aumento de la señal en la secuencia FLAIR en ponderación T2 de la sustancia blanca subyacente al foco displásico, que se extiende hacia el ventrículo con forma triangular de base cortical. Histológicamente representa un área de hipomielinización de la sustancia blanca subyacente y, en algunos casos, con presencia de células balón. Este signo facilita en varias ocasiones el diagnóstico de DCF, pero es prácticamente exclusivo de las DCF tipo IIB2.
Existe un alto porcentaje de DCF difícil de identificar y valorar en cuanto a su extensión con las secuencias anatómicas convencionales de RM. El DTI es una secuencia que estudia la magnitud y dirección de la difusión del agua en la sustancia blanca del cerebro. El parámetro utilizado para su cuantificación es la fracción de anisotropía (FA), con una escala de cero a uno, siendo el cero el tejido más isotrópico (movimiento libre del agua hacia todas las direcciones de distribución) y el uno el más anisotrópico (movimiento del agua restringido de distribución elipsoide). Dado que la sustancia blanca es un tejido estructuralmente muy organizado, la difusión del agua libre se puede distribuir únicamente de forma paralela a la orientación de los tractos nerviosos, volviéndose una manera indirecta y no invasiva de representación de las fibras. La información del DTI puede visualizarse, entonces, también en un mapa de color de direcciones (en rojo las fibras de derecha a izquierda, en verde las fibras anteroposteriores y en azul las cefalocaudales) y en reconstrucción tridimensional, la tractografía, para una mejor orientación espacial5.
En los últimos años ha cobrado importancia el DTI en el estudio de la epilepsia refractaria por sus hallazgos complementarios a las secuencias anatómicas convencionales. Por ello, el objetivo de este trabajo fue evaluar retrospectivamente los hallazgos en los mapas de fracción de anisotropía del DTI en pacientes con DCF.
ObservacionesEl trabajo fue aprobado por el comité de ética de la institución y, dado que es un estudio retrospectivo, no requirió de la firma de un consentimiento informado por parte de los pacientes.
Se realizó una búsqueda retrospectiva de pacientes con diagnóstico anatomopatológico de DCF en nuestra institución entre enero de 2008 y junio de 2015. En total, obtuvimos un resultado de 74 pacientes, pero se excluyeron los casos con otras patologías cerebrales asociadas, incluyendo las DCF tipo III, por lo que quedaron un total de 25 pacientes. De estos, se seleccionaron aquellos con estudio prequirúrgico de RM, de nuestra institución, que incluyera DTI.
Finalmente, tuvimos un resultado de 8 pacientes (3 de sexo masculino y 5 de sexo femenino) de entre 4 y 50 años de edad (media: 19,25 años; mediana: 16 años). La localización de la DCF fue temporal (n=4), frontal (n=2), parietal (n=1) y occipital (n=1).
Todos los pacientes contaban con estudio de RM en equipo 3 Tesla (Signa HDxt 3.0 T, GE Healthcare, Milwaukee, WI) con protocolo de epilepsia, que en nuestra institución incluye: secuencia volumétrica tridimensional con secuencia rápida de eco gradiente dañado en ponderación T1, planos coronales FLAIR y en ponderación T2 con foco en ambos hipocampos e imágenes axiales en ponderación T1, T2, FLAIR T2, T2* y difusión (DWI). Además, tenían imágenes de DTI de 56 direcciones con cortes de 3mm de espesor.
Las imágenes de RM fueron examinadas por un neurorradiólogo con 15 de años de experiencia en epilepsia, y se evaluaron junto con los datos clínicos y electroencefalográficos.
El foco de displasia se identificó en todos los casos en las imágenes anatómicas convencionales de RM. Se definieron los hallazgos positivos en imágenes convencionales y la localización anatómica de las alteraciones observadas. Se evaluó cualitativamente el mapa de FA del DTI y se definieron las alteraciones significativas en la región de la DCF, relativas a la región homóloga contralateral.
Asimismo, se corroboraron estos hallazgos en comparación con los valores cuantitativos de FA en la región definida como anormal y la región homóloga contralateral, utilizando las regiones de interés (ROI) del mismo volumen. Se evaluaron los hallazgos del DTI de forma aislada y se compararon con los descritos en las imágenes anatómicas convencionales (tabla 1).
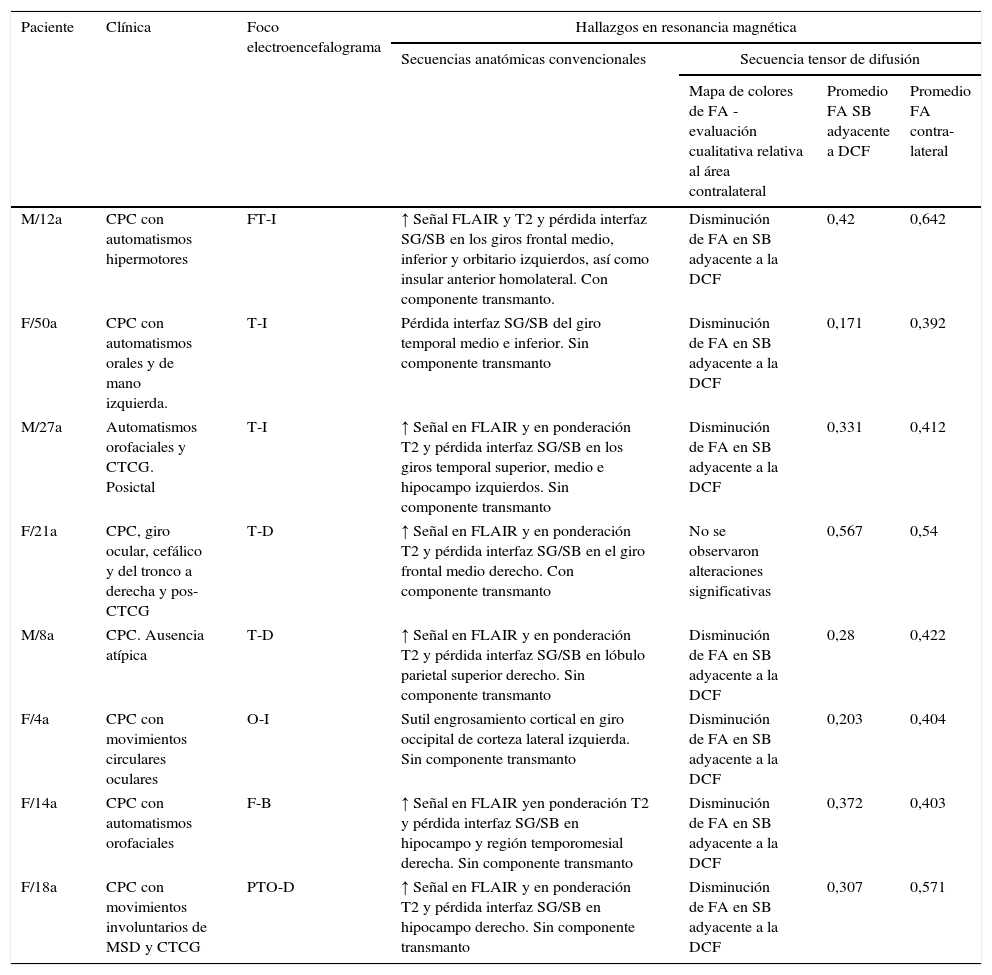
Selección de pacientes con diagnóstico anatomopatológico de displasia cortical focal: datos clínicos, electroencefalograma y resonancia magnética en secuencias anatómicas y tensor de difusión. Se evaluaron los valores promedio de fracción de anisotropía en las regiones de interés: sustancia blanca subyacente al área de displasia y región homóloga contralateral
| Paciente | Clínica | Foco electroencefalograma | Hallazgos en resonancia magnética | |||
|---|---|---|---|---|---|---|
| Secuencias anatómicas convencionales | Secuencia tensor de difusión | |||||
| Mapa de colores de FA - evaluación cualitativa relativa al área contralateral | Promedio FA SB adyacente a DCF | Promedio FA contra- lateral | ||||
| M/12a | CPC con automatismos hipermotores | FT-I | ↑ Señal FLAIR y T2 y pérdida interfaz SG/SB en los giros frontal medio, inferior y orbitario izquierdos, así como insular anterior homolateral. Con componente transmanto. | Disminución de FA en SB adyacente a la DCF | 0,42 | 0,642 |
| F/50a | CPC con automatismos orales y de mano izquierda. | T-I | Pérdida interfaz SG/SB del giro temporal medio e inferior. Sin componente transmanto | Disminución de FA en SB adyacente a la DCF | 0,171 | 0,392 |
| M/27a | Automatismos orofaciales y CTCG. Posictal | T-I | ↑ Señal en FLAIR y en ponderación T2 y pérdida interfaz SG/SB en los giros temporal superior, medio e hipocampo izquierdos. Sin componente transmanto | Disminución de FA en SB adyacente a la DCF | 0,331 | 0,412 |
| F/21a | CPC, giro ocular, cefálico y del tronco a derecha y pos- CTCG | T-D | ↑ Señal en FLAIR y en ponderación T2 y pérdida interfaz SG/SB en el giro frontal medio derecho. Con componente transmanto | No se observaron alteraciones significativas | 0,567 | 0,54 |
| M/8a | CPC. Ausencia atípica | T-D | ↑ Señal en FLAIR y en ponderación T2 y pérdida interfaz SG/SB en lóbulo parietal superior derecho. Sin componente transmanto | Disminución de FA en SB adyacente a la DCF | 0,28 | 0,422 |
| F/4a | CPC con movimientos circulares oculares | O-I | Sutil engrosamiento cortical en giro occipital de corteza lateral izquierda. Sin componente transmanto | Disminución de FA en SB adyacente a la DCF | 0,203 | 0,404 |
| F/14a | CPC con automatismos orofaciales | F-B | ↑ Señal en FLAIR yen ponderación T2 y pérdida interfaz SG/SB en hipocampo y región temporomesial derecha. Sin componente transmanto | Disminución de FA en SB adyacente a la DCF | 0,372 | 0,403 |
| F/18a | CPC con movimientos involuntarios de MSD y CTCG | PTO-D | ↑ Señal en FLAIR y en ponderación T2 y pérdida interfaz SG/SB en hipocampo derecho. Sin componente transmanto | Disminución de FA en SB adyacente a la DCF | 0,307 | 0,571 |
*M: masculino; F: femenino; a: años; CPC: convulsión parcial compleja; CTCG: convulsión tónico-clónica generalizada; FT: frontotemporal; T: temporal; O: occipital; F: frontal; PTO: parieto-témporo-occipital; D: derecha; I: izquierda; SG: sustancia gris; SB: sustancia blanca; FA: fracción de anisotropía.
Se observó una disminución de la FA de la sustancia blanca subyacente a la DCF en 7 de los 8 pacientes (87,5%). Solo 2 pacientes presentaron componente displásico transmanto en las imágenes anatómicas convencionales, mientras que en los otros 6 no se observaron alteraciones significativas en la señal de la sustancia blanca (figs. 1 y 2). En un paciente los hallazgos de RM convencional fueron prácticamente imperceptibles, con cambios únicamente en el espesor cortical, observándose alteraciones significativas en el mapa de FA (fig. 3), mientras que en otro paciente se detectaron alteraciones en las imágenes anatómicas, incluso con componente displásico transmanto, sin alteraciones en los mapas de FA.
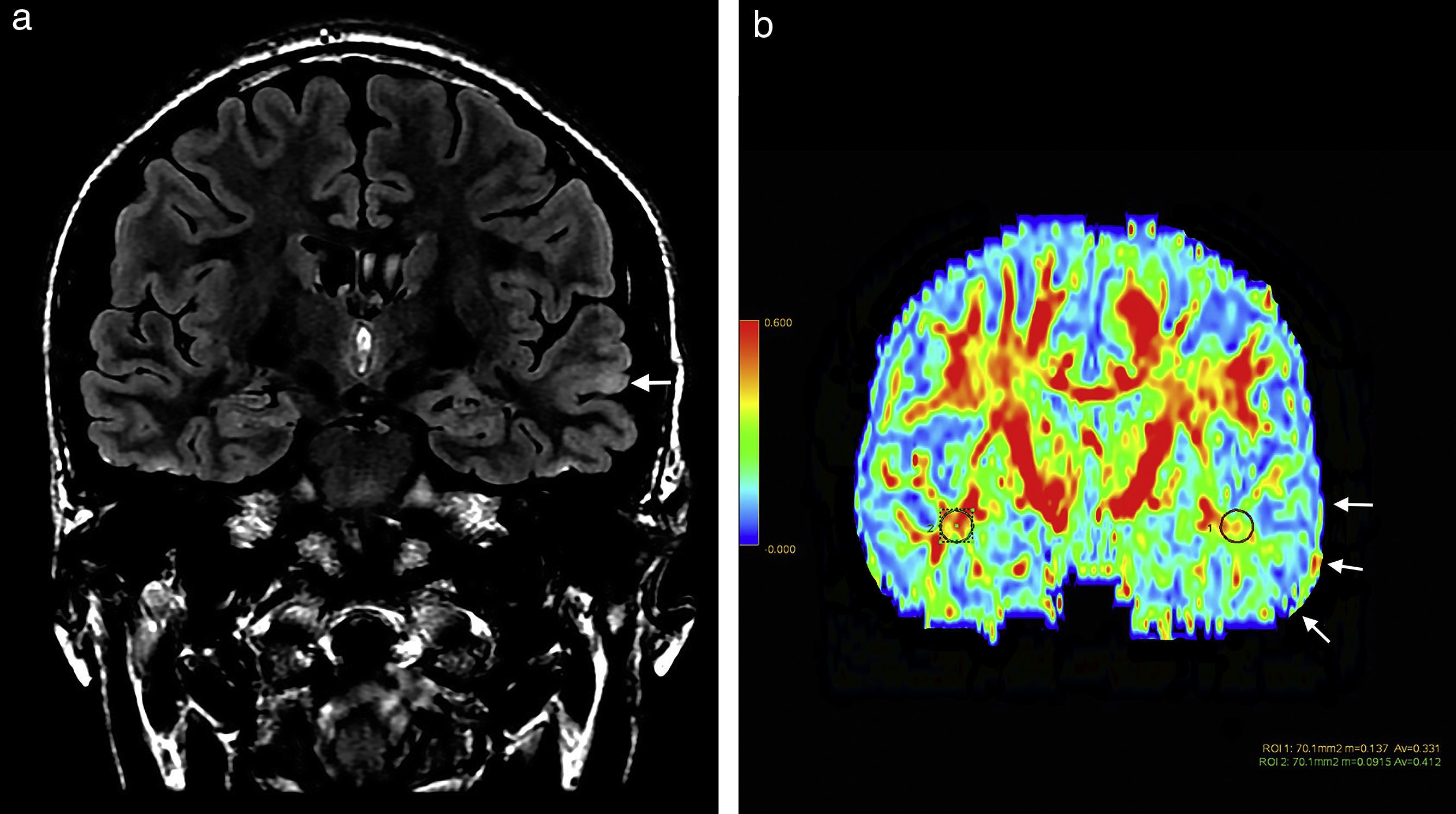
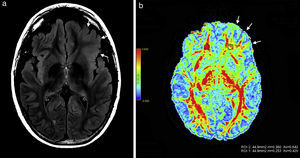
Paciente de sexo masculino de 27 años de edad evidencia (a) en secuencia en ponderación T2 FLAIR, en corte coronal, una leve hiperintensidad cortical a nivel del giro temporal superior del hemisferio cerebral izquierdo (flecha) y (b) en el mapa de colores de fracción de anisotropía una disminución de la misma a nivel de sustancia blanca temporal izquierda (flecha) con respecto a la región homóloga contralateral.
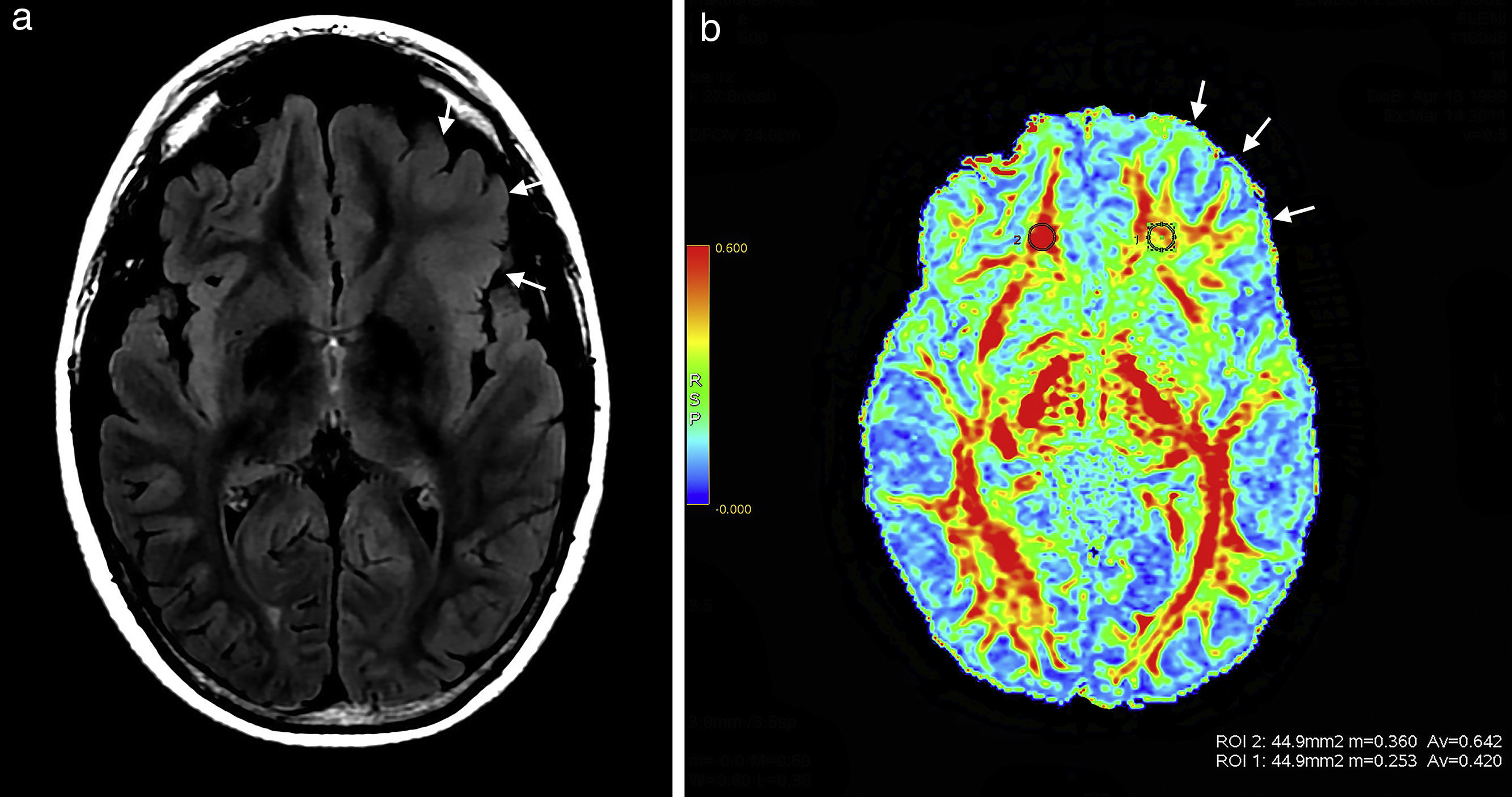
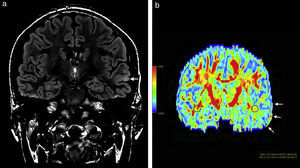
Paciente de sexo masculino de 12 años de edad manifiesta (a) en secuencia en ponderación T2 FLAIR una hiperintensidad en topografía cortical fronto-orbitaria izquierda, un aumento del espesor y la pérdida de interfase entre la sustancia gris y blanca (flechas). (b) En el mapa de colores de fracción de anisotropía se observa una disminución de la misma a nivel de la sustancia blanca fronto-orbitaria izquierda (flechas) con respecto a la región homóloga contralateral.
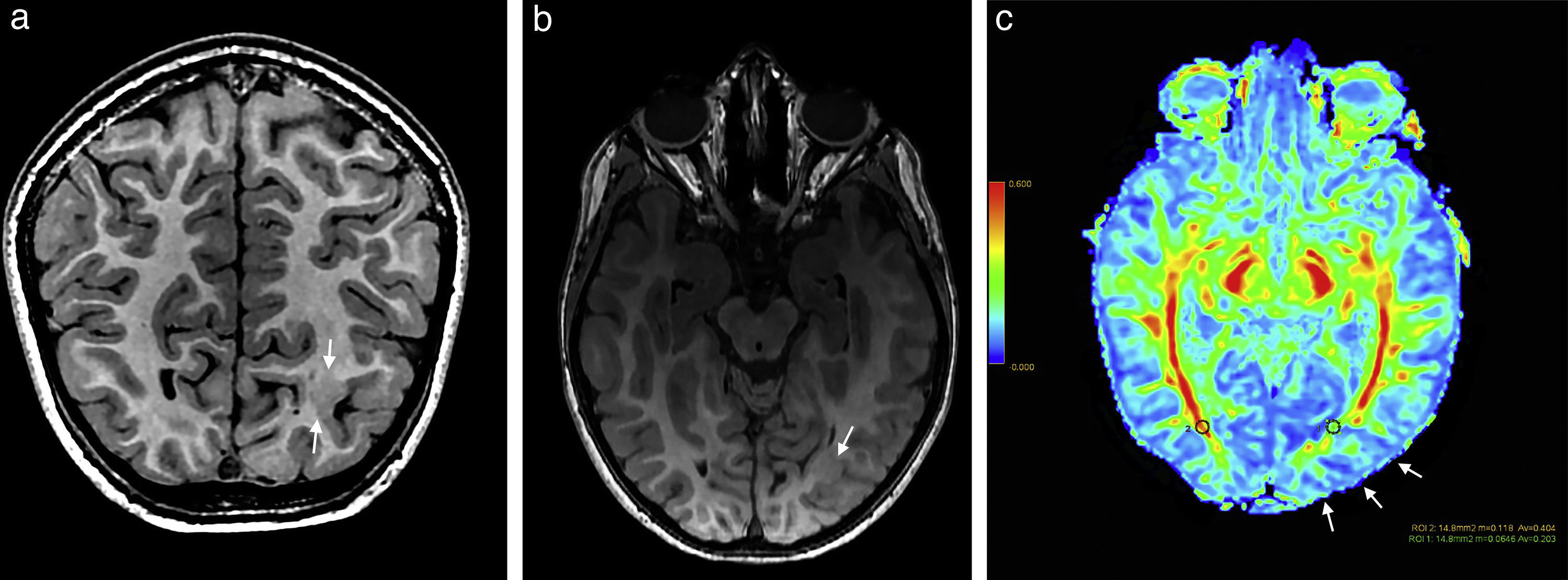
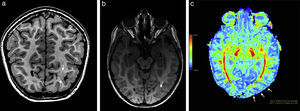
Paciente de sexo femenino de 4 años de edad muestra (a y b) en ponderación T1 y en tridimensional con secuencia rápida de eco gradiente dañado, en corte coronal y axial, un engrosamiento cortical focal con pérdida de diferenciación de la sustancia gris-blanca a nivel occipital basal izquierdo (flechas). (c) En el mapa de color de fracción de anisotropía se identifica una leve disminución de la misma a nivel de la sustancia blanca occipital izquierda (flechas) con respecto a la región homóloga contralateral.
Para el diagnóstico de la epilepsia refractaria, en los últimos años han cobrado importancia las secuencias funcionales, como el tensor de difusión, debido a que se ha demostrado que estas pueden evidenciar alteraciones que en los estudios estructurales no son visibles6. Hoy en día, esta secuencia se incluye en el estudio rutinario de epilepsia, en los casos de epilepsia temporal o en la asociada a anomalías del desarrollo cortical, así como en el planeamiento quirúrgico7.
La utilización de protocolos dirigidos y el análisis por especialistas, tanto de las imágenes morfológicas como de las funcionales de la RM, son fundamentales para la planificación de la cirugía. En el 87,5% de nuestros pacientes se observó una disminución de la FA del DTI a nivel de la sustancia blanca subyacente a la región de DCF.
Dada la baja anisotropía de la corteza cerebral normal, es difícil definir la disminución de la FA en el territorio displásico con respecto a la corteza normal. En cambio, la disminución de la FA resulta evidente en la sustancia blanca adyacente, ya que en la sustancia blanca normal la fracción de anisotropía suele ser más alta. Por ello, los hallazgos en las imágenes de DTI no son comparables, sino complementarios a los de las imágenes anatómicas convencionales de la RM. En nuestro trabajo, excepto los dos pacientes que tenían DCF con componente transmanto, el resto no presentó cambios de señal en la sustancia blanca en secuencias anatómicas convencionales, pero sí mostró una disminución de la FA con respecto a la región homóloga contralateral.
Al momento desconocemos si estos cambios visualizados en el DTI a nivel de la sustancia blanca reflejan cambios patológicos estructurales o si son el resultado de cambios funcionales secundarios a la lesión primaria y a las descargas eléctricas generadas por esta. Sin embargo, creemos que el DTI puede agregar valiosa información complementaria para el diagnóstico de esta patología y ayudar a determinar la extensión de la DCF y el territorio afectado funcionalmente, muchas veces de difícil detección con las secuencias anatómicas convencionales.
Futuros trabajos con un mayor número de pacientes deberán realizarse para determinar el valor estadístico de los hallazgos y definir si estos pueden cambiar la conducta quirúrgica de estas lesiones.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.