La pancreatitis autoinmune (PAI) es una forma distinta de pancreatitis crónica, que se caracteriza por un mecanismo patogénico autoinmune. Su frecuencia es levemente mayor en los pacientes de sexo masculino (60%) y la edad promedio de presentación oscila entre los 40 y 60 años, aunque el rango etario es mucho más amplio (de 14 a 80 años). Desde el punto de vista histológico, la PAI se presenta con un infiltrado inflamatorio denso, de extensión variable, que puede ser focal o comprometer difusamente todo el páncreas. Su presentación clínica en la mayoría de los casos es inespecífica: dolor abdominal leve y rara vez síntomas de pancreatitis aguda, pérdida de peso o ictericia. Varios estudios han descrito un compromiso multiorgánico por el proceso autoinmune, indicando la naturaleza sistémica de la enfermedad.
En 2011 el Consenso Internacional de Criterios Diagnósticos de la Pancreatitis Autoinmune (ICDC, por sus siglas en inglés) establecieron las directrices o guías diagnósticas, estipulando que la resonancia magnética (RM) y la colangiopancreatografía por RM (CPRM) constituyen las técnicas diagnósticas cardinales.
En este trabajo presentamos las características imagenológicas de la PAI, sus diagnósticos diferenciales y hallazgos en imágenes luego del tratamiento y seguimiento. Adicionalmente, comunicamos nuestra experiencia en esta enfermedad problemática y poco frecuente.
Autoimmune pancreatitis (AIP) is a distinct form of chronic pancreatitis caused by an autoimmune pathogenetic mechanism. It affects males (60%) slightly more frequently, and generally occurs between 40 to 60 years, although the possible range is much wider (14-80 years). Histologically AIP is characterised by the presence of a dense inflammatory infiltrate, with variable extension. It can be focal or diffuse throughout the whole pancreas. Clinical presentation in most cases is non-specific, with patients presenting with mild abdominal pain, rarely, acute pancreatitis symptoms, weight loss, and jaundice. Several studies reported multiple organ involvement due to the autoimmune process, suggesting a systemic nature of the disease.
In 2011 the International Consensus Diagnostic Criteria for autoimmune pancreatitis (ICDC) defined the guidelines, and magnetic resonance imaging (MRI) and MR-cholangiopancreatography (MRCP) became the reference diagnostic technique in the diagnosis of the disease.
This paper will review the imaging characteristics, the differential diagnosis, and the imaging features after treatment and follow up. Furthermore, our experience in this uncommon and challenging disease is reviewed
La pancreatitis autoinmune (PAI) es una forma distinta de la pancreatitis crónica, que se caracteriza por un mecanismo patogénico autoinmune. Sarles et al.1 fueron los primeros en describir esta entidad en 1961 como una inflamación crónica del páncreas de posible naturaleza autoinmune. En 1995 Yoshida et al.2 acuñaron por primera vez su nombre actual y describieron sus principales particularidades: aumento de los niveles séricos de las inmunoglobulinas, infiltración de leucocitos en el tejido pancreático, estenosis difusa e irregular del conducto pancreático principal, agrandamiento del parénquima pancreático y presencia de otras enfermedades autoinmunes.
Si bien en los años siguientes las dificultades diagnósticas llevaron a establecer diferentes criterios diagnósticos, resultó necesario definir universalmente los hallazgos clínicos, radiológicos y de laboratorio3–5. En 2011, en el Consenso Internacional de Criterios Diagnósticos de la Pancreatitis Autoinmune (ICDC, por su sigla en inglés) acordaron las pautas, estipulando que la resonancia magnética (RM) y la colangiopancreatografía por resonancia magnética (CPRM) constituían técnicas fundamentales en el diagnóstico de la entidad6.
En el presente artículo, comunicamos nuestra experiencia en esta enfermedad problemática y poco frecuente, dado que nuestra institución es un centro de referencia de enfermedades pancreáticas y nuestros radiólogos poseen un amplio conocimiento de la evaluación de las alteraciones del parénquima y conducto pancreáticos3,7–13.
Revisión de temaLa PAI es considerada una enfermedad pancreática poco frecuente, que corresponde al 7% de los casos de pancreatitis crónica. De 2002 a 2015 en nuestra institución hemos asistido a 186 pacientes afectados por la entidad.
Desde el punto de vista histológico, la PAI se caracteriza por la presencia de un infiltrado inflamatorio denso con extensión variable, que puede ser focal o comprometer difusamente todo el páncreas, con reemplazo progresivo del parénquima pancreático por fibrosis14. Por ello, desde el punto de vista morfológico, también se distingue una forma de pancreatitis autoinmune focal y otra difusa, a pesar de que aún se debate si ambos tipos constituyen o no dos etapas diferentes de la misma enfermedad3.
La variable focal se presenta como una lesión expansiva de la cabeza o del cuerpo y la cola del páncreas, y su diagnóstico diferencial con las neoplasias, principalmente con el adenocarcinoma pancreático, representa un problema15.
La frecuencia de la PAI es levemente mayor en el sexo masculino (60%) y la edad promedio oscila entre los 40 y los 60 años, aunque el rango puede ser mucho más amplio (de 14 a 80 años). Los pacientes no tienen antecedentes de alcoholismo, cálculos biliares o inflamación de la pared duodenal. Después de un breve período de tratamiento con esteroides, hay una remisión rápida y significativa de los síntomas y una resolución de los hallazgos radiológicos y de laboratorio9,10,16.
La clínica en la mayoría de los casos es totalmente inespecífica: dolor abdominal leve y rara vez síntomas de pancreatitis aguda, pérdida de peso o ictericia. En formas avanzadas, puede haber signos de insuficiencia pancreática exocrina y diabetes17. Además, varios estudios han descrito compromiso multiorgánico por el proceso autoinmune (lo que indica la naturaleza sistémica de la enfermedad). Los órganos afectados con más frecuencia son la vía biliar intra y extrahepática (68-88%), los riñones (35%), las glándulas salivales (12-16%) y el retroperitoneo (3-8%). También es común la presencia de síndromes autoinmunes, como la colitis ulcerosa, la tiroiditis de Hashimoto, la colangitis esclerosante, el eritema nodoso y el síndrome de Mikulicz.
Los hallazgos de laboratorio más habituales son el aumento de los niveles séricos de autoanticuerpos e inmunoglobulinas G, especialmente la tipo 4 (IgG4), que suelen duplicar los valores normales. Por esta razón, varios autores creen que la PAI es una enfermedad sistémica relacionada con la IgG4 con compromiso pancreático predominante. Al respecto, la IgG4 se considera un marcador útil para confirmar el diagnóstico, realizar el seguimiento terapéutico, detectar pacientes con enfermedad muy severa y estimar el riesgo de recurrencia18,19. Otros hallazgos de laboratorio son el aumento de las enzimas pancreáticas y hepáticas.
Desde el punto de vista radiológico, aun cuando la ecografía y la tomografía computada (TC) sean buenos instrumentos diagnósticos, la RM es considerada actualmente la técnica imagenológica de elección. Las alteraciones de la señal pancreática en las secuencias ponderadas en T1 y T2 y la evaluación dinámica después de la administración del contraste permiten un diagnóstico temprano y una correcta evaluación de la respuesta al tratamiento. Más aún, la CPRM proporciona una representación anatómica óptima de los sistemas ductales pancreático y biliar, contribuyendo al diagnóstico diferencial entre la PAI y las neoplasias pancreáticas6.
Anatomía patológicaEl aspecto histológico más típico y significativo de la PAI es la presencia de un infiltrado denso, localizado alrededor de los conductos interlobulillares de los acinos glandulares. Este se encuentra formado en su mayoría por linfocitos y células plasmáticas, pero también por macrófagos y mastocitos. Los conductos comprometidos se obstruyen y su epitelio se muestra típicamente similar a una estrella o hendidura. En general, las paredes ductales también están engrosadas por una fibrosis que recubre el conducto y se vuelve interlobulillar o intralobulillar en formas avanzadas. En este último caso, causa atrofia de las células acinares y aislamiento de islotes pancreáticos14,20.
Zamboni et al.13 demostraron que alrededor del 50% de los pacientes con PAI registra una modificación histológica adicional: miofibroblastos que causan inflamación y edema, con un típico aspecto de pseudotumor13,14,20,21. Además, puede observarse vasculitis y, menos comúnmente, fenómenos de arteritis.
Según el consenso de la Conferencia de Honolulu, la clasificación histológica más reciente, la PAI puede dividirse en dos grupos de acuerdo con su anatomopatología21:
- a)
PAI tipo 1: pancreatitis esclerosante linfoplasmocitaria (PELP) o pancreatitis sin lesión epitelial granulocítica (LEG). Como características histopatológicas distintivas, se destaca un denso infiltrado periductal linfoplasmocitario y plasmocelular, fibrosis estoriforme típica, vasculitis con infiltrado linfoplasmocitario y una alta densidad de células plasmáticas positivas para IgG4. Clínicamente, esta forma es una manifestación pancreática de un síndrome sistémico relacionado con la IgG4, con altos niveles séricos de IgG4 y compromiso orgánico extrapancreático, como colangitis esclerosante, síndrome de Sjögren y fibrosis retroperitoneal. Afecta sobre todo a los pacientes de edad avanzada (edad promedio: 64), por lo general de sexo masculino.
- b)
PAI tipo 2: pancreatitis ductal central idiopática (PDCI) o pancreatitis con LEG. Presenta un infiltrado periductal linfoplasmocitario, pero sin presencia de vasculitis y fibrosis estoriforme. Son comunes las lesiones epiteliales granulocíticas: esto es, fragmentos de epitelio de conductos interlobulillares, debidos a infiltración por neutrófilos, que pueden llegar a formar abscesos ductales.
Mientras que la PELP se asocia con una elevación de los valores de autoanticuerpos inespecíficos y de los niveles séricos de IgG4, la PDCI no posee marcadores autoinmunes serológicos definitivos y no está relacionada con manifestaciones autoinmunes extrapancreáticas. Asimismo, en comparación con la PELP, la PDCI afecta a pacientes una década más jóvenes, sin predominio de sexo.
Esta clasificación en dos patrones histopatológicos ha sido ampliamente utilizada por autores japoneses y norteamericanos4,5,22.
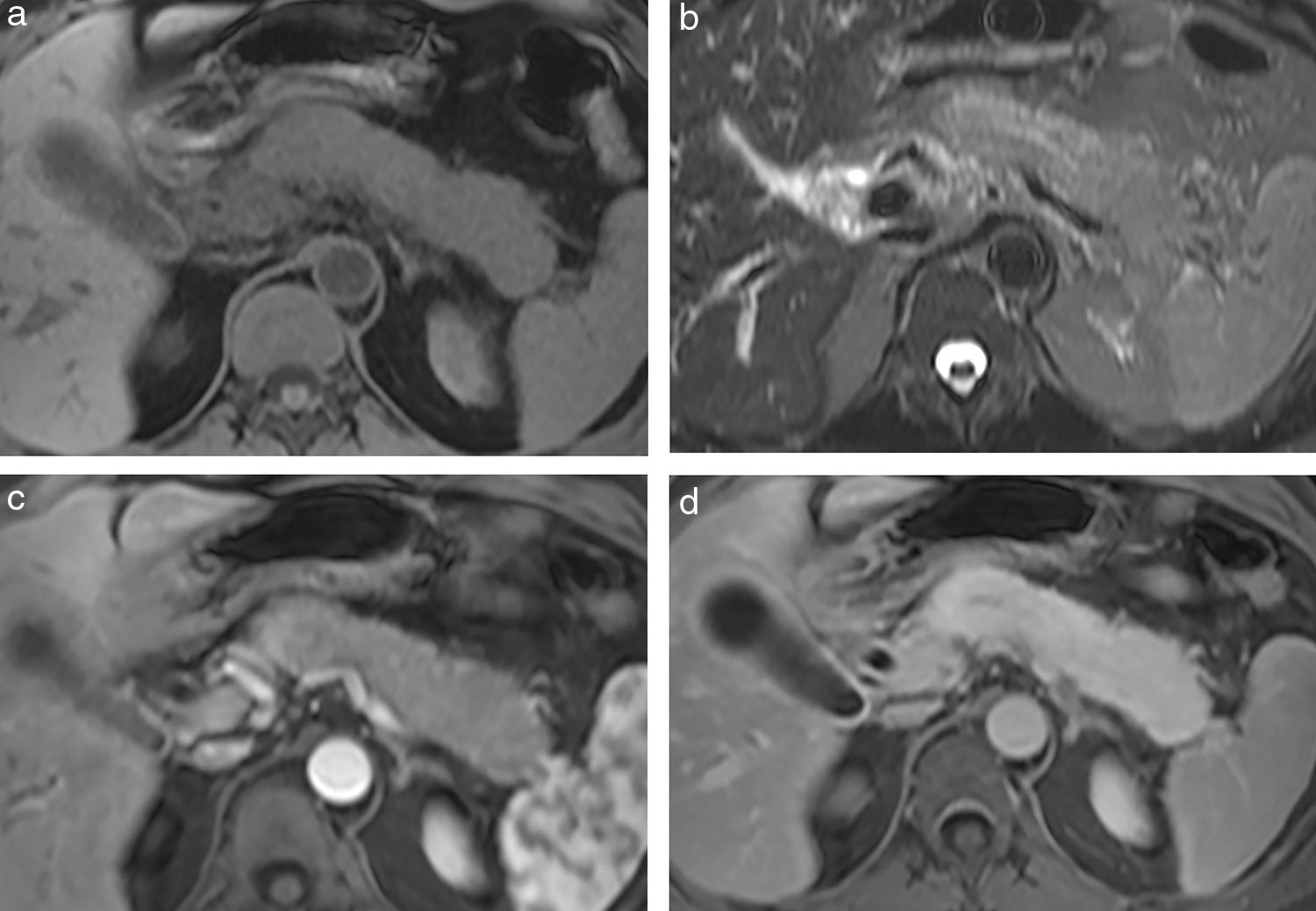
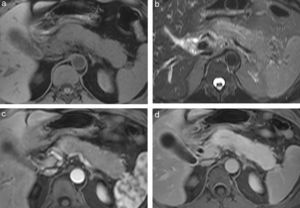
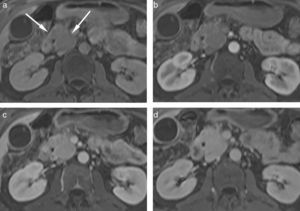
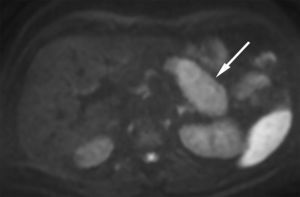
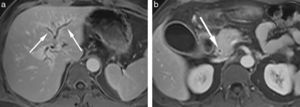
Estudios por imágenesUn hallazgo típico de la PAI es el agrandamiento de la glándula pancreática afectada. Debido al denso infiltrado inflamatorio, el parénquima comprometido aumenta su tamaño, pierde la estructura lobulillar fisiológica y es sustituido gradualmente por masas-regiones de fibrosis6,13,14,20,21. Cuando es difusa, la PAI afecta toda la glándula pancreática con un agrandamiento “en forma de salchicha” y bordes bien definidos; mientras que si es focal, además de ser menos común, se distingue por la existencia de una masa focal en la cabeza o en el cuerpo y cola del páncreas, difícil de diagnosticar por su similitud con el adenocarcinoma pancreático3,9,10,12,16 (figs. 1 y 2).
(a) En la secuencia eco de gradiente en ponderación T1 con supresión grasa, en plano axial, se observa un agrandamiento difuso de toda la glándula pancreática, que aparece hipointensa en comparación con el hígado. (b) En la secuencia ponderada en T2, con eco de espín rápido de disparo único y semi-Fourier (HASTE) en plano axial, con supresión grasa, el parénquima afectado se manifiesta hiperintenso en comparación con el parénquima hepático. Luego de la inyección del contraste, la lesión se muestra (c) hipovascular durante la fase arterial, (d) con retención de contraste durante la fase tardía.
(a) En la secuencia eco de gradiente en apnea con interpolación volumétrica con saturación grasa en plano axial se observa un agrandamiento focal de la cabeza del páncreas (flechas), que se muestra hipointensa en comparación con el hígado. Después de la inyección del contraste, la lesión (b) tiene un comportamiento hipovascular durante la fase arterial, (c) con realce progresivo durante la fase portal y (d) con retención del contraste en la fase tardía.
El infiltrado inflamatorio es responsable de la prolongación en los tiempos de relajación en ponderación T1 y T2. Por este motivo, el parénquima pancreático afectado, en comparación con el hígado o el eventual parénquima sano, suele aparecer hipointenso en las imágenes ponderadas en T1 (hallazgo que se aprecia mejor en las imágenes ponderadas en T1 con saturación grasa). En las secuencias ponderadas en T2, se observa en el páncreas afectado una leve hiperintensidad que se hace más evidente en la primera fase de la enfermedad, cuando el parénquima posee un infiltrado rico en células plasmáticas y neutrófilos9,12.
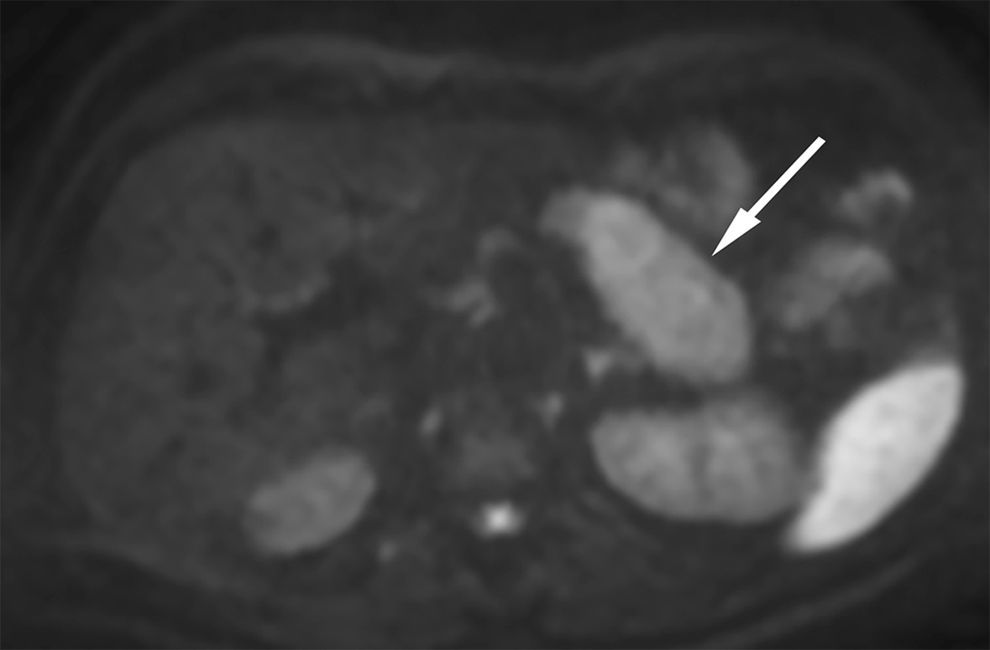
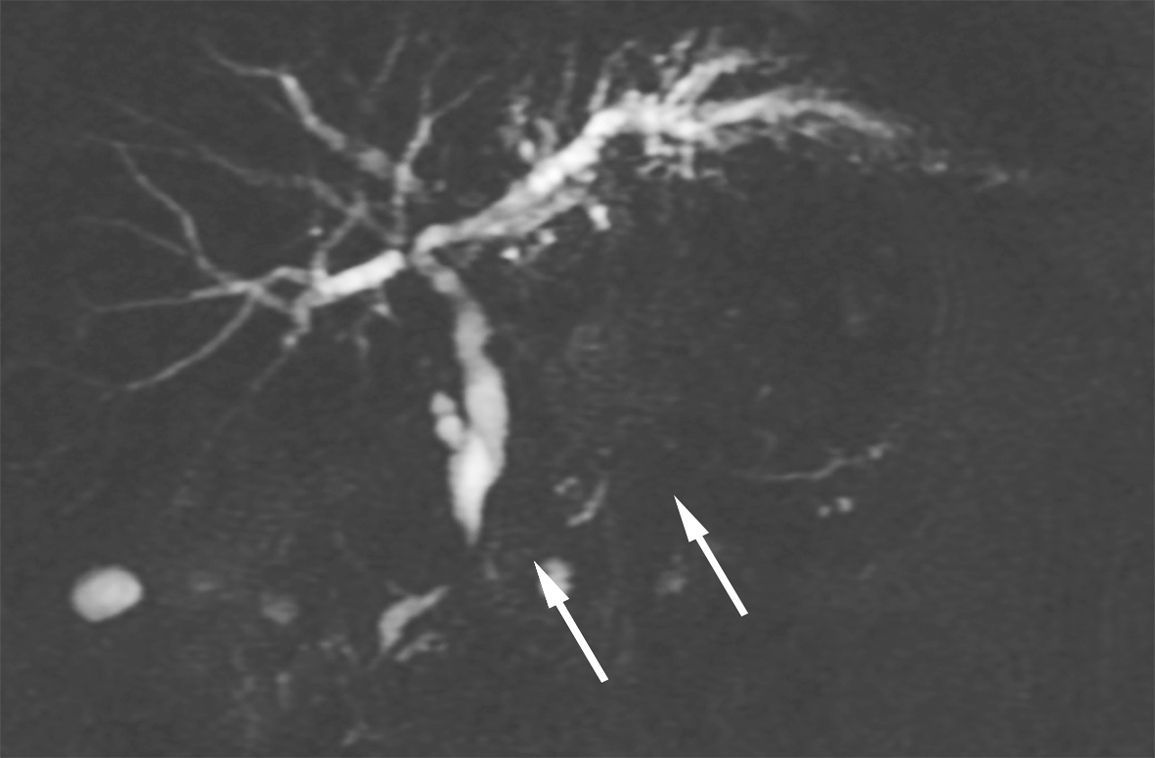
La técnica de difusión (DWI) por resonancia magnética se utiliza cada vez más para evaluar la PAI. La disminución de los valores del mapa de coeficiente de difusión aparente (ADC) se correlaciona con el aumento de la celularidad de la lesión y la consecuente restricción de la difusión del agua. Así, con la DWI, la PAI, al igual que el cáncer pancreático, presenta una elevada intensidad de señal en imágenes con valores b altos. Estas dos entidades se diferencian porque el cáncer pancreático suele evidenciarse con un área focal, mientras que la PAI revela áreas múltiples o difusas de alta intensidad (fig. 3). A su vez, los valores medios de ADC son significativamente más bajos en la PAI que en el cáncer pancreático, debido a la celularidad del infiltrado linfoplasmocitario denso8,23–25. En nuestra experiencia, de todos modos, la secuencia de DWI ha sido útil para la detección de masas pancreáticas, pero tuvo una efectividad relativamente baja en el diagnóstico diferencial con el adenocarcinoma pancreático8.
El patrón de realce del contraste es uno de los rasgos más característicos de la PAI. Al respecto, Manfredi et al.9 han comunicado que el parénquima afectado resulta hipovascular durante la fase arterial, con retención homogénea del contraste durante la fase tardía del estudio dinámico. Este hallazgo puede correlacionarse con el ensanchamiento de los espacios extracelulares y extravasculares debido a la presencia progresiva de fibrosis9,10,12,26–28.
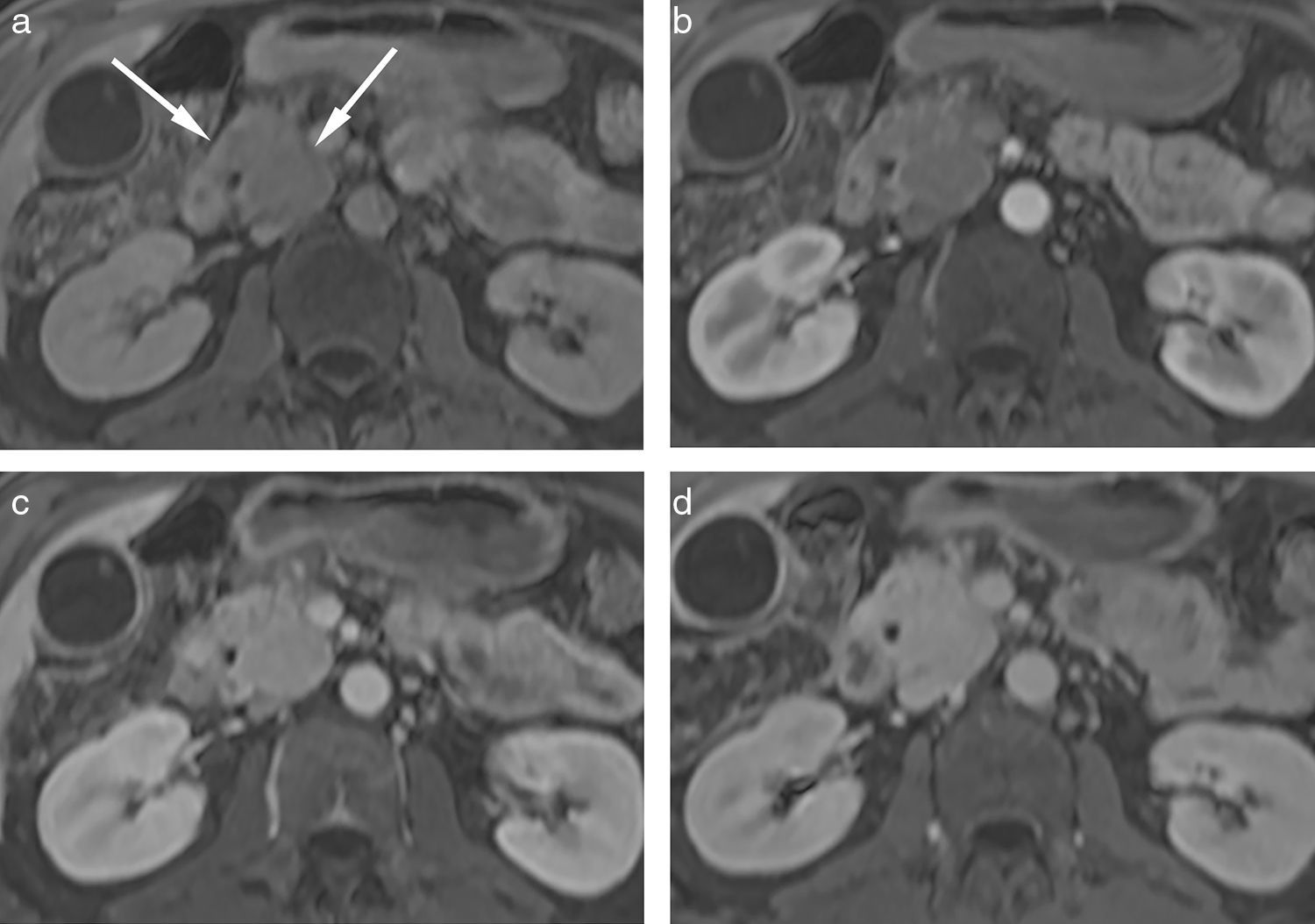
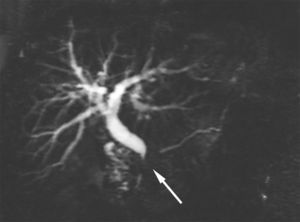
Otros hallazgos imagenológicos son las múltiples estenosis o el estrechamiento irregular del conducto pancreático principal (CPP). Desde el punto de vista histológico, el infiltrado periductal afecta todo el sistema ductal pancreático. La extensión del infiltrado inflamatorio produce agrandamientos focales o difusos de la glándula, que provocan una compresión extrínseca del CPP. En las formas difusas, el CPP distintivamente presenta estenosis multifocal a lo largo de toda la extensión de la glándula o un segmento estenótico (>1/3 de la longitud del CPP)6,29. Mientras, en las formas focales, el CPP habitualmente muestra una sola estenosis dentro de la pseudomasa pancreática. En el nivel preestenótico, el CCP se encuentra levemente dilatado, a diferencia del carcinoma pancreático en el que la estenosis infiltra al CPP en una sola estrechez corta, con marcada dilatación del CPP preestenótico12,30–32 (fig. 4).
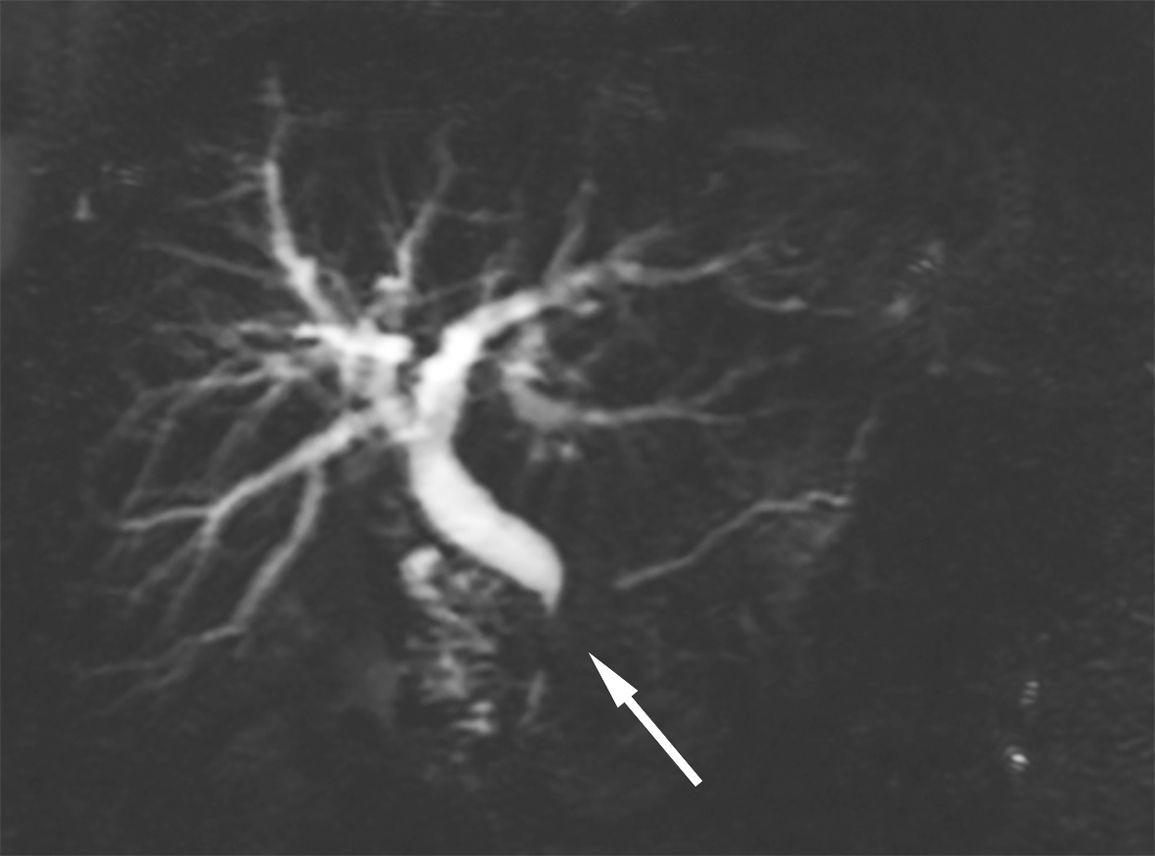
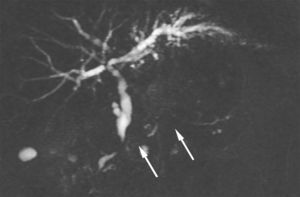
A su vez, a pesar de que en la PAI rara vez se observa dilatación de las ramas colaterales, un estudio reciente de Negrelli et al.12 sobre la variante focal demostró la presencia de múltiples estenosis en todo el trayecto del CPP, aun en regiones no afectadas por la enfermedad a nivel macroscópico (fig. 5). Estos hallazgos reflejan el comportamiento histológico de la entidad, ya que el infiltrado inflamatorio está centrado alrededor de los conductos pancreáticos y no limitado a una región del páncreas12.
Varios estudios, en particular los realizados por Carbognin et al.7 en nuestra institución, se han focalizado en la CPRM con secretina para la caracterización de las estenosis del CPP33. La estimulación con esta hormona aumenta la secreción de líquido en el sistema ductal y, al mismo tiempo, incrementa el tono muscular del esfínter de Oddi, con la consecuente mejora en la delineación del CPP7. Por ello, en casos complejos el uso de la secretina puede resultar útil para determinar mejor la compresión extrínseca del CPP por un infiltrado inflamatorio (como en los casos de PAI) o la obstrucción abrupta del sistema ductal (como suele observarse en infiltrados neoplásicos de adenocarcinomas pancreáticos).
Otra sello característico de la PAI, ya descrito en varios criterios diagnósticos, es la súbita remisión de los signos y síntomas radiológicos después de un tratamiento con esteroides a corto plazo. Luego de 2 o 3 semanas de tratamiento con esteroides en altas dosis, el parénquima afectado suele disminuir en tamaño y presentar vascularización fisiológica. También se observa una resolución completa o parcial de las estenosis del CPP después del tratamiento16,6. Las estenosis residuales se pueden correlacionar con la atrofia gradual y la fibrosis del parénquima afectado.
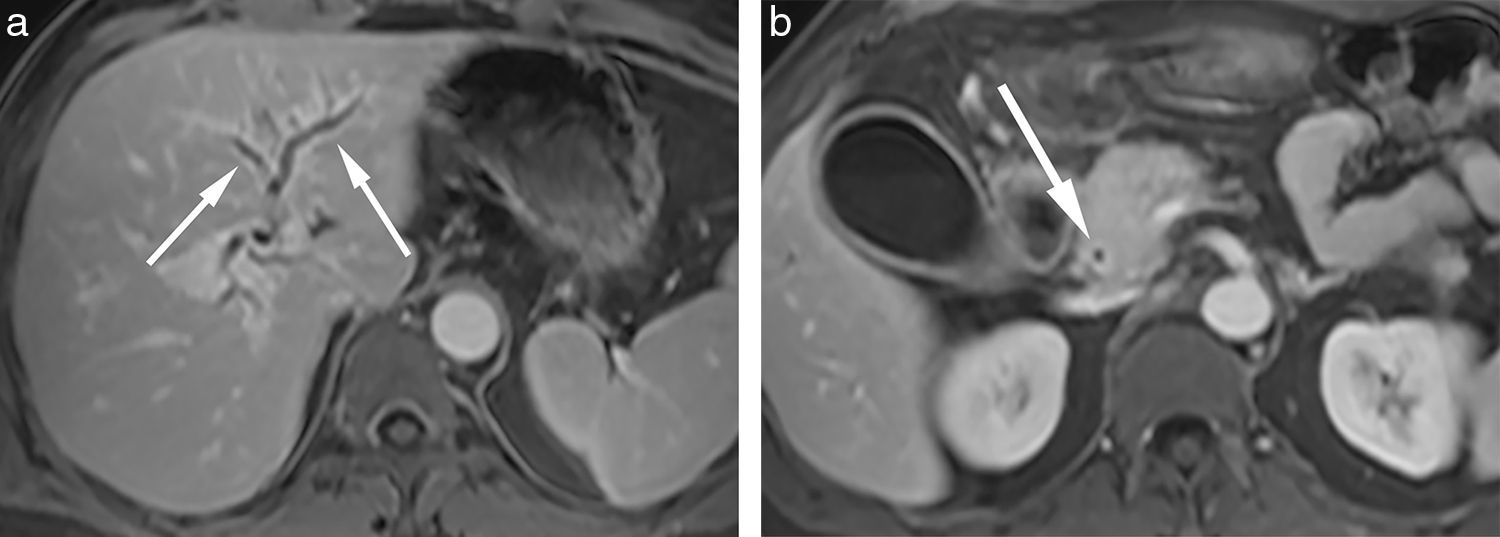
Además, se ha reportado ampliamente en la literatura el compromiso de otros órganos ante una PAI, sugiriendo que se trata de una enfermedad relacionada con la IgG4, con compromiso predominantemente pancreático6,16. El infiltrado periductal puede extenderse al colédoco intra y suprapancreático, y causar una inflamación que remede una colangitis esclerosante primaria con múltiples estenosis y realce tardío de la vía biliar intra y extrahepática9,12,19 (fig. 6).
(a) En las secuencias eco de gradiente en apnea con interpolación volumétrica (VIBE) con saturación grasa y contraste con quelatos de gadolinio, en plano axial, durante la fase portovenosa, se observa engrosamiento de la pared de la vía biliar intrahepática (flechas). (b) En el mismo paciente, la pared del colédoco aparece engrosada con retención de contraste (flecha).
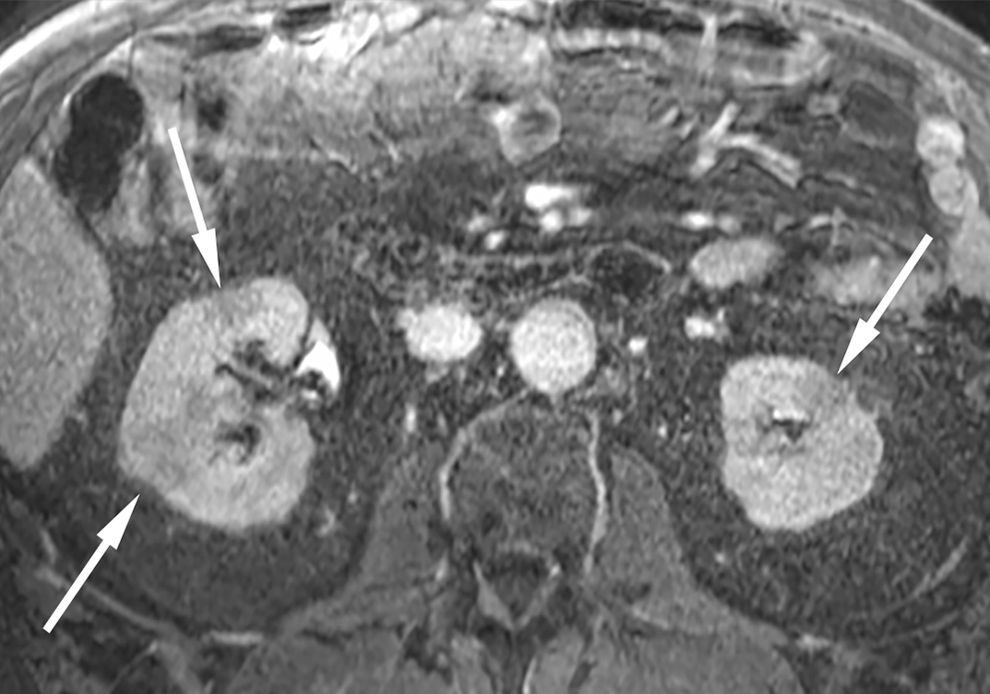
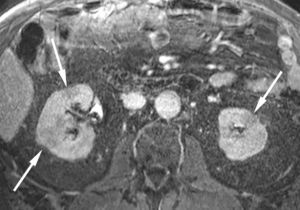
El compromiso renal, la segunda forma de PAI extrapancreática más frecuente, tiene diversos patrones, pero las lesiones comprometen predominantemente la corteza renal con múltiples lesiones redondeadas o cuneiformes, con un patrón similar al de la nefritis intersticial. Estas son hipointensas en las imágenes ponderadas en T1 e hipovasculares durante la fase arterial con realce de contraste tardío34 (fig. 7).
En las secuencias eco de gradiente en apnea con VIBE y saturación grasa con contraste con quelatos de gadolinio, en plano axial, durante la fase portovenosa, se observa la presencia de múltiples lesiones renales (flechas) hipointensas, en comparación con el parénquima renal adyacente no afectado.
Por último, otro compromiso extrapancreático poco frecuente, detectable en los estudios por imágenes abdominales, es la fibrosis retroperitoneal.
Así, las características indicadoras de PAI están representadas por alteraciones parenquimatosas, como la pérdida del patrón lobulillar de la glándula y el realce progresivo con retención de contraste del páncreas afectado durante la fase portovenosa y la fase tardía. La CPRM representa una herramienta útil para la evaluación del compromiso ductal con una estenosis larga (>1/3 de la longitud del CPP) o múltiples estenosis sin marcada dilatación preestenótica.
Diagnóstico diferencialEl diagnóstico diferencial de una masa pancreática representa un desafío. Dado que la PAI responde al tratamiento con esteroides, es fundamental diferenciarla del adenocarcinoma pancreático para evitar cirugías innecesarias. Al respecto, varios estudios han comunicado que en el 5-21% de las muestras pancreáticas, el diagnóstico histológico definitivo descartó cáncer16.
La ictericia obstructiva puede observarse en ambas entidades; sin embargo, la presencia de una ictericia fluctuante, en lugar de una constante y progresiva, se detecta con más frecuencia en la PAI. En los análisis de laboratorio, suele hallarse un aumento de los niveles séricos de las IgG, principalmente de la IgG4 en pacientes con PAI. No obstante, los falsos positivos de elevación de estas inmunoglobulinas también se encuentran, aunque rara vez, en el cáncer de páncreas6,18.
En la RM, el parénquima afectado aparece levemente hiperintenso en las imágenes ponderadas en T2 y típicamente hipovascular durante la fase arterial con realce tardío y retención de contraste. Por el contrario, el adenocarcinoma pancreático se mantiene hipovascular durante el estudio dinámico y aparece hipointenso en las imágenes ponderadas en T1 y T2. A su vez, en la PAI focal se observa una nítida demarcación entre el páncreas afectado y el parénquima adyacente no afectado, mientras que en los carcinomas de la cabeza del páncreas, el cuerpo y la cola se muestran atróficos9,10,30,35,36.
La CPRM constituye una herramienta útil en el diagnóstico diferencial entre estas dos entidades. Según algunos estudios, en los dos tipos de PAI se detectan estenosis no diagnosticadas del CPP largas o múltiples sin una marcada dilatación preestenótica, mientras que en el adenocarcinoma pancreático las estenosis suelen ser únicas, cortas y obstruyen el sistema ductal pancreático7,12,27,29,31.
La presencia de compromiso extrapancreático y la remisión de signos y síntomas tras el tratamiento con esteroides son altamente sugerentes de PAI. Sin embargo, en casos difíciles, especialmente en presencia de una masa focal de la cabeza del páncreas con dilatación del sistema ductal y pancreático (signo del doble conducto), se requiere citología por aspiración con aguja fina (CAAF) o punción por biopsia por aspiración con aguja fina (PAAF) para descartar cáncer16,36.
El diagnóstico diferencial con el linfoma puede ser complejo, dado que ambas entidades pueden manifestarse como un agrandamiento focal o difuso de la glándula y con hipovascularización del parénquima afectado durante la fase pancreática. Asimismo, el compromiso renal puede estar presente en ambas enfermedades. Por ello, su diferenciación se basa en el compromiso sistémico, altamente sugerente de linfoma (como son las lesiones esplénicas y las adenopatías retroperitoneales o mesentéricas).
Por último, la PAI puede confundirse con una pancreatitis aguda. Debido a que nunca se ha descrito necrosis pancreática en la PAI, el diagnóstico diferencial se limita a la pancreatitis edematosa. La presencia de una lesión focal con realce tardío sin estriación de la grasa peripancreática es altamente sugerente de PAI10,36.
Tratamiento y seguimientoLos esteroides representan la conducta terapéutica de elección, en tanto se ha establecido que la PAI responde a un mecanismo autoinmune. Después de realizar el diagnóstico y descartar la presencia de un cáncer pancreático, se debe iniciar un tratamiento con altas dosis de esteroides. Por lo general, los pacientes reciben 1mg por kilogramo de peso corporal durante 15-21 días.
Una vez iniciado el tratamiento, la respuesta es rápida. Esta se basa en datos clínicos, como la resolución de la ictericia obstructiva y la normalización de los niveles de IgG4, y la remisión de las alteraciones radiológicas. Tras el diagnóstico, la dosis de esteroides puede disminuirse progresivamente a 2,5-5mg por semana hasta su suspensión.
Una respuesta escasa o incompleta a los esteroides puede estar indicando otra enfermedad subyacente, y si el diagnóstico de cáncer no se descarta de manera confiable, es necesario realizar una cirugía. Ante el compromiso focal de la cabeza del páncreas suele llevarse a cabo una pancreatoduodenectomía, mientras que los compromisos focales del cuerpo y la cola del páncreas se tratan con esplenopancreatectomía distal. En casos poco frecuentes, las formas difusas de PAI que no responden al tratamiento con esteroides, se puede realizar una pancreatectomía total16,36–39.
Durante el período de seguimiento, el 6-54% de los pacientes tiene recaídas, siendo más frecuentes las recurrencias en los jóvenes con formas focales8,36,40. De acuerdo con Manfredi et al.9, la enfermedad recurrente se manifiesta con un agrandamiento focal o difuso de la glándula pancreática, o se limita a las vías biliares sin compromiso pancreático. En su estudio, además, todos los pacientes con enfermedad recurrente permanecieron clínicamente asintomáticos, sin alteraciones en los análisis de laboratorio, por lo que un seguimiento regular con estudios por imágenes resulta fundamental para un diagnóstico temprano de la recurrencia.
Las recaídas suelen tratarse con un segundo ciclo de esteroides, pero en algunos casos se requiere una terapia de mantenimiento a largo plazo con dosis bajas de esteroides o fármacos inmunosupresores ahorradores de esteroides10,16,41.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.