Presentar nuestra experiencia inicial con la embolización prostática como tratamien-to para la hiperplasia prostática benigna (HPB) desde la perspectiva técnica, y establecer la contribución del Diagnóstico por Imágenes.
Materiales y métodosDieciséis pacientes con trastornos del tracto urinario inferior debidos a HPB realizaron embolización prostática. Todos respondieron cuestionarios específicos para determinar la severidad de la sintomatología y su impacto en la calidad de vida y función eréctil. Además, fueron evaluados con ecografía y resonancia magnética de pelvis, flujometría urinaria y antígeno prostático específico (PSA) antes y 30 días después del procedimiento.
ResultadosLa embolización fue exitosa en todos los pacientes (10 en forma bilateral y 6 en unilateral). El tiempo medio de duración del procedimiento fue de 82 minutos y el de la radioscopia de 38,5min. Todos los procedimientos se llevaron a cabo en forma ambulatoria, con un tiempo medio de estancia hospitalaria de 6,4h. El consumo medio de contraste radiológico fue de 175ml. A los 30 días se verificó una reducción media de volumen prostático del 21%. Adicio-nalmente, se constató una mejoría clínica caracterizada, en promedio, por una disminución de 8 puntos en el cuestionario que mide los síntomas prostáticos, de 2 puntos en el cuestionario que calcula la calidad de vida y de 4 puntos en el cuestionario que sondea la función eréctil. La flujometría mejoró un 39% y el PSA se redujo un 26%. No hubo complicaciones mayores y solo se observaron efectos adversos menores en 9 pacientes.
ConclusiónLa embolización prostática para el tratamiento de la HPB demostró ser segura y eficiente en esta serie preliminar de pacientes.
To present the initial experience with prostatic embolization as an alternative treatment for benign prostatic hyperplasia (BPH) from a technical perspective to establish the contribution provided by diagnostic imaging.
Materials and methodsSixteen patients with lower urinary tract symptoms due to benign prostatic hyperplasia underwent prostatic embolization. All patients were evaluated with specific questionnaires to determine the severity of symptoms, impact on quality of life and erectile function, ultrasound and MRI of the pelvis, urinary flowmetry and PSA before and 30 days after the procedure.
ResultsEmbolization was successful in all patients; in 10 cases the procedure was performed bilaterally and in six, only one side was embolized. The average time for completion of the procedure was 82minutes and the average fluoroscopy time was 38.5minutes. All procedures were performed on an outpatient basis with an average hospital stay of 6.4hours. The mean contrast medium used was 175ml. At 30 days there was a mean reduction on prostate volume of 21%. Clinical improvement was characterized by a mean 8-point improvement on IPSS, 2 points on QOL and 4 points on IIEF. The uroflowmetry improved 39% and PSA dropped 26%. No major complications that implied unscheduled hospitalization or performing additional surgical procedures were seen. Minor adverse events were verified in 9 patients.
ConclusionThe initial results of prostatic embolization as an alternative treatment for BPH indicate that it is a safe and effective procedure to be consolidated as a new field of action of interventional radiology.
La hiperplasia prostática benigna (HPB) tiene una alta tasa de prevalencia en hombres a partir de los 50 años y su frecuencia aumenta aún más con el envejecimiento1,2. La HPB es una condición que habitualmente se asocia a síntomas del tracto urinario inferior (en particular, con la reducción del flujo urinario y la poliuria con urgencia miccional), alterando la calidad de vida3,4.
Según la gravedad de los síntomas y la evolución clínica, hay varias opciones para el manejo de la HPB. Estas van desde la observación o medicación hasta la intervención quirúrgica.
La eficacia demostrada por medicamentos como los bloqueadores alfa y los inhibidores de la 5-reductasa ha disminuido la indicación de cirugía. Sin embargo, esta, sea por resección transuretral o por adenectomía a cielo abierto, es considerada la conducta terapéutica de elección para los pacientes rebeldes al tratamiento farmacológico o para aquellos con complicaciones en la obstrucción urinaria5.
El procedimiento quirúrgico no está exento de riesgos y las complicaciones asociadas pueden ser: infección de la vía urinaria, estenosis, dolor posoperatorio, incontinencia o retención urinaria, disfunción sexual y hemorragias6.
Por este motivo, se han desarrollado tratamientos menos invasivos con el fin de disminuir la morbilidad de las intervenciones clásicas7,8. Dentro de las nuevas posibilidades terapéuticas se incluyen, entre otras, la termoterapia transuretral con microondas, la ablación transuretral con aguja, la enucleación o resección con láser de Holmium, la vaporización foto selectiva (láser de luz verde) de la próstata, la resección transuretral con energía bipolar y la incisión transuretral de la próstata8. No obstante, hay que destacar que estas alternativas aún no han demostrado una mayor eficacia para controlar la sintomatología de los pacientes con HPB8,9. Además, no están ampliamente disponibles y, por lo general, tienen un costo elevado.
Recientemente, se ha sugerido que la embolización prostática (EP) para el tratamiento de la HPB en el hombre puede ser tan eficaz como lo es la embolización uterina para el tratamiento de los fibromas uterinos en la mujer10. Los estudios experimentales preclínicos han mostrado que la EP es segura, no provoca disfunción eréctil y puede reducir el volumen prostático11–13. El primer reporte clínico fue descrito por DeMeritt et al.14, quienes trataron con embolización una hematuria provocada por una biopsia percutánea en un paciente con HPB. Ellos no solo lograron el objetivo hemostático, sino que, además, observaron en el paciente una mejoría clínica significativa de los síntomas relacionados con la HPB14. Posteriormente, otros autores también han estableci-do que la EP parecería ser segura y eficaz para controlar la sintomatología de los pacientes con HBP15,16.
En esta comunicación se presenta nuestra experiencia inicial con la EP como tratamiento para la HPB desde la perspectiva técnica y se establece la contribución del Diag-nóstico por Imágenes.
Materiales y métodosEste estudio fue aprobado por el Comité de Ética de Protocolos de Investigación de la institución y todos los pacientes incluidos firmaron el consentimiento informado. Entre agosto del 2012 y julio del 2013, 16 pacientes con una edad media de 72 años (rango: 52-87) fueron tratados con EP como forma de tratamiento para la HPB. Todos los casos eran refractarios al tratamiento médico y tenían indicación de cirugía.
Los pacientes fueron evaluados con cuestionarios específicos para determinar la intensidad de los trastornos del tracto urinario inferior y su impacto en la calidad de vida y función eréctil. Se utilizó la puntuación internacional de síntomas prostáticos (international prostatic symptoms score [IPSS]) para cuantificar la gravedad de la sintomatología, el cuestionario sobre calidad de vida (QOL) y la escala internacional de la función eréctil (international index of erectile function [IIEF]), presentes en el anexo 1.
En todos los casos, se verificó el nivel sérico del antígeno prostático específico (PSA) y también se realizó una flujometría urinaria para determinar el flujo máximo de orina (Qmáx), una ecografía para evaluar el volumen residual posmiccional (VRPM) y una resonancia magnética (RM) para establecer el volumen y las características anatómicas de la próstata.
Protocolo de resonancia magnética de próstata pre y posembolizaciónLa RM preembolización se realizó entre 7 y 10 días antes del procedimiento, mientras que el control posembolización se llevó a cabo a los 30 días.
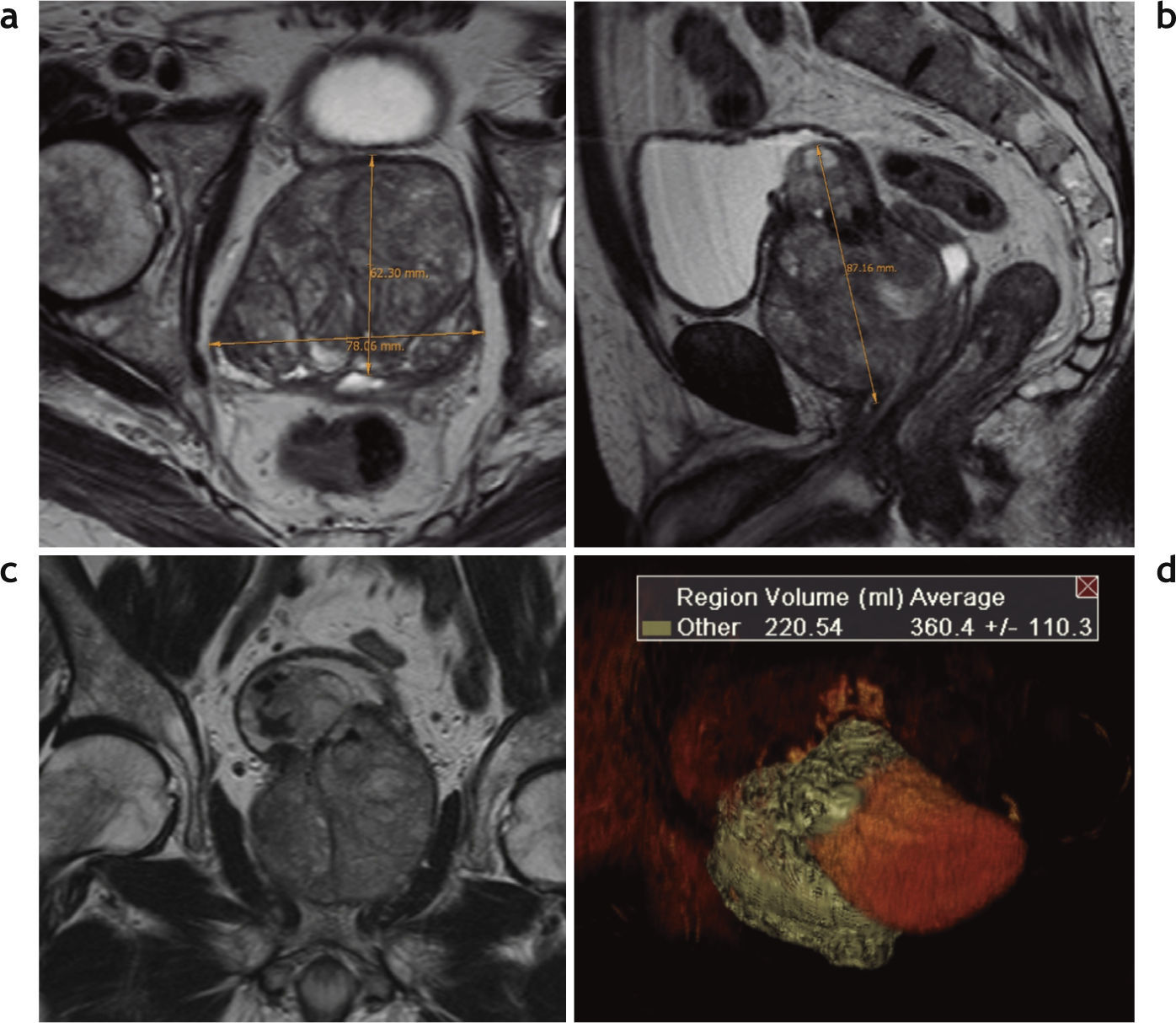
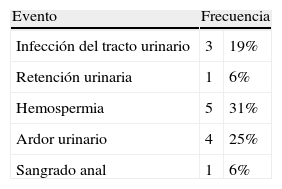
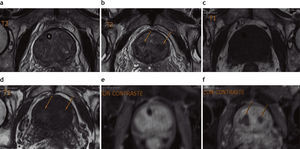
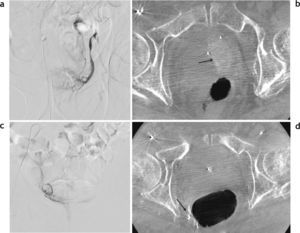
Los estudios se efectuaron con un equipo de 1,5 Tesla (Magnetom Avanto®; Siemens Medical Solutions, Erlangen, Alemania), empleando bobina corporal de superficie (body phased array surface coil), y se tomó como referencia para la orientación de las secuencias la superficie posterior de la próstata. Las secuencias transversales se programaron en forma perpendicular y las coronales en forma paralela al plano mencionado. El protocolo incluyó las secuencias sin contraste: turbo spin eco (TSE) en ponderación T1 corte transversal y T2 cortes transversal, sagital y coronal, así como técnicas de difusión/coeficiente de difusión aparente en corte transversal (valor de b: 50, 400 y 1000 s/mm2). Además, se incorporaron secuencias dinámicas (Flash 3D VIBE transversal) después de la administración por vía intravenosa de gadolinio (gatoterato de meglumina a una dosis de 0,1 mmol/kg con un flujo de 3ml/s, seguido de 20ml de solución salina a un flujo similar), con adquisiciones consecutivas durante 5min (luego de haber administrado el contraste), y se realizó otra secuencia tardía a los 7min con TSE cortes transversal, coronal y sagital. Los volúmenes prostáticos fueron calculados por sumatoria de secciones, siendo evaluadas por un radiólogo con 15 años de experiencia en uroimágenes (fig. 1).
Resonancia magnética de próstata, preembolización, secuencia TSE en ponderación T2, cortes (a) transversal y (b) sagital: se observa claramente la banda hipointensa que limita la glándula correspondiente a la cápsula verdadera y múltiples nódulos hiper-plásicos de señal heterogénea que deforman la glándula y comprimen la zona periférica, representada por una banda en el sector posterior de la glándula (flechas). (c) Corte coronal que evidencia el reemplazo y deformación de la glándula por múltiples nódulos. (d) Cálculo del volumen glandular.
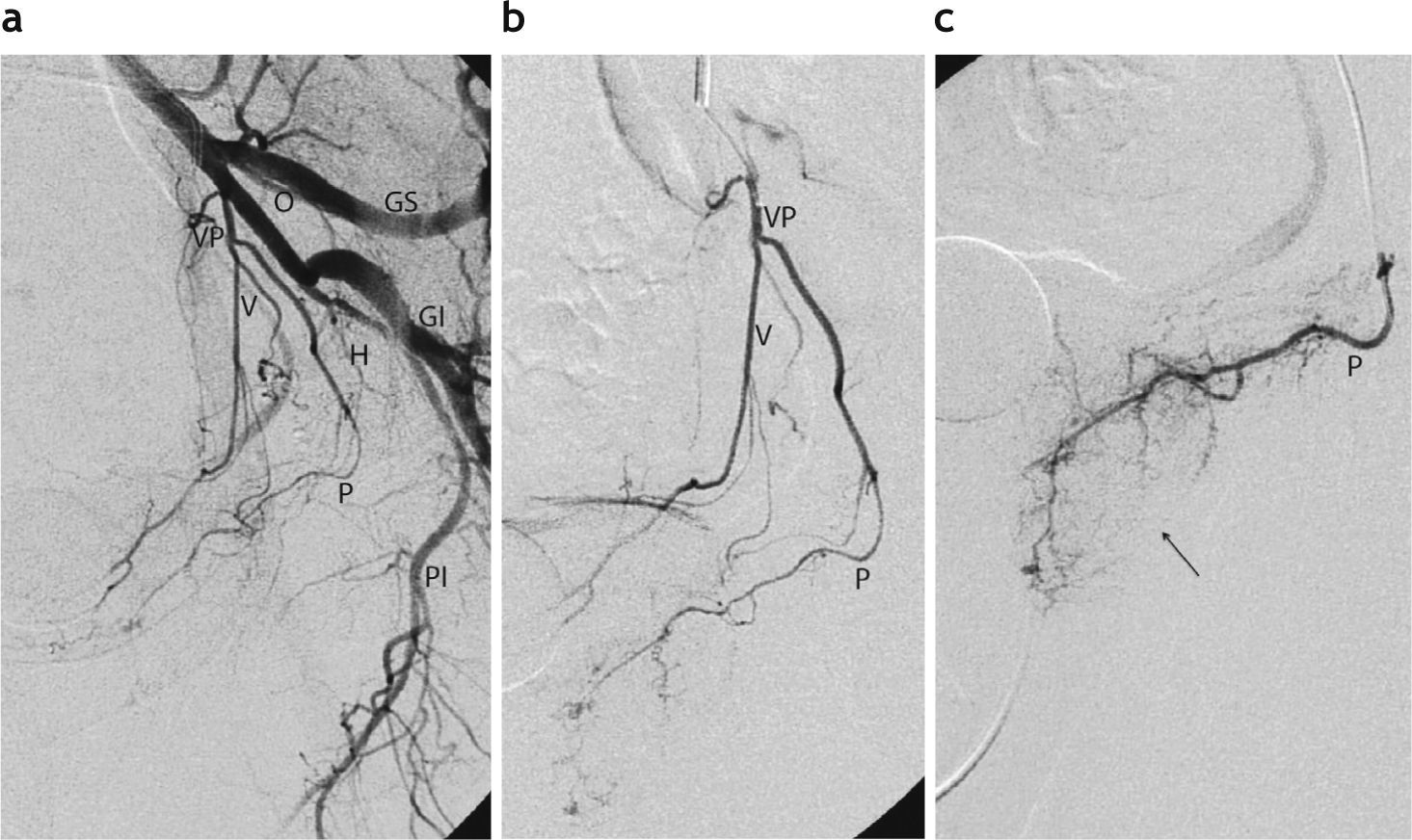
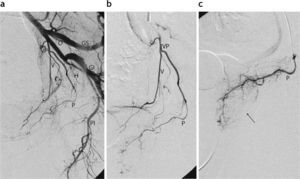
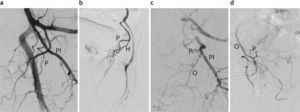
La embolización prostática, realizada en forma ambulatoria en todos los casos, se llevó a cabo en un equipo angiográfico con sustracción digital (Artis Zeego®; Siemens Medical Solutions, Erlangen, Alemania), ubicado en el quirófano híbrido de la sección de Angiografía y Terapia Endovascular. A todos los pacientes se les colocó una sonda vesical y se les administró una dosis de 400mg de ciprofloxacino por vía endovenosa antes de la intervención. El procedimiento se efectuó por punción percutánea y cateterismo de la arteria femoral común derecha con anestesia local. Se realizó una aortografía panorámica seguida de angiografías selectivas de ambas arterias hipogástricas para la identificación de la anatomía vascular de la pelvis, prestando particular atención al origen de las arterias prostáticas (fig. 2).
Angiografía pélvica para la identificación de las arterias prostáticas. (a) Arteriografía por sustracción digital con el caté-ter angiográfico colocado en la arteria hipogástrica izquierda. Imagen en incidencia oblicua anterior izquierda. Identifíquense los siguientes ramos: glútea superior (GS), glútea inferior (GI), pudenda interna (PI), obturatriz (O), tronco vesicoprostático (VP), vesical (V), prostática (P) y hemorroidal (H). (b) Angiografía selectiva del tronco vesicoprostático realizada a través del microcatéter. (c) Angiografía efectuada por cateterismo superselectivo de la arteria prostática izquierda con microcatéter. Obsérvese la retención glandular del contraste (flecha).
Una vez reconocidas, las arterias prostáticas fueron cateterizadas de forma selectiva con un microcatéter (Pro Great® 2,7, Terumo, EE. UU., o Maestro® 2,4, Merit Medical, South Jordan, EE. UU.) colocado coaxialmente a través de un catéter angiográfico 5 Fr.
A criterio del operador, en los casos dudosos se obtuvieron imágenes angiotomográficas (tomografía computada [TC] de haz cónico: Cone Beam CT)17.
Con el microcatéter ubicado en la posición correcta, se realizó una embolización a flujo libre con microesferas de trisacril (Embosphere®, Biosphere Medical, South Jordan, EE. UU.) hasta ocluir el flujo arterial prostático. Luego de hacer un control angiográfico posembolización, se retiró el catéter angiográfico y se practicó compresión manual en el sitio de la punción. Los pacientes fueron dados de alta 6h después, sin la sonda vesical y medicados con antibióticos orales (ciprofloxacino 1g/día) por 8 días y antiinflamatorios no esteroides a demanda. Todos fueron contactados por vía telefónica durante la primera semana y los síntomas o complicaciones fueron consignados y categorizados de acuerdo con la clasificación propuesta por la Sociedad Americana de Radiología Intervencionista18.
Un mes después de la embolización, se realizó una RM de próstata de control, otra flujometría y se midió el VRPM por ecografía y el PSA. Los pacientes también completaron nuevamente los cuestionarios IPSS, QOL y IIEF.
Dado que se trata de un reporte preliminar con un número reducido de pacientes y seguimiento corto, no se hizo un análisis estadístico estricto. Las variables categóricas se expresaron en porcentajes (%) y las variables continuas, con sus medias ± desviación estándar.
ResultadosLa embolización se realizó en forma bilateral en 10/16 (62,5%) pacientes y en forma unilateral en 6/16 (27,5%). Cuando fue unilateral, se debió a la imposibilidad de cateterizar una de las arterias prostáticas: en 3 casos por abundantes cambios arterioscleróticos en las arterias y en los otros 3 porque se comprobó la presencia de anastomosis de la arteria prostática con otros vasos (hemorroidal media, deferencial y cavernosa), impidiendo una embolización selectiva segura.
El tiempo medio del procedimiento fue de 82min (rango: 50-138) y el de la radioscopia de 38,5min (rango: 21-83). No se observaron complicaciones clínicas durante el procedimiento. El consumo medio de contraste yodado fue de 175ml (rango: 100-350).
Se observó que la arteria prostática (AP) izquierda se originaba en 8 casos a partir de la arteria vesical inferior (formando un tronco común —tronco vesicoprostático—), en 4 casos desde la arteria pudenda interna, en un caso en la arteria obturatriz y en 3 casos directamente desde la división anterior de la arteria hipogástrica.
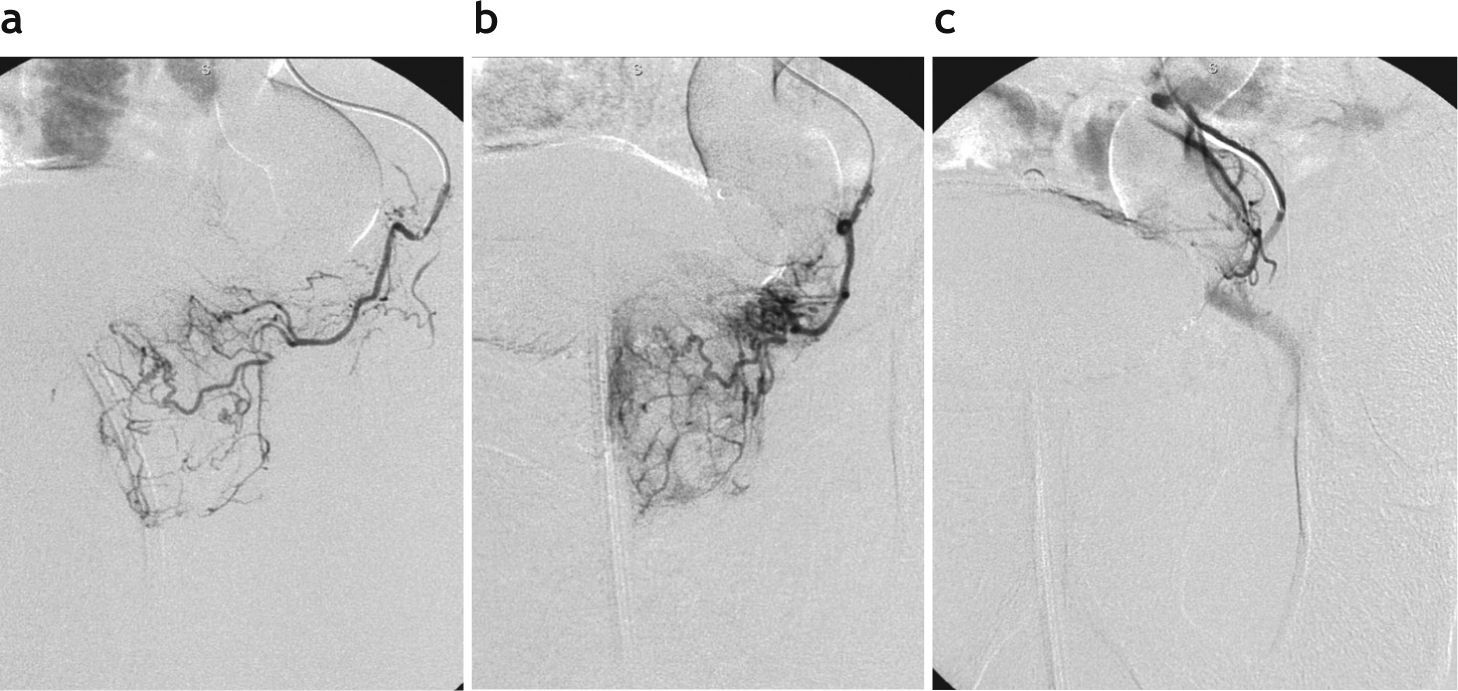
A su vez, la AP derecha se originaba en 7 casos a partir de la arteria vesical inferior (formando un tronco común —tronco vesicoprostático—), en 2 casos desde la arteria pudenda interna, en 2 casos en la arteria obturatriz, en un caso junto con la arteria rectal media y en 3 casos directamente desde la división anterior de la arteria hipogástrica (fig. 3).
Angiografía selectiva de la arteria prostática izquierda pre y posembolización. (a) Imagen en incidencia oblicua anterior izquierda permite identificar la vascularización arterial de la hemiglándula izquierda. (b) Imagen en posición neutral (anteroposterior). (c) Control angiográfico posembolización, evidenciando la interrupción del flujo a través de la arteria prostática izquierda.
En un caso se observaron 2 arterias prostáticas del lado derecho, una vesicoprostática originada en la arteria hipogástrica y otra en la pudenda interna. En 9 casos se realizaron imágenes angiotomográficas con el detector plano del angiógrafo (Cone Beam CT) para la identificación segura de la irrigación arterial de la próstata.
Los resultados clínicos del tratamiento a los 30 días se resumen en la tabla 1. No hubo necesidad de continuar con la medicación prostática específica en ningún paciente durante el período de observación de 30 días. En 2/5 pacientes que tenían retención aguda de orina y sonda vesical permanente antes del procedimiento se pudo retirar la sonda de forma definitiva.
Evolución de los parámetros investigados. Se presentan los promedios de los valores obtenidos con su desviación estándar
| Parámetro | Pre-EP | Pos-EP | Interpretación | |
| IPSS | 17 puntos ± 5,5 | 9 puntos ± 4,8 | Mejora clínica de 8 puntos | |
| QOL | 4 puntos ± 0,7 | 2 puntos ± 1,2 | Mejora de la calidad de vida en 2 | puntos |
| IIEF | 16 puntos ± 8,7 | 20 puntos ± 10,6 | Mejora de la función eréctil en 4 | puntos |
| PSA | 4,3 ng/dl ± 7,3 | 3,2 ng/dl ± 5 | Reducción sérica de 1 ng/dl | |
| Qmáx | 9 ml/s ± 4,9 | 12,5 ml/s ± 2,7 | Mejora el flujo de orina en 3 ml/s | |
| VRPM | 88 ml ± 83 | 48 ml ±34 | Mejora la retención posmiccional | de orina |
| Volumen prostático | 109 cc ± 51 | 87cc ± 34 | Reducción de volumen de 21% |
IIEF: escala internacional de la función eréctil; IPSS: puntuación internacional de síntomas prostáticos; PSA: antígeno prostático específico; Qmáx: flujo máximo de orina; QOL: calidad de vida; VRPM: volumen residual posmiccional.
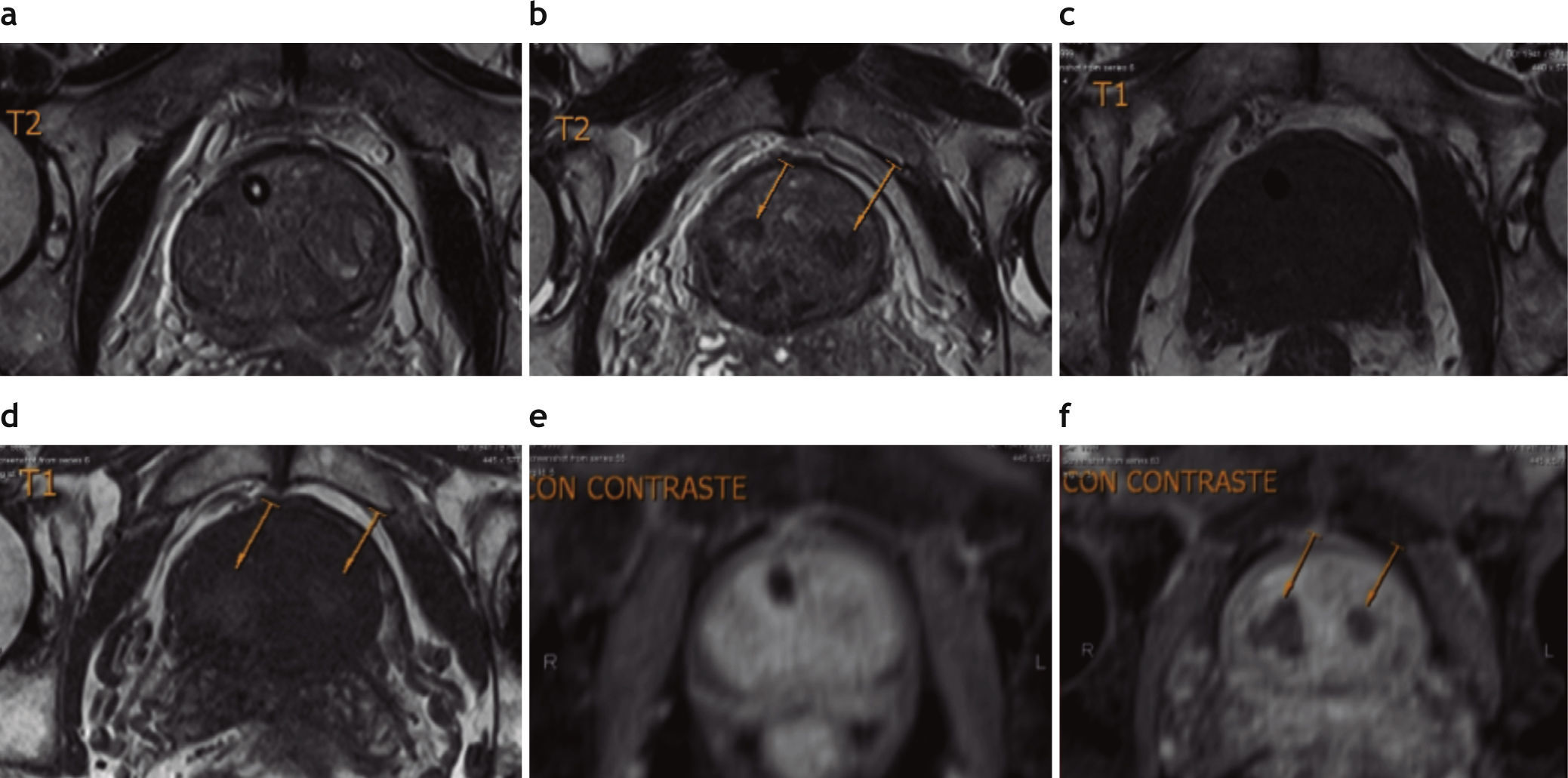
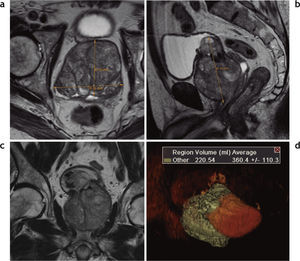
En todos los pacientes, la RM preembolización mostró un aumento del tamaño de la próstata a expensas de la glándula central, con compresión y adelgazamiento de la glándula periférica. En las secuencias ponderadas en T2, se evidenció hiperplasia glandular y estromal en todos los casos (fig. 4).
Resonancia magnética de próstata pre y posembolización. Al comparar (a) TSE en ponderación T2 preembolización con (b) TSE en ponderación T2 posembolización, se aprecia una disminución del volumen glandular, la ausencia de la sonda uretral y múltiples áreas nodulares con disminución de señal (flechas) en la glándula central. Comparando (c) TSE en ponderación T1 preem-bolización con (d) TSE en ponderación T1 posembolización, las áreas focales hipointensas en ponderación T2 coinciden con sectores hiperintensos en ponderación T1 (flechas), un hallazgo compatible con componente hemorrágico (necrosis hemorrágica). El cotejo de imágenes con contraste endovenoso en (e) TSE en ponderación T1 con contraste preembolización y (f) TSE en ponderación T1 posembolización evidencia la falta de captación de contraste, atribuible a una devascularización posembolización (flechas).
En la RM posembolización de todos los pacientes se pudo constatar una reducción del volumen prostático (promedio 21%) y una disminución en la intensidad de señal de la glándula en secuencia TSE en ponderación T2. En los controles se identificaron sectores prostáticos con ausencia o disminución de vascularización, siendo más evidente en 11 casos. En estos últimos, las áreas de devascularización afectaron a la glándula central de forma difusa en 9 y con múltiples nódulos en 1, mientras que el otro paciente presentó devascularización de casi toda la glándula central y, además, mostró señal hiperintensa heterogénea en secuencias en ponderación T1, un hallazgo interpretado como componente hemorrágico asociado a la devascularización.
De los 5 pacientes restantes, 2 evidenciaron signos de devascularización con afectación de la glándula central y periférica, 2 con predominio de la hemiglándula izquierda y 1 tuvo afectación bilateral.
Solo 9/16 pacientes tuvieron complicaciones menores o efectos adversos, todos de grado B según la clasificación propuesta por la Sociedad Americana de Radiología Intervencionista (tabla 2). Tres casos presentaron una infección urinaria (que remitió rápidamente con tratamiento antibiótico) y un paciente desarrolló una retención urinaria aguda (que requirió la colocación de una sonda vesical transitoria durante 25 días). Como efectos colaterales adversos, se detectó ardor urinario en 4 pacientes que resolvieron con corticoides por vía oral, en uno hubo un único episodio de sangrado anal y en 5 casos se registró hemospermia transitoria.
DiscusiónLa embolización es una técnica de la radiología intervencionista que se aplica en medicina hace casi 40 años y que ha demostrado ser muy útil para resolver múltiples patologías en las más diversas zonas del cuerpo humano. Específicamente en Urología, este método se emplea para contener hemorragias provocadas por traumatismos, tumores o alteraciones vasculares, o también como tratamiento para el varicocele19–23.
En la última década, se consolidó la embolización como tratamiento de los fibromas uterinos sobre la base de evidencia científica de nivel A, tal como destacó el Colegio Americano de Obstetras y Ginecólogos24. Curiosamente, los fibromas uterinos muestran una cierta similitud con el adenoma prostático: además de estar relacionados con la dependencia hormonal, ambos son patologías genitales muy prevalentes, que se caracterizan por presentar músculo liso y estroma. Por este motivo, es natural que haya surgido la siguiente hipótesis: si la embolización es eficaz para tratar los fibromas uterinos, ¿el efecto será el mismo en el tratamiento del adenoma prostático?
La observación de DeMeritt et al.14 desencadenó el desarrollo de investigaciones específicas sobre el tema. Recientemente, se han publicado varios estudios que establecen que la técnica parece ser segura y eficiente para controlar la sintomatología de la HPB25. El estudio con mayor casuística y seguimiento (más de 250 casos) demostró un control de la sintomatología en el 72% de los pacientes a los 36 meses26.
El presente estudio es apenas un relato preliminar sobre los efectos inmediatos de la EP en pacientes con HPB, pero los resultados de esta experiencia demuestran, a través de la mejoría clínica obtenida, que el método es reproductible y prometedor. Todos los exámenes objetivos, como el IPSS, el score de calidad de vida y función eréctil, el PSA y la flujometría, mejoraron significativamente después de la EP.
Pisco et al.27, en el artículo original sobre los primeros 15 pacientes tratados con EP, relatan una reducción media del volumen prostático del 26,5% a los 30 días. Posteriormente, con una casuística mucho mayor, el mismo grupo28 reporta una reducción media del volumen prostático del 20% (un resultado similar al obtenido en nuestra serie). Sin embargo, la relación directa entre la reducción del volumen prostático y la mejoría clínica no ha podido ser demostrada: Pisco et al.16 observaron 33 pacientes sin mejoría clínica, pese a tener una reducción de más del 15% en el volumen prostático, mientras que en el mismo reporte comunicaron 12 casos con aumento del volumen prostático postratamien-to que tuvieron mejoría clínica.
La utilización de la RM en la valoración pre y posprocedimiento también surge como extensión de lo aprendido en el tratamiento de los miomas uterinos29. Es bien conocido que la RM es un método por imágenes de alta discriminación tisular que facilita el reconocimiento de la anatomía y los cambios de vascularización, además de permitir una cuantificación del volumen glandular. El empleo del mismo protocolo de estudio para la evaluación pre y posembolización reduce la variabilidad en la comparación. Las secuencias en ponderación T2 son las de mayor utilidad para demostrar la anatomía glandular e identificar los cambios en la señal del componente glandular y estromal antes y después del tratamiento30. El empleo de secuencias TSE en ponderación T1, sin y con contraste intravenoso, permitió identificar tanto los sectores devascularizados como los cambios hemorrágicos secundarios a la necrosis obtenida por la embolización.
Si bien la embolización bilateral es recomendable para tratar toda la glándula involucrada, puede observarse una buena respuesta aun con la embolización unilateral. Efectivamente, Bilhim et al.31 reportaron un alivio de los síntomas en casi la mitad de los pacientes tratados unilateralmente. En nuestra serie los efectos también fueron satisfactorios en los pacientes intervenidos tanto en forma unilateral como bilateral, pero quizás la ausencia de resultados negativos obedezca al número limitado de la muestra.
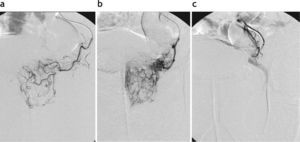
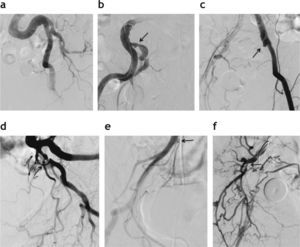
El origen de las arterias vesicoprostáticas es variable. En pacientes añosos, las arterias suelen ser tortuosas y elongadas, pero además pueden presentar lesiones estenótico-oclusivas ateromatosas31,32. Identificar con precisión el origen de las arterias prostáticas, navegar por un sistema arterial con curvas acentuadas y estrecheces localizadas, y hacer el cateterismo superselectivo de arterias muy finas es un desafío técnico particular de este procedimiento. En nuestro estudio, la presencia de alteraciones arterioscleróticas impidió el cateterismo selectivo bilateral y, consecuentemente, la embolización bilateral en 3 pacientes (fig. 5).
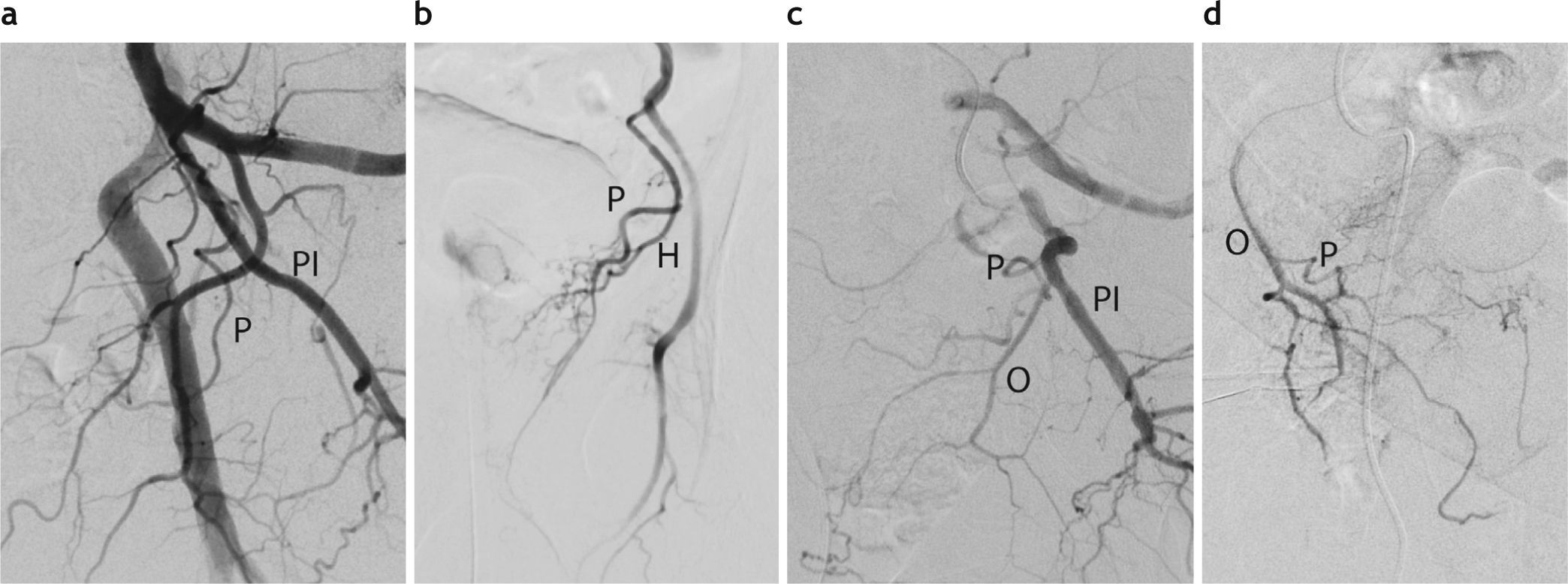
Variaciones en el origen de la arteria prostática (P). (a) Origen independiente en la división anterior de la arteria hipogástrica (AH). (b) Origen en el tronco común con la arteria hemorroidal (H). (c) Origen independiente en la pudenda interna (PI). (d) Origen en la arteria obturatriz (O).
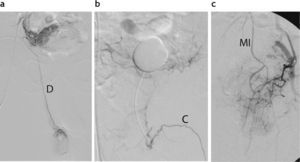
El conocimiento de la anatomía arterial funcional prostática es fundamental para realizar un tratamiento correcto y evitar complicaciones32. La arteria prostática está en íntima relación con la vascularización vesical, rectal y del sistema eyaculador32. Además, existen anastomosis varias con la arteria pudenda interna y rectal31,32 que pueden representar un riesgo potencial por el pasaje de partículas a través de estas comunicaciones, con la consecuente isquemia de tejidos no prostáticos. En nuestra serie inicial, observamos esta situación en 3 casos y decidimos evitar la embolización por temor a provocar alguna complicación isquémica no deseada. De tal manera, reconocer la arteria prostática en el procedimiento angiográfico es esencial para un tratamiento eficaz y seguro31,32 (figs. 6 y 7).
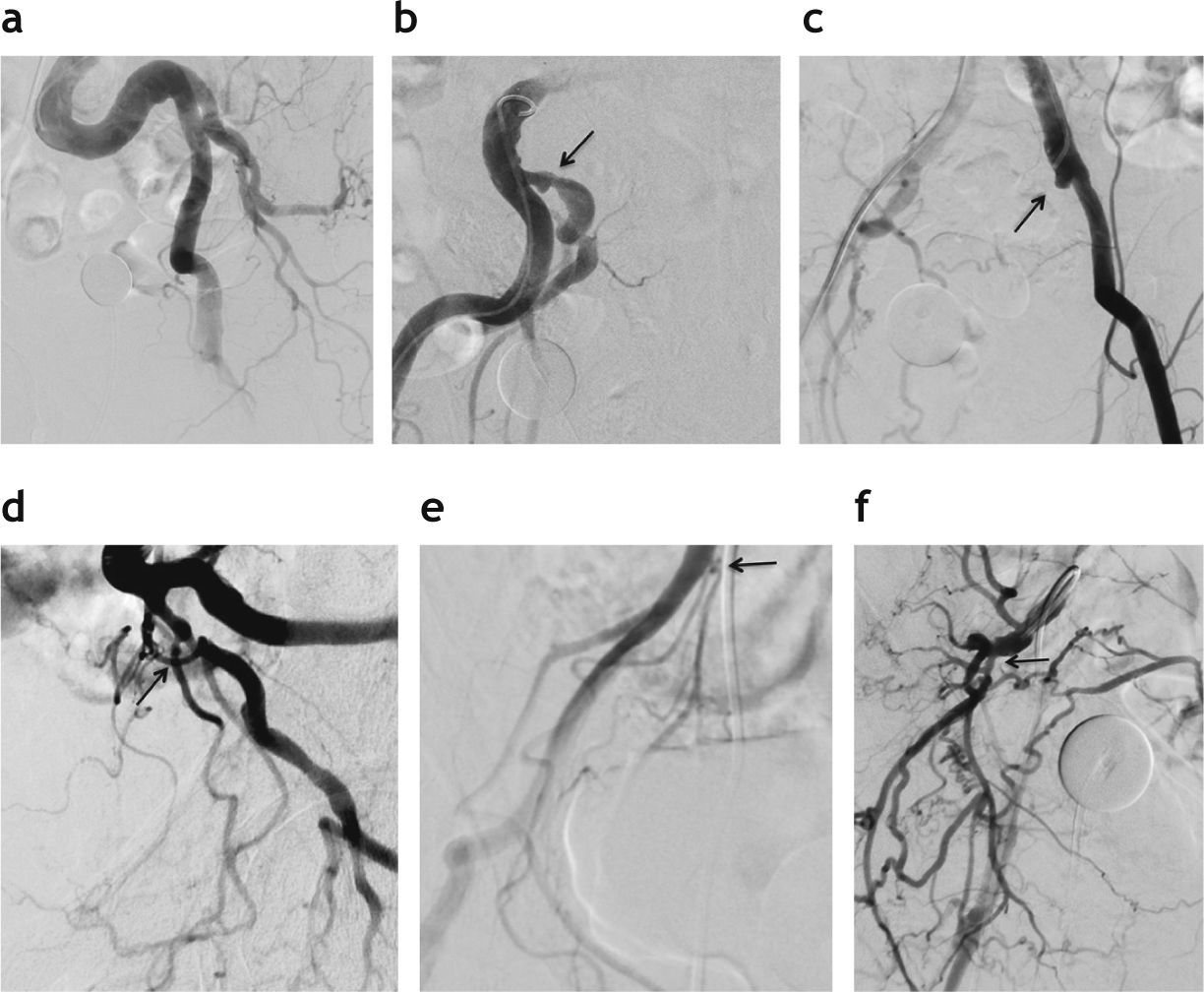
Alteraciones vasculares comúnmente observadas en pacientes con arteriosclerosis que dificultan las maniobras intra-vasculares durante la embolización prostática. (a) Acentuada flexuosidad de la arteria ilíaca izquierda. (b) Estenosis en el origen de la arteria ilíaca interna derecha (flecha). (c) Oclusión de la arteria ilíaca interna izquierda (flecha). (d) Estenosis en el origen de la arteria prostática izquierda (flecha). (e) Estenosis en el origen del tronco vesicoprostático derecho (flecha). (f) Estenosis en el origen de la división anterior de la arteria hipogástrica derecha (flecha).
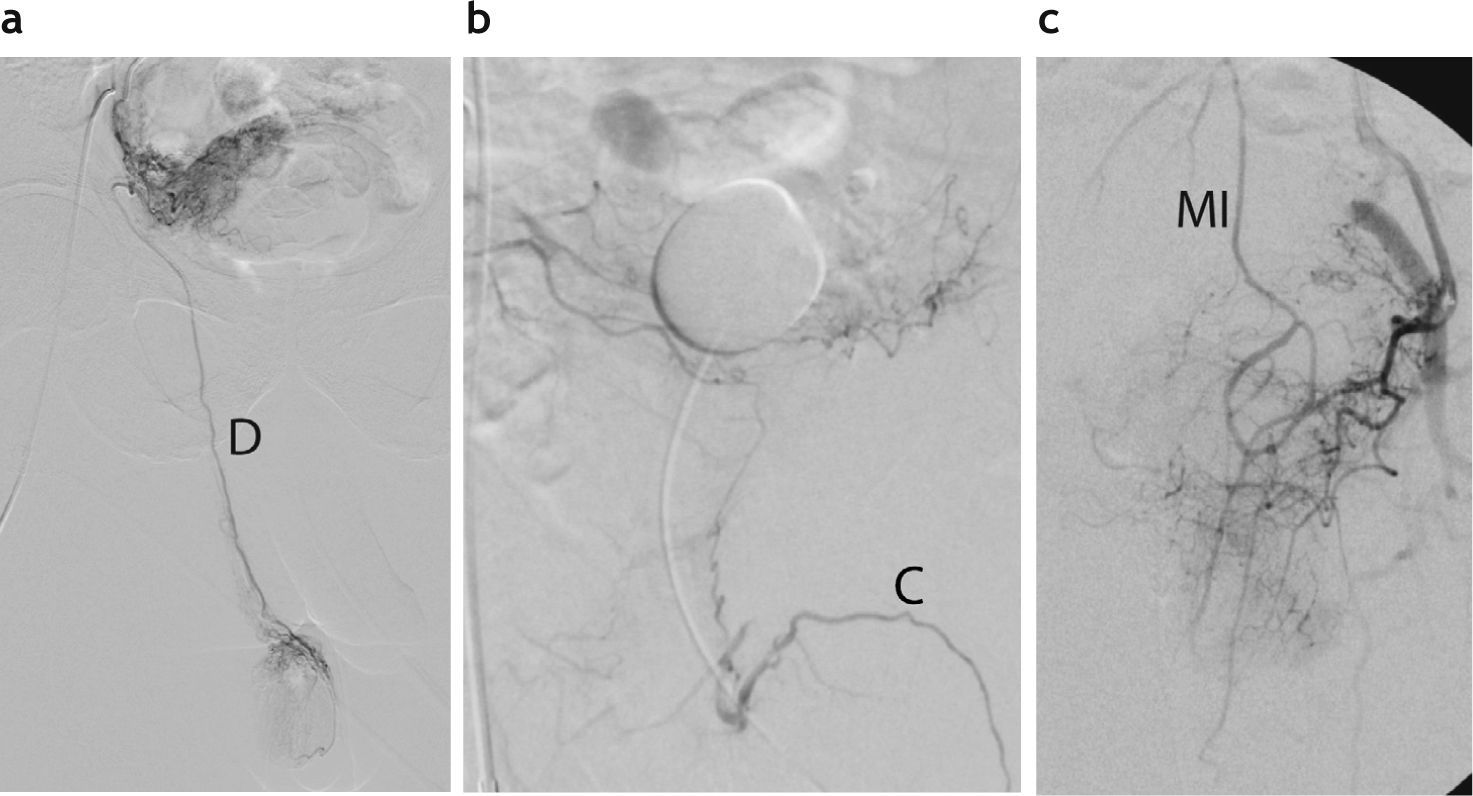
Hallazgos de anastomosis de la arteria prostática con otros ramos pélvicos. (a) Conexión del tronco vesicoprostático con la arteria deferencial (D) derecha. (b) Conexión con la arteria cavernosa izquierda (C). (c) Conexión con la arteria hemorroidal superior, tributaria de la arteria mesentérica inferior (MI).
Pisco et al.26 sugieren la utilización rutinaria de la angiografía por TC multidetector durante la selección de pacientes para descubrir previamente las variaciones anatómicas y el grado de dificultad técnica del procedimiento. Si bien esto puede contribuir con información anatómica, el método todavía no fue validado universalmente, por lo que este estudio no se realizó en ninguno de nuestros pacientes.
Otro recurso potencialmente útil en casos seleccionados es la TC de haz cónico (Cone Beam CT), ya que permite la obtención de angiotomografías en diferentes planos a partir de una angiografía rotacional17. Este es un sistema avanzado que utiliza el arco «C» con detector plano (flat panel) del equipo de fluoroscopia para adquirir y visualizar imágenes angiográficas en 3 dimensiones (3D). Dado que muestra imágenes de los tejidos con alto y bajo contraste (similar a las de la TC) en múltiples planos de visión, resulta sustancialmente mejor que la angiografía por sustracción digital convencional de un solo plano y la fluoroscopia17. Este recurso (con el que contamos en nuestro servicio) nos permitió en casos dudosos reconocer la vascularización extraprostática, evitando así la posibilidad de alguna complicación (fig. 8).
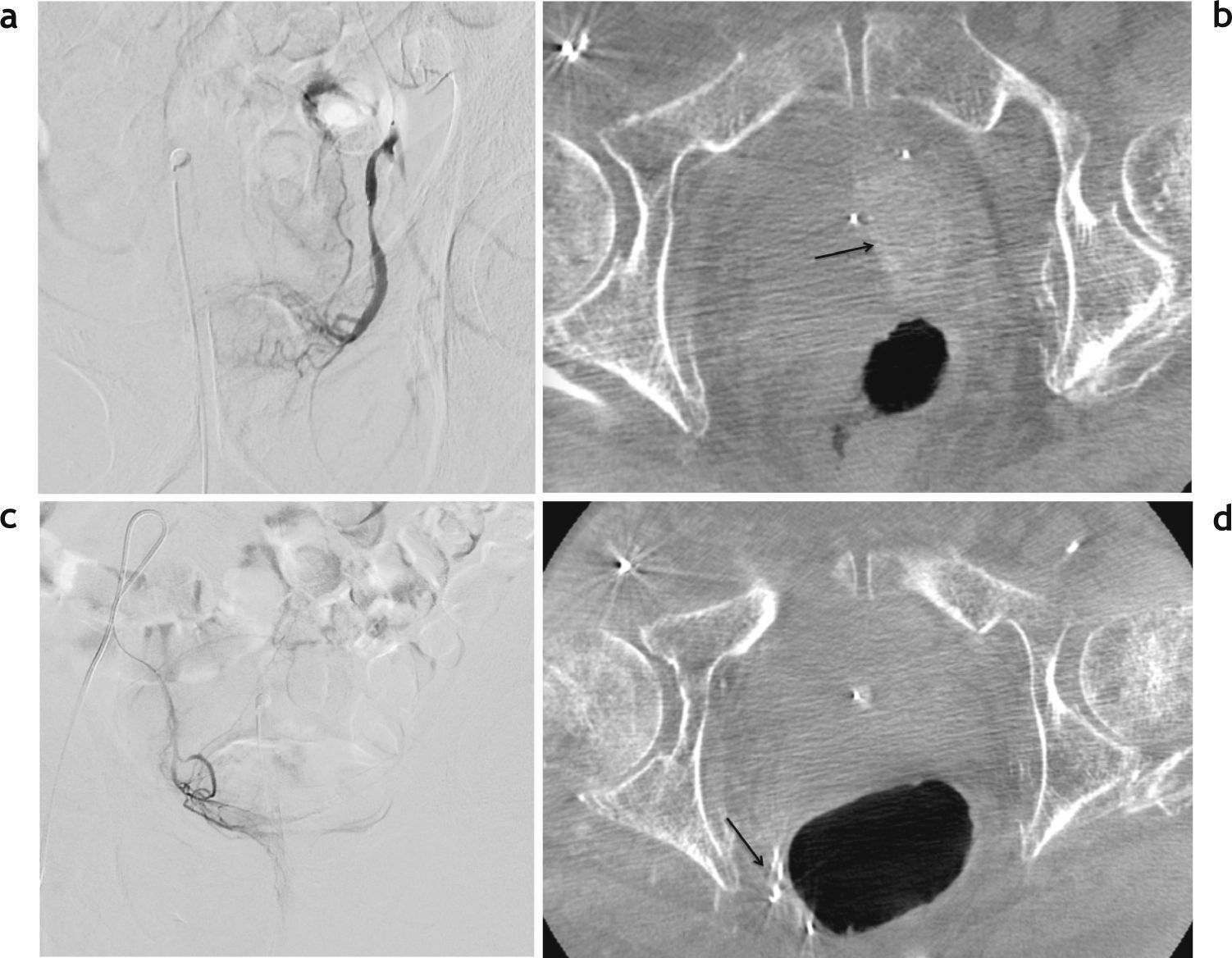
Imágenes obtenidas con el recurso Cone Beam CT. (a) Angiografía selectiva realizada con el microcatéter colocado dentro de un ramo originado en la arteria pudenda interna (PI) izquierda, cuyas características generan ciertas dudas sobre el tejido irrigado. (b) La imagen de TC obtenida con el angiógrafo digital evidencia la retención de contraste en el lecho prostático izquierdo (flecha). (c) Angiografía selectiva realizada con el microcatéter colocado dentro de un ramo originado en la arteria pudenda interna derecha, cuyas características generan dudas sobre el tejido irrigado. (d) La imagen de TC obtenida con el angiógrafo digital muestra la retención de contraste en la pared del recto (flecha), permitiendo la identificación de la arteria hemorroidal y evitando la embolización.
La EP presenta mínimos efectos adversos y prácticamente no produce dolor alguno. En nuestra serie, raramente fue necesario indicar analgésicos potentes y todos los pacientes pudieron irse de alta después de algunas horas de reposo. Esta excelente tolerancia al tratamiento ofrece una ventaja adicional para los pacientes, pero además, tiene un impacto benéfico en la ocupación de camas hospitalarias.
Cuando hubo efectos adversos o complicaciones de la EP en nuestro estudio, estos fueron de discreta magnitud y consideración menor, ya que no requirieron la internación del paciente ni intervenciones adicionales, salvo en un caso en el que el paciente evolucionó con retención aguda y fue necesario colocarle una sonda transitoria durante 25 días. Esta complicación también fue reportada por otros autores y se relaciona con la inflamación ocasionada por la isquemia del tejido glandular26.
Entre las limitaciones del presente estudio podemos mencionar: el número reducido de pacientes, el corto plazo de seguimiento y la falta de comparación de la EP con otros tratamientos. De todas formas, nuestro objetivo fue mostrar la seguridad y eficacia de esta nueva alternativa terapéutica y sus potenciales beneficios en una serie preliminar de casos tratados en nuestra institución.
Sin dudas, se necesitan más estudios con un mayor número de pacientes y un seguimiento más prolongado para determinar el verdadero alcance de esta técnica en el arsenal terapéutico de la HBP. Además, quedan muchos temas clínicos pendientes por investigar, entre ellos la identificación de subgrupos de pacientes en relación con el volumen prostático, el grado de obstrucción, la intensidad de la sintomatología, así como la durabilidad de su eficacia para una mejor indicación terapéutica. En cuanto a los aspectos técnicos, también resta definir, por ejemplo, el tipo y el tamaño de las partículas que se deben utilizar y/o la necesidad de embolizar unilateral o bilateralmente. Seguramente, estos puntos serán objetos de futuras investigaciones.
ConclusiónLa embolización prostática demostró en esta experiencia preliminar institucional ser un procedimiento factible y seguro, con un buen control de los síntomas a corto plazo, ya que logró una reducción del volumen prostático sin disfunción eréctil ni otras complicaciones importantes, como ya ha sido reportado en la literatura internacional.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Anexo 1 Cuestionario para la determinación de la Puntuación Internacional de Síntomas Prostáticos (IPSS)