En Neurorradiología los cambios de la sustancia blanca periventricular o subcortical en pacientes ancianos son descritos generalmente con leucoaraiosis, fenómenos hipóxico-isquémicos crónicos, leucoencefalopatía microangiopática o simplemente con alteraciones en la densidad o intensidad según el método elegido. Sin embargo, ¿es correcto el empleo de estas denominaciones?, ¿funcionan como sinónimos?, ¿tienen un mismo mecanismo de producción?
Las lesiones que afectan a la sustancia blanca se aprecian hipodensas en tomografía computada, hiperintensas en las secuencias ponderadas en T2 o FLAIR e hipointensas en la resonancia magnética en ponderación T1.
Describimos las distintas entidades que pueden afectar selectivamente la sustancia blanca en el paciente anciano y sus probables mecanismos de acción, para establecer una correcta denominación y realizar los diagnósticos diferenciales.
In Neuroradiology the changes in the deep or sub-cortical white matter in elderly people are generally described as leukoaraiosis, chronic hypoxic-ischaemic processes, microangiopathic leucoencephalopathy, or they are simply mentioned as density or intensity changes according to the selected imaging method. However, are these terms correct?, Are they synonyms?, Do they have the same aetiology?
The lesions that affect white matter are hypodense in computed tomography, hyperintense in T2-weighted or FLAIR, or hypointense in T1 images in magnetic resonance.
A description is presented on the different conditions that can selectively affect the white matter in the elderly patient and their probable mechanisms of action in order to establish a correct nomenclature, as well as make differential diagnoses.
En ocasiones el léxico de los informes médicos puede provocar confusión o controversia por la terminología empleada. Este es el caso de las imágenes focales o difusas que afectan a la sustancia blanca (SB) profunda periventricular o subcortical en los pacientes ancianos, ya que suelen denominarse leucoaraiosis (LA), leucomalacia, degeneración hipóxica-isquémica crónica, desmielinización isquémica o relacionada con la edad avanzada, modificaciones isquémicas de pequeños vasos, leucoencefalopatía microangiopática, subcortical, arterioesclerótica o subcortical arterioesclerótica, leucopatía periventricular o isquemia de la sustancia blanca profunda1–3. Todas estas denominaciones parecen ser sinónimos en la descripción de una misma imagen, pero ¿cuál es el término más apropiado?
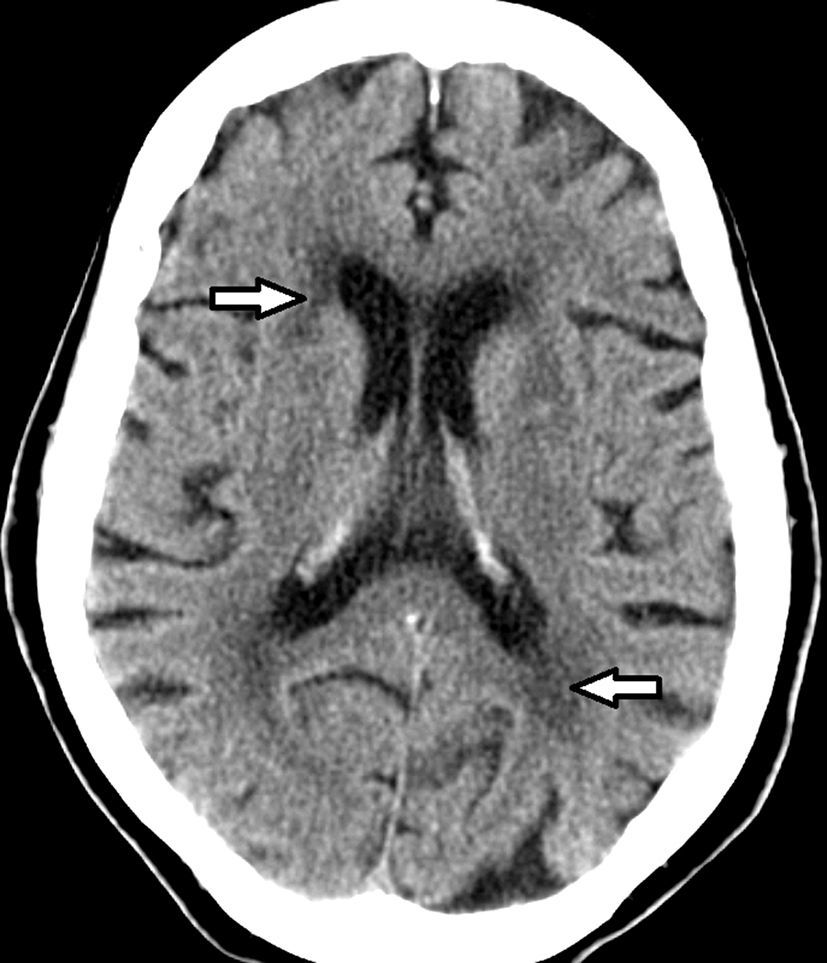
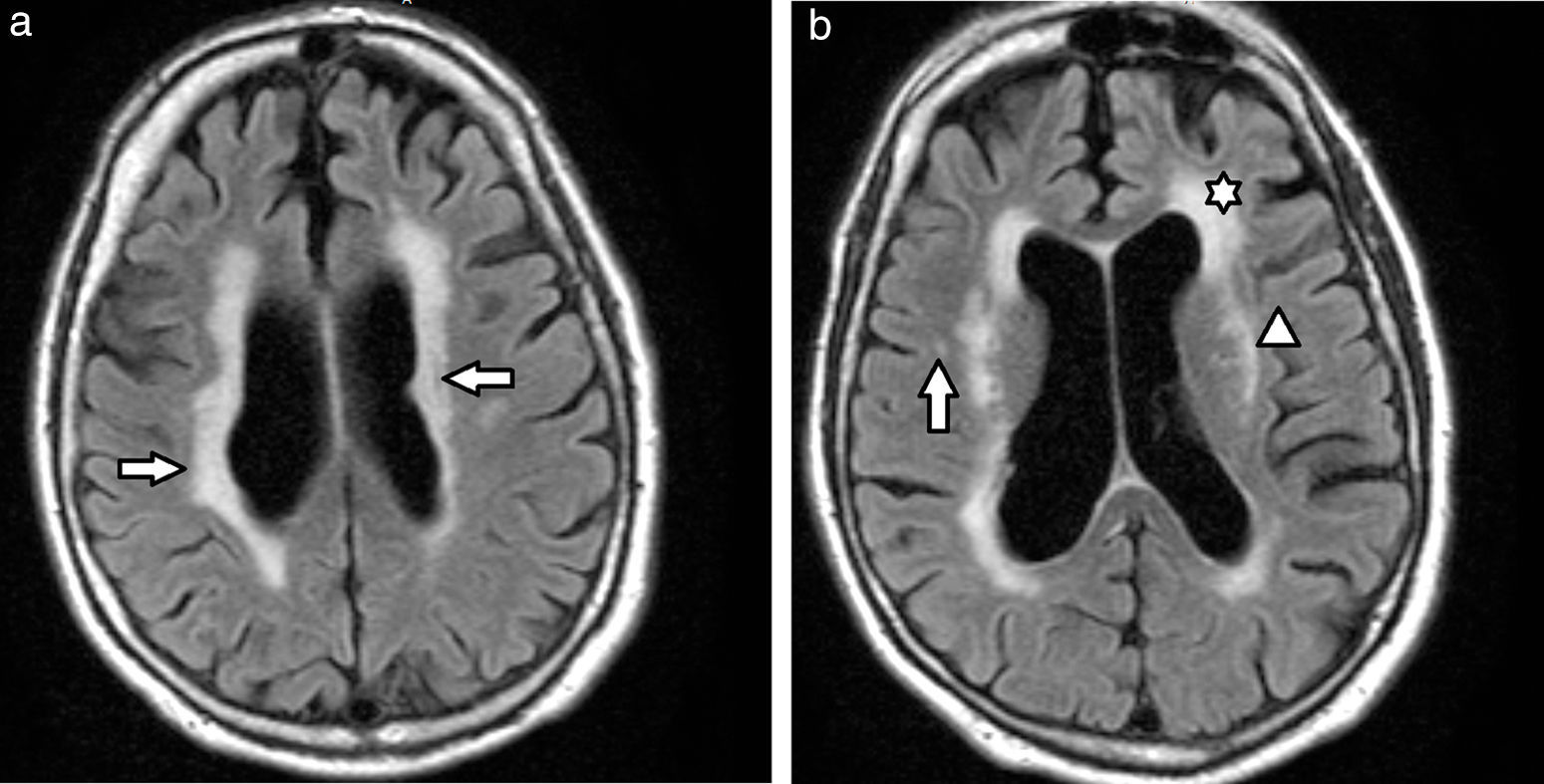
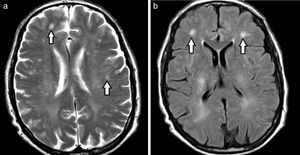
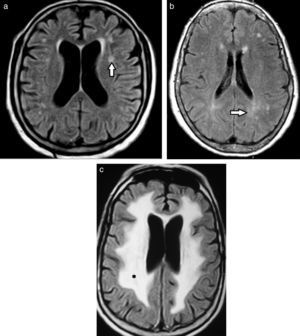
Etimología de leucoaraiosisOriginalmente evaluadas por tomografía computada (TC), las lesiones de la sustancia blanca profunda en los pacientes añosos fueron denominadas leucoaraiosis. Este término deriva del griego leuko (blanco) y araios (enrarecimiento o rarefacción), y fue empleado por primera vez por Hachinski en 1987 para describir los cambios en la sustancia blanca como hipodensidades periventriculares1,4–11 (fig. 1). A su vez, Tarvonen Schroder la define como un signo inespecífico de afectación de la sustancia blanca5. Lo cierto es que la leucoaraiosis no presupone un mecanismo etiológico, vascular o de otro tipo, y es sinónimo de la leucoencefalopatía8.
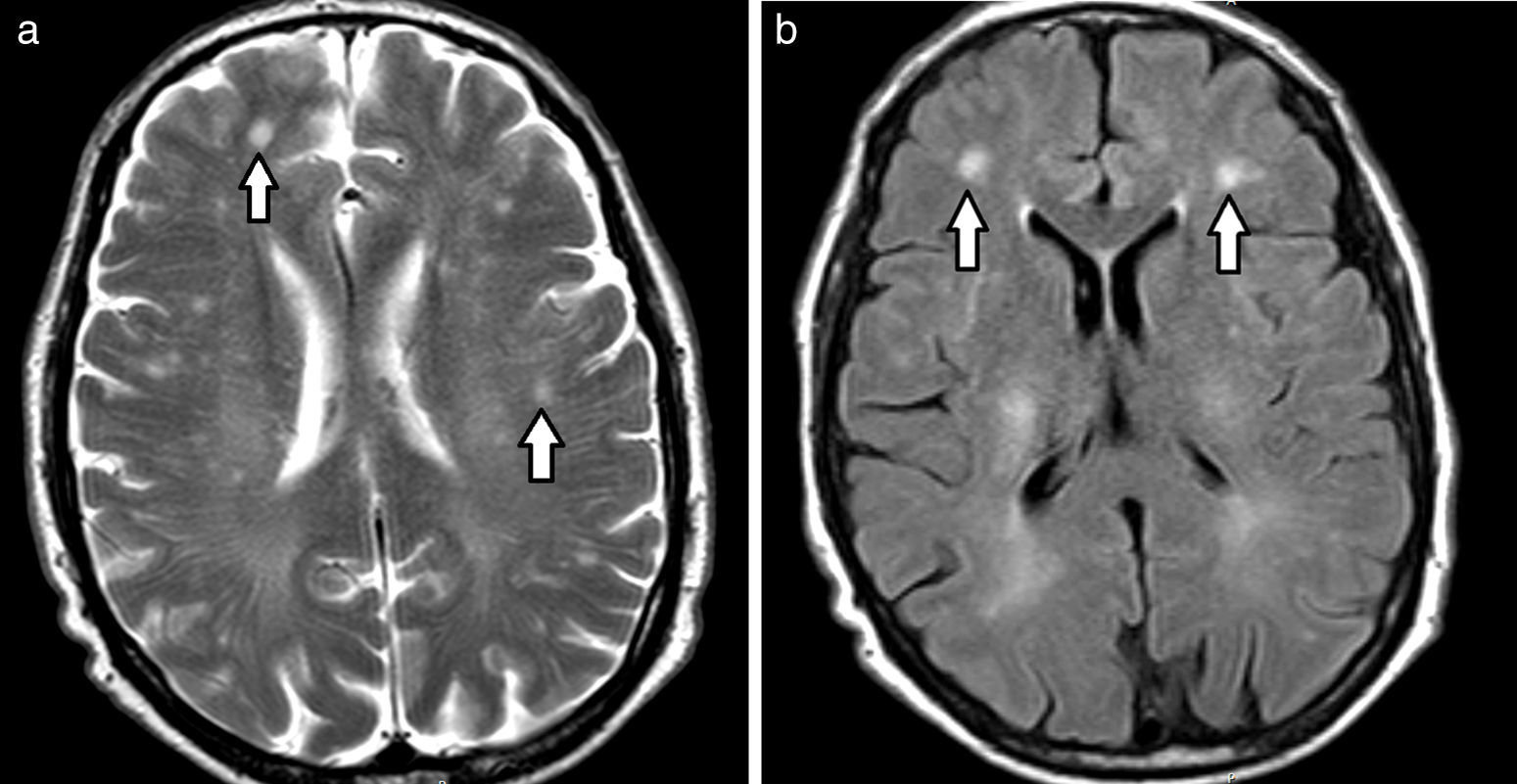
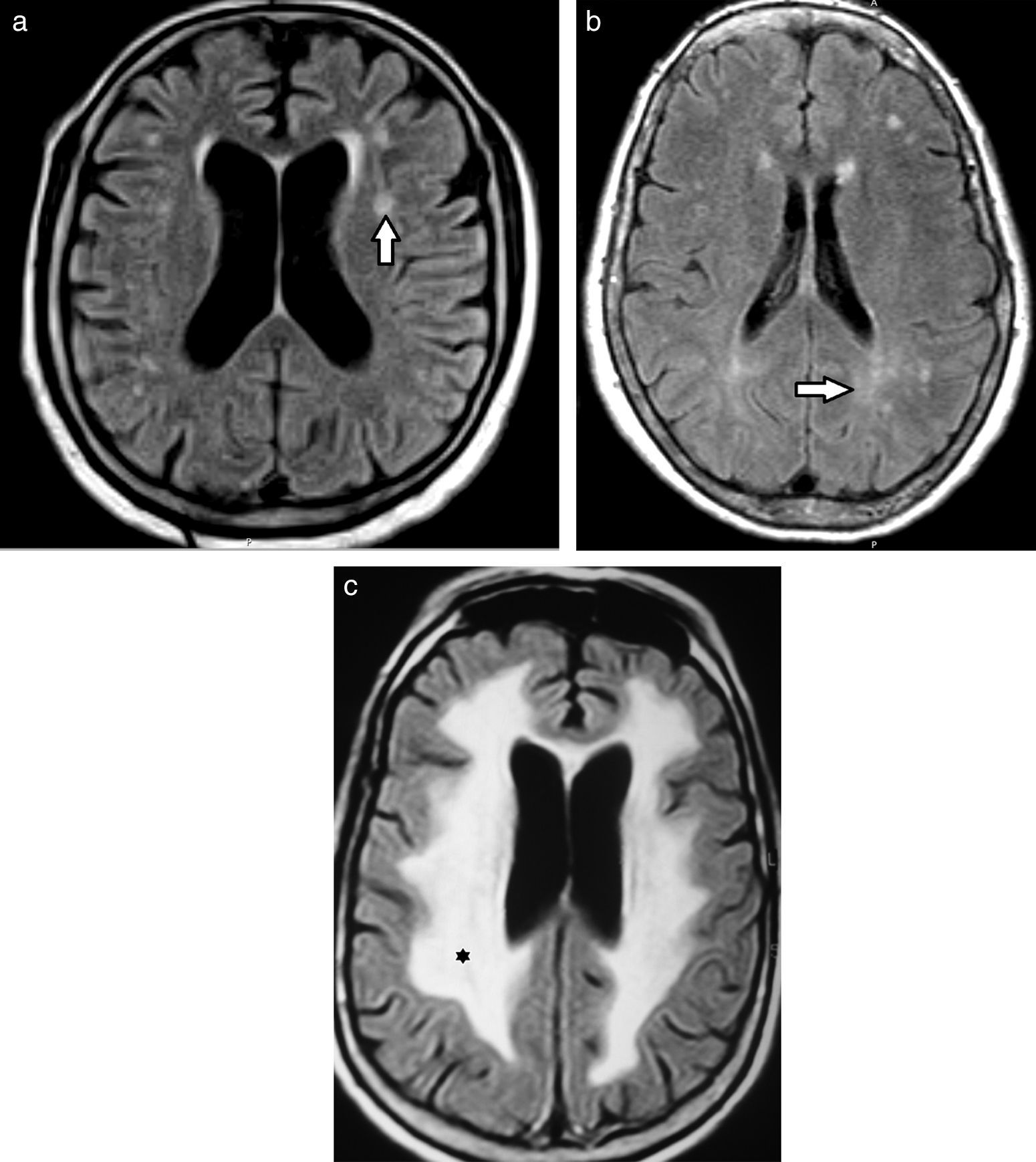
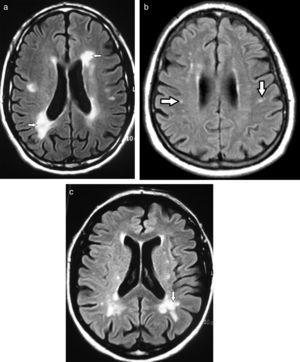
Diagnóstico por imágenesResonancia magnéticaEn la resonancia magnética (RM), los hallazgos se visualizan hiperintensos en las secuencias ponderadas en T2 y recuperación de inversión atenuada de fluido (FLAIR), e hipointensos en ponderación T11,3,4,6,9,12–14 (fig. 2). Para valorar estas alteraciones de la sustancia blanca profunda, la secuencia FLAIR es la más indicada debido a su excelente resolución espacial y diferenciación tisular15.
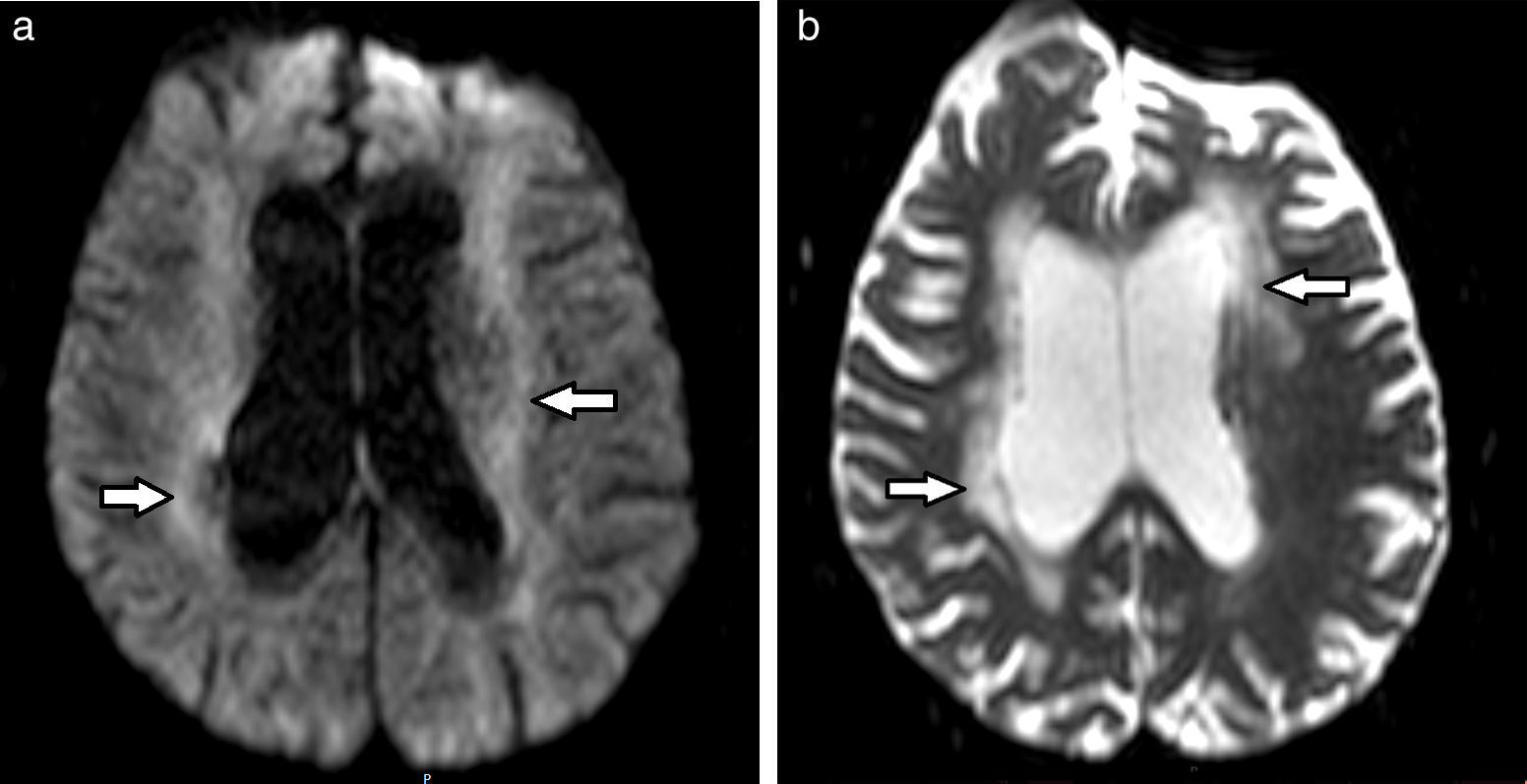
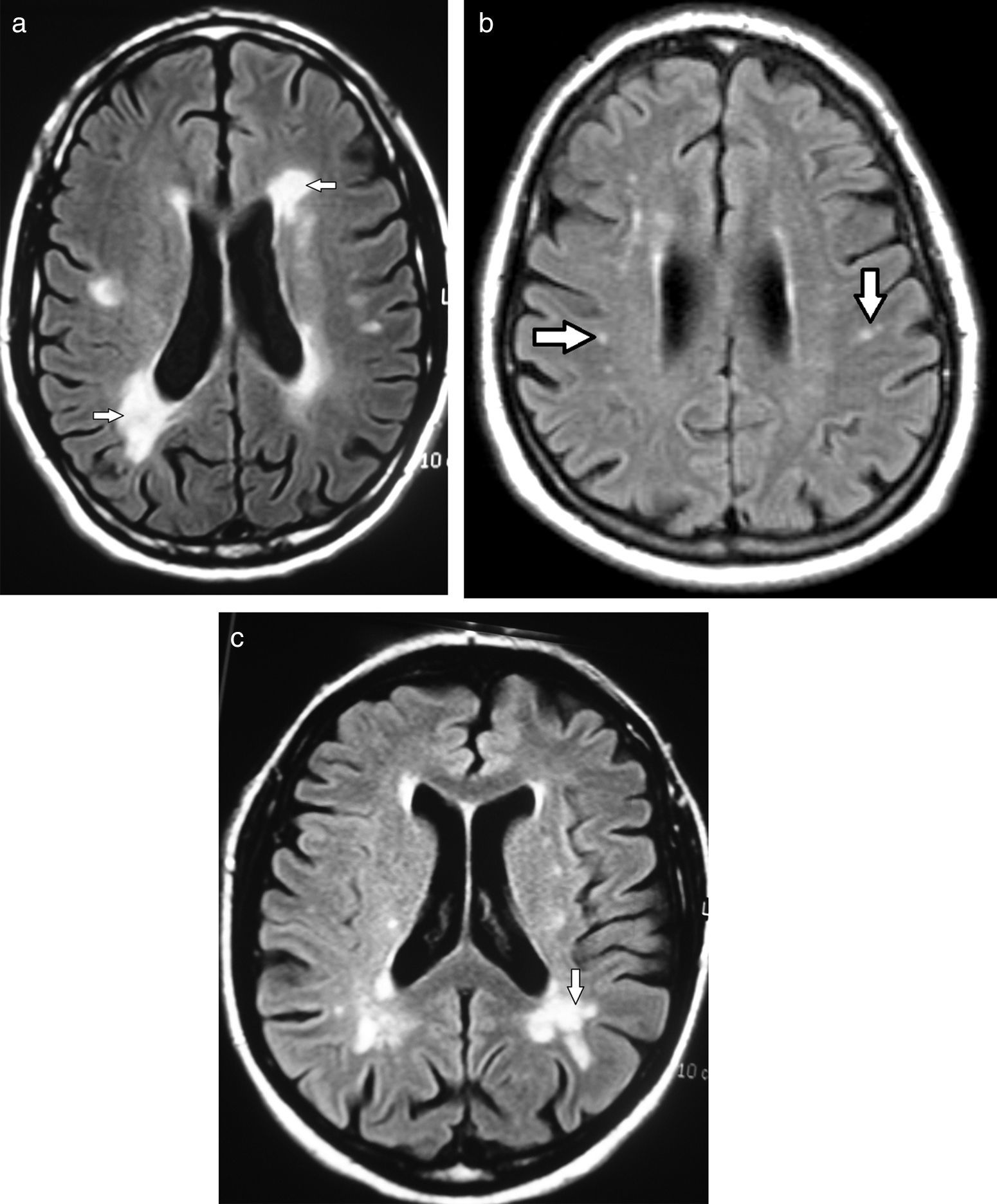
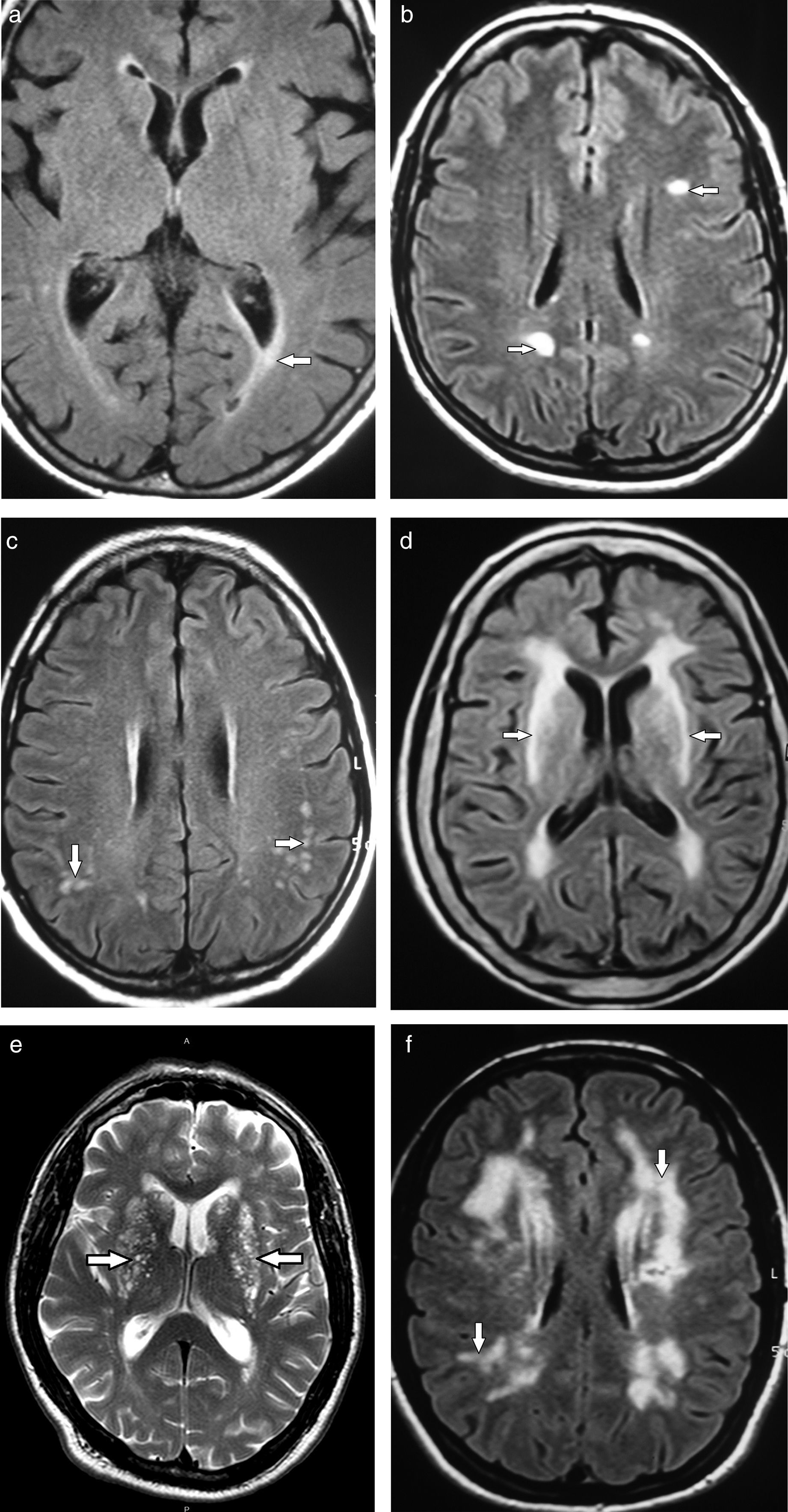
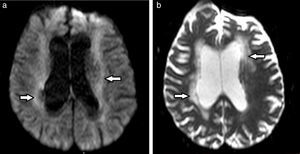
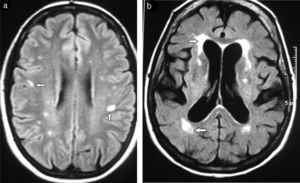
En lo que respecta a las secuencias con difusión (DWI) y mapa de coeficiente de difusión aparente (ADC), las imágenes pueden ser hiperintensas. Mientras más severa es la LA, más hiperintenso es el mapa de ADC12 (fig. 3).
La secuencia tensor de difusión provee información de la integridad de las fibras nerviosas y en los casos de hiperintensidades de la SB tiene difusividad aumentada con disminución de la fracción de anisotropía15.
Tomografía computadaLa LA es evidenciable en TC solo cuando las lesiones son muy avanzadas en la RM7.
Consideraciones generales, factores de riesgo y comorbilidades de la leucoaraiosisLas hiperintensidades periventriculares y de la SB subcortical son denominadas en la literatura anglosajona como unidentified bright objects (UBO), y se definen como áreas puntiformes mayores de 5mm, hiperintensas en ponderación T2 en la RM e hipodensas en la TC, que afectan selectivamente a la SB profunda periventricular o subcortical16,17. Medrano17 las define, al igual que a las UBO, como al menos cinco focos hiperintensos en ponderación T2 de hasta un centímetro de diámetro, con o sin lesiones confluentes de un diámetro superior a un centímetro.
La LA constituye un hallazgo habitual relacionado con la edad avanzada. Muestra una apariencia anormal de la SB subcortical, especialmente a nivel de los centros semiovales, y suele respetar al cuerpo calloso y la fibras en U, pudiendo o no acompañarse de síntomas3,5,6,10,13,17,18.
La presencia de lesiones en la SB se encuentra en el 95% de los pacientes mayores de 65 años17. En la población general, la prevalencia de hiperintensidades en ponderación T2 en la sustancia blanca aumenta con la edad, siendo del 11-21% en las personas de 64 años y del 94% en las de 82 años1–3,5–7,11,15,17,19. En los pacientes asintomáticos, se presentan en el 20-30%20.
En los casos con demencia vascular, las hiperintensidades de la SB tienen una prevalencia del 80%, mientras que en la enfermedad de Alzheimer varía entre el 26 y el 80%. Las lesiones de la SB están asociadas con la edad avanzada del paciente y los factores de riesgo cerebrovasculares (hipertensión, diabetes, obesidad, tabaquismo y ateroesclerosis, por ejemplo)1,3,9,15,16,19,21.
Los principales factores de riesgo para desarrollar LA son la edad avanzada, la hipertensión arterial y los niveles plasmáticos de homocisteína aumentados14. Sin embargo, hay controversia al respecto. Yun et al.15 sostienen que la asociación con diabetes, colesterol, tabaquismo y homocisteína no es consistente, así como otros autores descartan que las enfermedades cardiovasculares sean factores de riesgo para el desarrollo de hiperintensidades en la SB5,6. Para Auriel et al.6 el principal factor de riesgo para LA es la edad avanzada y secundariamente la enfermedad de Parkinson (dado que la presencia y severidad de la LA tiene correlato con la severidad de los síntomas clínicos de la enfermedad de Parkinson).
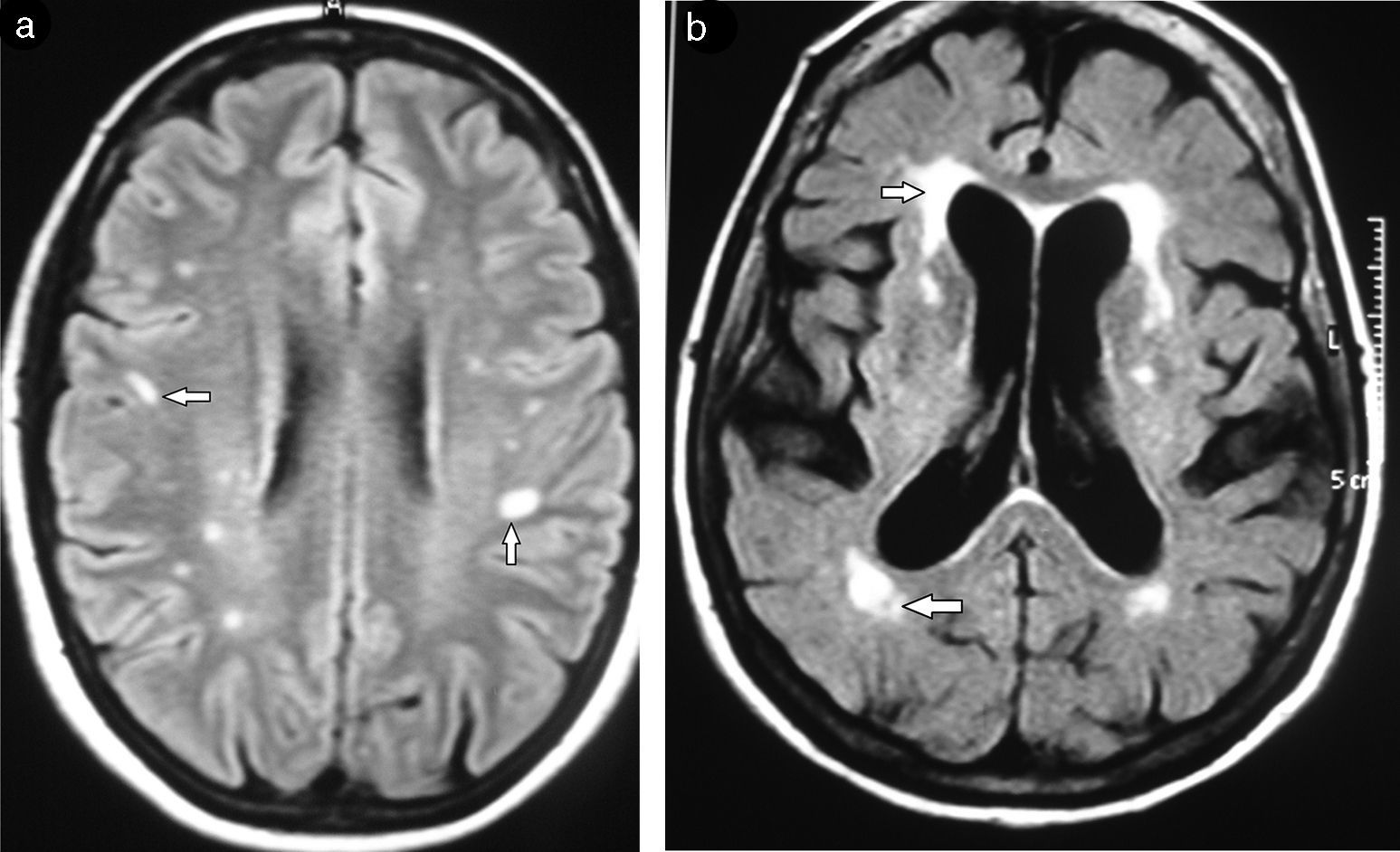
La presencia de lesiones puntiformes hiperintensas se asocia en un 18% a microsangrados en pacientes mayores de 60 años. Además, pueden estar vinculadas a enfermedad cerebrovascular o cardiovascular, demencia, depresión, síndrome bipolar, esquizofrenia, Alzheimer, esclerosis múltiple, hidrocefalia a presión normal, lupus o enfermedad metabólica hereditaria tipo CADASIL1,2,8,12,17. La frecuencia y severidad de las lesiones aumentan con la edad y las cifras tensionales9.
Las hiperintensidades de la SB tienen una prevalencia del 67-98% en pacientes con stroke, del 29 al 100% en la enfermedad de Alzheimer y del 30 al 55% aproximadamente en los pacientes con Parkinson4,5,8,12,15,18,19. La aparición de estas hiperintensidades se relaciona íntimamente con el deterioro cognitivo, los cambios en las funciones ejecutivas o la velocidad de procesamiento mental, la disminución de la fluidez verbal fonética y semántica, el enlentecimiento de las funciones ejecutivas (planificación, categorización y secuenciación) con un aumento de la mortalidad2,3,8,9,15,19.
Los pacientes migrañosos han demostrado tener lesiones hiperintensas de aspecto vascular, principalmente en los lóbulos frontales y los centros semiovales17. Algunos estudios enuncian que el grado de atrofia cerebral está en relación con el número y severidad de las lesiones de la SB periventricular15. A su vez, las lesiones de la SB están asociadas con trastornos en la marcha, caídas, incontinencia urinaria y depresión (por disrupción de fibras de haces frontoestriados)15,21.
Las hiperintensidades pueden verse en pacientes añosos, asintomáticos o con demencia6,8,12,16,22,23. El hallazgo más distintivo en la enfermedad de Alzheimer es la presencia de un halo hiperintenso que rodea los ventrículos laterales, presente en el 50% de estos casos22.
Existe una relación entre los niveles bajos de vitamina D y la presencia de hiperintensidades en la SB en mayores de 50 años, sintomáticos o no23. En algunos pacientes, la LA puede estar asociada a lesiones de tipo vascular, como infartos grandes o lagunas, sin que tengan un mecanismo etiológico común8.
La LA es un predictor de enfermedad cerebrovascular, especialmente de infartos lacunares, así como también puede predisponer a infartos hemorrágicos, sobre todo cuando se asocian a la ingesta de anticoagulantes6,9,24.
Factores hereditariosSierra et al.25 han postulado que la presencia del genotipo DD y/o el alelo D del gen de la enzima convertidora de angiotensina tendría un papel predisponente en la formación de lesiones de la SB. En su trabajo demostraron que la existencia del genotipo DD en pacientes con lesiones de la SB fue significativamente mayor (64%) que en aquellos sin estas lesiones (28%). Lo mismo ocurre con la proporción del alelo D, siendo mayor en los pacientes con lesiones de la SB (74%) que en aquellos sin alteraciones (51%)9.
Otro estudio de cohorte de origen japonés asocia los niveles elevados de homocisteína por la mutación C677T del gen de la metilenotetrahidrofolato reductasa (MTHFR) con la presencia de lesiones de la SB e infartos silentes en pacientes de 40 a 80 años9.
Algunos trabajos indican que las hiperintensidades tendrían carácter hereditario con polimorfismos, siendo los responsables los genes apolipoproteína E (epsilon +–), metilenotetrahidrofolato reductasa (677 citosina/timina polimorfa thymine) y angiotensinógeno (Met 235 Thr)15.
AnatomopatologíaEtiopatogénesisLa etiología y patogénesis de las lesiones puntiformes hiperintensas de la SB profunda no están claras. Algunos investigadores postulan fenómenos isquémicos moderados, con episodios breves y repetidos de hipotensión, de naturaleza crónica y asociados con la pobre red de colaterales de la circulación periventricular y la alteración de la indemnidad de la barrera hematoencefálica, que resultan en la extravasación en el parénquima encefálico y la acumulación de líquido en el espacio extracelular, originando un edema vasogénico y la liberación de sustancias neurotóxicas1,4,6,8,12,15–17,19,26.
Otros sugieren compromiso con dilatación de los espacios de Virchow-Robin, desmielinización difusa con pérdida de células gliales y axonopatía que deriva en espongiosis, alteración de la expansión endotelial y de la respuesta de vasos cerebrales y sistémicos. Esta también genera cambios en el flujo de circulación del líquido cefalorraquídeo, edema cerebral transitorio, degeneración walleriana y engrosamiento de fibras de colágeno de tipo no inflamatorio de las paredes de las venas periventriculares que ocasiona déficit de retorno venoso en la SB profunda6,7,24.
En los casos asociados a hipertensión arterial, se cree que los valores altos de tensión arterial en forma sostenida y prolongada en el tiempo originan alteraciones endoteliales que producen el paso de proteínas plasmáticas al interior de la pared vascular. Esto ocasionaría una degeneración hialina y la fibrosis, que engrosarían la pared, estrecharían la luz vascular y reduciría el flujo sanguíneo derivando en isquemia1.
Por su parte, Murray et al.27 postulan que las hiperintensidades de la SB son un fiel reflejo de la pérdida de la densidad de la mielina y de los pequeños vasos.
Anatomía microvascularLa SB está irrigada por arteriolas penetrantes anastomóticas u originadas en los principales vasos cerebrales sin red de colaterales, por lo que se la considera circulación terminal. Esto la hace susceptible a sufrir lesiones por isquemia1,3,9.
La afectación de estas arteriolas por estrechamiento de su luz genera disminución del aporte sanguíneo en forma crónica, originando la LA1,11,15. En estos procesos no participan los grandes vasos, sino que son las pequeñas arterias las que irrigan la sustancia blanca subcortical y periventricular. Sin embargo, algunos autores plantean que estos vasos son pequeñas venas medulares esclerosadas (consideradas como circulación terminal), con pocas anastomosis con el sistema de irrigación periférico, por lo que corresponden a un área propensa a sufrir isquemia severa1,7,8,13.
Existe una capa delgada de SB subcortical de 4mm de espesor, denominada fibras en U, que es irrigada por vasos penetrantes y por vasos cortos corticales. La riqueza de anastomosis y de vasos nutricios explicaría por qué estas fibras se encuentran generalmente indemnes cuando no hay lesiones de la SB8,9.
Otra teoría para la formación de hiperintensidades de la sustancia blanca postula que la alteración en la reactividad vasomotora y su autorregulación ocasionan edema crónico, apoptosis y disfunción endotelial3.
A modo de resumen, se menciona que las hiperintensidades pueden ser consecuencia de una isquemia cerebral crónica, de una rotura de la barrera hematoencefálica, de una disfunción endotelial o de la combinación de alguno o todos estos eventos1,4,11.
Los estudios anatomopatológicos de las lesiones hiperintensas demuestran palidez de la sustancia blanca, vacuolización, escasas lagunas, astrocitos reactivos y rarefacción del tejido asociado a una pérdida de mielina con gliosis leve8,9,13,15,19.
Patrones semiológicos de hiperintensidades de la sustancia blancaMorfología, configuración y localizaciónLas hiperintensidades de la SB adoptan la configuración de lesiones puntiformes aisladas, múltiples o parcheadas, con tendencia a la coalescencia o se ven como casquetes que rodean a los ventrículos laterales, tanto en la SB subcortical como en la profunda o periventricular2,11,24.
Estas lesiones no son estáticas, y tienden a progresar y confluir en el tiempo, siendo predominantes en el sexo femenino15,21. Se ubican en la sustancia blanca profunda, respetando las fibras subcorticales, y se disponen de forma adyacente a las estructuras vasculares afectadas en la enfermedad de pequeños vasos19.
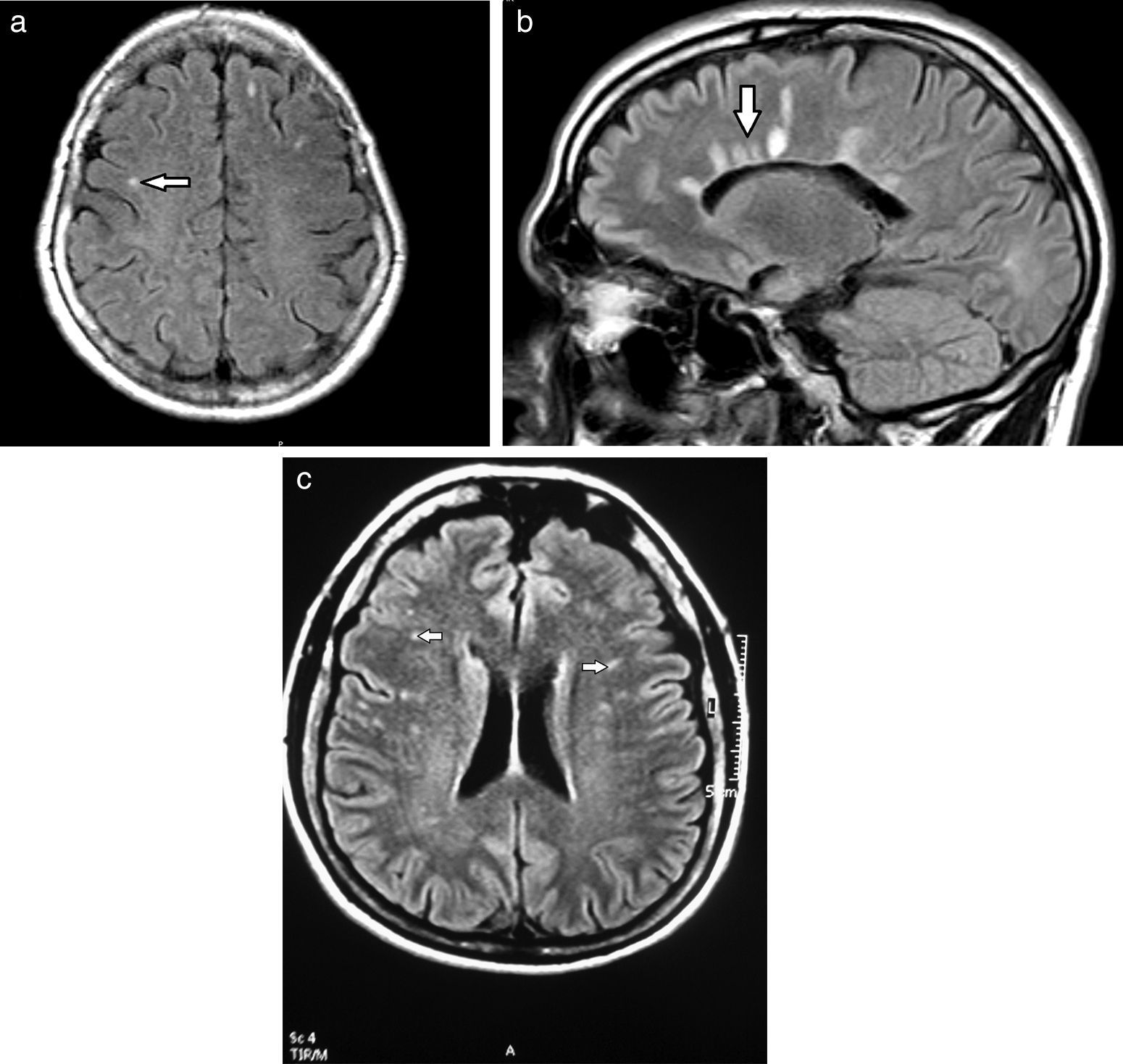
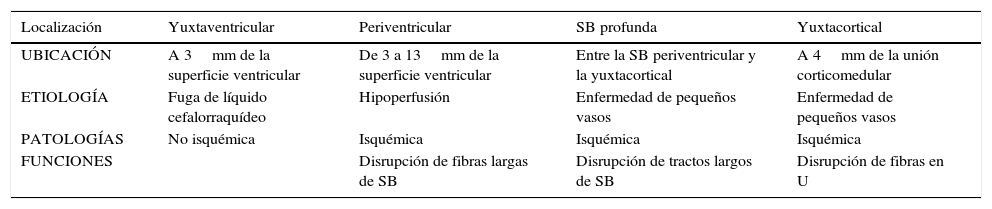
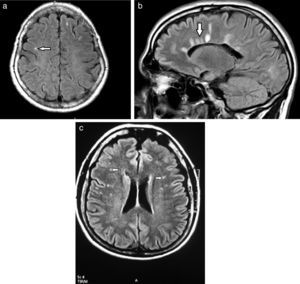
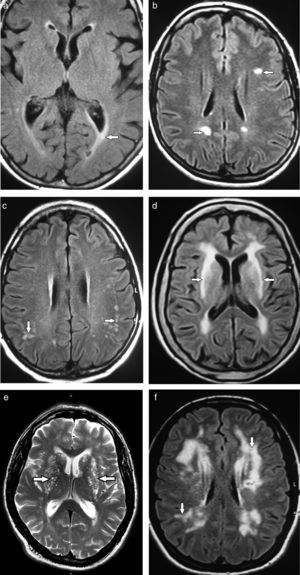
Subclasificación semiológica en relación con la localizaciónSegún su localización, las lesiones de la SB se diferencian en tres patrones: el vascular, el perivascular y el inespecífico17 (fig. 4). Sus características se enumeran en la tabla 1.
Características semiológicas de lesiones de la sustancia blanca
| Patrón vascular | Patrón perivascular | Patrón inespecífico |
|---|---|---|
| Más prevalente | Inflamación perivascular | Sustancia blanca profunda no limítrofe |
| Lesión arteriolar | Periventricular ovoide | Amorfas, puntiformes, redondas |
| Subcortical | Yuxtacortical | |
| No yuxtacortical | Fusiforme u ovoide | |
| Sustancia blanca profunda limítrofe | Dedos de Dawson | |
| Periventricular irregular | Supra o infratentorial | |
| Supra>infratentorial | Lesiones grandes | |
| Frontoparietal | Realce en anillo incompleto (esclerosis múltiple) | |
| Ganglios basales | ||
| Suelen no realzar |
La presencia de un patrón vascular asociado a microsangrados lleva a formular dos diagnósticos diferenciales: la hipertensión arterial (HTA) y la angiopatía amiloide (AA). La afectación infratentorial o de ganglios basales orienta sobre una microangiopatía hipertensiva o ateroesclerótica, mientras que la localización periférica lobar de los microsangrados es típica de AA17.
Si un paciente con hiperintensidades puntiformes en la sustancia blanca con patrón vascular presenta factores de riesgo cardiovasculares, la afectación puede ser atribuida a estos; pero si estos no están presentes, se piensa en angiopatía amiloide, cefaleas, enfermedades tóxico-metabólicas o metabólicas (CADASIL) o vasculitis, entre otras17.
Patrón perivascularDentro de las causas con patrón perivascular, la principal entidad es la esclerosis múltiple. Si el cuadro clínico no es acorde con esta entidad, debe sospecharse encefalomielitis aguda diseminada (ADEM), leucoencefalopatía aguda diseminada, lupus eritematoso sistémico, enfermedad de Sjödren o de Lyme, sarcoidosis, criptococosis, vasculitis (como enfermedad de Beçhet) o metabolopatías (como mucopolisacaridosis)17.
Patrón inespecíficoLa afectación de la SB en forma inespecífica puede verse en: infección por el virus de la inmunodeficencia humana (HIV), enfermedad de Lyme, encefalopatía por sífilis, ADEM, desórdenes metabólicos como leucodistrofias, fenilcetonuria y enfermedades mitocondriales (MELAS)24,28.
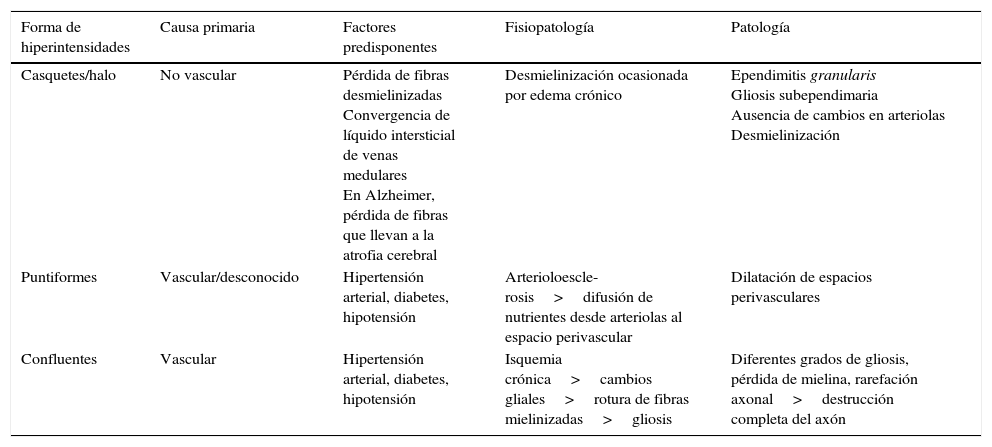
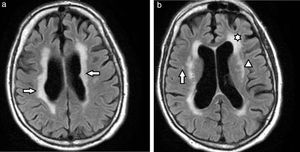
Subclasificación según localización y mecanismo de producciónKim et al.2 categorizan a las lesiones de la sustancia blanca según su localización (tabla 2) para caracterizarlas en mecanismos de producción y fibras afectadas (fig. 5).
Clasificación de lesiones en la sustancia blanca según localización
| Localización | Yuxtaventricular | Periventricular | SB profunda | Yuxtacortical |
|---|---|---|---|---|
| UBICACIÓN | A 3mm de la superficie ventricular | De 3 a 13mm de la superficie ventricular | Entre la SB periventricular y la yuxtacortical | A 4mm de la unión corticomedular |
| ETIOLOGÍA | Fuga de líquido cefalorraquídeo | Hipoperfusión | Enfermedad de pequeños vasos | Enfermedad de pequeños vasos |
| PATOLOGÍAS | No isquémica | Isquémica | Isquémica | Isquémica |
| FUNCIONES | Disrupción de fibras largas de SB | Disrupción de tractos largos de SB | Disrupción de fibras en U |
SB: sustancia blanca.
Medrano17 define a las hiperintensidades como lesiones de la SB relacionadas al envejecimiento, incluso hace mención a la escala visual de Fazekas para valorarlas. Esta escala tiene 4 grados (fig. 6; tabla 3), de acuerdo a la “normalidad” de estos hallazgos: el grado 1 es normal con el envejecimiento, el grado 2 es patológico en menores de 75 años y el grado 3 es patológico en todos los casos1,11,17.
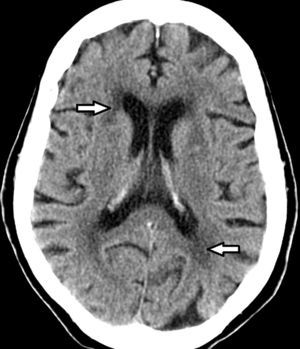
Filippi y De Stefano clasifican a las hiperintensidades según su morfología en casquete/halo, puntiforme o confluente11 (fig. 7; tabla 4).
Fisiopatología de las hiperintensidades de la sustancia blanca
| Forma de hiperintensidades | Causa primaria | Factores predisponentes | Fisiopatología | Patología |
|---|---|---|---|---|
| Casquetes/halo | No vascular | Pérdida de fibras desmielinizadas Convergencia de líquido intersticial de venas medulares En Alzheimer, pérdida de fibras que llevan a la atrofia cerebral | Desmielinización ocasionada por edema crónico | Ependimitis granularis Gliosis subependimaria Ausencia de cambios en arteriolas Desmielinización |
| Puntiformes | Vascular/desconocido | Hipertensión arterial, diabetes, hipotensión | Arterioloescle-rosis>difusión de nutrientes desde arteriolas al espacio perivascular | Dilatación de espacios perivasculares |
| Confluentes | Vascular | Hipertensión arterial, diabetes, hipotensión | Isquemia crónica>cambios gliales>rotura de fibras mielinizadas>gliosis | Diferentes grados de gliosis, pérdida de mielina, rarefación axonal>destrucción completa del axón |
Otros autores clasifican a las hiperintensidades por localización y morfología (tabla 5). Las grado 1 son consideradas normales, mientras que las grado 2 y 3 se asocian a lesiones de etiología microvascular, relacionadas con factores de riesgo cardiovasculares14 (fig. 8).
Clasificación de hiperintensidades según la morfología y localización
| Distribución | Clasificación |
|---|---|
| Sustancia blanca profunda y subcortical | * Hiperintensidades puntiformes * Parcheadas o confluentes tempranas * Confluentes |
| Periventriculares | * Lineales que rodean a los cuernos frontales u occipitales de los ventrículos laterales * Bandas que rodean a los ventrículos laterales * Hiperintensidades confluentes que se extienden a la sustancia blanca profunda |
Los diagnósticos diferenciales se dividen en entidades congénitas o adquiridas; dentro de las primeras se mencionan las leucodistrofias y la leucomalacia, mientras que las adquiridas son más numerosas. Entre ellas, se incluyen microinfartos por ateroesclerosis asociados a factores de riesgo cardiovasculares (diabetes, hipertensión arterial, dislipemia, etc.), dilatación de espacios de Virchow-Robin, esclerosis múltiple, vasculitis, infecciones, intoxicaciones, traumatismos, etc.17,24,28–33
Los diagnósticos diferenciales se realizan por la edad, la clínica, los antecedentes del paciente o el tipo de patrón imagenológico2,7–9,11,13,16,17,20,24,28–39 (fig. 9; tabla 6). Detallar cada uno de ellos excede los alcances del presente artículo, pero señalamos a la ependimitis granularis como una variante anatómica que se presenta con focos o casquetes triangulares, hiperintensos en las secuencias ponderadas en T2 o FLAIR en RM, dispuestos por delante o de forma lateral a las prolongaciones frontales de los ventrículos laterales, generalmente en forma bilateral y simétricamente. Representa gliosis residual por edema intersticial crónico40.
Diagnósticos diferenciales de las hiperintensidades en la sustancia blanca
| • Leucomalacia |
| • Leucodistrofia metacromática |
| • Dilatación de espacios de Virchow-Robin |
| • Ependimitis granularis |
| • Angiopatía amiloide |
| • Vasculitis primaria |
| • Esclerosis múltiple |
| • CADASIL (arteriopatía autosómica dominante cerebral con infartos subcorticales y leucoencefalopatía) |
| • Leucoencefalopatía posterior reversible |
| • Leucoencefalopatía hipóxica tardía |
| • Mielinolisis pontina y extrapontina |
| • Enfermedad de Binswanger |
| • Neurocisticercosis |
| • Mucopolisacaridosis |
| • Lesión axonal difusa |
| • Leucoencefalopatía multifocal progresiva |
La aparición de hiperintensidades de la sustancia blanca es un hallazgo común en ancianos y constituye un predictor altamente fiable para la valoración del riesgo de stroke, demencia o mortalidad.
El reconocimiento del patrón morfológico y geográfico, junto con la clínica y antecedentes del paciente colabora en la realización de diagnósticos etiológicos, para poder entablar diagnósticos diferenciales que ayudan en la correcta denominación de las lesiones de la SB.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.