El linfoma primario del sistema nervioso central (LPSNC) tiene una presentación predecible en las imágenes convencionales, tanto en pacientes inmunocompetentes como inmunodeprimidos. Analizamos las características imagenológicas que nos permiten reconocer ambos casos y realizamos una revisión de las formas clínicas más relevantes del LPSNC, así como su aspecto en las imágenes obtenidas con técnicas convencionales del Diagnóstico por Imágenes, basándonos en un análisis retrospectivo de nuestros archivos institucionales y la literatura actual. La revisión abarca todas las presentaciones relevantes de esta enfermedad poco frecuente para permitir un diagnóstico temprano, crucial para el adecuado tratamiento.
Primary central nervous system lymphoma (PCNSL) has a predictable imaging appearance on conventional imaging in immunocompetent and immunocompromised patients. The imaging features that enable both types of patients are discussed. The extensive imaging review presented here of the most relevant PCNSL clinical presentations and their imaging appearances using conventional imaging techniques is based on a retrospective analysis of our institutional files and on the current literature. The review covers all of the relevant appearances of this uncommon disease to enable early diagnosis, which is crucial for proper patient management.
El linfoma primario del sistema nervioso central (LPSNC) es una forma de enfermedad extraganglionar que se origina en el cerebro, las leptomeninges, la médula espinal o los ojos, y suele quedar limitada al sistema nervioso central (SNC). Anteriormente la entidad era considerada un tumor poco común, responsable de menos del 2% de las neoplasias cerebrales. Sin embargo, en las últimas dos décadas se ha observado una mayor frecuencia en pacientes inmunocompententes e inmunodeprimidos1. En la actualidad comprende el 5-7% de los tumores primarios cerebrales, observándose en el 1-2% de todos los pacientes con linfoma no Hodgkin (LNH)2,3.
La patogénesis del LPSNC no se comprende bien en los pacientes inmunocompetentes sin un factor de riesgo aislado. Las enfermedades inmunosupresoras, como la inmunodeficiencia congénita, la infección por el virus de inmunodeficiencia humana/síndrome de inmunodeficiencia adquirida (VIH/SIDA) y las terapias inmunosupresoras, fundamentalmente utilizadas en el trasplante de órganos sólidos, constituyen los principales factores de riesgo para el desarrollo de este linfoma. La patogénesis de esta enfermedad en pacientes inmunodeprimidos está casi siempre asociada con la infección latente de células B por el virus de Epstein-Barr (VEB). La introducción del tratamiento antirretroviral altamente activo (HAART) durante la última década en el tratamiento de pacientes HIV ha contribuido a la disminución de la incidencia de LPSNC en esta población en particular2–4.
En cuanto a los hallazgos histológicos, se encuentra LNH extraganglionar de grado intermedio a alto, de origen en células B, en aproximadamente el 90% de casos (subtipo de linfoma difuso de células B grandes). Las variantes T de los linfomas representan menos del 4% de todos los casos del LPSNC en el mundo occidental2,5. El linfoma de Hodgkin es también un diagnóstico posible, aunque se lo considera muy poco frecuente6.
Para evitar cirugías innecesarias en el LPSNC, se debe alcanzar un diagnóstico correcto a través de estudios imagenológicos, en particular de la resonancia magnética (RM).
Este trabajo repasa las características más relevantes del LPSNC en estudios convencionales de imágenes, basándonos en un análisis retrospectivo de nuestros archivos institucionales y la literatura actual. Es importante conocer todas las presentaciones relevantes de esta enfermedad poco frecuente para determinar un diagnóstico temprano, crucial para el tratamiento apropiado del paciente. Realizamos búsquedas de estudios en MEDLINE, utilizando las palabras clave LPSNC, linfomas del SNC, resonancia magnética y estudios de diagnóstico por imágenes. Incluimos publicaciones en inglés entre enero de 2000 y diciembre de 2014.
Aspectos clínicosLa presentación clínica depende del sitio del SNC afectado. Los pródromos clínicos son breves debido a que la mayoría de los pacientes se diagnostica 1 o 2 meses después del inicio de los síntomas7–9.
La forma más típica del LPSNC consiste en la aparición de síntomas neurológicos focales y progresivos, indicadores de un efecto de masa en el cerebro o en la médula espinal. Contrariamente a la enfermedad ganglionar, este linfoma rara vez tiene síntomas B, como fiebre, pérdida de peso o sudores nocturnos2,3,8–10.
Las presentaciones peculiares y poco comunes del LPSNC en las que la proliferación de linfocitos atípicos rellena la microvasculatura y se disemina gradualmente con infiltración progresiva de la sustancia blanca, sin una lesión cerebral focal, se denominan linfoma intravascular. En la mayoría de los casos, son un tipo de linfoma difuso de células B grandes que promueven la obliteración de los vasos pequeños como una enfermedad multisistémica, siendo más frecuentes en el SNC y la piel11,12. La mayoría de los pacientes (60-90%) presenta síntomas que reflejan alteraciones isquémicas en el cerebro, la médula espinal o los nervios periféricos/pares craneales. Estas simulan accidentes cerebrovasculares de vasos pequeños, mielopatía o neuropatía13. Si no se lo trata, el linfoma intravascular sigue una evolución clínica de recaída-remisión o recaída-progresión14.
En lo que respecta a la lesión difusa, infiltrativa y no destructiva que afecta a la sustancia blanca, causada por células linfomatosas, se denomina actualmente “linfomatosis cerebri”15,16. Se manifiesta clínicamente con una variedad de cuadros, como cambios de personalidad, déficit cognitivo y marcha atáxica. La afectación del SNC puede producir eventos isquémicos transitorios, accidente cerebrovascular, trastornos de la personalidad, crisis epilépticas, demencia de rápida progresión, marcha inestable, encefalopatía subaguda y mielopatía11,15–17.
Por su parte, el linfoma leptomeníngeo primario es un subtipo poco frecuente del LPSNC que se presenta con cefaleas, náuseas, vómitos, rigidez de la nuca, paresia de los pares craneales y radiculopatías18. En este caso, el linfoma tiende a infiltrar los tejidos subependimarios, diseminándose a las meninges a través del líquido cefalorraquídeo (LCR). Esto probablemente refleja el origen del tumor en las células periadventicias de arteriolas que penetran a través de los espacios de Virchow-Robin en estas regiones7.
En cuanto al linfoma primario ocular, este es un subtipo poco frecuente de LPSNC (10-20%) que afecta el vítreo, el espacio subretinal o la cámara anterior, sin compromiso sistémico o del SNC. Puede ser la única expresión de linfoma (linfoma primario intraocular) o puede estar seguido de lesiones cerebrales después de semanas o meses10,19. Algunos pacientes no desarrollan síntomas oculares, mientras que otros presentan visión borrosa, percepción de moscas volantes y uveítis inespecíficas, por lo general refractarias al tratamiento con corticoides tópicos o sistémicos2,20.
La médula espinal es el sitio más inusual de afectación en pacientes con LPSNC y pocas veces se describe entre los casos infrecuentes de mielopatías. Pese a la quimioterapia, las tasas de morbimortalidad son altas debido a las lesiones multifocales del SNC, incluida la invasión mediante los espacios perivasculares21. Los linfomas en los ganglios y nervios raquídeos (neurolinfomatosis), la cola de caballo y el nervio ciático son muy raros10,22.
Características imagenológicasEn pacientes con sospecha de LPSNC, se requiere un examen físico detallado y estudios complementarios de diagnóstico por imágenes para descartar el compromiso de otros órganos y sistemas. La biopsia cerebral, después de la tomografía computada (TC) con contraste o preferiblemente la RM con contraste de gadolinio, es el método más apropiado para determinar un diagnóstico específico7,9,10,23. El tratamiento con esteroides puede interferir con el diagnóstico histopatológico. Si bien el LPSNC se puede diagnosticar exitosamente sin interrumpir la administración de corticoides, siempre que sea posible, estos medicamentos deben suspenderse en pacientes con diagnóstico presuntivo de LPSNC durante por lo menos 7-10 días antes de la biopsia5,10.
La estadificación imagenológica incluye estudios del eje cráneo-espinal completo, además del análisis del líquido cefalorraquídeo, la biopsia de médula ósea, la serología para VIH y el examen para la detección del tumor primario en ojos, tórax, abdomen y testículos2,5,10. Al respecto, la tomografía por emisión de positrones (PET/TC) de cuerpo entero ha demostrado mayor sensibilidad que la tomografía estándar2,5.
Lesiones del parénquima cerebral en el linfoma primario del sistema nervioso centralTomografía computada y resonancia magnética convencionalesPor su celularidad, elevada proporción núcleo/citoplasma, ruptura de la barrera hematoencefálica (BHE) y predilección por las regiones periventriculares profundas, el LPSNC del parénquima cerebral suele tener un aspecto hipercelular característico tanto en la TC como en la RM. De hecho, todas las lesiones muestran realce del contraste7,23–26. No obstante, este aspecto típico suele variar entre individuos inmunocompetentes e inmunodeprimidos (tabla 1).
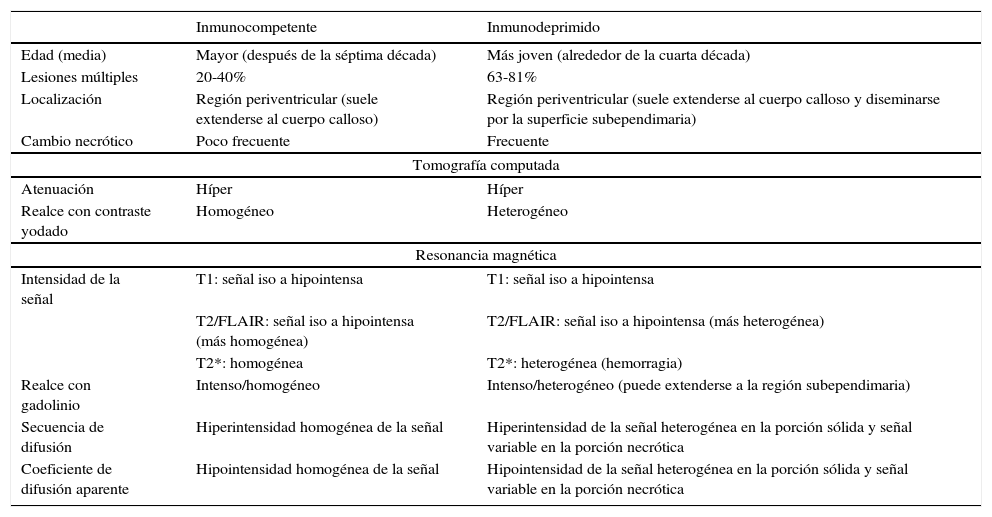
Características imagenológicas útiles para reconocer un linfoma primario del sistema nervioso central en pacientes inmunocompetentes e inmunodeprimidos
| Inmunocompetente | Inmunodeprimido | |
|---|---|---|
| Edad (media) | Mayor (después de la séptima década) | Más joven (alrededor de la cuarta década) |
| Lesiones múltiples | 20-40% | 63-81% |
| Localización | Región periventricular (suele extenderse al cuerpo calloso) | Región periventricular (suele extenderse al cuerpo calloso y diseminarse por la superficie subependimaria) |
| Cambio necrótico | Poco frecuente | Frecuente |
| Tomografía computada | ||
| Atenuación | Híper | Híper |
| Realce con contraste yodado | Homogéneo | Heterogéneo |
| Resonancia magnética | ||
| Intensidad de la señal | T1: señal iso a hipointensa | T1: señal iso a hipointensa |
| T2/FLAIR: señal iso a hipointensa (más homogénea) | T2/FLAIR: señal iso a hipointensa (más heterogénea) | |
| T2*: homogénea | T2*: heterogénea (hemorragia) | |
| Realce con gadolinio | Intenso/homogéneo | Intenso/heterogéneo (puede extenderse a la región subependimaria) |
| Secuencia de difusión | Hiperintensidad homogénea de la señal | Hiperintensidad de la señal heterogénea en la porción sólida y señal variable en la porción necrótica |
| Coeficiente de difusión aparente | Hipointensidad homogénea de la señal | Hipointensidad de la señal heterogénea en la porción sólida y señal variable en la porción necrótica |
En pacientes inmunocompetentes, el linfoma cerebral suele presentarse con una lesión única de localización hemisférica central (65%), que afecta la región supratentorial (87%) y a menudo alcanza o cruza la línea media a través del cuerpo calloso7. Las lesiones del LPSNC afectan el hemisferio cerebral (38%), el tálamo/ganglios basales (16%), la región periventricular (12%) y el cerebelo (9%). La localización superficial adyacente a las meninges es infrecuente5,10,23.
Se cree que las células atípicas densamente agrupadas son responsables de la hiperatenuación típica que suele observarse en la TC sin contraste (70%)23,26. Las lesiones múltiples se describen en el 20-40% de los pacientes27. El realce poscontraste es característicamente homogéneo y la presencia de una masa con realce difuso en el cuerpo calloso sin necrosis es muy sugerente de LPSNC2,5,7,23,26.
Sin embargo, en la RM el LPSNC puede mostrar un realce variable con patrones radiales lineales, signos de muesca (notch sign) y patrones de realce periféricos, incluidos la captación en anillo o en anillo incompleto27,28. Al respecto, cuando el realce es periférico, el LPSNC debe ser diferenciado de las enfermedades infecciosas y de la lesión cerebral desmielinizante tumefacta clásica29,30.
En pacientes inmunocompetentes, la hemorragia intratumoral es infrecuente, así como la calcificación interna, aunque esta última puede verse si existe antecedente de quimio o radioterapia23,25,27.
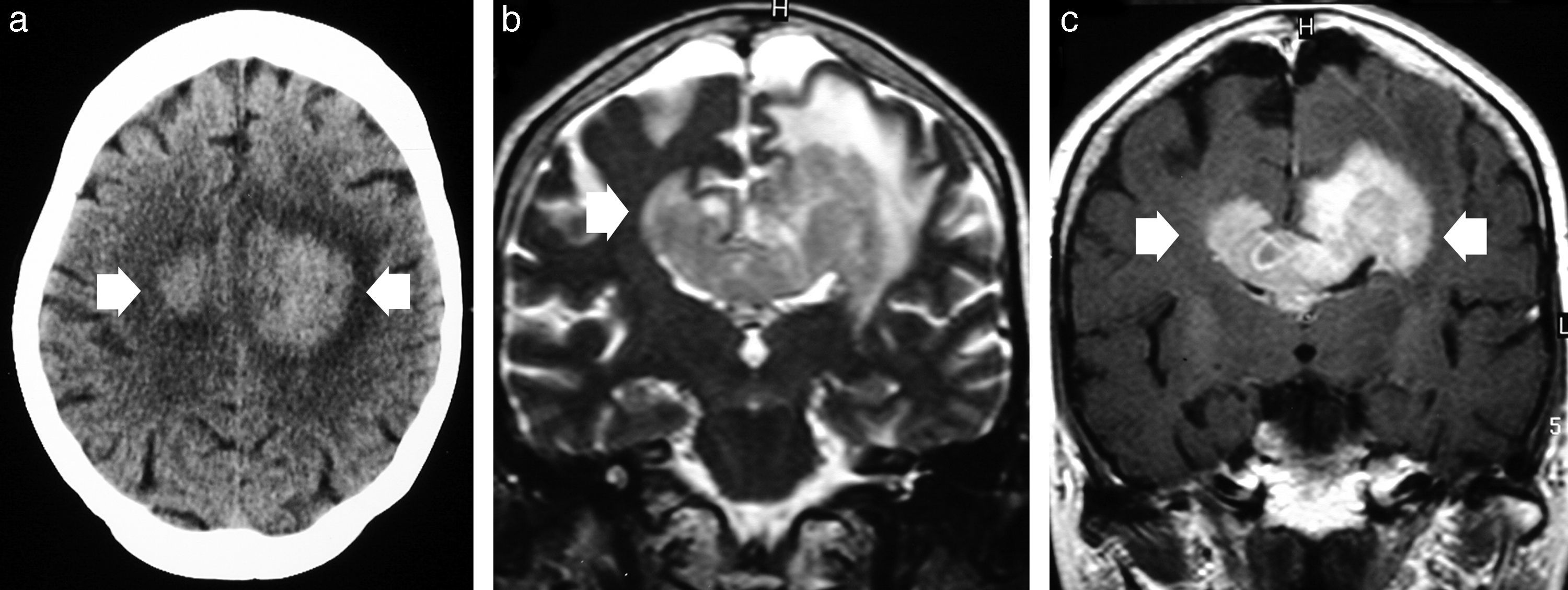
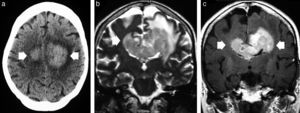
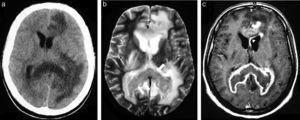
En la mayoría de los pacientes, la RM revela una señal de intermedia a baja con respecto a la sustancia gris en las secuencias ponderadas en T1, T2 y recuperación de inversión atenuada de fluido (FLAIR)7. Después de la administración intravenosa de gadolinio en las secuencias ponderadas en T1, las lesiones suelen mostrar un realce del contraste homogéneo de moderado a marcado (74%), que se considera la marca distintiva del LPSNC en pacientes inmunocompetentes (fig. 1)7,23,26.
Linfoma primario de células B grandes del sistema nervioso central en un paciente inmunocompetente. La TC sin contraste muestra (a) una lesión espontáneamente hiperdensa que cruza el cuerpo calloso (flechas), mientras que (b) la secuencia ponderada en T2, en corte axial, confirma una lesión isointensa con respecto a la sustancia gris (flecha), que se distingue del edema vasogénico perilesional y es predominante en el hemisferio cerebral izquierdo. (c) La imagen axial en ponderación T1 después de la administración intravenosa de gadolinio evidencia un marcado realce de contraste homogéneo (flechas).
Por lo general, se observan los hallazgos clásicos de una lesión ocupante de espacio, incluyendo el efecto de masa y el edema vasogénico circundante, aunque son menos prominentes que los observados en pacientes con gliomas malignos o metástasis cerebrales31.
Pacientes inmunodeprimidosEspecialmente en los casos VIH positivo, el LPSNC suele desarrollarse con una alteración aguda del estado mental en el marco de una encefalopatía. Esta presentación se correlaciona con el patrón más frecuente de realce difuso y multifocal (71%) de lesiones infiltrativas únicas o múltiples, que se observa habitualmente en esta población (30-80%).
El tumor afecta el parénquima cerebral periventricular supratentorial en el 55% de los pacientes, comprometiendo con frecuencia el cuerpo calloso, los ganglios basales y otros núcleos cerebrales profundos26.
A su vez, se suele encontrar un LPSNC de aspecto necrótico en esta población (64%). Las porciones sólidas del tumor en general conservan su aspecto imagenológico en la TC sin contraste (hiperatenuación) y la RM sin contraste (señal isointensa o hipointensa en ponderación T2/FLAIR), mientras que el realce poscontraste es variable, tanto en la TC como en la RM, y por lo general irregular, heterogéneo o periférico en hasta el 75% de los casos7,25,26,30.
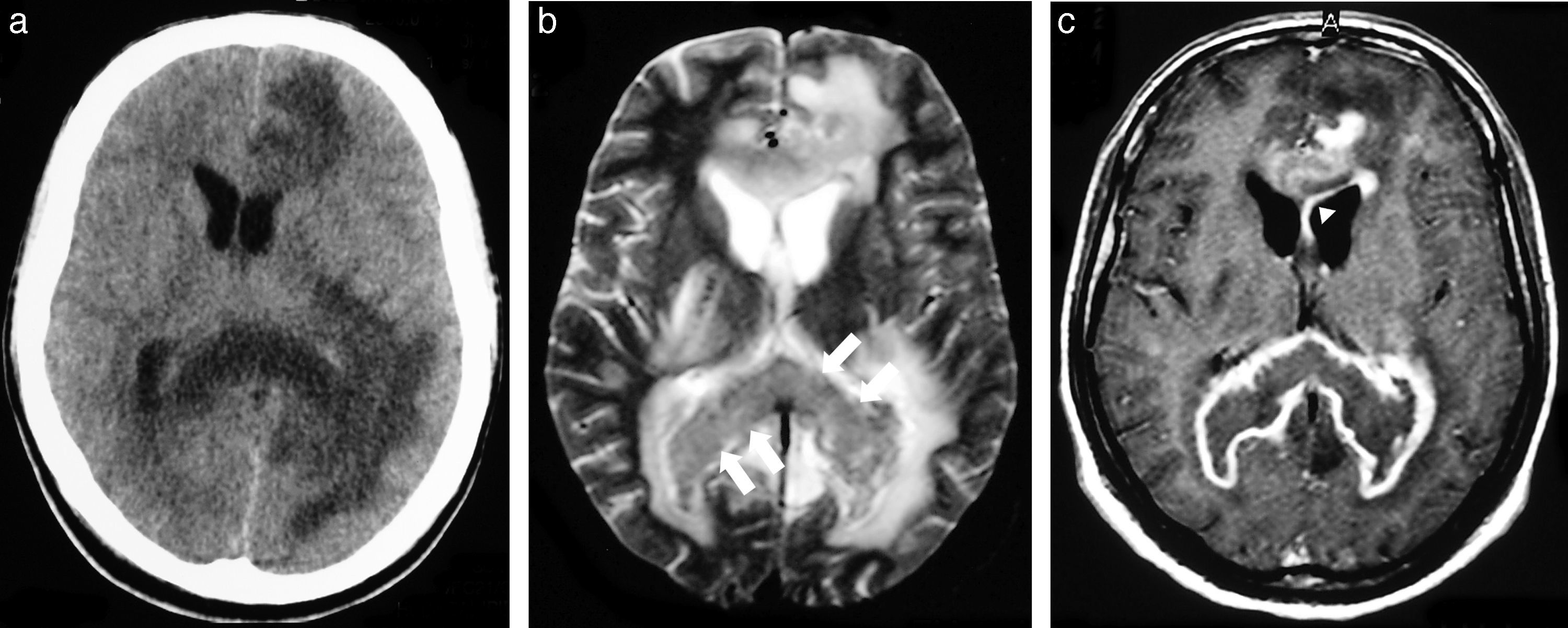
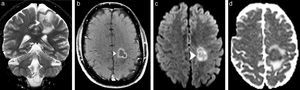
La extensión por los espacios de Virchow-Robin y la invasión de la superficie ventricular, que producen siembra subependimaria, son características del LPSNC en el contexto de una inmunodepresión23,25 (fig. 2).
Linfoma primario de células B grandes del sistema nervioso central en un paciente inmunodeprimido. (a) La TC sin contraste muestra una extensa lesión hipodensa que afecta la rodilla y el esplenio del cuerpo calloso, asociada con un importante edema vasogénico perilesional. (b) La imagen axial en ponderación T2 detecta una lesión isointensa (flechas) con un área periférica hiperintensa de edema vasogénico. (c) La imagen axial comparativa, en ponderación T1 después de la administración intravenosa de gadolinio, confirma una extensa área necrótica con realce periférico de aspecto irregular. Se observa invasión de la superficie ventricular (siembra subependimaria) en el asta frontal izquierda (punta de flecha).
Asimismo, la hemorragia espontánea en las lesiones del LPSNC no es infrecuente en pacientes inmunodeprimidos. Incluso, la hemorragia espontánea, la ausencia de realce de la lesión cerebral o la alteración difusa de la señal de la sustancia blanca no excluyen el LPSNC en este contexto en particular.
Por su parte, el trastorno linfoproliferativo postrasplante (TLP) primario del SNC es una complicación poco común del trasplante de órganos sólidos. Su incidencia varía según la edad del receptor, el tipo e intensidad de inmunodepresión y el tipo de trasplante de órgano32. Aproximadamente el 15% de los trasplantados con TLP presenta compromiso del SNC en una media de tiempo variable desde el trasplante hasta el momento del diagnóstico, aunque generalmente sucede varios años después de la intervención33.
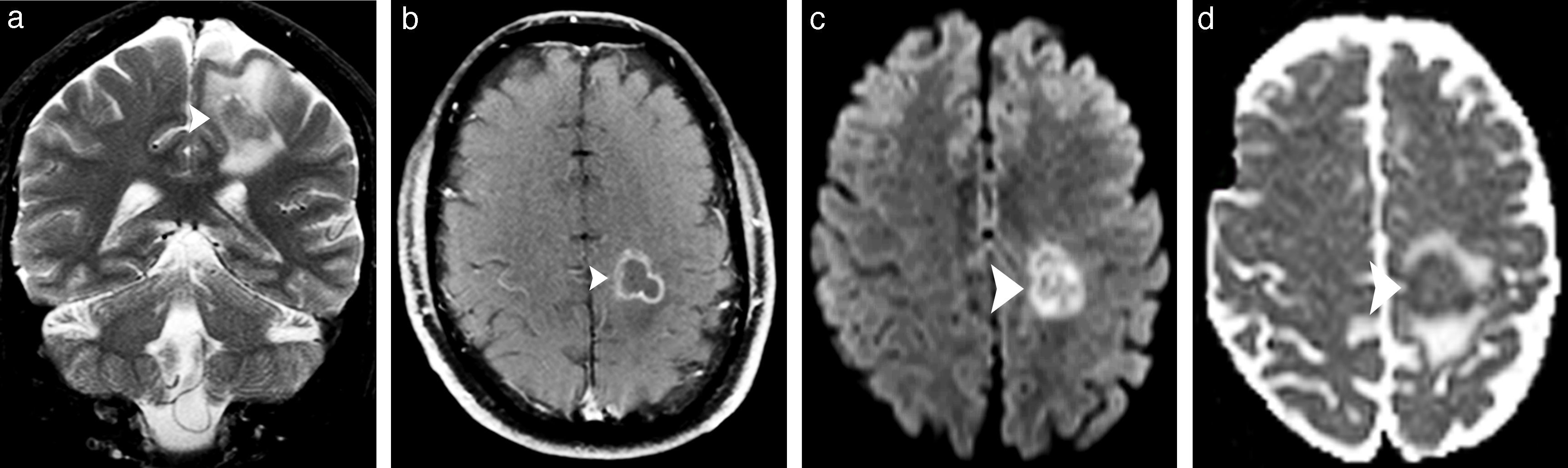
Si bien el TLP puede ser un trastorno focal, muchas veces se presenta con lesiones multifocales afectando cualquier parte del cerebro. Predomina en los hemisferios cerebrales, por lo general en la sustancia blanca subcortical o en los ganglios basales, con lesiones de realce homogéneo o en anillo (fig. 3)34.
Trastorno linfoproliferativo diecisiete años después de un trasplante renal. (a) La secuencia coronal ponderada en T2 identifica una lesión focal hipointensa en el centro semioval izquierdo, rodeada por un edema vasogénico (punta de flecha). (b) La imagen axial en ponderación T1 después de la administración intravenosa de gadolinio evidencia un patrón de realce en anillo de la lesión focal (punta de flecha). (c) La DWI sugiere hipercelularidad con restricción del movimiento de las moléculas de agua, (d) confirmada en el mapa ADC (puntas de flechas).
Se recomienda un método invasivo para analizar el tejido a fin de confirmar el diagnóstico y determinar el tratamiento. Para ello, suele ser necesario realizar una biopsia cerebral. La mayoría de los pacientes presenta enfermedad monomórfica positiva para VEB de origen en células B32.
Enfermedad extraaxialMientras el LPSNC determina tumores focales del parénquima cerebral respetando los espacios extraaxiales, en los linfomas sistémicos se observa con más frecuencia una infiltración meníngea (enfermedad de la duramadre o leptomeníngea), que está asociada a un mal pronóstico. Después de la administración intravenosa de gadolinio, las secuencias ponderadas en T1 y FLAIR son las secuencias de RM más sensibles para demostrar infiltración leptomeníngea18.
El linfoma de la duramadre sin compromiso sistémico o cerebral ocurre pocas veces. Afecta comúnmente la convexidad cerebral, pero también puede aparecer en la hoz, el tentorio, las regiones selares/paraselares o la columna vertebral24,25. La anatomía patológica muestra LNH de bajo grado (linfoma de la zona marginal de tipo tejido linfático relacionado con la mucosa [MALT]). Dado que el SNC no contiene tejido MALT, se ha planteado como hipótesis que las células meningoteliales de la membrana aracnoidea podrían ser análogas a las células epiteliales de los tejidos en los que aparecen los linfomas MALT. Pocos trabajos han descrito la presentación típica del linfoma MALT intracraneal que simula un meningioma globular2,35,36.
Las lesiones pueden ser únicas o múltiples y se muestran hiperdensas en la TC (lo que refleja su hipercelularidad)37; mientras que en la RM craneal se ven lesiones extraaxiales únicas o múltiples, con asiento en la duramadre, que realzan en forma difusa después de la inyección de gadolinio. El linfoma de la duramadre puede no distinguirse radiográficamente de un meningioma, pero la presencia de edema vasogénico e invasión cerebral parenquimatosa con un límite borroso entre el tumor y el cerebro lo sugiere35.
La afección de la bóveda craneal se considera inusual, en particular en el caso del LPSNC. En una amplia revisión, los investigadores han detectado un patrón imagenológico típico con tumores de cráneo expansivos que afectan los tres compartimentos de la bóveda craneal, incluyendo el cuero cabelludo, el hueso del cráneo y la paquimeninge, aun en ausencia de osteólisis38. Este patrón típico se puede observar en la TC y RM. Al respecto, las secuencias ponderadas en T1 con saturación grasa poscontraste de gadolinio son útiles para establecer la extensión y el realce del tumor en los compartimentos intra y extracraneales. Curiosamente, la erosión ósea no suele ser evidente en las TC, independientemente del tamaño de la lesión al momento del diagnóstico38.
Linfomatosis cerebriEl término “linfomatosis cerebri” indica una forma de LPSNC difusa e infiltrante que no forma una masa. Se caracteriza por una hiperintensidad de la sustancia blanca, progresiva, bilateral y muchas veces simétrica en las secuencias ponderadas en T2 y FLAIR sin realce de contraste. Las alteraciones en la RM se describen, en su mayoría, en la sustancia blanca de las regiones frontal y periventricular profunda, los ganglios basales y el cuerpo calloso. Las estructuras infratentoriales también pueden verse afectadas15,39.
Linfoma intravascularEl linfoma intravascular del SNC puede mostrar lesiones hiperintensas inespecíficas en la sustancia blanca, compatibles con la afectación de pequeños vasos. Se observa con múltiples áreas difusas, bilaterales y asimétricas de hiperintensidad de señal en la sustancia blanca y gris en las secuencias ponderadas en T2/FLAIR y en las de difusión (DWI). Esto indica alteración microvascular, más frecuentemente en la sustancia blanca subcortical y periventricular7.
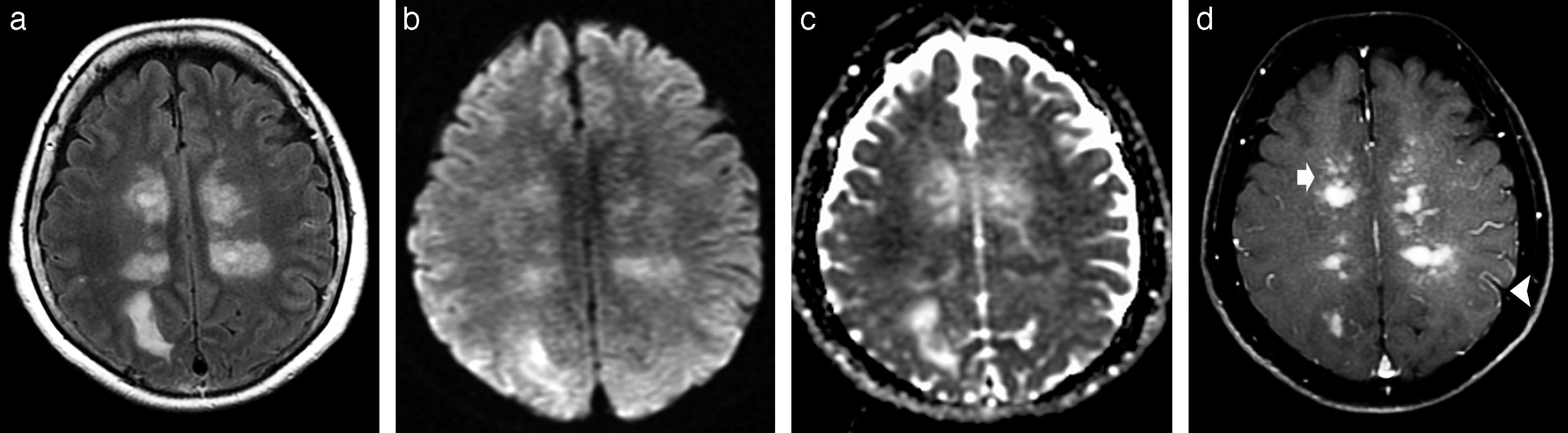
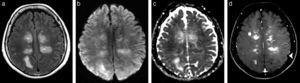
La TC no suele contribuir significativamente al diagnóstico diferencial, por lo que se recomienda la RM de cerebro y médula espinal, incluyendo secuencias ponderadas en T1 con contraste para aumentar la sensibilidad y seleccionar la lesión diana para la biopsia17. Se han descrito patrones variables de realce meníngeo y parenquimatoso con contraste, principalmente pequeñas áreas lineales o puntiformes de realce dentro de la gran área de alteración en ponderación T2/FLAIR (fig. 4)11,12.
Linfoma intravascular primario del sistema nervioso central. (a) La imagen axial de secuencia FLAIR revela áreas bilaterales confluentes de alteraciones del parénquima cerebral, predominantemente en el cuerpo calloso y las regiones periventriculares. (b) La DWI muestra áreas similares de restricción, (c) confirmadas en el mapa ADC. (d) El corte axial en ponderación T1 después de la administración intravenosa de gadolinio evidencia patrones variables de realce del contraste meníngeo (punta de flecha) y parenquimatoso (flecha).
La médula espinal suele estar afectada, aunque la sensibilidad de la RM es reducida. Estos casos requieren un fuerte índice de sospecha, estudios diagnósticos intensivos y un bajo umbral para la realización de la biopsia. Si hay nódulos cutáneos, sus muestras suelen revelar el diagnóstico11.
Linfoma ocular y orbitalEl linfoma primario ocular es un subtipo poco frecuente de LPSNC, cuyo diagnóstico certero suele demorarse debido a la variabilidad de sus manifestaciones. Además, en algunos casos hay una respuesta inicial positiva a la terapia con corticoides por uveítis o pseudotumor orbital (erróneamente diagnosticados). Por este motivo, es esencial un alto índice de sospecha para avalar la biopsia de tejido con citología y estudios complementarios40.
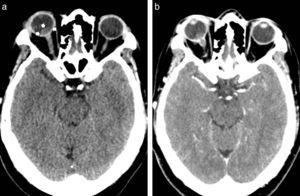
Hasta el 80% de los pacientes con linfoma primario ocular desarrollan LPSNC en el cerebro, mientras que solo el 10-20% de los pacientes con LPSNC presenta compromiso ocular19. El aspecto imagenológico es variable e incluye desde exámenes de TC y RM normales (principalmente en los linfomas primarios oculares) hasta la presencia de masas tumorales que realzan en los tejidos blandos, sugiriendo el diagnóstico cuando afectan el vítreo, la membrana coroides, el iris, el cuerpo ciliar, la retina o el nervio óptico7,20 (fig. 5).
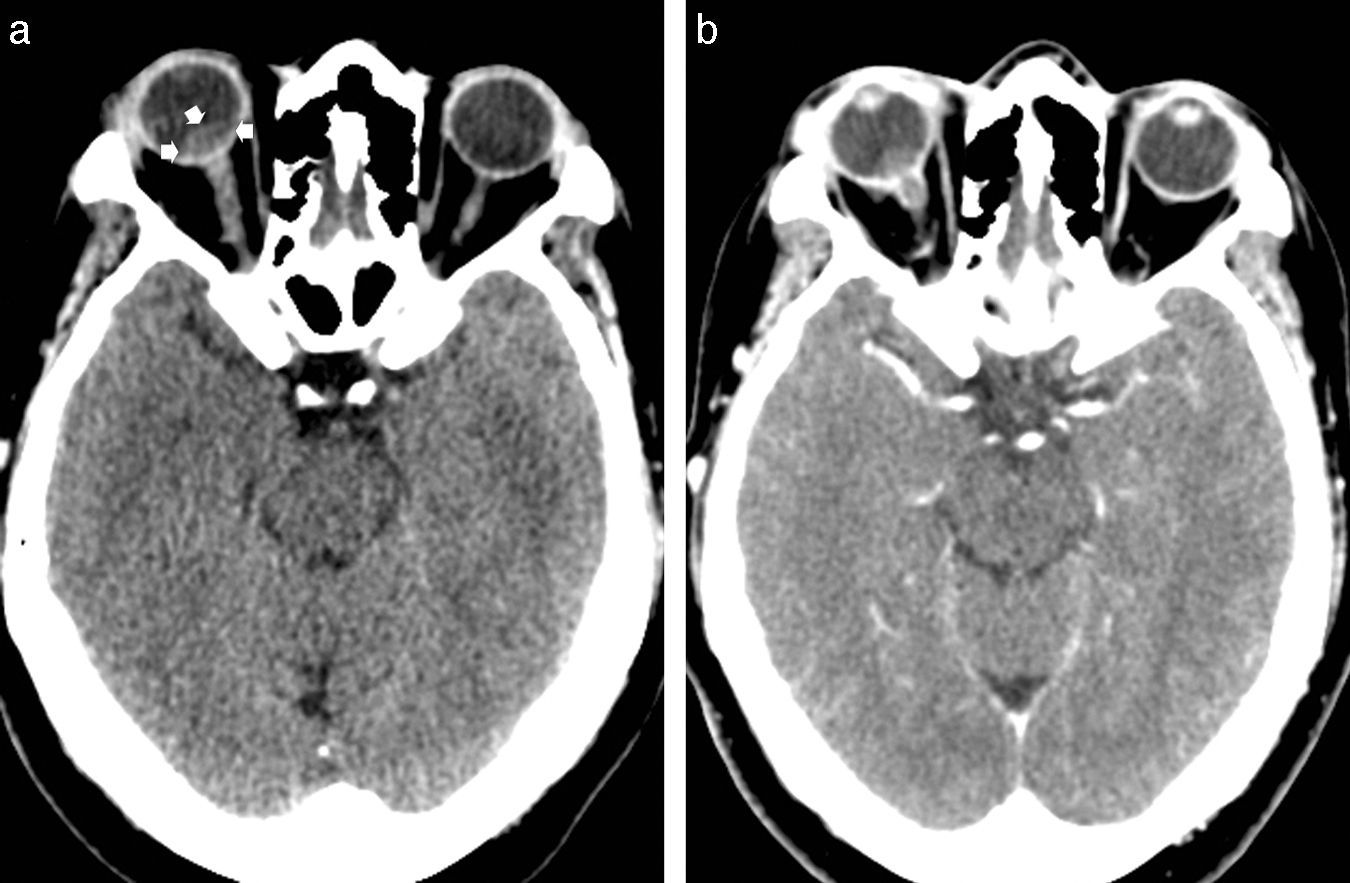
Linfoma primario intraocular. (a) La TC en corte axial anterior a la administración del contraste revela una masa nodular con hiperatenuación en comparación con el vítreo adyacente (flechas), que afecta el globo ocular posterior derecho con invasión del nervio óptico. (b) Después de la administración intravenosa de contraste, la imagen axial comparativa confirma infiltración del nervio óptico con discreto realce del contraste.
Los linfomas de la órbita suelen reflejar la diseminación orbital de una enfermedad sistémica. Al respecto, el linfoma MALT es el subtipo más frecuente de LNH primario de la órbita20. Estos linfomas se producen en el tejido linfoide adquirido en ciertos sitios extraganglionares, como resultado de la inflamación crónica o trastornos autoinmunitarios41. El exoftalmos, las alteraciones visuales, la diplopía y el movimiento restringido son síntomas habituales, típicamente indoloros42.
Cualquier parte de la órbita puede estar afectada. Los tumores son hiperdensos en la TC sin contraste, hipointensos en las secuencias ponderadas en T1 y de hipo a hiperintensos en las secuencias ponderadas en T2 con realce homogéneo de gadolinio7. También se han descrito linfomas orbitales de localización extraconal y en el cuadrante superior lateral.
Linfoma espinalSegún Haque et al.7, el linfoma espinal se produce, por orden decreciente de frecuencia, en el compartimento óseo, extradural-epidural, intradural extramedular o intradural intramedular.
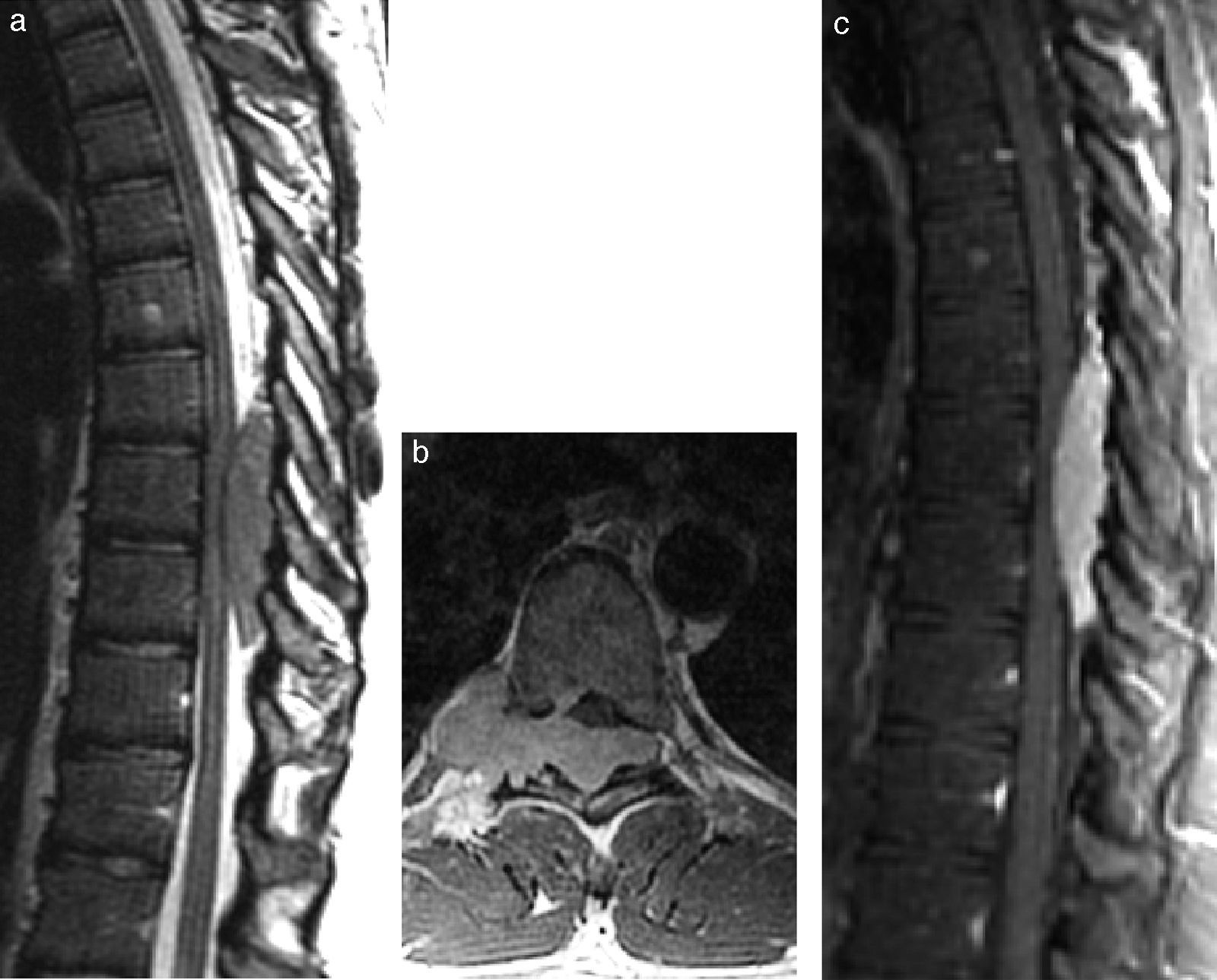
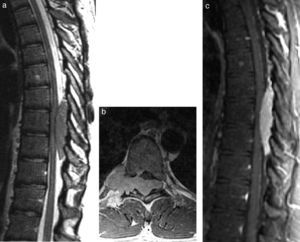
El linfoma epidural espinal puede ser el resultado de una afección primaria, pero suele ser causado por una invasión contigua de una enfermedad vertebral o paravertebral. Por lo general, consiste en la presencia de una masa en el tejido blando con hipointensidad de señal en las secuencias ponderadas en T2 y realce homogéneo de gadolinio. Se disemina longitudinalmente por múltiples segmentos y moldea el espacio epidural, extendiéndose a través del agujero intervertebral (fig. 6).
Linfoma epidural. (a) La imagen sagital en ponderación T2 muestra una masa tumoral en el tejido blando con hipointensidad de la señal en el espacio epidural del segmento torácico de la columna. Las imágenes (b) axial y (c) sagital en ponderación T1 después de la administración intravenosa de gadolinio confirman un realce homogéneo del contraste de la lesión, que se disemina en forma longitudinal por múltiples segmentos y moldea el espacio epidural, extendiéndose a través del agujero intervertebral derecho.
En cuanto al linfoma intramedular, es la forma menos común de LPSNC. Suele ser el resultado de una enfermedad leptomeníngea diseminada42. El tumor leptomeníngeo se observa fundamentalmente con engrosamiento de las raíces nerviosas y realce variable de gadolinio, en ocasiones con masas nodulares que realzan a lo largo de la superficie de la médula espinal7,42. Cuando hay engrosamiento de las raíces nerviosas de la cola de caballo, este patrón imagenológico simula neurolinfomatosis.
NeurolinfomatosisEs una forma rara del LNH. Suele manifestarse con una poli o mononeuropatía dolorosa, causada por infiltración del linfoma de los pares craneanos y nervios periféricos, plexos y raíces. Puede preceder a un linfoma sistémico o a un LPSNC7.
El engrosamiento fusiforme o nodular de los plexos o nervios afectados suele evidenciarse en la TC o RM con hiperintensidad de la señal en las secuencias ponderadas en T2 e inversión-recuperación con tiempo de inversión corto (STIR). El realce del contraste es variable.
El estudio de PET/TC podría resultar útil para el diagnóstico y tratamiento, ya que demuestra la actividad hipermetabólica de las raíces o nervios afectados.
ConclusiónEl LPSNC es una presentación peculiar y poco frecuente de ciertos subtipos del linfoma no Hodgkin, en general del linfoma difuso de células B grandes. Las técnicas imagenológicas cumplen un papel esencial tanto en su diagnóstico como en el tratamiento, en particular la RM con contraste que es el método de elección para estudiar las diferentes presentaciones.
La mayoría de los pacientes inmunocompetentes desarrolla una única lesión cerebral parenquimatosa con fuerte realce homogéneo, mientras que los inmunodeprimidos suelen evidenciar realce heterogéneo y necrosis.
Los radiólogos y hematólogos deben estar familiarizados con el amplio espectro de patrones imagenológicos del LPSNC para confirmar un diagnóstico temprano, administrar el tratamiento apropiado y realizar su seguimiento.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.