Los análisis de osteoporosis en restos óseos cobran relevancia en tanto permiten evaluar el estado de salud ósea de una población. Una de las regiones óseas utilizadas para la estimación de la pérdida de la densidad mineral ósea es la epífisis proximal del fémur. El objetivo del trabajo fue analizar, a partir de restos esqueletarios, la variación de la estructura ósea del fémur proximal en adultos y estudiar su relación con la masa corporal, sexo y edad.
Materiales y métodosSe tomó una muestra de 30 fémures izquierdos pertenecientes a la colección osteológica «Prof. Dr. Rómulo Lambre» de la Facultad de Ciencias Médicas (Universidad Nacional de La Plata), y se estimaron 2 índices radiológicos, el índice córtico metafisario y el índice trabecular. Posteriormente, se estudió la relación entre los valores obtenidos y la masa corporal, el sexo y la edad de los individuos.
ResultadosEl valor promedio estimado por el índice córtico metafisario señaló una baja calidad ósea, sin diferencias entre sexos, y no presentó correlaciones con la edad ni con el peso de los individuos. El 50% de los fémures presentó un valor de índice trabecular indicativo de osteoporosis, sin una diferencia significativa entre sexos.
ConclusiónLa baja calidad ósea del material se ajustó a lo esperado, debido a la edad de los sujetos analizados. Esto puede haber interferido en la visibilidad de otros procesos, ocurridos en vida, que podrían haber sido causantes de la pérdida de densidad mineral ósea.
Analyses of osteoporosis in human bone remains become relevant because allow us to evaluate the health of past population. An usual area used for estimating the loss of bone mineral density is the proximal epiphysis of the femur. The aim of this paper is to analyze changes in proximal femoral bone structure, in relation to body mass, sex and age of individuals.
Materials and methodsThe sample consist of 30 left femurs belonging to Prof. Dr. R. Lambre Osteological Collection, housed at the Faculty of Medical Sciences, National University of La Plata. Two indices were estimated radiologically (Trabecular Index and Cortico Metaphyseal Index), and related to body mass, sex and age of individuals.
ResultsThe average value estimated by Cortico Metaphyseal Index pointed to a low quality of bone, with no differences between males and females. This index showed no correlation with age and weight of individuals. A 50% of the individuals showed a Trabecular Index indicative of osteoporosis, with no significant difference between sexes.
ConclusionThe poor quality of the bone material observed was adjusted to expectation, given the age of the individuals analyzed, which conspired against the visibility of other processes causing the loss of Bone Mineral Density happened earlier in the life of individuals.
La osteoporosis es un estado avanzado de osteopenia (es decir, una desproporcionada pérdida de masa ósea)1. El máximo valor de densidad mineral ósea (DMO) ocurre entre los 25 y 30 años2, pero posteriormente este valor decrece en función de la predisposición génica, la actividad física, la ingesta de alimentos ricos en vitamina D y el consumo de alcohol, tabaco y cafeína2,3. La enfermedad afecta inicialmente al tejido esponjoso, ya que posee mayores tasas de remodelación4, y se ve modificada por una disminución en el número y tamaño trabecular1,5. El promedio anual de la pérdida de masa ósea puede llegar a ser del 0,7%3. Como vemos, es una patología de tipo multifactorial, aunque relacionada habitualmente con 2 procesos principales: el envejecimiento y el dimorfismo sexual.
En general, se reconocen 2 clases de osteoporosis. Entre ambas, la diferencia fundamental radica en que en la tipo I se ven afectadas aproximadamente 6 mujeres por cada hombre (de allí que también sea conocida como osteoporosis posmenopáusica). Además, esta aparece de forma más temprana (entre los 55 y 75 años) y afecta directamente al tejido trabecular, provocando principalmente fracturas en los huesos del carpo y aplastamiento vertebral. Por su parte, la osteoporosis tipo II (u osteoporosis senil) aqueja a personas > 60 años y tiene un diferencia menor en la prevalencia entre sexos (a razón de 2 mujeres por cada hombre). Este segundo tipo compromete al tejido trabecular y cortical, y ocasiona fracturas de cadera y acuñamiento vertebral2.
Una de las regiones óseas más utilizadas para la estimación de la pérdida de DMO es la epífisis proximal del fémur. Los cambios estructurales observados allí son progresivos y, por ende, es posible clasificarlos para llevar a cabo una correlación con el riesgo de fracturas6,7. El tejido esponjoso de la epífisis femoral proximal está compuesto por un sistema estructural de trabéculas que se forma y desarrolla en respuesta a las fuerzas de tensión y compresión que se ejercen contra el esqueleto al soportar el peso del cuerpo. A partir de la pérdida del balance entre osteoblastos y osteoclastos, se produce la resorción de áreas de tejido óseo de una manera ordenada e identificable8,9.
Si bien la investigación de casos clínicos y trabajos experimentales en animales de laboratorio10–15 cubren un vasto campo de la bibliografía específica, es notable la escasez de estudios destinados a la determinación de la pérdida de masa ósea a través de restos esqueletarios16–18. Los análisis de restos óseos cobran relevancia en tanto nos permiten evaluar el estado de salud ósea de una población en una época determinada, ya sea del pasado reciente o incluso de tiempos pretéritos.
En este sentido, los análisis epidemiológicos de diversas patologías hechos a partir de material esqueletario son, cada vez con más frecuencia, realizados con colecciones osteológicas documentadas. Estas, al contar con datos fehacientes sobre los individuos (como su sexo y edad de muerte), permiten establecer asociaciones más precisas entre los factores de riesgo y la patología estudiada.
Con el fin de generar aportes para una mejor comprensión de la dinámica de la osteoporosis, el objetivo del presente trabajo fue analizar, a partir de restos esqueletarios, la variación de la estructura ósea del fémur proximal en adultos y estudiar su relación con la masa corporal, el sexo y la edad de los individuos.
Materiales y métodosCaracterísticas de la muestraLa muestra estuvo integrada por 30 fémures izquierdos, pertenecientes a la colección osteológica «Prof. Dr. Rómulo Lambre» de la Facultad de Ciencias Médicas de la Universidad Nacional de La Plata. La característica más relevante de la serie es que, además de estar compuesta por un elevado número de casos, tiene información documentada sobre cada una de las personas a partir de datos tomados del Cementerio Municipal La Plata (institución de donde provienen los restos)19,20.
En cuanto a la distribución por sexos, nuestra muestra estuvo integrada por 15 casos de sexo masculino y 15 femeninos, todos adultos entre los 26 y 95 años (promedio de edad: 66,13 años). Las fechas de fallecimiento registradas iban desde el año 1951 hasta 2001, y 21 casos de los 30 correspondían a la década 1990–1999. La nacionalidad era mayoritariamente argentina (76,6%).
Vale aclarar que para estimar el índice de masa corporal y para el análisis de correlación entre esta estimación y el índice córtico metafisario (ICM) se consideraron solo 27 fémures, debido a la mala preservación de 3.
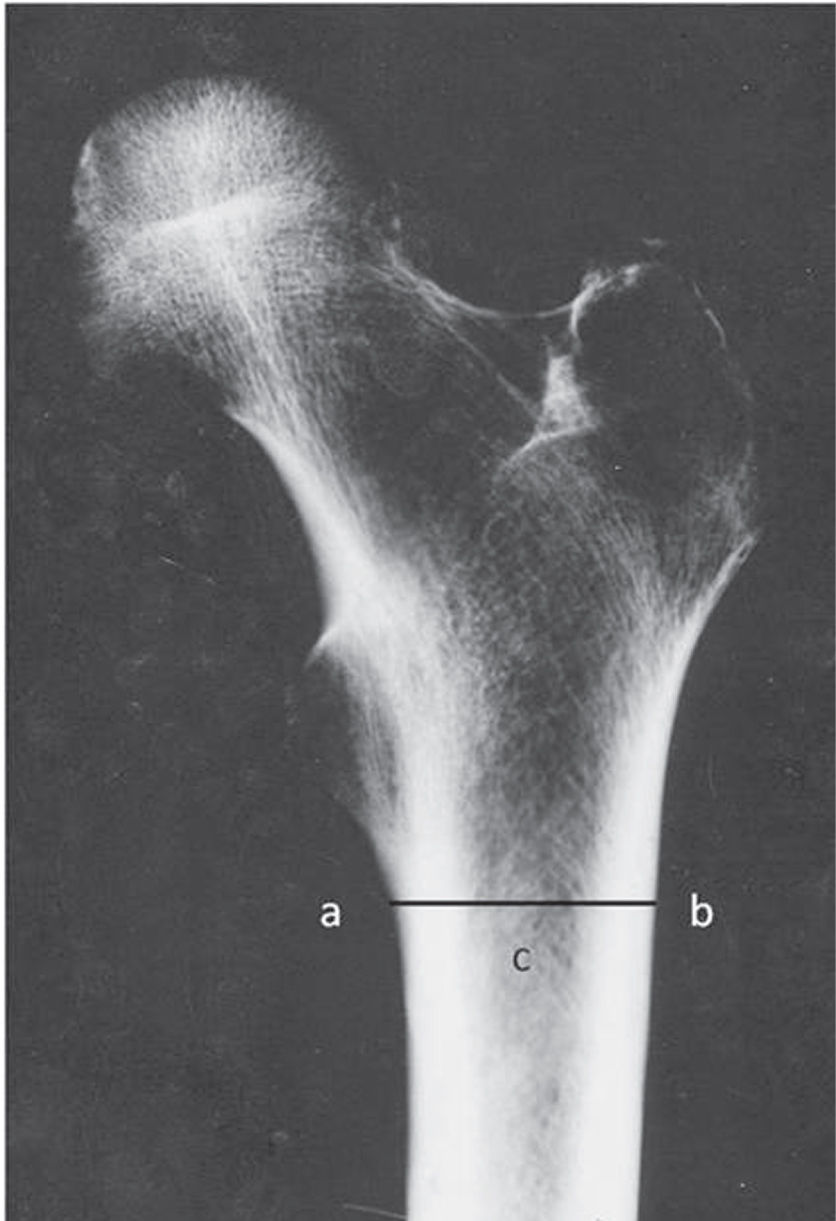
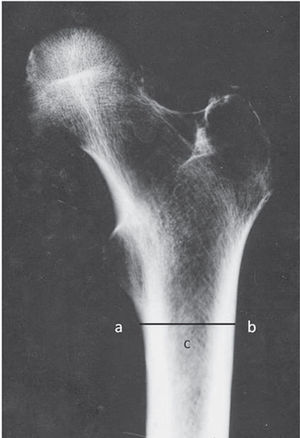
MetodologíaA pesar de no brindar un valor numérico de densidad mineral, como la densitometría ósea21, diversos autores han optado por la morfometría radiográfica para cuantificar la resorción cortical, a través de la medición de las dimensiones corticales, y así valorar la calidad ósea. Los índices resultantes son relaciones entre el espesor cortical y el diámetro total del fémur (índice córtico diafisario de Lizaur Utrilla, índice córtico diafisario femoral de Gómez García e ICM)22. El ICM (utilizado en el presente trabajo) se consigue sumando el grosor de ambas zonas corticales y dividiéndolo por el diámetro total diafisario (medido a la altura de la base del trocánter menor) (fig. 1). Los valores superiores a 0,39 para este índice indican una buena calidad ósea.
Otra manera de observar los cambios producidos por la pérdida de DMO fue propuesta por Singh et al.6 Esta consiste en la evaluación radiológica de las estructuras trabeculares de la epífisis proximal del fémur (un área particularmente afectada debido a las fuerzas a las que está sometida)1,23. El índice trabecular o de Singh, si bien no arroja como resultado un valor cuantitativo y ha sido criticado por su escasa precisión10,13, aún resulta de utilidad para las comparaciones intramuestrales2,24.
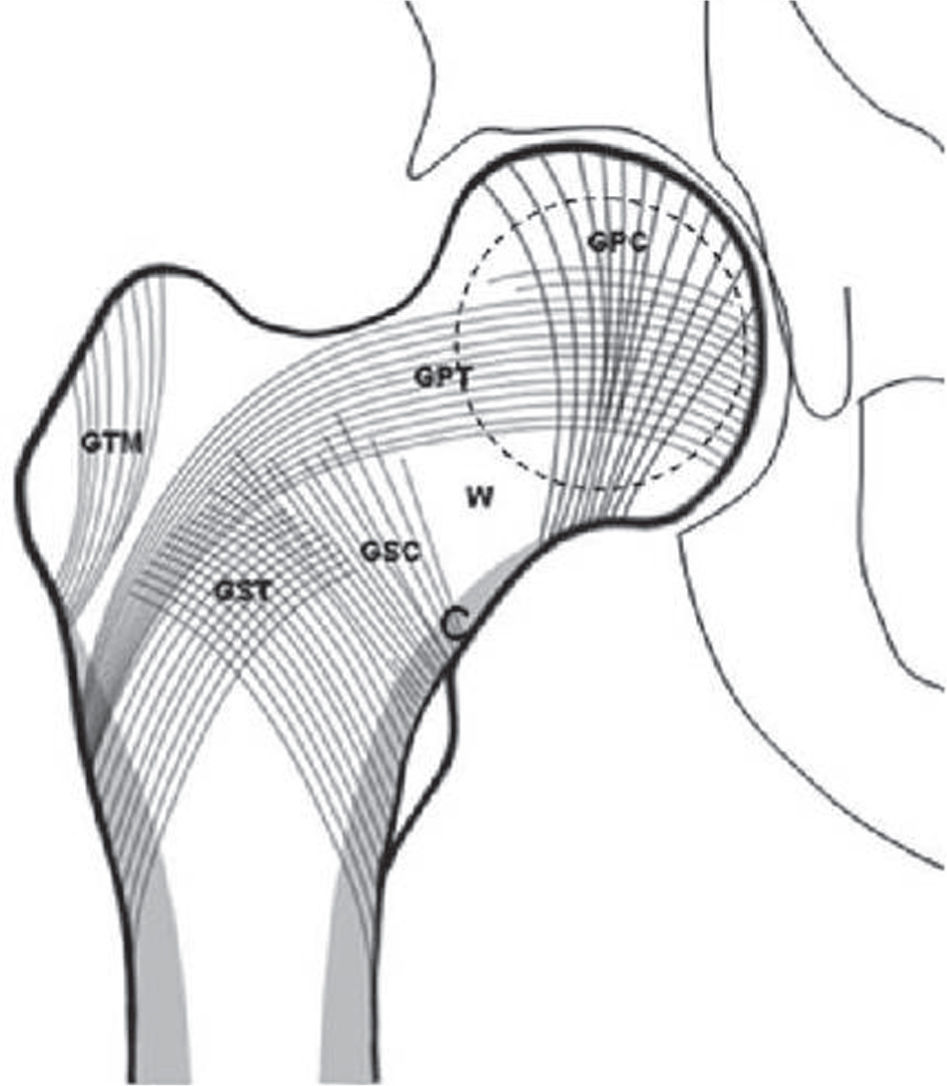
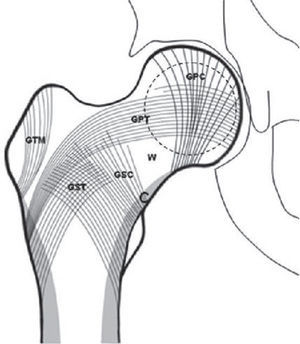
Mediante el índice trabecular se distinguen, en norma fronto-anterior, los 2 sistemas trabeculares en forma de arcos: uno discurre desde la cortical medial o interna hacia el eje longitudinal del fémur y el segundo tiene su origen en la cortical lateral o externa. Las trabéculas que conforman estos arcos se denominan tensiles o compresivas, dependiendo de las cargas a las que estén sometidas, y se dividen en 5 grupos: grupo compresivo principal, grupo compresivo secundario, grupo trocantérico mayor, grupo tensil principal y grupo tensil secundario (fig. 2).
Esquema de la disposición trabecular de la epífisis proximal del fémur (GTM: grupo trocantérico mayor; GPT: grupo tensil principal; GPC: grupo compresivo principal; GST: grupo tensil secundario; GSC: grupo compresivo secundario; W: triángulo de Ward; C: cortical)25.
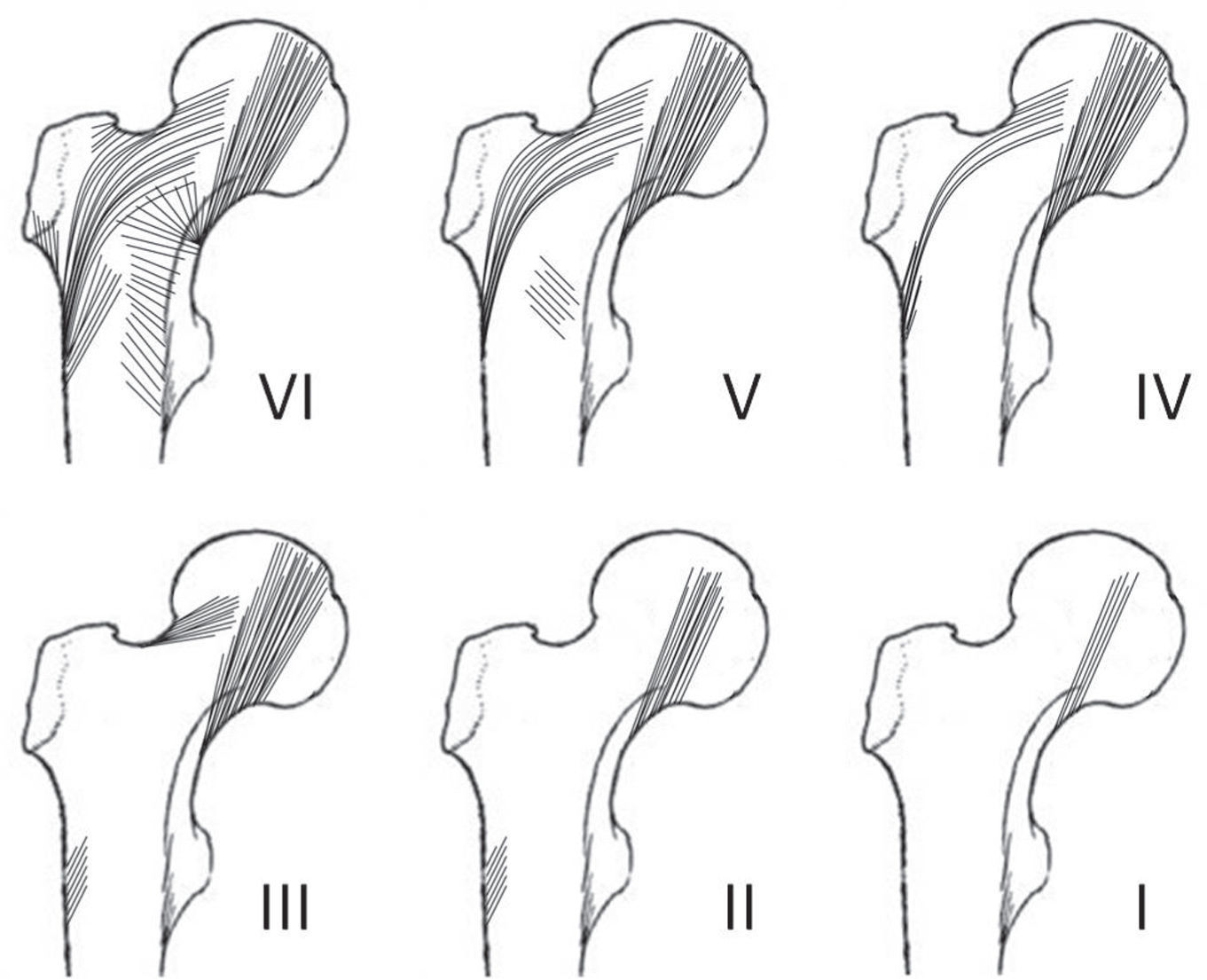
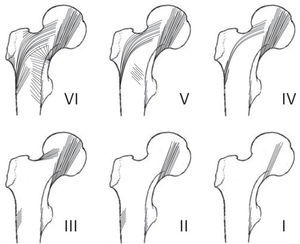
En el cuello del fémur, los grupos compresivos y el grupo tensil principal delimitan un espacio con pocas y delgadas trabéculas denominado «triángulo de Ward»23,25,26. Cuando hay osteoporosis, estos grupos son progresivamente menos visibles. El método utilizado con esta base determina una escala de valores para la osteoporosis compuesta por 6 grados o fases, siendo las 1, 2 y 3 indicativas de enfermedad. Las características de cada fase (fig. 3) son:
- •
Fase 6: todos los grupos trabeculares son visibles y el extremo proximal se ve completamente ocupado por el tejido esponjoso.
- •
Fase 5: se nota la imagen del triángulo inferior del cuello (triángulo de Ward), limitado por el haz curvado de la cabeza y el trocánter. Los grupos principales tensiles y compresivos se ven acentuados.
- •
Fase 4: el triángulo de Ward se encuentra vacío. Se observan parcialmente las estructuras de las trabéculas accesorias, y el grupo tensil principal se ve notablemente reducido.
- •
Fase 3: ya no se hallan las estructuras de las trabéculas accesorias, y se evidencia una discontinuidad entre el grupo tensil principal y el trocánter mayor. Este grado es el primero que indica osteoporosis.
- •
Fase 2: la estructura de las trabéculas curvadas se observa en forma parcial y las compresivas principales se ven con claridad.
- •
Fase 1: el grupo principal compresivo se encuentra reducido en número.
Las radiografías se realizaron mediante un equipo Polimatch Siemmens 120kV 500mAs, perteneciente al Hospital Interzonal Especializado de Agudos y Crónicos San Juan de Dios, en La Plata.
Dado que hasta el momento no existe una forma exacta de determinar el peso individual a partir de los restos óseos27, para establecer la masa corporal de los individuos se han desarrollado fórmulas que permiten obtener una aproximación28–30. Los métodos mecánicos de estimación se basan en la medición de los rasgos óseos que soportan gran parte del peso del cuerpo, como por ejemplo, el diámetro máximo de la cabeza femoral. Los resultados obtenidos a partir de su aplicación posibilitan una comparación intramuestral. La fórmula utilizada en este trabajo fue la propuesta por Ruff et al.28, debido a que toma en cuenta el sexo de los individuos: para los hombres, se estima una masa corporal = (2,471×cabeza femoral − 54,9)×0,9; mientras que para las mujeres, la masa corporal = (2,426×cabeza femoral − 35,1)×0,9.
Análisis de los datosSe realizaron pruebas de hipótesis mediante diversos análisis estadísticos. Se comparó la proporción de individuos que presentaron valores indicativos de una calidad ósea disminuida (estimada por el ICM y el índice trabecular) entre los sexos mediante un examen de proporciones. Las correlaciones entre variables se llevaron a cabo con el examen de Pearson, mientras que el análisis de las diferencias entre medias se hizo a través de la prueba t para datos métricos y de los exámenes U de Mann-Whitney y Z de Kolmogorov-Smirnov para datos no métricos. Todos los estudios se realizaron con el programa de análisis estadístico SPSS 17.0 y el nivel de significación fue de 0,05.
BioéticaTodos los trabajos realizados con la colección osteológica Lambre se enmarcan en la legislación municipal vigente31,32 y fueron aprobados por el Comité de Bioética de la Facultad de Ciencias Médicas de la Universidad Nacional de La Plata.
ResultadosÍndice córtico metafisarioLa pérdida de DMO promedio, estimada mediante el ICM, fue de 0,35. Para el sexo femenino, el valor obtenido fue menor que para el masculino (mujeres = 0,31; hombres = 0,38), aunque no se detectaron diferencias significativas (t=−1,694; p=0,101) (tabla 1).
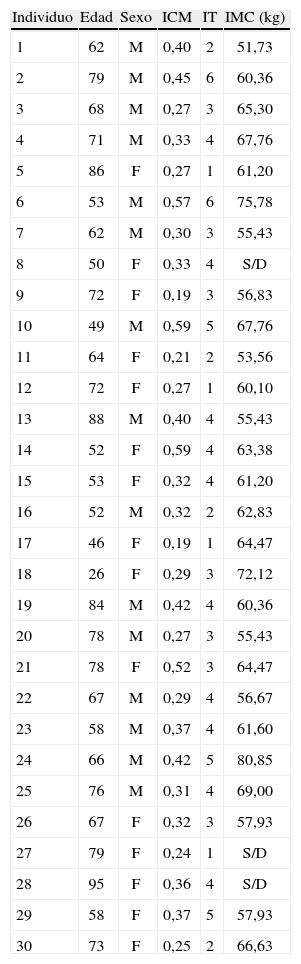
Detalle de los índices estimados en la muestra de 30 fémures de personas adultas.
| Individuo | Edad | Sexo | ICM | IT | IMC (kg) |
| 1 | 62 | M | 0,40 | 2 | 51,73 |
| 2 | 79 | M | 0,45 | 6 | 60,36 |
| 3 | 68 | M | 0,27 | 3 | 65,30 |
| 4 | 71 | M | 0,33 | 4 | 67,76 |
| 5 | 86 | F | 0,27 | 1 | 61,20 |
| 6 | 53 | M | 0,57 | 6 | 75,78 |
| 7 | 62 | M | 0,30 | 3 | 55,43 |
| 8 | 50 | F | 0,33 | 4 | S/D |
| 9 | 72 | F | 0,19 | 3 | 56,83 |
| 10 | 49 | M | 0,59 | 5 | 67,76 |
| 11 | 64 | F | 0,21 | 2 | 53,56 |
| 12 | 72 | F | 0,27 | 1 | 60,10 |
| 13 | 88 | M | 0,40 | 4 | 55,43 |
| 14 | 52 | F | 0,59 | 4 | 63,38 |
| 15 | 53 | F | 0,32 | 4 | 61,20 |
| 16 | 52 | M | 0,32 | 2 | 62,83 |
| 17 | 46 | F | 0,19 | 1 | 64,47 |
| 18 | 26 | F | 0,29 | 3 | 72,12 |
| 19 | 84 | M | 0,42 | 4 | 60,36 |
| 20 | 78 | M | 0,27 | 3 | 55,43 |
| 21 | 78 | F | 0,52 | 3 | 64,47 |
| 22 | 67 | M | 0,29 | 4 | 56,67 |
| 23 | 58 | M | 0,37 | 4 | 61,60 |
| 24 | 66 | M | 0,42 | 5 | 80,85 |
| 25 | 76 | M | 0,31 | 4 | 69,00 |
| 26 | 67 | F | 0,32 | 3 | 57,93 |
| 27 | 79 | F | 0,24 | 1 | S/D |
| 28 | 95 | F | 0,36 | 4 | S/D |
| 29 | 58 | F | 0,37 | 5 | 57,93 |
| 30 | 73 | F | 0,25 | 2 | 66,63 |
ICM: índice córtico metafisario; IT: índice trabecular; IMC: índice de masa corporal.
En cuanto al porcentaje de individuos que presentaron valores indicativos de una calidad ósea disminuida, se alcanzó un 70% para el total de la muestra. Aunque se observó un 33,3% más para el sexo femenino (86,6%) que para el masculino (53,3%), esta diferencia no resultó significativa (z=0,72; α=0,05).
No se observó una relación entre la edad y los valores del ICM de los individuos tomados en su conjunto (r=−0,09; p=0,61) ni tampoco cuando la muestra fue separada por sexos (femeninos: r=−0,01; p=0,95, y masculinos: r=−0,29; p=0,28). A su vez, tampoco se registró una relación entre los valores del ICM y del índice de masa corporal (r=0,32; p=0,09).
Índice trabecular (o de Singh)De acuerdo con la evaluación de estructuras trabeculares de la epífisis proximal del fémur, se estimó un 50% de la muestra con un índice ≤ 3, indicativo de osteoporosis (tabla 1). Este porcentaje fue mayor en las mujeres (sexo femenino = 66,66%; masculino = 33,33%), aunque no se observaron diferencias significativas (p=0,08).
Mediante el test de Mann-Whitney observamos que no se detectaron diferencias significativas entre las medias de ambos sexos (U=98,000; p=0,535). De acuerdo con los resultados obtenidos mediante el examen de Kolmogorov-Smirnov para 2 muestras, se observó que tampoco existieron diferencias significativas entre ambas dispersiones (Z=0,365; p=0,999).
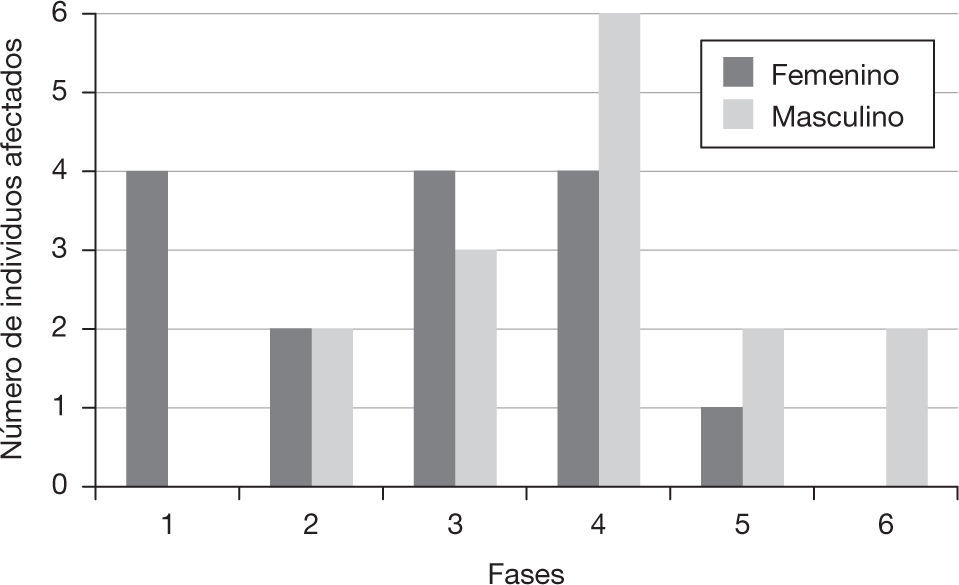
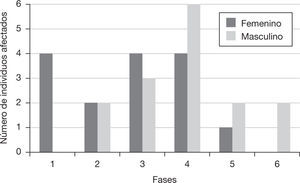
Los resultados de este análisis radiológico mostraron que la fase 4 tuvo un mayor número de individuos. Además, no se detectaron hombres en la fase 1 (esto es, la de mayor grado de osteoporosis) y ninguna de las mujeres se encontró dentro la fase 6 (la de mínimo grado de osteoporosis) (fig. 4).
Número de individuos de acuerdo con la fase de pérdida de densidad mineral ósea, según el método propuesto por Singh et al.6 dividido por sexos. Las fases 1, 2 y 3 son indicativas de osteoporosis.
Dentro de los análisis osteopatológicos realizados a partir de restos esqueletarios, la observación macroscópica ha sido (y continúa siendo) la principal vía de acceso para la detección y diagnóstico. Sin embargo, en casos como el de la pérdida de densidad de masa ósea se torna imprescindible contar con técnicas y métodos complementarios debido a que el aspecto externo del hueso puede ser normal, aunque haya una disminución de su peso1,5. Algunos investigadores2,14 sugieren que la única forma de establecer un diagnóstico de certeza es la observación de fracturas patológicas en la epífisis proximal de fémur, la epífisis distal del radio o en los cuerpos vertebrales. El análisis radiológico, por su parte, sigue siendo muy utilizado porque muestra los cambios internos sufridos por el hueso, sobre todo en las zonas más susceptibles a fracturas14.
La dificultad del análisis cuantitativo del estado de mineralización ósea de un grupo humano a través de sus restos óseos debe ser tenido en cuenta, ya que no existen normas estandarizadas en el ámbito mundial, tales como el T-store o Z-score para estudios clínicos33. Como ya se discutió, existen diversas maneras de cuantificar la pérdida de DMO tanto en pacientes como en restos óseos: análisis radiológicos, histológicos y densitométricos, principalmente21,34–37. A su vez, cada uno de estos exámenes puede realizarse mediante una multiplicidad de técnicas, establecimiento de índices y determinación de parámetros. Toda esta situación genera un escenario donde la comparación interpoblacional de las DMO promedio o de la prevalencia de osteoporosis se ve obstaculizada y resulta de extrema dificultad.
A pesar de estas complejidades, existen ciertas tendencias claramente visibles a partir del análisis realizado. El valor promedio del ICM < 0,3522, así como los resultados de la aplicación del índice de Singh mostraron en promedio una baja calidad ósea, de acuerdo con lo esperado, debido al promedio alto de edad de muerte. Estudios realizados en nuestro país y en el extranjero reconocen frecuencias elevadas para este segmento etario de la población, estableciendo que más del 50% de los individuos > 65 años muestran una pérdida de DMO15.
Un aspecto que habitualmente se considera en el análisis es el sexo. La inmensa mayoría de los estudios y campañas preventivas se dirigen a las mujeres, puesto que ellas son las más comprometidas por los desbalances hormonales. En nuestro país, un análisis en el ámbito nacional, realizado por Spivacow y Sánchez38, estableció que 2 de cada 4 mujeres posmenopáusicas tienen osteopenia, 1 padece osteoporosis y 1 presenta niveles normales de DMO.
Por este motivo, resulta llamativo que con las diversas técnicas radiológicas empleadas la diferencia entre los niveles de desmineralización ósea entre ambos sexos no haya sido estadísticamente significativa. Sin embargo, como ya fue descrito, la osteoporosis tiene 2 formas de presentación: mientras la posmenopáusica actúa con mucha mayor frecuencia en las mujeres de 45 a 70 años, la senil muestra un dimorfismo mucho menos marcado hacia los 60–70 años. Esta dinámica en los procesos de pérdida de DMO podría explicar la ausencia de diferencias significativas entre ambos sexos. Dado que la edad de los individuos fallecidos concuerda con la pérdida de mineralización tipo II o senil, podría haber ocurrido un ocultamiento o disminución de las diferencias en el desequilibrio fisiológico del sistema esqueletal.
Este mismo fenómeno podría haber signado la ausencia de una correlación negativa en la relación entre la pérdida de DMO y el mayor peso de los individuos (estimado a partir del índice de masa corporal). Las posibles reducciones de masa ósea debidas al sustento de un mayor peso se verían solapadas y en parte ocultadas por la disminución de DMO propia de la senilidad.
El aumento en la incidencia de osteoporosis en individuos > 65 años está acompañado por un marcado impacto en su morbilidad y mortalidad. Los factores nutricionales y genéticos, la actividad física y la tasa de remodelación ósea determinan la capacidad de resistencia del hueso. Una vez alcanzado el pico de DMO hacia los 30 años, se produce un progresivo e inexorable declinamiento (a razón de 0,5% por año)15,37,39. Por ello, las características etarias de la mayor parte de los individuos que integraron nuestra muestra podrían haber interferido en la visualización de dicha disminución. Una representación limitada de la franja entre los 20 y 50 años no permitió una mejor observación del proceso de disminución trabecular desde sus inicios.
Cualquiera que sea el sexo, cuando los individuos trasponen la barrera de los 60–70 años sufren un tipo de cambio histofisiológico que consiste en la disminución de los niveles de hormonas sexuales y en un aumento de la actividad osteoclástica2,37. A este proceso se suman alteraciones en la movilidad y diferenciación de células madre mesenquimatosas40, potencialmente precursoras de osteoblastos y adipocitos. Este aumento en adipogénesis en desmedro de la generación de osteoblastos incidiría en el balance del sistema óseo. Incluso estudios recientes41–43 han propuesto con base en experimentos con roedores que los adipocitos depositados en la médula ósea tras la disminución hematopoyética podrían desempeñar un papel patológico. Cocultivos de osteoblastos y adipocitos evidencian que estos últimos inhiben las actividades y la supervivencia de los osteoblastos, posiblemente a causa de la liberación de adipocinas y ácidos grasos44.
La baja calidad ósea del material observado se ajustó a lo esperado, debido a que se trataba de individuos seniles. A su vez, esta característica pudo haber interferido en la visibilidad de otros procesos causantes de la pérdida de DMO, ocurridos durante la vida de los individuos (fenómeno observado en otras patologías degenerativas detectadas en la colección, como hernias discales y osteoartritis)45–47.
ConclusiónLos estudios destinados a la determinación de la pérdida de masa ósea a partir de restos esqueletarios son escasos, sobre todo si se compara con la vastísima bibliografía paleopatológica disponible. Estos resultados, aunque preliminares, nos ubican en el comienzo de una senda de nuevas investigaciones, aumentando el número de muestras y sumando nuevas herramientas, como la tomografía y la densitometría ósea. Si bien se desconoce gran parte de la historia de vida de los individuos (enfermedades, embarazos, fracturas, nutrición, causa de la muerte), aportes como el presente trabajo contribuyen al conocimiento de la salud ósea de una población, confirmando o refutando hipótesis propuestas desde otras aproximaciones, y sugieren nuevas líneas de investigación a partir de la evidencia.
Los autores declaran que no tienen ningún conflicto de intereses, excepto la Dra. Inda y el Dr. Plischuk que declaran como posible conflicto de intereses ser coautores de un artículo al que se hace referencia en este estudio.