A válvula aórtica transcateter de segunda geração Lotus™ foi desenhada para proporcionar ao intervencionista o controle completo de sua liberação durante o procedimento. O presente estudo apresenta a experiência inicial e os desfechos hospitalares de pacientes tratados com essa prótese no Brasil.
MétodosRegistro observacional, retrospectivo, que incluiu pacientes com estenose aórtica grave sintomáticos, considerados de alto risco cirúrgico, tratados em sete centros.
ResultadosReceberam o dispositivo 31 pacientes, sendo 61,3% do sexo feminino, com idade de 82,9 ± 6,9 anos e escore STS de 6,5 ± 4,1%. A área valvar aórtica foi de 0,73 ± 0,18cm2 e o gradiente médio de 51,7 ± 13,9mmHg. Todos os procedimentos foram realizados pela via transfemoral, e a pré‐dilatação foi necessária em 65% dos casos. A taxa de sucesso do procedimento foi de 96,7%. Não houve complicação vascular com necessidade de intervenção cirúrgica e nem casos de acidente vascular cerebral. O gradiente médio após o procedimento foi de 10,5 ± 5,8mmHg e não foram observadas regurgitações aórticas de graus moderado/importante. A taxa de implante de marca‐passo definitivo foi de 38,7%, e a permanência hospitalar de 8,5 ± 4,8 dias.
ConclusõesNa experiência inicial com o implante da válvula aórtica Lotus™, os resultados hospitalares demostraram a segurança e a eficácia do dispositivo, além de ausência de regurgitação aórtica relevante.
The second‐generation Lotus™ transcatheter aortic valve was designed to provide the interventional cardiologist with complete control of its release during the procedure. This study presents the initial experience and in‐hospital outcomes of patients treated with this prosthesis in Brazil.
MethodsThis observational and retrospective study included patients with symptomatic severe aortic stenosis considered at high surgical risk, treated in seven centers.
ResultsThe device was used in 31 patients, 61.3% female, aged 82.9 ± 6.9 years, and with STS score of 6.5 ± 4.1%. The aortic valve area was 0.73 ± 0.18cm2 and the mean gradient was 51.7 ± 13.9mmHg. All procedures were performed by the transfemoral access route, and pre‐dilation was necessary in 65% of cases. The success rate of the procedure was 96.7%. There were no vascular complications requiring surgical intervention nor cases of stroke. The mean gradient after the procedure was 10.5 ± 5.8mmHg; no cases of moderate to severe aortic regurgitation were observed. The rate of permanent pacemaker implantation was 38.7%, and mean in‐hospital length of stay was 8.5 ± 4.8 days.
ConclusionsIn the initial experience with the use of the Lotus™ aortic valve, in‐hospital results demonstrated the safety and efficacy of the device; no cases of significant aortic regurgitation were observed.
A estenose valvar aórtica é uma patologia com alta prevalência na população em idosos e está associada a elevadas taxas de morbimortalidade cardiovascular, a partir do momento em que se iniciam os sintomas. Para esses pacientes, o tratamento de escolha é a cirurgia de troca valvar, no entanto, nem todos são candidatos ideais a esse tipo de procedimento, em decorrência do alto risco cirúrgico frequentemente observado em indivíduos nesta faixa etária.1,2
A literatura evidencia resultados favoráveis com o implante percutâneo de prótese valvar aórtica (TAVI, sigla do inglês transcatheter aortic valve implantation), com reduções nas taxas de mortalidade e novas hospitalizações, quando comparados aos de pacientes considerados inoperáveis, além de taxas similares de mortalidade, quando comparados ao tratamento cirúrgico em pacientes de alto risco.3,4 Dessa forma, ao longo da última década, a TAVI se consolidou como uma importante alternativa terapêutica para o subgrupo de pacientes com estenose valvar aórtica degenerativa, cujo risco cirúrgico é considerado alto ou inaceitável.5–8
No entanto, esses procedimentos ainda apresentam potenciais limitações e complicações, como acidente vascular cerebral, regurgitação paravalvar residual, complicações vasculares e necessidade de implante de marca‐passo definitivo.9 Nesse contexto, as válvulas transcateter de segunda geração apresentam mudanças importantes, como, por exemplo, proporcionar o reposicionamento ou a recaptura antes de seu implante, ou empregar um selador em sua base, para reduzir o risco de regurgitação paravalvar.
Descrevemos, neste artigo, a experiência inicial no Brasil com a válvula aórtica transcateter de segunda geração Lotus™ (Boston Scientific Corporation, Natick, EUA), assim como seus desfechos hospitalares.
MétodosTrata‐se de um registro observacional, retrospectivo e multicêntrico. Foram arrolados todos os pacientes que receberam a válvula Lotus™ nas seguintes instituições: Instituto do Coração do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo, Hospital Sírio‐Libanês e Hospital São Luiz, Unidade Morumbi, todos situados em São Paulo (SP); Hospital e Maternidade Brasil, em Santo André (SP); Hospital Quinta D’OR, no Rio de Janeiro (RJ); Hospital Esperança, em Recife (PE); e Instituto de Cardiologia do Rio Grande do Sul, Porto Alegre (RS). A escolha do dispositivo foi realizada pelo operador, com base em características da valva aórtica, da aorta e do trajeto ilíaco femoral.
DispositivoO sistema Lotus™ para implante transcateter de válvula aórtica é composto por uma bioprótese de pericárdio bovino suturada a uma armação de nitinol, feita a partir de um fio único.
Uma das principais características do dispositivo é o Adaptive Seal™, que consiste em um revestimento externo, localizado na parte inferior da válvula, para selamento do anel aórtico, com a finalidade de minimizar a regurgitação paravalvar.
A válvula encontra‐se disponível em três diferentes tamanhos (23, 25 e 27mm), sendo pré‐montada no sistema de entrega (fig. 1). O dispositivo é liberado e expandido por meio de rotação em sentido anti‐horário, por expansão mecânica controlada.
A válvula Lotus™ é composta por três folhetos de pericárdio bovino suturados a uma armação de nitinol. Possui uma marca radiopaca em posição central, que auxilia no posicionamento, e um dispositivo de selamento de poliuretano/policarbonato, cuja função é se adaptar à anatomia do anel valvar e minimizar a regurgitação paravalvar. O dispositivo é expansível mecanicamente e atinge a conformação final pelo acionamento dos mecanismos de travamento, localizados em cada ponto de inserção dos folheto.
A estimulação ventricular com alta frequência, com o marca‐passo transvenoso, não é necessária durante o implante da válvula. A liberação pode ser feita pausadamente, já que os folhetos da prótese iniciam seu funcionamento em estágio precoce da liberação.
A válvula Lotus™ pode ser recapturada e reposicionada em qualquer estágio do procedimento, até mesmo quando totalmente expandida, por rotação em sentido horário da porção distal do sistema de entrega. Uma vez em posição final satisfatória, a liberação definitiva ocorre em duas etapas, por rotação em sentido horário do anel de liberação (fig. 2).
Válvula Lotus™ pré‐montada no sistema de entrega. A rotação da porção distal do sistema de entrega (blue knob) em sentido anti‐horário resulta em liberação e expansão mecânica do dispositivo; em sentido horário, resulta em alongamento e reembainhamento, caso haja necessidade de reposicionamento. A rotação horária do anel de liberação (black ring) leva à liberação da válvula.
A seleção dos pacientes foi realizada pela equipe multidisciplinar (Heart Team). Resumidamente, os critérios utilizados foram alto risco cirúrgico, de acordo com a estratificação da Society of Thoracic Surgeons (STS), quando o risco estimado de mortalidade fosse ≥ 8%, e/ou quando o Heart Team considerasse que existiam comorbidades que elevassem de forma proibitiva o risco do procedimento cirúrgico. Os pacientes deveriam apresentar estenose aórtica grave, documentada por ecocardiografia transtorácica ou transesofágica (área valvar aórtica < 1,0cm2 e/ou gradiente transvalvar médio > 40mmHg e/ou velocidade de pico > 4 m/s) e insuficiência cardíaca congestiva classe funcional 2 ou maior, de acordo com a New York Heart Association (NYHA).
ProcedimentoO principal método utilizado para triagem anatômica dos pacientes foi a angiotomografia computadorizada de coração e aorta. Com essas imagens mediram‐se estruturas como o anel valvar (diâmetros, perímetro e área), a via de saída do ventrículo esquerdo e a junção sinotubular, além da altura dos óstios coronarianos e dos diâmetros dos acessos vasculares (sistema ilíaco‐femoral). Dessa forma, foi possível escolher entre os tamanhos disponíveis das próteses (23, 25 ou 27mm), além de determinar qual a melhor via de acesso e toda a anatomia do trajeto a ser percorrido pelo dispositivo.
Os procedimentos foram realizados de acordo com as práticas de cada hospital, e os desfechos hospitalares foram avaliados pelos critérios do Valve Academic Reserch Consortium (VARC) 2.10 Os pacientes receberam aspirina e clopidogrel antes do procedimento, que foram mantidos nos primeiros 3 meses após o implante do dispositivo, sendo a aspirina administrada indefinidamente.
Os dados clínicos, laboratoriais, eletrocardiográficos e de imagem foram tabulados em uma planilha única, para posterior análise. As variáveis qualitativas foram descritas como números absolutos e porcentuais, e as variáveis quantitativas como média e desvio padrão.
ResultadosForam tratados 31 pacientes consecutivos em 7 diferentes hospitais, a partir de outubro de 2015, correspondendo a 80% do volume de dispositivos Lotus™ implantados no Brasil.
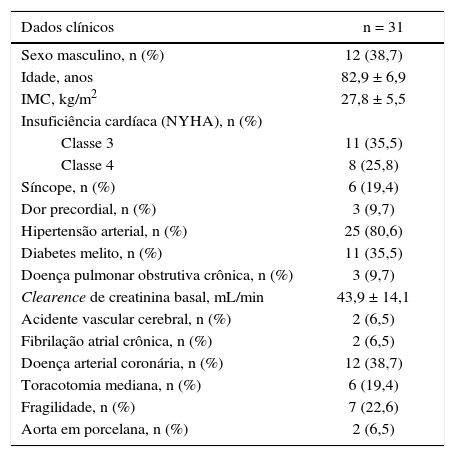
A população foi majoritariamente do sexo feminino (61,3%), com a maioria absoluta dos pacientes apresentando sinais e sintomas de insuficiência cardíaca congestiva classes 3 ou 4 de acordo com NYHA, ou síncope (tabela 1).
Características clínicas
| Dados clínicos | n = 31 |
|---|---|
| Sexo masculino, n (%) | 12 (38,7) |
| Idade, anos | 82,9 ± 6,9 |
| IMC, kg/m2 | 27,8 ± 5,5 |
| Insuficiência cardíaca (NYHA), n (%) | |
| Classe 3 | 11 (35,5) |
| Classe 4 | 8 (25,8) |
| Síncope, n (%) | 6 (19,4) |
| Dor precordial, n (%) | 3 (9,7) |
| Hipertensão arterial, n (%) | 25 (80,6) |
| Diabetes melito, n (%) | 11 (35,5) |
| Doença pulmonar obstrutiva crônica, n (%) | 3 (9,7) |
| Clearence de creatinina basal, mL/min | 43,9 ± 14,1 |
| Acidente vascular cerebral, n (%) | 2 (6,5) |
| Fibrilação atrial crônica, n (%) | 2 (6,5) |
| Doença arterial coronária, n (%) | 12 (38,7) |
| Toracotomia mediana, n (%) | 6 (19,4) |
| Fragilidade, n (%) | 7 (22,6) |
| Aorta em porcelana, n (%) | 2 (6,5) |
IMC: índice de massa corporal; NYHA: New York Heart Association.
A mortalidade estimada pelo escore STS foi de 6,5 ± 4,1%, pelo EuroSCORE II foi 7,6 ± 7,0%, e pelo EuroSCORE logístico foi 14,0 ± 9,1%. Alguns pacientes apresentavam características não contempladas por esses escores, como fragilidade, aorta em porcelana ou tórax hostil, que elevariam consideravelmente o risco cirúrgico.
A área valvar aórtica pelo ecocardiograma foi de 0,73 ± 0,18cm2, sendo que 70% dos pacientes apresentavam algum grau de regurgitação aórtica e 20% tinham disfunção ventricular de grau moderado a importante. Os dados ecocardiográficos relacionados a gradientes máximo e médio, basal e após o procedimento podem ser observados na tabela 2.
Todos os procedimentos foram realizados pela via transfemoral, sendo 58% de forma percutânea e 42% por dissecção. Em 84% dos casos, os pacientes foram submetidos à anestesia geral e ecocardiografia transesofágica, enquanto que, nos 16% restantes, foram realizadas sedação consciente e ecocardiografia transtorácica. Os procedimentos foram realizados em caráter eletivo em 87% dos casos e, em 13%, em regime de urgência. Pré‐dilatação foi necessária em 65% dos procedimentos. Um paciente era portador de bioprótese em posição aórtica e foi submetido a procedimento valve‐in‐valve.
A válvula de 23mm foi utilizada em 45% dos casos, seguida pela de 25mm (39%) e a de 27mm (16%). Em apenas um caso (3%), houve necessidade de pós‐dilatação.
Houve sucesso do implante dos dispositivos, de acordo com os critérios VARC‐2, em 96,7% dos casos, com um óbito (3,2%) causado por tamponamento cardíaco após perfuração do ventrículo direito com o eletrodo do marca‐passo provisório.
Houve importante queda do gradiente pressórico ventrículo esquerdo/aorta após a intervenção. Em 83% dos casos, foi observada ausência completa de regurgitação aórtica; em 17% (cinco casos), a regurgitação constatada foi mínima e, em um caso (3%), leve. Não observamos regurgitações aórticas de graus moderado ou importante.
Não houve complicação vascular com necessidade de intervenção cirúrgica e nem casos de acidente vascular cerebral. Lesão renal aguda grau 1, conforme classificação VARC‐2, foi observada em 32% dos pacientes (dez casos) e grau 2 em 3% dos paciente (um caso). Não houve nenhum caso de lesão renal aguda grau 3.
A taxa de implante de marca‐passo definitivo após o implante da válvula foi de 38,7% e a permanência hospitalar foi de 8,5 ± 4,8 dias.
DiscussãoO principal achado do presente estudo é que o implante transcateter de prótese valvar aórtica com o dispositivo de segunda geração Lotus™ associou‐se à alta taxa de sucesso do procedimento, com baixa incidência de regurgitação periprotética residual e índices relativamente elevados de implante de marca‐passo definitivo pós‐procedimento. Os resultados de nossa série refletem a experiência inicial com essa prótese em nosso meio e se assemelham aos resultados de estudos internacionais previamente realizados (tabela 3).11,12
Resultados pós‐implante percutâneo de prótese valvar aórtica com o sistema Lotus™ na literatura e neste estudo
| Variável | REPRISE I (n = 11) | REPRISE II (n = 250) | RESPOND (n = 500) | Presente estudo (n = 31) |
|---|---|---|---|---|
| Gradiente médio, mmHg | 13,7 ± 3,7 | 12,05 ± 4,35 | 10,4 ± 4,3 | 10,5 ± 5,8 |
| Leak paravalvar ≥ moderado, % | 0 | 1,8 | 0,4 | 0 |
| Implante de marca‐passo definitivo, % | 36 | 28,6 | 30,6 | 38,7 |
As próteses consideradas de primeira geração, com comercialização no Brasil e amplamente estudadas na literatura, possuem características diferentes: a primeira é feita de pericárdio suíno e autoexpansível (CoreValve, Medtronic Inc., Minneapolis, EUA) e a segunda, composta por pericárdio bovino e balão‐expansível (Edwards SAPIEN, Edwards Lifesciences, Irvine, EUA). Ambas as próteses demonstraram eficácia e segurança, no entanto, ainda têm limitações quando comparadas à cirurgia convencional, principalmente em incidência de acidente vascular cerebral, regurgitação paravalvar aórtica e necessidade de marca‐passo definitivo. Outro aspecto importante a ser ressaltado é a relativa dificuldade de se implantarem esses dispositivos na posição considerada ideal. Uma vez posicionada e com o balão inflado, a válvula balão‐expansível não pode ser reposicionada, enquanto, a autoexpansível apresenta uma pequena possibilidade de reposicionamento, a partir de certo ponto da liberação. Esses aspectos tornam‐se extremamente relevantes em pacientes com anéis valvares muito calcificados (um dos preditores de regurgitação paravalvar), válvulas bicúspides e aortas horizontalizadas, assim como em pacientes com óstios coronarianos com implantação baixa e, consequentemente, com maior predisposição à oclusão coronariana. É de extrema importância ressaltar que esses dois dispositivos já apresentam melhorias técnicas em suas novas gerações, no entanto estas ainda encontram‐se em fase de registro em órgãos regulamentadores e não estão comercialmente disponíveis no Brasil.
A bioprótese valvar aórtica de segunda geração Lotus™ apresenta características únicas, que podem suprir as limitações dos dispositivos acima, como, por exemplo, a capacidade de ser 100% reposicionável e recapturável, além de apresentar um selador em sua base, que minimiza a chance de regurgitação paravalvar. Essas características, associadas a um mecanismo que permite o funcionamento precoce antes de sua liberação, permitem maior estabilidade hemodinâmica durante o procedimento, com menor necessidade de uso de aminas vasoativas. Esse perfil permitiu que, neste estudo, 16% dos procedimentos fossem realizados com estratégia minimamente invasiva, com anestesia local e sedação consciente, e sem a utilização de ecocardiografia transesofágica, trazendo mais conforto aos pacientes e alta hospitalar mais precoce.
Obviamente, a válvula apresenta limitações, como necessitar de acessos vasculares arteriais com maior diâmetro, assim como um dispositivo de entrega mais rígido e, de certa forma, desfavorável a anatomias muito tortuosas. O dispositivo Lotus™ apresenta também maiores taxas de implante de marca‐passo definitivo quando comparado às demais válvulas. Muito se discute sobre as possíveis causas dessa maior incidência de bloqueios atrioventriculares avançados, mas as mais prováveis são o maior perfil do dispositivo e sua força radial.
ConclusõesA experiência inicial no Brasil com o dispositivo Lotus™ apresentou dados compatíveis com os da literatura mundial, ofertando aos operadores a possibilidade de utilização de uma válvula aórtica de segunda geração com excelentes resultados no que diz respeito à segurança e à eficácia.
Fonte de financiamentoNão há.
Conflitos de interessesOs autores declaram não haver conflitos de interesse.
A revisão por pares é de responsabilidade da Sociedade Brasileira de Hemodinâmica e Cardiologia Intervencionista.